INTRODUCCION
En la terapia de tumores sólidos de estirpe epitelial se están empleando nuevos fármacos dirigidos contra el receptor del factor de crecimiento epidérmico (EGFR) 1,2. Dentro de este grupo, el gefitinib (Iressa®) es el más usado y el más estudiado.
Su mecanismo de acción se basa en la inhibición de la tirosina cinasa acoplada al EGFR, impidiendo así la cascada de señales de la división celular 3. El gefitinib fue aprobado en 2003 por la Food and Drug Administration (FDA) para el tratamiento en monoterapia del cáncer de pulmón no microcítico en pacientes con enfermedad avanzada tras fallo de la quimioterapia convencional (docetaxel o derivados del platino) 4. No obstante, su uso se está generalizando y comienza a utilizarse en otros tumores sólidos de estirpe epitelial de cabeza y cuello, ovario, mama y colon. Por su mecanismo de acción, el fármaco gefitinib, produce múltiples y variados efectos secundarios cutáneos, que son los más frecuentes después de los gastrointestinales.
CASO CLINICO
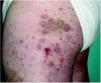
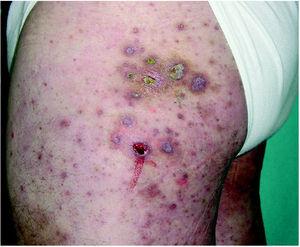
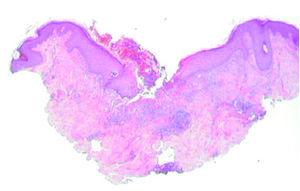
Un varón de 46 años, diagnosticado de carcinoma epidermoide de pulmón estadio IIID (T4N0M0) en septiembre de 2004, recibió inicialmente tratamiento quirúrgico y quimioterapia coadyuvante. En julio de 2004 se objetivó un nódulo pulmonar no accesible a diagnóstico por punción aspirativa con aguja fina (PAAF) ni por fibrobroncoscopia. Se realizó una tomografía de emisión de positrones que sugería malignidad, por lo que se inició quimioterapia de rescate. El paciente presentó elevación de transaminasas, y se decidió suspender la quimioterapia e iniciar tratamiento con gefitinib (Iressa®) 250 mg/día como tratamiento de tercera línea. A las 2 semanas del inicio del tratamiento con gefitinib el paciente presentó una erupción acneiforme facial, que no requirió la supresión del tratamiento. A los 2 meses aparecieron lesiones consistentes en nódulos eritematosos, pruriginosos, en la cara lateral de ambos muslos, discretamente infiltrados a la palpación, no dolorosos y centrados por una costra, intensamente hiperqueratósica. Las costras se desprendían fácilmente ante la mínima fricción, y dejaban úlceras de fondo limpio y hemático (fig. 1).
Fig. 1.--Pápulas y nódulos con centro hiperqueratósico que se desprenden al mínimo roce.
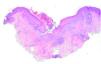
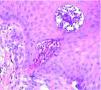
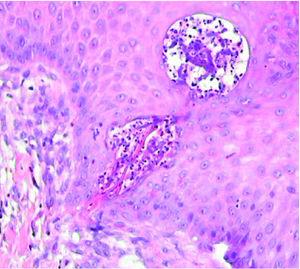
Se realizó cultivo de las lesiones, que se procesó para aerobios, anaerobios, micobacterias y hongos con resultado negativo. Se realizó, además, una biopsia cutánea; en el estudio histológico se apreciaba un epitelio con acantosis e hiperqueratosis, con una invaginación central ocupada por queratina ortoqueratósica y paraqueratósica, celularidad inflamatoria, material necrótico y elementos de tejido conjuntivo (fig. 2). En esta zona y a mayor aumento se observaban haces de colágeno dispuestos verticalmente y atravesando la epidermis. La dermis mostraba cambios degenerativos y un infiltrado inflamatorio mixto (fig. 3). No se apreció la localización folicular ni restos de folículo piloso, a pesar de la realización de múltiples cortes histológicos.
Fig. 2.--Se aprecia la rotura de la epidermis (aumentos y fución). (Hematoxilina-eosina, ×2.)
Fig. 3.--Se observan fibras de colágeno dispuestas verticalmente que atraviesan la epidermis, acompañadas de celularidad inflamatoria y detritus celulares. (Hematoxilina-eosina, ×20.)
Se inició tratamiento con emolientes tópicos y curas locales. Tras la supresión del fármaco puesto que ya se había obtenido respuesta del tumor primario, las erosiones curaron en el periodo de una semana y, en la actualidad, 9 meses después de la supresión de gefitinib, el paciente no presenta lesiones.
DISCUSION
Patterson englobó, en 1984, dentro de las dermatosis perforantes, la foliculitis perforante, la enfermedad de Kyrle, la colagenosis perforante reactiva y la elastosis perforante serpiginosa 5,6. El nexo común a todas ellas es el hallazgo en la histología de eliminación transepitelial de fibras de colágeno, fibras elásticas o tejido conjuntivo necrótico 7.
Actualmente la opinión más aceptada es que la foliculitis perforante, la enfermedad de Kyrle y la colagenosis perforante reactiva adquirida reflejan diferentes momentos evolutivos clinicopatológicos de una misma entidad 8.
La etiopatogenia de las dermatosis perforantes no está aclarada. Ha sido descrita en asociación con otras enfermedades, las más comunes diabetes mellitus 5 e insuficiencia renal crónica 8-10, pero también con colangitis esclerosante, hipertensión arterial, enfermedad cardiovascular arterioesclerótica, acantosis nigricans juvenil 5, psoriasis 10-11 e infección por el virus de la inmunodeficiencia humana (VIH) 12. El mecanismo por el cual se produce la disrupción del infundíbulo piloso y la posterior eliminación transfolicular de detritus y material dérmico no se conoce. Carter et al 13 proponen como explicación una queratinización anormal y prematura 12. La eliminación de material extraño depositado en dermis, mediante proliferación excesiva del epitelio folicular es un mecanismo posible, y así se ha demostrado experimentalmente 14. Mehregan fue el primero en postular que el pelo enrollado dentro del infundíbulo podía dañar el epitelio folicular e iniciar el fenómeno de transeliminación 7. Paulovic et al 15 proponen los traumatismos repetidos como mecanismo patogénico.
El gefitinib, por su mecanismo de acción, podría interferir en el normal funcionamiento de la epidermis y provocar cambios similares a los propuestos como responsables de las dermatosis perforantes. En primer lugar, el gefitinib es capaz de alterar la queratinización y diferenciación de los queratinocitos 15. Pero los principales cambios los encontramos en el folículo. El EGFR tiene un papel esencial en la regulación del ciclo del pelo, estimulando el paso de anágeno a catágeno 16. En ratones, la alteración, mediante manipulación genética del EGFR produce pelo más corto, atrófico y ondulado 17. Por otro lado, el EGFR, interviene en la transición de anágeno a telógeno, mediante un proceso mediado por complejo mayor de histocompatibilidad (MHC) de clase I; se produce un infiltrado en la porción inferior del folículo que acaba en su degeneración 18,19.
El gefitinib es un nuevo antineoplásico cuyo uso comienza a generalizarse por sus buenos resultados. Este fármaco tiene una serie de efectos secundarios en la piel con los que el dermatólogo debe familiarizarse. Lee et al describen estos efectos en un estudio sobre 64 pacientes tratados con gefitinib 20. El 53 % de ellos presentaban lesiones en la piel. Estos datos son similares a los aportados por la FDA (tabla 1). Estas reacciones cutáneas son esperadas por el mecanismo de acción del propio fármaco en la piel, y en ningún caso son un signo de alergia o reacción inmunológica 20,21. La mayoría de ellas son bien toleradas, como sucede en nuestro paciente.
Recientemente se han descrito, además, hiperpigmentación progresiva de la cara, tronco y piernas tras varios meses de tratamiento 22 y erupciones purpúricas 23. En la literatura médica revisada no aparece descrita reacción cutánea como la del paciente presentado, que fue de intensidad suficiente como para requerir la supresión del fármaco.
Los efectos cutáneos al iniciar tratamiento con gefitinib aparecen con más frecuencia en el primer mes 21, sin embargo, su eficacia como antineoplásico se puede empezar a evaluar a partir del segundo y tercer mes. Habitualmente la resolución de las lesiones ocurre tras la supresión del fármaco 24,25.
La posibilidad de que continúen apareciendo nuevos casos de reacciones no descritas es elevada, puesto que los inhibidores del factor de crecimiento epidérmico son fármacos cada vez más utilizados, ya que sus indicaciones engloban los tumores más frecuentes (pulmón, mama, colon, cabeza y cuello). Por otro lado, el receptor del factor de crecimiento epidérmico se encuentra muy distribuido en la piel y se expresa en los queratinocitos, en células de las glándulas sebáceas, ecrinas, en la parte superior del epitelio de la vaina del folículo piloso y en algunas células endoteliales 18. Esta ubicuidad produce una amplia posibilidad de reacciones.
Se necesitan más estudios que aclaren por qué algunos pacientes desarrollan toxicidad cutánea y otros no, así como por qué en unos casos es más grave, y persiste meses tras la supresión del fármaco. Posiblemente haya una susceptibilidad individual que lo justifique. La mayoría de las reacciones cutáneas son leves 26 y quizá lo mejor es individualizar cada caso. Siempre hay que dar prioridad al control del tumor, y esperar a la evaluación de la respuesta al tratamiento. Esto supone el control de las lesiones cutáneas hasta los 3 meses del inicio del tratamiento 27.
Correspondencia:
Montse Fernández-Guarino.
Hospital Ramón y Cajal.
Ctra. Colmenar, km 9,100. 28034 Madrid. España.
montsefdez@msn.com
Recibido el 15 de septiembre de 2005.
Aceptado el 30 de enero de 2006.