La dermatoscopia es una técnica no invasiva que ha demostrado mejorar la precisión diagnóstica en el carcinoma basocelular (CBC). Desde la descripción inicial llevada a cabo por Menzies et al., basada fundamentalmente en hallazgos asociados a la presencia de pigmento, se ha generado una importante cantidad de bibliografía útil en la práctica clínica diaria. De una forma práctica, podemos clasificar las estructuras dermatoscópicas asociadas al diagnóstico de CBC en estructuras pigmentadas, vasculares y no pigmentadas/no vasculares. Una de las aplicaciones más recientes de la dermatoscopia en el CBC trata de pronosticar el subtipo histológico mediante el examen dermatoscópico y permite fundamentalmente diferenciar entre el CBC superficial y no superficial. Sin embargo, la dermatoscopia también nos permite sospechar variantes agresivas con mayor riesgo de recurrencia. La exploración dermatoscópica exhaustiva en el seguimiento de pacientes con daño actínico o historia de múltiples CBC posibilita la detección de lesiones muy incipientes, con repercusiones terapéuticas y pronósticas importantes.
Dermoscopy is a noninvasive technique that has been demonstrated to improve diagnostic accuracy in basal cell carcinoma (BCC). The first dermoscopic model for the diagnosis of BCC, based mainly on the identification of pigmented structures, was described by Menzies et al., and since then dermoscopy has generated an abundance of literature useful to routine clinical practice. From a practical perspective, dermoscopic structures associated with BCC can be classified as pigmented, vascular, or nonpigmented/nonvascular. One of the most recent applications of dermoscopy in BCC is as an aid to predicting histologic subtype and essentially differentiating between superficial and nonsuperficial BCC. It can also, however, help raise suspicion of more aggressive variants with a higher risk of recurrence. A thorough dermoscopic examination during follow-up of patients with actinic damage or a history of multiple BCCs can facilitate the detection of very incipient lesions and significantly impact treatment and prognosis.
El carcinoma basocelular (CBC) es el tumor maligno más frecuente en el ser humano, con una incidencia creciente y una morbilidad y costes significativos1. La incidencia en nuestro medio se ha estimado en aproximadamente 250 tumores/100.000 personas-año2,3.
La dermatoscopia es una técnica no invasiva que ha demostrado mejorar la precisión diagnóstica en lesiones cutáneas pigmentadas y no pigmentadas. En la actualidad, forma parte esencial de la exploración clínica en dermatología. El examen dermatoscópico mejora la precisión diagnóstica para el CBC, permitiendo diferenciar estos tumores de otros procesos neoplásicos o inflamatorios, e incluso permitiendo diferenciar de forma fiable entre subtipos histológicos4,5. La detección precoz del CBC puede ser crucial para reducir la morbilidad asociada al propio tumor o a su tratamiento6. En este sentido, el coste económico asociado al abordaje terapéutico primario del tumor se incrementa con el tamaño del mismo7. Para poder llevar a cabo este diagnóstico precoz, una adecuada formación en dermatoscopia es fundamental4.
Dermatoscopia del carcinoma basocelularLa descripción inicial de la dermatoscopia del CBC por Menzies et al. se basaba en gran medida en criterios asociados a la presencia de pigmento. Según su método, para el diagnóstico del CBC es imprescindible la ausencia de retículo pigmentado y la detección de una o más de las siguientes estructuras clásicas: nidos ovoides azul-gris, estructuras en hoja de arce, estructuras en rueda de carro, ulceración (no asociada a traumatismo reciente) y telangiectasias arboriformes. Este modelo mostró una sensibilidad del 97% para el CBC pigmentado, así como una especificidad del 93% frente al melanoma (MM) y del 92% respecto a lesiones pigmentadas benignas8.
Este método ha confirmado su reproducibilidad y fiabilidad6. Sin embargo, desde la descripción inicial del método de Menzies, se ha generado una importante bibliografía que aporta nuevos criterios y evidencias que han contribuido a la mejora del diagnóstico dermatoscópico del CBC.
Las estructuras dermatoscópicas asociadas al diagnóstico de CBC pueden clasificarse de forma práctica en estructuras pigmentadas, estructuras vasculares y un tercer grupo de estructuras no pigmentadas y no vasculares9 (tabla 1).
Principales estructuras dermatoscópicas en el carcinoma basocelular (Adaptado de Wozniak-Rito et al.)
| Estructuras pigmentadas | Estructuras vasculares | Otras estructuras |
|---|---|---|
| Nidos ovoides azul-gris | Telangiectasias arboriformes | Múltiples erosiones |
| Glóbulos azul-gris | Telangiectasias finas y cortas | Ulceración |
| Puntos azul-gris | Áreas brillantes blanco-rojizas | |
| Estructuras en hoja de arce | Estructuras blancas brillantes | |
| Estructuras en rueda de carro | ||
| Estructuras concéntricas |
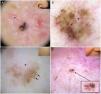
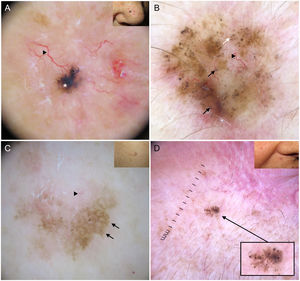
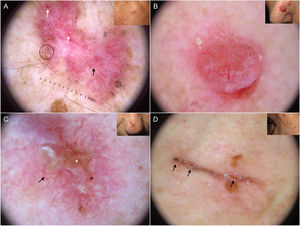
Los nidos ovoides azul-gris son las estructuras pigmentadas de mayor tamaño, presentándose como estructuras confluentes de morfología ovoide o alargada10 (fig. 1A). Su correlación histopatológica es la presencia de nidos tumorales de gran tamaño con agregados de pigmento invadiendo la dermis11. Los glóbulos azul-gris son similares a los anteriores, pero más pequeños, presentándose como estructuras redondas u ovales distribuidas de forma dispersa10 (fig. 1B). Histológicamente, corresponden a nidos tumorales de pequeño tamaño en dermis papilar y/o reticular11. Los puntos azul-gris aparecen netamente enfocados y dispersos de forma aleatoria (fig. 1B). Representan pequeños agregados tumorales en la unión dermoepidérmica (UDE) o dermis superficial, aunque también pueden corresponder a pigmento libre o melanofagia en la UDE10,11.
Estructuras dermatoscópicas en carcinoma basocelular. A) Carcinoma basocelular infiltrativo en donde se observa un gran nido ovoide azul-gris (asterisco blanco) y telangiectasias arboriformes (triángulo). B) Carcinoma basocelular infiltrativo pigmentado con múltiples glóbulos azul-gris (flechas negras), puntos azul-gris (flecha blanca) y telangiectasias arboriformes (triángulo). C) Carcinoma basocelular superficial pigmentado con telangiectasias finas (triángulo) y estructuras en hoja de arce (flechas negras). D) Carcinoma basocelular pigmentado de 2 mm que presenta múltiples estructuras concéntricas.
Las estructuras en hoja de arce son extensiones bulbosas conectadas a una base común en la periferia del tumor, simulando la forma de una hoja, y no deben partir nunca desde un retículo pigmentado. Son estructuras altamente específicas de CBC9.10 (fig. 1C). Las denominadas estructuras en rueda de carro, también muy específicas de CBC, consisten en proyecciones radiales conectadas a un eje central más pigmentado10. En ocasiones, las proyecciones radiales se encuentran mal definidas y se presentan como estructuras globulares con un área central más oscura, recibiendo el nombre de estructuras concéntricas (fig. 1D). Estos tres tipos de estructuras corresponden a nidos pigmentados a nivel de la UDE y dermis papilar superficial11.
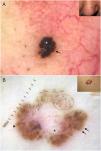
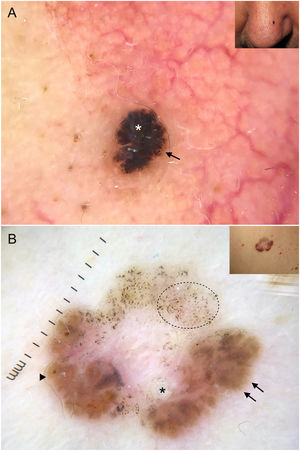
Cabe destacar que en CBC muy pigmentados pueden estar presentes estructuras dermatoscópicas propias de lesiones melanocíticas, como glóbulos marrones, velo azul-blanquecino, múltiples puntos grises («peppering») o más raramente retículo pigmentado o proyecciones6 (fig. 2A, B). En estos casos donde el CBC puede ser un auténtico simulador clínico y dermatoscópico de melanoma, la microcopia confocal de reflectancia (MCR) ha demostrado tener un papel importante12.
Carcinomas basocelulares con criterios propios de lesiones melanocíticas. A) Lesión intensamente pigmentada de 3 mm con velo azul-blanquecino (asterisco blanco) y glóbulos marrones (flecha negra). B) Patrón multicomponente en un carcinoma basocelular en regresión: múltiples puntos grises (círculo con línea de puntos), proyecciones (flechas negras), áreas en hoja de arce (triángulo) y quiste tipo milia (asterisco); además se aprecian estructuras blancas brillantes y una vascularización polimorfa.
Las telangiectasias arboriformes son las estructuras vasculares más destacables en el CBC, con un valor predictivo positivo (VPP) del 94%13. Se trata de vasos de color rojo brillante, generalmente de una longitud mayor a 1 mm, que se ramifican irregularmente en capilares más finos. Estos vasos están perfectamente enfocados debido a su ubicación en la superficie del tumor10 (fig. 1A, B). Desde el punto de vista histológico, corresponden a la neovascularización tumoral en forma de vasos dilatados en la dermis.
Las telangiectasias finas y cortas son el segundo patrón vascular más frecuente. Son vasos cortos (< 1 mm), escasamente ramificados, que corresponden a vasos telangiectásicos situados en la dermis9,10 (fig. 1C).
Más raramente pueden observarse estructuras vasculares propias de otro tipo de neoplasias, incluyendo lesiones melanocíticas, como vasos puntiformes, lineales irregulares, vasos en horquilla o vasos en coma6.
Otras estructurasLa ulceración se manifiesta como áreas sin estructura rojo-anaranjadas y traduce una pérdida total de la epidermis y parte de la dermis superficial9. Las erosiones son pequeñas áreas marrón-rojizas o amarillo-anaranjadas de menor tamaño que la ulceración, que histológicamente se corresponden con una necrosis focal de la epidermis14.
Las áreas brillantes blanco-rojizas sin estructura corresponden a una fibrosis difusa de la dermis y del estroma tumoral9,10.
Las estructuras blancas brillantes solo son visibles mediante luz polarizada. Estas pueden presentarse como líneas blancas y cortas que se entrecruzan de forma ortogonal (líneas blancas brillantes o crisálidas). Sin embargo, en el CBC estas estructuras tienden a disponerse de forma más bien desorganizada o dispuestas en paralelo. La combinación de líneas o hebras blancas brillantes con áreas blancas brillantes es altamente sugestiva de CBC no pigmentado, mientras que las líneas blancas cortas con distribución ortogonal son más típicas del melanoma15,16. Aunque su correlación histológica no está clara, parecen traducir fibrosis dérmica y del estroma11.
Criterios dermatoscópicos de reciente descripciónExisten ciertos criterios dermatoscópicos recientemente publicados que pueden ser de utilidad en la práctica clínica.
Se ha descrito la presencia de un patrón estrellado circunferencial que se extiende desde la periferia visible del tumor y puede estar compuesto por líneas blancas, vasos o pliegues de la superficie cutánea. Este hallazgo se ha relacionado con el diagnóstico de CBC infiltrante (CBCi)17.
Las estructuras en hoja de arce en negativo son un signo dermatoscópico sutil que puede ayudar en la delimitación de los márgenes del tumor, fundamentalmente en CBCs no pigmentados. Consisten en estructuras bulbosas no pigmentadas, morfológicamente comparables a las áreas en hoja de arce y que interrumpen las estructuras presentes en la piel circundante, como telangiectasias o léntigos solares18.
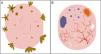
Patrones dermatoscópicos según el subtipo histológicoLa mayoría de las estructuras dermatoscópicas tienen una correlación directa con la histología y por ello, pueden ser un excelente nexo de comunicación entre el clínico y el patólogo11. En los últimos tiempos se ha tratado de establecer en qué medida la dermatoscopia permite diferenciar entre subtipos histológicos de CBC19,20 (figs. 3 y 4). Esta diferenciación puede ser relevante desde el punto de vista terapéutico y afecta fundamentalmente a la distinción entre CBC de bajo riesgo y aquellos subtipos con un comportamiento agresivo21,22.
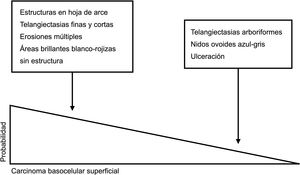
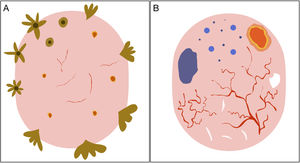
Claves para diagnóstico diferencial dermatoscópico entre carcinoma basocelular superficial y no superficial. Las estructuras en hoja de arce, las telangiectasias finas y cortas, las erosiones múltiples y las áreas brillantes blanco-rojizas sin estructura son potentes predictores del diagnóstico de carcinoma basocelular superficial. Por el contrario, las telangiectasias arboriformes, los nidos ovoides azul-gris y la ulceración predicen el diagnóstico de variantes histológicas diferentes al carcinoma basocelular superficial5,9.
Representación esquemática. A) Carcinoma basocelular superficial: estructuras en hoja de arce, estructuras en rueda de carro, estructuras concéntricas, erosiones múltiples y telangiectasias finas y cortas. B) Carcinoma basocelular no superficial: telangiectasias arboriformes, nido ovoide azul-gris, múltiples puntos y glóbulos azul gris, ulceración y estructuras blanquecinas.
Este grupo incluye fundamentalmente al CBC superficial (CBCs) y al CBC nodular (CBCn). Estas variantes se comportan generalmente de forma indolente y presentan un riesgo menor de recurrencia22.
Carcinoma basocelular superficialSegún el modelo llevado a cabo por Lallas et al., la presencia simultánea de estructuras en hoja de arce y telangiectasias finas y cortas, junto con la ausencia de nidos ovoides azul-gris, telangiectasias arboriformes y ulceración, presenta un alto valor predictivo para el diagnóstico de CBCs. Estos autores desarrollaron un algoritmo para la discriminación entre CBCs y otros subtipos histológicos con una sensibilidad del 81,9% y una especificidad del 81,8%5.
Según una reciente revisión sistemática, las estructuras más frecuentes en este subtipo histológico serían las telangiectasias finas y cortas (60%), las erosiones múltiples (43%) y las estructuras blancas brillantes (43%), en el contexto de un fondo compuesto por áreas blanco-rojizas sin estructura (79%)20. En lesiones pigmentadas, los puntos y glóbulos azul-gris son el hallazgo más frecuente (27%), mientras que las estructuras en hoja de arce están presentes en un 25% de los casos. Las estructuras en rueda de carro o las estructuras concéntricas, aunque bastante específicas de este subtipo, son menos frecuentes5,20,23.
Por localizaciones, las telangiectasias finas, las estructuras radiadas y las erosiones se han asociado de forma independiente con la localización en el tronco (fig. 5A)24.
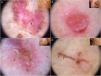
Subtipos de carcinoma basocelular. A) Carcinoma basocelular superficial: áreas en rueda de carro (círculo), telangiectasias finas (flecha negra), múltiples erosiones (flechas blancas); se aprecian además áreas brillantes blanco-rojizas sin estructura y estructuras blanquecinas. B) Carcinoma basocelular nodular: telangiectasias arboriformes y estructuras blanquecinas. C) Carcinoma basocelular morfeiforme con telangiectasias escasamente ramificadas (flecha negra) y de predominio en la periferia del tumor, asociadas a ulceración central (asterisco blanco). D) Carcinoma basocelular lineal con múltiples erosiones (flechas negras), siguiendo un pliegue cutáneo en contexto de cutis romboidal.
Las telangiectasias arboriformes son el hallazgo dermatoscópico fundamental del CBCn. Estas estructuras están presentes en un 75% de los casos en las series publicadas, mientras que las estructuras blancas brillantes (43%) y la ulceración (31%) son las siguientes estructuras en frecuencia20 (fig. 5B). Por otra parte, los CBCn pigmentados suelen presentar nidos ovoides azul-gris (36%), generalmente en combinación con telangiectasias arboriformes5,20. Otras estructuras pigmentadas presentes con menor frecuencia en el CBCn son los glóbulos y los puntos azul-gris 10.
Subtipos histológicos de alto riesgoSe consideran como subtipos histológicos de alto riesgo aquellos tumores con un patrón de crecimiento infiltrativo, mal delimitados y con tendencia a la invasión perivascular y perineural. Estas características dificultan su extirpación completa y conllevan tasas de recurrencia mayores22. En términos generales, los CBC de comportamiento agresivo parecen presentar una menor superficie rosada y una relativa ausencia de vasos en la parte central del tumor25.
Carcinoma basocelular morfeiformeEl CBC morfeiforme o esclerodermiforme (CBCe) puede presentar estructuras dermatoscópicas reconocibles de forma más tardía26. El 75% de los casos muestra una hipopigmentación sin estructura («en porcelana»). Otro hallazgo frecuente en el CBCe son las telangiectasias arboriformes, presentes en un 51% de los casos, y que suelen ser más finas, dispersas y con menor número de ramificaciones20,27 (fig. 5C). El CBCe raramente presenta pigmentación y cuando la presenta, lo hace generalmente en forma de nidos ovoides azul-gris20.
Carcinoma basocelular infiltrativoEl CBCi presenta habitualmente telangiectasias arboriformes (76%) y ulceración (44%)20. Otros hallazgos frecuentes son áreas rojizas brillantes, múltiples glóbulos azul-gris y telangiectasias finas22,23 (fig. 1A, B). A pesar de que las erosiones múltiples se relacionan fundamentalmente con el CBCs, también se han relacionado con el CBCi de forma significativa22.
Carcinoma basocelular micronodularApenas existen referencias específicas a las características dermatoscópicas del CBC micronodular (CBCm). Algunos de los hallazgos descritos son vasos truncados y múltiples glóbulos azul-gris28,29.
Carcinoma basoescamosoEn el trabajo llevado a cabo por Giacomel et al. con 22 carcinomas basoescamosos, los criterios dermatoscópicos principales en el carcinoma basoescamoso (CBE) fueron en orden de frecuencia los vasos arboriformes periféricos no enfocados (73%), masas de queratina (73%), escamas superficiales (68%), ulceración/costras hemáticas (68%), estructuras blanquecinas (64%) y áreas azul-gris (59%). Todas las lesiones excepto una, presentaron al menos un criterio dermatoscópico de CBC y otro asociado al carcinoma escamoso (CEC)30.
En un estudio retrospectivo posterior sobre 36 tumores se identificó como criterio dermatoscópico más frecuente en el CBE las masas de queratina (91,7%). Otras estructuras frecuentes fueron las escamas superficiales (77,8%), ulceración (69,4%), áreas blanquecinas sin estructura (69,4%), terrones blancos (66,7%) y manchas hemáticas sobre las masas de queratina (66,7%). Con relación a las estructuras vasculares se detectó un patrón polimorfo en el 61% de las lesiones, que en la gran mayoría incluía telangiectasias arboriformes. Los autores también describen la presencia de rosetas en un 11,1% de los pacientes de su serie y concluyen que el CBE se caracteriza por un patrón vascular sugestivo de CBC junto con hallazgos dermatoscópicos de queratinización31.
Otros subtiposFibroepitelioma de PinkusEl fibroepitelioma de Pinkus (FEP) se caracteriza por la presencia de telangiectasias arboriformes finas y menos ramificadas que pueden estar asociadas a vasos puntiformes y estrías blanquecinas. En la variante pigmentada se pueden apreciar áreas marrón-gris sin estructura, así como puntos azul-gris. Otros hallazgos frecuentes son los quistes de milia y la ulceración32. Recientemente se ha descrito el patrón en retículo blanquecino (retículo invertido) en el FEP33.
Carcinoma basocelular linealSe trata de una variante morfológica poco frecuente que puede asociarse a los diferentes subtipos histológicos de CBC. Su aspecto lineal podría deberse a la limitación del crecimiento lateral por fibrosis dérmica, a interacciones del estroma con las líneas de Langer o a un fenómeno de Koebner. Desde el punto de vista dermatoscópico pueden presentar cualquiera de los criterios dermatoscópicos asociados al CBC34 (fig. 5D).
Dermatoscopia en el manejo del carcinoma basocelularLa presencia de erosiones y ulceración ha demostrado ser un predictor de la respuesta frente a imiquimod. En este sentido una erosión única incrementa siete veces la probabilidad de respuesta completa (RC), la presencia de múltiples erosiones lo hace 38 veces, mientras que la ulceración está asociada a un incremento en ocho veces de la probabilidad de RC35.
La dermatoscopia permite evidenciar la presencia de estructuras pigmentadas en un 30% de CBC no pigmentados clínicamente. Este hecho puede proporcionar información adicional que puede condicionar algunos tratamientos como la terapia fotodinámica36.
El examen dermatoscópico tras tratamientos no ablativos en el CBCs ha demostrado su utilidad en la valoración de tumor residual. En esta línea, la presencia de criterios dermatoscópicos residuales (estructuras pigmentadas, ulceración y telangiectasias arboriformes) predice de forma fiable la persistencia de tumor37,38. Por otro lado, las áreas blanco-rojizas sin estructura y las telangiectasias finas superficiales pueden monitorizarse, mientras que la ausencia de criterios dermatoscópicos asociados al CBCs predice de forma segura la RC histológica38.
Diagnóstico precoz del carcinoma basocelular con dermatoscopiaEl CBC es un tumor de lento crecimiento (aproximadamente 0,5 mm cada 10 semanas). Este hecho unido a su reducida capacidad para metastatizar le confieren en general un buen pronóstico. Sin embargo, en muchas ocasiones existe un retraso diagnóstico que puede condicionar su tratamiento, los costes asociados al mismo y finalmente su pronóstico. La evidencia actual apoya la detección precoz del CBC, especialmente en el área H de la cara, puesto que pequeños cambios en su tamaño pueden tener repercusiones terapéuticas y pronósticas importantes39. En este sentido, lesiones de pequeño tamaño pueden ser tratadas mediante extirpaciones quirúrgicas relativamente sencillas, mientras que el tratamiento de tumores más grandes puede conllevar cirugías complejas y con una gran morbilidad o incluso hacer inviable el tratamiento quirúrgico.
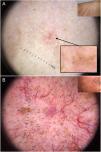
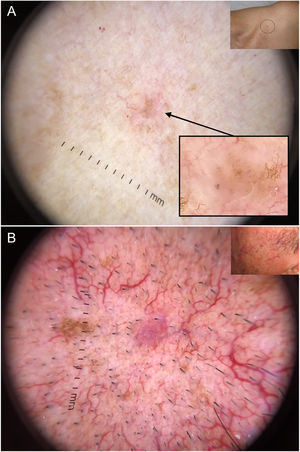
En esta línea, la dermatoscopia ha demostrado ser una herramienta fiable en la detección de lesiones de pequeño tamaño (< 5 mm), habiéndose observado que los CBC presentan habitualmente criterios dermatoscópicos característicos desde su aparición, a diferencia de lo que ocurre con las lesiones melanocíticas40,41 (fig. 6). En el estudio llevado a cabo por Longo et al. solo la ulceración y las erosiones múltiples fueron significativamente más frecuentes en los CBC de mayor tamaño (> 5 mm)40. Por otra parte, las estructuras pigmentadas cómo los nidos ovoides azul-gris y los múltiples puntos azul-gris pueden ser la clave en la detección temprana de lesiones de otro modo escasamente perceptibles40–42.
Carcinomas basocelulares de muy pequeño tamaño. A) Carcinoma basocelular micronodular de 2 mm; las estructuras pigmentadas, en este caso múltiples puntos azul-gris, permitieron reconocerlo; se aprecia la interrupción de las estructuras de la piel circundante (telangiectasias y léntigos). B) Carcinoma basocelular nodular de 3 mm con telangiectasias finas y vasos en horquilla.
La dermatoscopia es una herramienta fundamental en el abordaje actual del CBC. Su utilidad va más allá del reconocimiento de lesiones más o menos evidentes y permite orientar de forma fiable el subtipo histológico, así como detectar lesiones muy incipientes. La exigencia en el diagnóstico precoz del CBC en pacientes con daño actínico tiene como consecuencia una menor morbilidad, con cirugías más simples y un menor coste asociado a su tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.