La dermatitis atópica infantil es una enfermedad de distribución mundial, con una elevada prevalencia en los países desarrollados, lo que la ha convertido en una prioridad de salud. A pesar de que es una entidad que ha sido estudiada durante años todavía existen numerosas controversias en distintas áreas. En esta revisión se comentan los principales trabajos publicados sobre el tema, actualizando diversos conceptos: terminología aplicada (diferencia entre atópica y atopiforme), epidemiología, etiopatogenia (estudios moleculares, genes implicados y factores ambientales), medida de la gravedad, influencia en la calidad de vida del paciente y la familia, impacto económico y tratamientos.
Although childhood atopic dermatitis is reported throughout the world, it has become a health priority in developed countries, where its prevalence is particularly high. Despite extensive study for many years, various aspects of the disease are still subject to debate. This review will discuss the main studies published on the topic and update certain concepts such as the terminology used (the difference between atopic and atopiform), epidemiology, etiopathogenesis (molecular mechanisms, implicated genes, and environmental factors), assessment of severity, influence on the quality of life of the patients and their families, economic impact, and treatment.
La dermatitis atópica es una enfermedad inflamatoria de elevada prevalencia y amplia distribución en el mundo actual, sobre todo en los países desarrollados. Su inicio suele producirse durante la infancia, atenuándose gradualmente con la edad, aunque puede persistir en el adulto e incluso aparecer en esta época de la vida.
La terminología empleada en este tema ha sido motivo de confusión y discusión durante más de un siglo1. El término dermatitis atópica fue acuñado por Wise y Sulzberger en 19332 para definir una entidad que se caracterizaba por sequedad cutánea, prurito, lesiones eritematosas y curso crónico recidivante. En la actualidad se emplean tanto las denominaciones de dermatitis atópica como eccema atópico, y ambas son aceptables.
Recientemente ha resurgido la discrepancia conceptual en el intento de separar aquellas formas de dermatitis atópica que no presentan otros datos de atopia. Se ha propuesto el nombre de «dermatitis atopiforme» para aquellos cuadros que muestran los signos clínicos de dermatitis atópica pero que no tienen sensibilización a alergenos del medio ni presencia de IgE específica para algún alergeno; es lo que también se ha denominado dermatitis atópica «intrínseca»3,4. Según los defensores de esta división así se logrará una mayor fiabilidad de los estudios sobre el tema, que están dificultados por el sesgo de selección4. Otros autores consideran que lo único que logra la nueva terminología es confundir a facultativos y pacientes, sin mejorar el tratamiento ni la información, así como incrementar el número de pruebas de tipo alérgico5. Por otra parte, también es conveniente aclarar la definición del término «atopia», empleado por primera vez por Coco y Cooke en 19236 para denominar una entidad familiar caracterizada por hipersensibilidad de piel y mucosas a alergenos del medio con elevación de IgE. En una publicación de consenso de la Organización Mundial de Alergia7 se ha definido el término atopia como «tendencia personal o familiar para la sensibilización y producción de anticuerpos IgE en respuesta a la exposición a alergenos ordinarios» y se recomienda reservarlo para la predisposición genética al desarrollo de anticuerpos IgE específicos frente a alergenos comunes.
EpidemiologíaLa dermatitis atópica infantil se ha convertido en un problema de salud pública en los países desarrollados, con una prevalencia entre el 20 y 30%8. Dicha prevalencia ha aumentado en las últimas décadas en estos países, multiplicándose por 3 o por 49. Según el Estudio Internacional de Asma y Alergias en la Infancia (ISAAC), la prevalencia de síntomas de dermatitis atópica en niños de 6 o 7 años durante un período mínimo de un año presentó una gran variabilidad entre distintas zonas geográficas: se acerca a ese 20 % en Inglaterra o Australia mientras que presenta valores inferiores al 2 % en China o Irán10. Estudios recientes parecen indicar que la prevalencia de dermatitis atópica puede haber tocado techo en algunos países, presentando valores estables en los últimos años, como en el caso de Dinamarca o Japón11,12. No obstante, un estudio realizado en Suiza en niños de 5 a 7 años constata la estabilización de la prevalencia de asma alérgica y de rinoconjuntivitis entre 1991 y 2001, mientras persiste el incremento de la dermatitis atópica, especialmente entre las niñas13.
Las zonas urbanas presentan una prevalencia mayor que las rurales dentro de los países desarrollados, y las clases sociales altas se encuentran más afectadas14. En cuanto a la afectación por sexos un estudio entre adolescentes de 12 a 16 años encontró una prevalencia mayor en las mujeres (25,7 %) que en los varones (17 %)15. Un reciente trabajo realizado entre niños de 5 a 7 años diferencia entre eccema de tipo atópico y no atópico (siendo este último aquel que sólo presenta los datos clínicos de dermatitis atópica, pero sin sensibilización a ningún alergeno). Los resultados muestran una frecuencia global de eccema mayor en las niñas, mientras que la frecuencia de eccema atópico es igual en ambos sexos16.
En el 45 % de los casos en niños el comienzo de la dermatitis atópica se produce durante los primeros 6 meses de vida, en el 60 % durante el primer año y en más del 85% antes de los 5 años de edad17. Se ha postulado que el 30% de los niños con dermatitis atópica desarrollan asma y el 35 % rinoconjuntivitis18. Sin embargo el concepto popular de la «marcha atópica» (niños que comienzan con eccema atópico y posteriormente sufren asma y rinoconjuntivitis según se hacen mayores) se encuentra en discusión19. Un estudio multicéntrico de cohortes realizado en Alemania mostró que la presencia de sibilancias precoces en el niño y un patrón de sensibilización determinado eran los principales predictores de la existencia de asma en la edad escolar, independientemente de la presencia de dermatitis. Sin estos dos factores asociados, el eccema en edades tempranas por sí solo no aumentaba el riesgo de asma20.
EtiopatogeniaLa etiopatogenia de la dermatitis atópica es compleja; existen numerosos factores implicados y buena parte de ellos todavía no son bien conocidos, como tampoco lo es la relación existente entre los mismos. Clasificaremos los factores implicados en tres grupos distintos para su mejor comprensión.
Mecanismos inmunológicos y bioquímicosEstá comúnmente aceptado que existen alteraciones inmunológicas implicadas en el desarrollo de la dermatitis atópica, pero persisten controversias en cuanto a la relación causa-efecto, el tipo de anomalías implicadas y la relación entre ellas21.
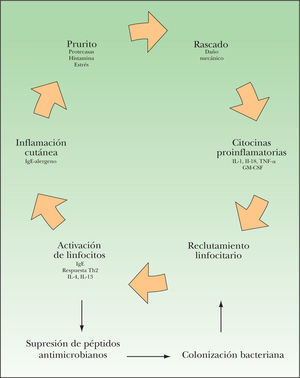
En el origen del eccema atópico parece existir un ciclo que se retroalimenta: el prurito y el daño mecánico producido por el rascado inducen la producción de citocinas proinflamatorias (IL-1, IL-18, TNF-α, GM-CSF) que reclutan a los leucocitos en la piel22. Las distintas poblaciones leucocitarias se activan a través de diferentes procesos; los linfocitos sufren una diferenciación a la vía Th2 inducidos por las células dendríticas; estas células dendríticas muestran asimismo una capacidad aumentada para la presentación de antígenos y se unen a los complejos IgE-antígeno. Los complejos IgE-antígeno inducirán asimismo la agregación y activación de los mastocitos. Las células Th2 activadas liberan IL-4 e IL-13, que suprimen la producción de péptidos antimicrobianos (β-defensinas 2 y 3). Virus, bacterias y hongos se aprovechan de esta disminución, colonizando la piel y liberando productos proinflamatorios (superantígenos, proteoglicanos y ácido lipotecoico) que amplificarán la activación leucocitaria. Con esta activación se incrementa la liberación de mediadores inflamatorios, como las proteasas y la IL-31, que perpetúan el prurito (fig. 1).
Recientes trabajos dan un paso más en el estudio de la cadena bioquímica, relacionando las alteraciones moleculares con la gravedad clínica; de este modo se ha correlacionado el nivel sérico de IL-16 (marcador de diferenciación Th2) y el índice clínico de severidad SCORAD23.
En un estudio reciente se ha abierto la puerta a nuevas interrelaciones, en concreto con la obesidad. Un trabajo con más de 400 niños de 10 años de edad encontró niveles menores de adiponectina en los que padecían dermatitis atópica24. La adiponectina regula el metabolismo energético, y valores bajos también se han asociado con resistencia a la insulina, obesidad y mayor riesgo de enfermedades cardiovasculares. En un futuro serán necesarios nuevos estudios que profundicen en estas correlaciones, todas ellas de gran importancia.
También se ha publicado hace poco tiempo algún trabajo que extiende el estudio del óxido nítrico exhalado más allá del asma. Hasta ahora se había observado su elevación en asmáticos, valorándose como marcador de inflamación bronquial. En un trabajo llevado a cabo en niños en Holanda se encontró que los que padecían dermatitis atópica tenían valores de óxido nítrico exhalado menores que los que no presentaban dermatitis, independientemente de la presencia de asma25. Esto debería llevar a la investigación del papel del óxido nítrico más allá de la patología bronquial.
GenéticaLa asociación familiar de la dermatitis atópica y el elevado nivel de concordancia entre gemelos univitelinos indican una importante implicación de las alteraciones genéticas en su patogenia. Por otra parte, la asociación con asma y rinitis alérgicas señala alteraciones genéticas que se correlacionan con los desequilibrios inmunes de tipo Th2. Se ha implicado un grupo de genes localizados en el cromosoma 5q31-3326, que regulan la producción de interleuquinas de la vía Th2 como son las IL-3, 4, 5 y 13, así como el GM-CSF. También se han identificado polimorfismos en la región que codifica el receptor de la IL-4 (16q12) y mutaciones en la región promotora del gen RANTES (17q11) que influirían en la expresión de la dermatitis atópica8.
Asimismo se han asociado polimorfismos en el gen SPINK5 (afectado en el síndrome de Netherton) en el eccema atópico27, así como mutaciones en el gen de la filagrina, implicado en la ictiosis vulgar y con elevada frecuencia de portadores en la población europea28.
Por otra parte se han encontrado coincidencias en el análisis genético entre dermatitis atópica y psoriasis, en concreto los loci 1q21, 17q25 y 20p, lo que podría indicar algún tipo de relación entre estas dos enfermedades inflamatorias29.
Factores ambientalesEl incremento que se ha producido en la prevalencia de la dermatitis atópica infantil en los países desarrollados ha dado lugar a la aparición de múltiples teorías sobre posibles factores ambientales implicados.
Los incrementos observados en la prevalencia de patología alérgica probablemente dependan más de factores ambientales que de otras características del individuo. Esto parece sustentarse con estudios como los realizados en población alemana, donde se obtienen prevalencias significativamente diferentes de enfermedades alérgicas entre el Este y el Oeste, siendo las características genéticas de los individuos similares, pero con marcadas diferencias ambientales y socioeconómicas, especialmente antes de la unificación30.
Alrededor del 33 % de los niños con dermatitis atópica moderada a grave presentan positividad para IgE específica frente a alguna proteína alimentaria. Este es un valor mucho más alto que en la población normal; no obstante, solamente una minoría de esos alergenos presenta relevancia clínica, comprobada por pruebas de provocación17,31. Por otra parte, en un estudio publicado recientemente se ha correlacionado la presencia de alergia a las proteínas del huevo con una mayor gravedad del eccema atópico y con un mayor tiempo de evolución de las lesiones32.
La alimentación con leche materna ha sido citada repetidamente como factor protector de dermatitis atópica; un metaanálisis realizado por Gdalevich33 et al mostró que la alimentación exclusiva con leche materna durante los tres primeros meses de vida se asocia con una menor incidencia de dermatitis atópica, pero solamente en aquellos niños con antecedentes familiares de primer grado de la enfermedad.
Ha recibido mucha atención la «hipótesis de la higiene» que promulga que la menor exposición de los niños a gérmenes que se produce en las zonas desarrolladas puede evitar una adecuada maduración del sistema inmunológico. De este modo, una menor incidencia de infecciones en edades tempranas condicionará una mayor probabilidad de padecer dermatitis atópica. Esta teoría ha dado lugar a múltiples estudios, que han sido recientemente revisados en su mayoría por Flohr et al34. En estos trabajos no se ha podido establecer una relación causal consistente entre la infección por algún patógeno concreto y la menor incidencia de dermatitis atópica. Por otra parte, Zutavern et al35 han elaborado un estudio de cohortes históricas con más de 4.000 niños en los que se analizaba la exposición a infecciones respiratorias (pudiendo el niño desarrollar infección clínicamente o no). El resultado fue que la exposición a infecciones respiratorias durante el embarazo y durante el primer año de vida tenía un efecto protector en el desarrollo posterior de atopia (tanto dermatitis como asma o rinitis).
Se ha observado en dos estudios de cohortes36,37 que los niños que son enviados a la guardería presentan una menor incidencia de dermatitis atópica. El contacto con animales constituye un motivo de discusión, ya que algunos trabajos no han encontrado diferencias, mientras otros concluyen un efecto preventivo de cara al desarrollo de eccema atópico, e incluso en algún caso con disminución de la concentración de IgE34. En este mismo sentido se ha postulado que el crecimiento en el medio rural, especialmente en granjas, podría tener un efecto beneficioso en el desarrollo de atopia. Varios estudios no han encontrado asociación34, pero un estudio de cohortes sueco de larga duración encontró una reducción en la incidencia de dermatitis atópica en los nacidos después de 1971 que habían crecido en granjas38.
También se ha estudiado el efecto de la exposición a endotoxinas, un grupo de polisacáridos de la superficie celular de bacterias gramnegativas. Estas podrían ser inductoras de IL-10 e interferón-alfa, además de servir de explicación a la influencia de las mascotas y el entorno agrícola en la frecuencia de dermatitis atópica. Se ha observado en dos estudios de cohortes39,40 que los niños que están en contacto con endotoxinas durante los primeros meses de vida desarrollan dermatitis atópica con menor frecuencia.
ClínicaExiste un amplio espectro en la presentación clínica del eccema atópico, desde mínimas lesiones flexurales hasta eritrodermia. La piel del niño presenta generalmente una intensa xerosis y el prurito es un dato constante. Sobre la superficie cutánea pueden aparecer lesiones en cualquier localización, pero existe un patrón de afectación típico que varía con la edad41. En la dermatitis atópica del lactante (hasta los dos años) las lesiones suelen ser más agudas, con pápulas y vesículas que se erosionan precozmente. Estas se localizan con preferencia en la cara, sobre todo en la frente y las mejillas, aunque suelen respetar la zona perioral. También suelen presentarse lesiones en zonas de extensión de los miembros, así como en el cuero cabelludo. A partir de los dos años las lesiones cambian, y suelen hacerse más crónicas, con liquenificación y engrosamiento cutáneo. Además, las zonas donde se localizan se vuelven más específicas, con preferencia por los pliegues antecubitales y poplíteos, caras de flexión de las muñecas, cara anterior de los pies y el primer dedo. Se produce también con frecuencia la afectación labial, en muchos casos empeorada por el chupeteo y la humedad constante de la zona42.
Gravedad y calidad de vidaLa valoración de la gravedad de la dermatitis atópica ha sido y es motivo de controversia y se han diseñado varios índices para su medición objetiva. El más conocido y utilizado es el SCORAD, que combina la medición de la superficie afectada con la regla de los nueves y la presencia de 6 datos clínicos: eritema/pigmentación, edema/pápulas, exudado/costra, excoriación, liquenificación/prurigo y xerosis. Se añade además una valoración del prurito y de la alteración del sueño. A mayor puntuación, mayor gravedad, estableciéndose tres grados principales: leve con una puntuación menor de 15, moderada entre 15 y 40 y grave por encima de 4043. Este índice ha sido cuestionado sobre todo en su relación con la afectación subjetiva por parte del paciente y sus familiares44. Se han postulado otros parámetros para evaluar la gravedad del cuadro, como por ejemplo la combinación de tres signos clínicos que han demostrado ser predictores independientes de gravedad: excoriación, eritema y edema/pápulas45.
Por otra parte, se han desarrollado varias pruebas no invasivas para la medición objetiva de la gravedad46, como son la medida de la pérdida de agua transepidérmica, la evaluación del eritema y la pigmentación mediante espectroscopia, la ecografía de alta frecuencia para identificar el edema o la evaluación del perfil epidérmico para estudiar la descamación y la rugosidad cutáneas. Todos estos estudios pueden ser útiles tanto en la evaluación de la gravedad como en la investigación de la fisiopatología de la enfermedad.
La calidad de vida también es un parámetro importante a la hora de abordar un paciente con dermatitis atópica. Un reciente estudio43 muestra que en esta patología se ven afectadas significativamente la salud mental, el equilibrio emocional y las relaciones sociales. Además, se recomienda el empleo de escalas de calidad de vida que tengan en cuenta estos aspectos principalmente y den menos importancia a la afectación física. Pero no sólo se encuentra afectada la calidad de vida del paciente que sufre la enfermedad, sino también la del entorno familiar. El cuidado de un niño con dermatitis atópica se ha relacionado con alteraciones del sueño en los padres, que son comparativamente mayores que en los padres de hijos asmáticos. Esta afectación del ritmo del sueño se correlaciona también con un mayor grado de ansiedad y de depresión (esta última solamente en las madres)47.
DiagnósticoEl diagnóstico de la dermatitis atópica se realiza mediante la clínica, dado que no existe ninguna prueba que ofrezca sensibilidad o especificidad relevantes. A pesar de ser una patología ampliamente estudiada no existe un consenso definitivo para realizar dicho diagnóstico. Existen varios factores que pueden influir en este problema, como son la heterogeneidad clínica de la enfermedad, su variabilidad en el tiempo, la implicación de otras especialidades como alergología, pediatría, etc.
Para solucionar este problema se han elaborado diversos criterios diagnósticos, entre los que destacan los de Hanifin y Rajka por un lado y los del Grupo de Trabajo Británico por otro. Hanifin y Rajka elaboraron en 1980 una serie de criterios clínicos para el diagnóstico de la dermatitis atópica, con el consenso de autores estadounidenses y europeos48. Constituyen un grupo de signos y síntomas que se agrupan en manifestaciones mayores y menores, debiendo estar presentes al menos 3 de cada grupo (tabla 1). El manejo habitual de estos criterios es difícil, y se complica más debido a las características propias de la patología, que varían con la edad. El Grupo de Trabajo Británico, por su parte, elaboró unos criterios diagnósticos más sencillos (tabla 2), partiendo de la colaboración de dermatólogos, pediatras y médicos de atención primaria49-51. Estos criterios diagnósticos han sido comparados observándose que los de Hanifin y Rajka presentan una mayor sensibilidad que los del Grupo de Trabajo Británico (96 frente a 86 %) y una especificidad similar (93 frente a 95 %)52. Esto indicaría que los criterios diseñados por Hanifin y Rajka serían superiores, pero en la práctica muchos autores dudan de su aplicabilidad, especialmente en los estudios poblacionales, debido al tiempo necesario para aplicarlos, la presencia de pruebas de laboratorio (IgE, epicutáneas) y parecerían más indicados para su uso hospitalario. Los pacientes con enfermedad leve suponen el principal problema para el empleo de criterios diagnósticos; los criterios de Grupo Británico presentan dificultades, concretamente si la prevalencia es baja y existe otra patología pruriginosa frecuente en la población53.
Criterios diagnósticos de Hanifin y Rajka (45)
| A. Mayores |
| Prurito |
| Morfología y distribución típica: |
| Liquenificación flexural (adultos) |
| Afectación de cara, flexuras y superficie de extensión (niños) |
| Cronicidad y recurrencias |
| Antecedentes familiares o personales de atopia |
| B. Menores |
| Xerosis |
| Ictiosis |
| Hiperlinealidad palmar |
| Queratosis pilar |
| Reactividad cutánea en pruebas cutáneas (respuesta tipo I) |
| Elevación de IgE sérica |
| Comienzo a edad temprana |
| Incremento de infecciones cutáneas y déficit de inmunidad celular |
| Dermatitis inespecíficas de manos y pies |
| Eccema del pezón |
| Queilitis |
| Conjuntivitis recidivante |
| Doble pliegue de Dennie-Morgan |
| Queratocono |
| Catarata subcapsular anterior |
| Oscurecimiento de párpados |
| Palidez facial o eritema |
| Pitiriasis alba |
| Pliegues en la parte anterior del cuello |
| Prurito con el sudor |
| Intolerancia a la lana y disolventes de grasas |
| Acentuación perifolicular |
| Intolerancia a alimentos |
| Evolución influida por factores emocionales y ambientales |
| Dermografismo blanco o blanqueamiento retardado |
Criterios diagnósticos del Grupo de Trabajo Británico (49-51)
| Necesario |
| Patología cutánea pruriginosa en los últimos 12 meses |
| Al menos 3 de los siguientes |
| Inicio antes de los 2 años de edad (no usar en niños menores de 4 años) |
| Historia de afectación de flexuras |
| Historia de piel seca |
| Dermatitis flexural visible o por fotografías |
| Historia personal de atopia (o familiar atópico en primer grado si son menores de 4 años) |
La dermatitis atópica constituye una carga económica cuantiosa tanto para las familias como para los sistemas de salud. Se han realizado varios estudios para cuantificar el valor económico exacto de los tratamientos prescritos, la asistencia médica, las medidas de cuidados y las horas dedicadas a la enfermedad. En un estudio multicéntrico realizado recientemente en Alemania, la media de coste económico de un brote de dermatitis atópica es de 123 euros por paciente. Anualmente cada enfermo supone un total de 1.425 euros, con un rango que fluctúa entre 956 (cuadros leves) y 2.068 euros (graves)54. En un estudio en niños preescolares realizado en el Reino Unido se estimaron unos costes medios de 79,59 libras esterlinas por niño al año, correspondiendo la mayoría a las consultas asumidas por el sistema nacional de salud (28,62 libras/niño/año) y a las prescripciones (22,03 libras/niño/año). Del total de prescripciones, el 76 % de los costes correspondían a emolientes y productos de higiene y baño55. Se realizó un estudio multicéntrico en EE.UU. comparando los costes de cada enfermedad de la tríada atópica, obteniéndose una medi de 219 dólares por paciente y año en dermatitis atópica, 627 dólares por paciente y año en asma y 57 dólares por paciente y año en rinoconjuntivitis. En este estudio se destaca que, en los casos del asma y de la dermatitis los costes son mayores en los momentos en que los tratamientos se aplican por primera vez, descendiendo luego, lo que parece indicar que el aprendizaje es importante en el manejo de estas patologías y contribuye a disminuir los costes asociados56.
TratamientoTópicoEn el tratamiento de la dermatitis atópica los corticoides tópicos se consideran el patrón oro con el que se deben comparar el resto de tratamientos57. Se han recogido más de 80 ensayos clínicos aleatorizados y controlados con terapia corticoidea tópica en dermatitis atópica, presentando buenos resultados globales58. La potencia y la formulación empleada dependerán de la zona a tratar y de la cronicidad de las lesiones, necesitando las zonas liquenificadas una mayor potencia. Una aplicación diaria es suficiente, no presentando ventajas el uso de medicación dos veces al día, lo que sí puede aumentar los efectos secundarios18. Se ha visto que la aplicación de glucocorticoides sobre la piel sana dos veces por semana puede reducir la frecuencia de brotes en comparación con el uso de emolientes solos, por lo que puede estar indicado este tratamiento de mantenimiento en casos rápidamente recidivantes o graves59,60. Además, su empleo ha demostrado disminuir la colonización cutánea por S. aureus61. Los efectos secundarios son bien conocidos y frecuentemente sobrestimados por los pacientes y sus familiares, a pesar de que las nuevas formulaciones han demostrado un potencial de atrofia cutánea mucho menor que las antiguas y de que varios estudios han encontrado una incidencia muy baja de complicaciones tanto locales como sistémicas18.
La aplicación de antibióticos tópicos asociados a la terapia corticoidea presenta ventajas frente a los corticoides tópicos17. El antibacteriano tópico de elección parece ser el ácido fusídico, debido a su baja concentración mínima inhibitoria y a su capacidad de penetración62.
Los inhibidores tópicos de la calcineurina han demostrado ser efectivos en el tratamiento de la dermatitis atópica. Tacrolimus tópico parece presentar una eficacia similar a los corticoides de potencia alta, mientras que pimecrolimus es sustancialmente menos potente63. Los estudios comparativos existentes en edades pediátricas confirman una eficacia superior de tacrolimus tópico frente a pimecrolimus e hidrocortisona. No parecen existir diferencias significativas en cuanto a la respuesta a la concentración al 0,03 y 0,1%64 en niños. Tanto tacrolimus como pimecrolimus no producen atrofia cutánea, pero sí presentan otros efectos secundarios; en el momento de su aplicación producen sensación de prurito-quemazón local, lo que supone una molestia añadida en la piel del niño atópico. No se encontraron diferencias en la frecuencia de efectos adversos en niños entre las concentraciones de tacrolimus 0,03 % y 0,1 %, así como tampoco se observaron comparando tacrolimus con pimecrolimus64. Su uso está contraindicado en pacientes con síndrome de Netherton, debido a la posibilidad de absorción sistémica. Recientemente la Agencia Norteamericana del Medicamento (FDA) lanzó una advertencia respecto al uso de ambos fármacos, en función de una posible falta de seguridad a largo plazo y a una posible relación con ciertos tumores, especialmente linfomas. Un reciente estudio de cohortes65 no ha demostrado que el empleo de estos productos aumente el riesgo de padecer linfomas. Por otra parte, los estudios de coste-eficacia de los inhibidores de la calcineurina frente a los esteroides tópicos defienden el empleo de los primeros como medicamentos de segunda línea66. Al igual que ocurre con los corticoesteroides tópicos existen estudios que apoyan el empleo tanto de tacrolimus como de pimecrolimus tópicos como terapia de mantenimiento una vez mejorado el brote, obteniéndose un tiempo más prolongado de remisión clínica y reduciendo la dosis total de corticoides tópicos total67,68.
El empleo de emolientes es ampliamente reconocido como medida básica en el tratamiento y la prevención de los brotes de dermatitis atópica. Se ha demostrado que su uso combinado con esteroides tópicos acelera la curación y disminuye la cantidad de esteroide necesaria para resolver el brote69.
SistémicoLos corticoides sistémicos se recomiendan en pautas cortas para controlar brotes agudos de eccema, teniendo en cuenta que es frecuente el rebrote al suspender el tratamiento. No se aconseja el empleo a largo plazo en niños17.
Existen pocas evidencias que sustenten el uso de antihistamínicos orales en la dermatitis atópica57. El empleo de antihistamínicos con efecto sedante puede ayudar al sueño nocturno, aunque no por su efecto antipruriginoso. Por otra parte, el niño puede beneficiarse de estos fármacos en otras manifestaciones de atopia, como la rinoconjuntivitis o el dermografismo.
Ciclosporina ha demostrado un rápido control de los síntomas, pero se produce un rebrote rápido al suspender su administración70. El tratamiento continuado con ciclosporina oral ha logrado un control satisfactorio de la sintomatología71. Se ha comparado en niños el uso mantenido de este fármaco (un año) con la realización de ciclos de tratamiento de 12 semanas con al menos 7 días de descanso entre ellos. El tratamiento continuado resultó más efectivo en general, pero en algunos casos se logró un buen control de la enfermedad con dosis acumuladas bastante inferiores, por lo que sería una opción a valorar72. Un reciente metaanálisis73 confirma la eficacia de este fármaco, estimando la mejoría clínica en un 55 % de media (si bien se echa en falta la existencia de estudios de mayor tamaño y con un plazo de tiempo superior).
Se han empleado otros inmunosupresores en el tratamiento de la dermatitis atópica grave, como azatioprina, que en un ensayo clínico aleatorizado mostró una reducción de la actividad de la enfermedad del 26 % en 12 semanas en dosis de 2,5mg/kg. Sin embargo, se observaron efectos secundarios como leucopenia y problemas gastrointestinales, en ocasiones graves74. Menos pacientes han recibido micofenolato mofetil, observándose unos resultados prometedores en cuanto a la mejoría en dos estudios (55 y 68 %), aunque el número de casos presentado es pequeño75,76.
La fototerapia puede ser eficaz en el manejo de la dermatitis atópica y se realiza con frecuencia en adultos, si bien no se recomienda su uso en menores de 12 años, salvo en casos excepcionales17.
El interferón-γ se ha mostrado eficaz en algunos estudios, en los que se incluían tanto adultos como niños, disminuyendo la actividad de la dermatitis entre el 30 y el 50 %. No se ha encontrado beneficio en el empleo de inmunoglobulinas intravenosas77.
La restricción dietética ha demostrado ser eficaz en el caso de los niños con IgE específica frente al huevo, pero no se han establecido otros alimentos en los que suceda lo mismo57. Parece lógico establecer dietas libres de aquellos alimentos a los que se ha demostrado alergia mediante RAST, si bien la prueba más importante sería la de provocación, que en muchos casos no puede realizarse17.
El empleo de probióticos en el tratamiento y la prevención de la dermatitis atópica había levantado expectativas inicialmente; sin embargo, varios estudios realizados en niños encontraron que la administración de Lactobacillus no ofrece ventajas en el tratamiento de los brotes de eccema78 ni en la prevención del desarrollo de dermatitis atópica79. Incluso se ha observado una mayor frecuencia en la sensibilización a diversos alergenos comprobada mediante prick-test en los niños que recibieron Lactobacillus acidophilus en los primeros 6 meses de vida79.
En los últimos años los tratamientos biológicos han aparecido en el campo de la dermatología, demostrando múltiples posibilidades. Se ha probado infliximab en adultos con dermatitis atópica grave, administrándose en 9 pacientes y lográndose inicialmente una buena respuesta, pero que solamente se mantuvo a largo plazo en dos de ellos80. Etanercept se empleó en dos niños con dermatitis atópica, sin obtenerse mejoría y con complicaciones asociadas81. Efalizumab presenta, al menos en principio, unos mejores resultados en dermatitis atópica. Se ha publicado una serie de 10 pacientes (adultos) con dermatitis atópica tratados con efalizumab durante 12 semanas, lográndose en 6 de ellos mejorías evidentes (superiores al 50 % de EASI [Eczema Area and Severity Index])82. Existe un trabajo publicado donde un niño con dermatitis atópica grave tratado con efalizumab presentó mejoría; previamente su evolución había sido mala a pesar de haber recibido ciclosporina y etanercept83. Omalizumab es un anticuerpo monoclonal humanizado anti-IgE que se emplea en el tratamiento del asma persistente en mayores de 12 años con función pulmonar reducida. Existen varias series de casos donde se ha obtenido buena respuesta en pacientes con dermatitis atópica refractaria a otros tratamientos84,85. También se han publicado tres casos donde se ha empleado sin mejoría86. Algunos autores indican que unos niveles de IgE demasiado elevados condicionarían un menor efecto, teniendo este fármaco su hueco en casos donde la elevación de IgE sérica no supere las 7.000 UI/ml87.
En cuanto al cuidado de los aspectos emocionales de la dermatitis atópica parece recomendable una atención psicológica basada en una intervención educativa e informativa sobre los aspectos clínicos y preventivos de la enfermedad. Existe un trabajo donde se observó que esa intervención disminuía los índices de ansiedad88. Sin embargo, un reciente estudio realizado en España no observó diferencias globales en los niveles de ansiedad realizando o no intervención, aunque sí existían diferencias en el subgrupo de edades de 9 a 15 años89.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.