Los linfocitos T CLA+ representan un subgrupo de linfocitos T de memoria con tropismo cutáneo que están implicados en diferentes enfermedades cutáneas mediadas por células T.
Material y métodosSe estudió la expresión de algunos genes asociados a la psoriasis en queratinocitos de enfermos y sanos cultivados en diferentes condiciones, entre ellas la activación por sobrenadantes de linfocitos T CLA+ activados mediante anti-CD3/anti-CD28.
ResultadosLos queratinocitos psoriásicos activados por linfocitos CLA+ expresan más IP-10, HLA-DR, ICAM-1 e iNOS.
DiscusiónEstos resultados sugieren que hemos establecido un modelo in vitro que permite estudiar la función efectora de los linfocitos T CLA+ sobre los queratinocitos en la psoriasis. Este modelo puede permitir la identificación de genes relevantes en la patogenia de la psoriasis al ser inducidos por linfocitos T CLA+.
Cutaneous lymphocyte antigen (CLA) is expressed by a subgroup of memory T cells that exhibit skin homing and are implicated in cutaneous T-cell-mediated diseases.
Material and methodsExpression of genes associated with psoriasis was analyzed in keratinocytes taken from patients and healthy individuals and cultured under different conditions, including activation using supernatants from CLA+ T lymphocytes activated with anti-CD3 and anti-CD28 antibodies.
ResultsKeratinocytes from psoriasis patients activated by CLA+ T lymphocytes expressed higher levels of interferon-inducible protein 10, HLA-DR, intercellular cell adhesion molecule 1, and inducible nitric oxide synthase.
ConclusionsOur results suggest that we have developed an in vitro model that will allow analysis of the effector role of CLA+ T lymphocytes on keratinocytes in psoriasis. This model may allow the identification of genes involved in the pathology of psoriasis through induction by CLA+ T lymphocytes.
El antígeno leucocitario cutáneo (CLA) es un carbohidrato de membrana que se induce durante la activación del linfocito en el ganglio linfático, y que confiere a las células que lo expresan un tropismo cutáneo y la capacidad de infiltrar la piel1,2. Hasta la fecha, los linfocitos T CLA+ circulantes han sido implicados en la patogénesis de las inflamaciones cutáneas crónicas mediadas por células T como la dermatitis atópica, el eccema de contacto, el vitíligo y la dermatitis alérgica de contacto1,3. En la psoriasis estos linfocitos T CLA+ con tropismo cutáneo presentan papeles patogénicos diferentes en las fases aguda y crónica de la enfermedad4,5. En la fase aguda estarían implicados en el desencadenamiento de la lesión psoriásica a través de su interacción con las células dendríticas y los queratinocitos6. Recientemente hemos demostrado un mayor grado de activación de linfocitos T CLA+ circulantes, correlacionándose con el PASI y el BSA en las fases agudas de la psoriasis7. En las lesiones crónicas, las células T infiltrantes persistirían activadas y producirían mediadores que mantendrían el crecimiento y la diferenciación de los queratinocitos a través de mediadores derivados de las células dendríticas8.
Dado que los linfocitos T CLA+ constituyen la mayoría de los linfocitos T presentes en las placas psoriásicas9, el estudio de su interacción sobre células residentes como los queratinocitos puede aportar información sobre los mecanismos patológicos de la psoriasis. Aunque en los últimos años se ha podido caracterizar el perfil de expresión génica10 todavía no se ha estudiado la influencia que tienen los linfocitos T en la expresión génica de células relevantes como los queratinocitos. Este estudio ha desarrollado un modelo in vitro que permite determinar qué genes inducen los linfocitos T CLA+ activados en los queratinocitos psoriásicos del mismo individuo.
Material y métodosSe estudiaron muestras de sangre periférica y biopsias cutáneas procedentes de tres pacientes adultos con psoriasis vulgar (excluyéndose explícitamente aquellos con eritrodermia, psoriasis pustulosa o artritis asociada). A todos ellos se les practicó una extracción sanguínea para aislar las subpoblaciones linfocitarias CLA+ y CLA– y una biopsia cutánea en fresco para el cultivo celular y el estudio de la expresión génica.
A los pacientes incluidos en el estudio se les había practicado previamente una biopsia confirmatoria. Se valoró la gravedad (PASI), extensión (BSA) y se revisaron las características clínicas, incluyendo los posibles factores desencadenantes (infección estreptocócica, estrés, etc.). Las muestras se obtuvieron tras un período de blanqueo mínimo de 6 semanas sin ningún tipo de tratamiento. Asimismo, se incluyeron en el estudio dos controles sanos. Todos los pacientes y controles firmaron un consentimiento informado.
Purificación de linfocitos T CLA+ circulantes de sangre periférica y activaciónLas células T CLA+ se purifican a partir de linfocitos obtenidos de sangre periférica mediante una separación de Ficoll a partir de 60ml de sangre. Seguidamente se realizan tres separaciones inmunomagnéticas consecutivas utilizando anticuerpos conjugados a partículas magnéticas según el protocolo descrito11. Las dos primeras separaciones eliminan linfocitos CD14, CD19, CD16, y CD45RA, obteniéndose una suspensión celular de linfocitos T de memoria CD45R0. La tercera separación permite escindir las subpoblaciones de células de memoria CLA+ y CLA– de dicha población de linfocitos T de memoria. Los linfocitos purificados se incuban en RPMI 10 % FCS y se activan con anti-CD3 y anti-CD28 a razón de 500.000 células/ml.
Transcurridas 48 horas se obtienen los sobrenadantes de estos cultivos y se congelan a -80°C hasta su posterior utilización para activar los cultivos de queratinocitos.
Cultivo de queratinocitosSe cultivaron queratinocitos procedentes de biopsias cutáneas según los protocolos previamente publicados. Se incubaron los queratinocitos cultivados (P2-P4) durante 6 horas con o sin estímulo (IFN-γ 100 U/ml o sobrenadantes de células T activadas con anti-CD3/anti-CD28).
Se realizó la extracción del ARN de los queratinocitos cultivados mediante el kit Gene Elute Mammalian (Sigma) y se procedió a la realización de cADN mediante el kitHigh Capacity cADN Reverse Transcription (Applied Biosystems) para su posterior análisis por reacción en cadena de la polimerasa a tiempo real (RT-PCR) mediante ABI7900HT (Applied Biosystems) y procesado de la información con el programa de análisis SDS Ver. 1.0 (Applied Biosystems).
Análisis de la expresión génica en queratinocitos mediante reacción en cadena de la polimerasa a tiempo realSe han evaluado 18 genes en queratinocitos (tabla 1). Los resultados se presentan como RQ (Relative Quantity). Este parámetro está normalizado para un house–keeping gene interno que es la GAPDH.
Genes expresados en queratinocitos y analizados inicialmente por RT-PCR
| Gen | Relevancia |
| IL-7 | Citoquina relacionada con la inflamación crónica y supervivencia de linfocito T |
| IL-8 | Quimiocina específica de neutrófilos |
| IP-10 | Quimiocina específica de linfocitos T activados |
| IL-15 | Citoquina relacionada con la inflamación crónica |
| VEGF | Factor pro-angiogénico |
| ICAM-1 | Molécula de adhesión indicadora de activación de queratinocitos |
| TNF-α | Citoquina proinflamatoria clave en psoriasis |
| HLA-DR2 | Molécula asociada a la presentación de antígenos a los linfocitos T |
| Psoriasin | Péptido antimicrobiano natural |
| TLR1 | Receptor asociado a la respuesta immune innata |
| TLR2 | Receptor asociado a la respuesta inmune innata |
| TLR5 | Receptor asociado a la respuesta inmune innata |
| IL-19 | Citoquina expresada en psoriasis poco caracterizada |
| IL-20 | Citoquina expresada en psoriasis poco caracterizada |
| CCL-27 | Quimiocina específica para linfocitos T CLA+ |
| Ki67 | Indicador de proliferación celular |
| EGF | Factor de crecimiento epidérmico |
| ERB-B2 | Señalización del crecimiento celular |
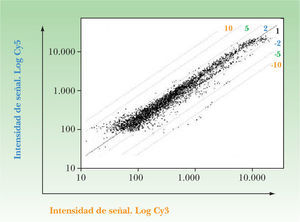
Se realizó un estudio de expresión génica utilizando el sistema de PIQOR Skin Patho microarray de la compañía Memorec (Colonia, Alemania) de queratinocitos de psoriasis incubados con sobrenadantes de linfocitos CLA+ activados con CD3/CD28 y de queratinocitos de psoriasis incubados con sobrenadantes de linfocitos CLA+ no activados, con el objetivo de estudiar diferencias de expresión de 1.127 genes expresados en la piel. Para ello se obtuvo el ARN de los queratinocitos psoriásicos incubados durante 6 horas con sobrenadantes de linfocitos T CLA+ activados o no activados. El ARN de queratinocitos activados con sobrenadantes de linfocitos T CLA+ se marcó con Cy5 y el de los incubados con sobrenadante de linfocitos T CLA+ no activados con Cy3.
ResultadosActivación de queratinocitos psoriásicos y sanos por subpoblaciones de linfocitos memoria (CLA+/CLA–)Análisis de la expresión génica mediante reacción en cadena de la polimerasa a tiempo real.
La incubación de queratinocitos con sobrenadantes de las subpoblaciones de células de memoria CLA+/CLA–induce un patrón de expresión génica diferente tal y como se muestra en la tabla 2. De los 18 genes estudiados (tabla 1) los que se ven más aumentados por los linfocitos T CLA+ respecto a los CLA– son IP-10, HLA-DR, ICAM-1 e IL-19 (tabla 2). El resto de los genes estudiados no se afectaban durante las primeras 6 horas de cultivo con sobrenadantes de células T. En los pacientes psoriásicos, respecto a los sujetos sanos, se aprecia una mayor expresión de IP-10, HLA-DR e ICAM-1. En estos experimentos se incluyó el IFN-γ como control de activación. La activación con IFN-γ indica una mayor sensibilidad de queratinocitos psoriásicos respecto a los sanos frente a esta citoquina y reafirma la funcionalidad de los queratinocitos en estos estudios.
Expresión génica en queratinocitos inducida por IFN-γ (control de activación) o por sobrenadantes de linfocitos T CLA+/CLA−activados con anti-CD3/anti-CD28.
| Genes de queratinocitos | Psoriasis (n = 3) | Controles (n = 2) | ||||
| IFN-γ | CLA+ | CLA− | IFN-γ | CLA+ | CLA− | |
| IP-10 | 1.646 ± 1.281 | 1.253 ± 883 | 447±314 | 210 ± 74,9 | 722±1011 | 79,7 ± 83,4 |
| HLA-DR | 244±166 | 53,2 ± 23,6 | 28,6 ± 17,1 | 144± 173 | 31,1 ± 21,8 | 7,7 ± 4,1 |
| ICAM-1 | 46,2 ± 12,7 | 63,0 ± 20,7 | 18,7 ± 1,4 | 12,5 ± 4,7 | 14,2 ± 7,5 | 4,5 ± 3,3 |
| IL-19 | 0,4 ± 0,06 | 4,9 ± 1,9 | 0,1 ± 0,08 | 0,5 ± 0,2 | 6,0 ± 1,9 | 0,9 ± 0,5 |
En los pacientes psoriásicos, respecto de los sujetos sanos, se objetivó una mayor expresión de IP-10, HLA-DR e ICAM-1.
Los resultados más relevantes de la micromatriz multigénica se expresan en la figura 1 y en la tabla 3 conjuntamente. En la figura se presenta la intensidad de la señal para cada uno de los genes analizados. La intensidad obtenida para cada cADN se muestra en una escala doble-logarítmica. Las diagonales identifican los genes cuya expresión se encuentra aumentada o disminuida. En la tabla 3 se presentan algunos de los genes de los queratinocitos cuya expresión aumenta si se incuban con sobrenadante de linfocitos T CLA+ activados respecto de los incubados con sobrenadantes de linfocitos T CLA+ no activados, y se comenta la relevancia funcional de dichos genes en la patología psoriásica.
Algunos genes encontrados en la micromatriz multigénica relevantes en cuanto a la diferencia de expresión entre queratinocitos incubados con sobrenadantes de linfocitos CLA+ activados con CD3/CD28 y de queratinocitos de psoriasis incubados con sobrenadantes de linfocitos CLA+ no activados
| Gen | Aumento de expresión* | Función y relevancia en psoriasis |
| CCL20 (MIP3 alfa) Hs.75498 | 1,90 | MIP3 alfa es una quimiocina específica de CCR6. Los linfocitos T CLA+ son CCR6+ y se encuentran presentes en las lesiones psoriásicas |
| CCL28 Hs.334633 | 2,12 | CCL28 es un ligando de CCR10. Los linfocitos T CLA+ son CCR10+ |
| iNOS Hs.193788 | 1,86 | iNOS está presente en las lesiones psoriásicas y es producido por queratinocitos y células dendríticas |
| ALCAM (CD166) Hs.10247 | 1,70 | Es un ligando de CD6 expresado en células T. ALCAM está implicado en la interacción del queratinocito con la célula T |
| Anfirregulina Hs. 270833 | 2,36 | La anfirregulina es miembro de la familia de EGF. Es un factor autocrino para queratinocitos. En psoriasis la anfirregulina causa la disminución de la actividad de las uniones adherentes (adherents junctions). Ratones transgénicos para anfiregulina presentan un fenotipo psoriásico26 |
| ACP5 fosfatasa ácida tartrato resistente Hs.1211 | 2,63 | Fosfatasa resistente a tartrato. Este gen puede estar implicado en actividades anti-bacterianas |
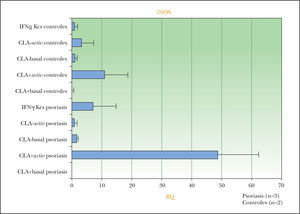
El gen de la sintasa de óxido nítrico (iNOS) fue uno de los genes que se detectaron aumentados en la micromatriz multigénica y que podría estar inducido preferentemente por los linfocitos T CLA+ psoriásicos en queratinocitos de pacientes. Para determinar su relevancia se realizó la confirmación por RT-PCR. La figura 2 muestra que la condición de sobrenadante de linfocitos T CLA+ activados de pacientes con psoriasis es la que induce más expresión génica en los queratinocitos de las placas psoriásicas.
Confirmación por RT-PCR del resultado de la micromatriz multigénica en iNOS para las diferentes condiciones de queratinocitos (Kcs) sanos/controles y psoriásicos cultivados: incubados con IFN-γ, con sobrenadantes de linfocitos T CLA+/–activados (activ) o basales. La condición de queratinocitos psoriásicos incubados con sobrenadantes de linfocitos T CLA+ autólogos activados genera la mayor cantidad de mARN para iNOS.
Durante la formación de la placa de psoriasis existe, en primer lugar, la infiltración dérmica por linfocitos, que es seguida de la hiperplasia de la epidermis12,13. Asimismo, en la piel sana distante del borde de la placa se ha observado la existencia de una infiltración significativa por linfocitos T CLA+ CD8+ y linfocitos T CD45RO+, que preceden a la hiperproliferación epidérmica14,15. Estos resultados apoyan la hipótesis del secuestro de los linfocitos T CLA+ en las fases agudas de la psoriasis16,17.
Hasta la actualidad, la influencia de los linfocitos T sobre los queratinocitos se ha estudiado mediante el sistema de generación de líneas o clones de linfocitos T obtenidos a partir de linfocitos presentes en las biopsias18,19. Estos sistemas requieren de la generación de suficientes linfocitos para poder realizar dichos estudios, así como de activaciones artificiales y la utilización de células presentadoras de antígeno que, ciertamente, influyen en el fenotipo de los linfocitos, modificando sus características. En nuestro caso, el estudio de linfocitos T CLA+ purificados a partir de sangre periférica resuelve este problema y permite realizar activaciones ex vivo20. Hemos utilizado este modelo para caracterizar las funciones efectoras de los linfocitos T CLA+ en los queratinocitos (de enfermos con psoriasis y controles sanos), mediante el análisis de la expresión génica inducida mediante cultivo celular condicionado por linfocitos T CLA+ activados con anti-CD3/anti-CD28.
Los resultados obtenidos sugieren que los linfocitos T CLA+ inducen un perfil de expresión génica en los queratinocitos diferente al de los linfocitos T CLA–. Hemos observado que los genes de la IP-10, HLA-DR, ICAM-1 e IL-19 están significativamente expresados en las lesiones psoriásicas10. Los resultados de la micromatriz multigénica nos han permitido explorar las posibilidades de nuestro modelo de expresión génica sobre un mayor número de genes en queratinocitos psoriásicos inducidos por células CLA+. Genes como CCL20 y CCL28 son quimiocinas que atraen linfocitos T CLA+21,22. La anfirregulina está claramente asociada con la patogénesis de la psoriasis23 y el gen ALCAM está implicado en la interacción del linfocito T con el queratinocito24. Con el fin de asegurar la relevancia de estos genes es preciso confirmar su expresión mediante RT-PCR, tal como hemos procedido con la iNOS. Al comparar la capacidad de inducción de la iNOS en queratinocitos la condición de linfocitos T CLA+ y queratinocitos psoriásicos autólogos es la que genera la mayor cantidad de mARN para la iNOS.
La expresión de iNOS e IL-19 en los queratinocitos, dos genes involucrados previamente en la patogenia de la psoriasis, no se había relacionado anteriormente con la actividad efectora de los linfocitos T. Estos genes están asociados con la respuesta inmune innata y en nuestro estudio son inducidos por los linfocitos T CLA+ representantes de la respuesta inmune adquirida. El efecto del IFN-γ sobre la expresión de iNOS e IL-19 es muy inferior al efecto de los sobrenadantes de los linfocitos T CLA+ de pacientes con psoriasis, sugiriendo que existen otros mediadores además del IFN-γ producidos por los linfocitos T CLA+ capaces de inducir su expresión.
La iNOS es una sintasa de óxido nítrico (NO) inducida tras un estímulo. Existen otras dos isoformas que producen NO, ambas constitutivas, que son la NOS tipo cerebral (bNOS) y la NOS tipo endotelial (eNOS)25. En psoriasis se ha detectado un incremento significativo de la expresión de iNOS en piel lesional, en comparación con la piel sana, siendo la expresión de bNOS y eNOS menor (tanto en piel sana como lesional)26. Estudios de hibridación in situ e inmunohistoquímica localizaron el mARN y la proteína del iNOS en los queratinocitos epidérmicos de las lesiones psoriásicas27,28, así como en la papila dérmica29. La expresión de iNOS, incluida en los queratinocitos, parece estar inducida por diferentes citocinas, entre ellas la IL-826,30.
La iNOS sintetiza NO, un radical libre que ha sido implicado en la patogenia de diferentes enfermedades inflamatorias, incluida la psoriasis. Se ha descrito que niveles bajos de NO promueven la proliferación de los queratinocitos, mientras que los elevados pueden detener la proliferación e iniciar la diferenciación celular, incluso en los queratinocitos31,32. En la psoriasis, a pesar de la marcada sobreexpresión de iNOS, existe una gran hiperproliferación de los queratinocitos. Este hecho parece indicar que hay una baja actividad de la iNOS sobreexpresada, y por lo tanto una acción antiproliferativa poco efectiva. Bruch-Gerharz et al justifican este hallazgo aparentemente contradictorio con la arginasa 1 (ARG-1)27. En los queratinocitos psoriásicos la ARG-1 también se encuentra sobreexpresada, colocalizada con la iNOS27. Participa en la regulación de la actividad de la iNOS compitiendo por un sustrato común, la arginina, y produce L-ornitina, como precursor de la síntesis de poliaminas. Se ha descrito que la L-ornitina induce la proliferación de los queratinocitos31. Además, la competición de sustrato daría lugar a una baja producción de NO en los queratinocitos. Bruch-Gerharz et al describieron un aumento de la producción de NO al inhibir la actividad de la arginasa en queratinocitos en cultivo27, lo que confirmaría la baja actividad de la iNOS en queratinocitos psoriásicos. Otra posible explicación para la baja concentración de NO en queratinocitos sería la sobreexpresión del péptido relacionado con el gen de la calcitonina (CGRP) en las lesiones psoriásicas, el cual parece suprimir la producción de NO, probablemente a través de la inhibición de la actividad de iNOS32. Contrariamente, algunos autores han descrito el aumento de concentración de NO en la placa de psoriasis, e incluso en el suero de pacientes con psoriasis33. Sin embargo, estos experimentos analizan la producción total de NO en la piel psoriásica o la cantidad de NO en suero, sin especificar el tipo celular que lo ha producido. Aparte de los queratinocitos existen otras células productoras de NO a través de la iNOS (células dendríticas) y también a través de las otras isoformas enzimáticas (melanocitos, endotelio y glándula sudorípara)29.
La IL-19 forma parte de la familia de citocinas de la IL-10 y se une al receptor heterodímero IL-20R1/IL-20R2. La IL-19 actúa como citoquina proinflamatoria o moduladora de la respuesta inflamatoria innata in vitro34. Es capaz de inducir IL-6 y TNF-α en monocitos, dando lugar a una apoptosis mediada por TNF-α35. En la psoriasis la IL-19 está expresada en epidermis de piel afecta, concretamente en queratinocitos basales y suprabasales localizados en la epidermis suprapapilar. No se ha hallado en monocitos/macrófagos, células endoteliales, melanocitos, células de Langerhans o linfocitos T de las placas de psoriasis36. Asimismo, se ha sugerido que la IL-19 no sólo está producida por los queratinocitos, sino que también actúa sobre ellos37. Se ha demostrado una disminución de la expresión de la IL-19 tras el tratamiento con IL-438 o ciclosporina39. Estos hallazgos, junto con nuestros resultados de sobreexpresión al ser estimulado por sobrenadante de linfocitos T CLA+ activados, sugieren que la expresión de mARN de IL19 depende de la presencia de células T no productoras de IFN-γ.
En conclusión, nuestros datos sugieren que los linfocitos T circulantes CLA+ poseen la capacidad de activar queratinocitos psoriásicos induciéndoles la expresión de genes asociados a la respuesta innata y que se han descrito previamente en la lesión psoriásica. Estos resultados apoyan el papel de los linfocitos T en la patogenia de la psoriasis. Sin embargo, son necesarios nuevos estudios que aclaren el significado de las diferencias de expresión génica que hemos observado, así como los mediadores responsables producidos por los linfocitos T.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Financiación: Premio Fundación Salud 2000 para el estudio de la inmunología clínica de la psoriasis (2003).