La obesidad y la diabetes son 2 enfermedades crónicas de distribución mundial, de incidencia en aumento tanto en niños como en adultos. Clínicamente se caracteriza por comprometer distintos órganos, entre ellos la piel. Las manifestaciones cutáneas secundarias o agravadas por la obesidad y la diabetes son variadas, y en su mayoría están relacionadas con el tiempo de evolución. Entre ellas se incluyen: fibromas laxos, acantosis nigricans, estrías, xerosis, queratosis pilar, hiperqueratosis plantar, infecciones cutáneas por hongos y bacterias, granuloma anular, necrobiosis lipoidea, psoriasis y dermatitis atópica, entre otros.
En esta revisión presentamos los hallazgos cutáneos en niños con estas 2 enfermedades; como también en los síndromes relacionados, recordando la importancia de la piel como herramienta para la sospecha clínica y el diagnóstico temprano de enfermedades sistémicas.
Obesity and diabetes are chronic diseases that affect people all over the world, and their incidence is increasing in both children and adults. Clinically, they affect a number of organs, including the skin. The cutaneous manifestations caused or aggravated by obesity and diabetes are varied and usually bear some relation to the time that has elapsed since the onset of the disease. They include soft fibromas, acanthosis nigricans, striae, xerosis, keratosis pilaris, plantar hyperkeratosis, fungal and bacterial skin infections, granuloma annulare, necrobiosis lipoidica, psoriasis, and atopic dermatitis.
In this review article we present the skin changes found in children with diabetes mellitus and obesity and related syndromes and highlight the importance of the skin as a tool for establishing clinical suspicion and early diagnosis of systemic disease.
La obesidad y la diabetes son 2 enfermedades crónicas de distribución mundial cuya incidencia está en aumento y que afectan distintos órganos, entre ellos la piel1. Aunque son más frecuentes en adultos, cada vez se observan más en la población infantil. Así, según informes de la Organización Mundial de la Salud el 20% de los niños y adolescentes en Europa sufre de sobrepeso, siendo obesos un tercio de ellos2. Actualmente se diagnostican 3.700 casos anuales de diabetes tipo2 en niños y adolescentes3, claramente superiores a informes previos4. Ante esta situación será cada vez más frecuente la consulta por problemas clínicos relacionados con estas enfermedades.
Las manifestaciones cutáneas en la diabetes y la obesidad están directamente relacionadas con la edad de inicio, la cronicidad y la severidad de la enfermedad de base. En esta revisión haremos una descripción en 2 secciones, correspondiendo la primera a los hallazgos cutáneos relacionados con la diabetes y la segunda a los relacionados con la obesidad, basados en clasificaciones previas.
DiabetesLa diabetes mellitus (DM) consiste en un grupo heterogéneo de trastornos caracterizado por niveles elevados de glucosa en sangre y alteración del metabolismo de hidratos de carbono y lípidos5. Se clasifica en tipo1 (DM1) y tipo2 (DM2), según el origen etiopatogénico, presentando unas características clínicas específicas en los pacientes. La DM1 se origina por la destrucción, de probable origen autoinmune, de las célulasB de los islotes pancreáticos, encargadas de la secreción de insulina. Se caracteriza por un inicio clínico repentino con insuficiencia de insulina, tendencia a la cetoacidosis incluso en estados basales, y una dependencia absoluta de insulina para mantener la vida. En la DM2 los pacientes pueden permanecer relativamente asintomáticos durante muchos años, y se produce por un defecto dual: acción deficiente de insulina (resistencia) y deterioro de la función de las célulasB, pudiendo mostrar niveles bajos, normales o elevados de insulina. El paciente típico con DM2 es una persona obesa con antecedentes familiares de diabetes.
Las complicaciones de la diabetes parecen ser de origen multifactorial, ocurriendo como resultado de anormalidades bioquímicas, estructurales y funcionales6. De estas anomalías es importante resaltar el incremento del proceso bioquímico de glucación avanzada en los pacientes diabéticos como consecuencia de la hiperglucemia crónica y aumento de estrés oxidativo. La glucación avanzada implica la generación de un grupo heterogéneo de residuos químicos conocidos como productos finales de glucación avanzada (o advanced glycated end-products) conocidos como AGE7, como resultado de una reacción no enzimática de la glucosa con proteínas, lípidos y ácidos nucleicos, los cuales van a reaccionar con receptores específicos para producir los efectos nocivos.
El 30% de los pacientes adultos diabéticos presentarán manifestaciones cutáneas en algún momento de la vida, las cuales varían dependiendo de la edad de inicio y del tipo de diabetes. En los niños, esto no es una excepción. La DM1 es la forma más frecuente en niños4, con una edad media de presentación de 8años, puede estar asociada a alteraciones del crecimiento y enfermedades autoinmunes, y con manifestaciones relacionadas con alteraciones de la microvasculatura. Debido al incremento de la obesidad y de la resistencia a la insulina en niños, la DM2 también ha incrementado su prevalencia en este grupo poblacional, sobre todo en adolescentes3.
Existen muy pocas revisiones sobre la clasificación de las manifestaciones cutáneas tanto en niños como en adultos con diabetes, por lo que clasificamos las manifestaciones como fueron presentadas en 1985 por la doctora Edidin4, quien las dividió en cambios cutáneos secundarios a diabetes, cambios cutáneos que se producen con mayor frecuencia en diabéticos, manifestaciones cutáneas de síndrome de resistencia a la insulina y cambios cutáneos relacionados con la terapia con insulina (tabla 1).
Manifestaciones cutáneas en niños diabéticos
| Cambios cutáneos secundarios a diabetes | Enfermedades dermatológicas asociadas a diabetes | Manifestaciones asociadas a síndrome de resistencia a la insulina | Complicaciones del tratamiento con insulina |
| XerosisQueratosis pilarRubeosis facieiLimitación de movilidad articularInfecciones:a. Hongosb. BacteriasMicroangiopatía y neuropatía | Granuloma anularNecrobiosis lipoideaDermopatía diabéticaAsociación a enfermedades autoinmunes:a. Hipotiroidismob. Hipertiroidismoc. Enfermedad celiacad. Enfermedad de Addisone. Vitíligo | Acantosis nigricansFibroepiteliomas o AcrocordonesObesidadHirsutismoAcnéSeborrea | Eritema localLipohipertrofiaCicatricesAmpollas |
Se incluyen en este grupo los cambios cutáneos producidos por los elevados niveles de glucemia o por el compromiso de estructuras vasculares y nerviosas características de la diabetes, como son la xerosis, la rubeosis faciei, la limitación de la movilidad articular, las infecciones, la microangiopatía y la neuropatía.
Xerosis y engrosamiento de la pielLa xerosis, o sequedad de la piel, es uno de los signos más tempranos y frecuentes de la diabetes, estando presente hasta en el 22% de los pacientes con DM18. Este hallazgo ha sido demostrado al medir la pérdida transepidérmica de agua y la conductibilidad de alta frecuencia en el antebrazo9. Otro hallazgo llamativo es que incluso en ausencia de xerosis clínicamente aparente, la piel de los pacientes diabéticos presenta una alteración de la descamación, una reducción de la elasticidad10 y un grosor mayor que la de la población general que puede contribuir a la reducción de la elasticidad11. Clínicamente, el engrosamiento de la piel se clasifica en 3 categorías distintas: a)engrosamiento benigno de la piel; b)síndrome esclerodermia-like, y c)escleredema de Buschke. Se cree que es una manifestación producida por la glucación anormal de colágeno durante episodios de hiperglucemia o por proliferación del colágeno promovida por el exceso de insulina12. Las manos y los pies son los sitios de predilección del engrosamiento benigno en los pacientes diabéticos, asociado especialmente al síndrome de limitación articular13. Aunque la piel engrosada puede ser asintomática, es un hallazgo medible por ecografía cutánea11.
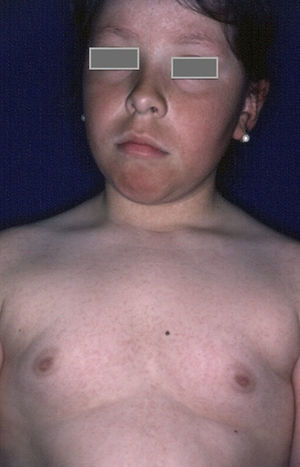
Queratosis pilarLa queratosis pilar es una condición frecuente en niños diabéticos, con una prevalencia del 11,7% en pacientes con DM1 mayores de 10años8. La etiología no es clara, y al parecer la xerosis de la piel desempeña un papel importante para su desarrollo14. Clínicamente se caracteriza por pápulas foliculares rugosas con un grado variable de eritema, localizadas principalmente en superficies extensoras de brazos y piernas, y ocasionalmente en la cara, los glúteos y el tronco (fig. 1). Ocurre en forma de brotes durante el invierno, mejorando usualmente en verano15. Se asocia principalmente a la dermatitis atópica y a un índice de masa corporal elevado16. El tratamiento incluye agentes queratolíticos, retinoides y corticoides tópicos de potencia baja17.
Rubeosis facieiLa rubeosis faciei de los pacientes diabéticos o el eritema facial característico de los pacientes diabéticos (fig. 2) se deben a dilataciones de la microvasculatura en las mejillas, probablemente originadas por la alteración de la microcirculación inducida por hiperglucemia18. La prevalencia es mayor en pacientes con DM2 (21-59%)19 que en niños con DM1 (7%)8, estando directamente relacionada con la duración de la enfermedad.
Limitación de la movilidad articularLa limitación de la movilidad articular, también descrita como queiroartropatía diabética o síndrome de movilidad articular limitada, es la primera complicación a largo plazo clínicamente aparente de la DM1 en la infancia20. Consiste en la contractura asintomática bilateral de las articulaciones de los dedos y de articulaciones largas, asociada al engrosamiento con aspecto cerúleo de la piel y a la talla baja. Al parecer su origen es a partir de la glucación no enzimática del colágeno, produciéndose un colágeno reticulado insoluble que conferiría rigidez tanto a la dermis como a las articulaciones7. La frecuencia de presentación es variable, estando presente en el 2,3% de los pacientes con DM1 en algunas series de casos8, y en otras, en el 30% de los pacientes menores de 21años, de baja estatura y diabéticos21. La incidencia de esta complicación ha disminuido en los últimos años con el mejor control de las cifras de glucemia.
Las articulaciones inicialmente comprometidas son las interfalángicas proximales de los dedos cuarto y quinto de la mano, con una rigidez o contractura en flexión que limita la extensión de los dedos acompañadas de cambios esclerodermiformes de la piel. Esta rigidez puede extenderse a los demás dedos y a las muñecas, codos, tobillos, rodillas, dedos de los pies y columna cervical y dorsal. El desarrollo de esta complicación se ve relacionado directamente con el tiempo de duración de la diabetes y el apropiado control de la misma, por lo que son raros los casos descritos en menores de 10 años22. Los pacientes que presentan esta limitación de movilidad de las articulaciones tienen un mayor riesgo de desarrollar otras complicaciones microvasculares de la DM, principalmente retinopatía, nefropatía y neuropatía23.
InfeccionesLa susceptibilidad a infecciones severas, recurrentes o atípicas en los pacientes diabéticos es un hecho bien conocido. En los niños diabéticos las infecciones más frecuentes suelen ser por hongos y bacterias, principalmente especies de Candida, Staphylococcus y Streptococcus5, sin asociación o predisposición a infecciones virales específicas.
HongosLos niños diabéticos muestran una mayor susceptibilidad a infecciones por dermatofitos y cándidas, especialmente tinea pedis, onicomicosis y candidiasis de las mucosas o de los pliegues. La tinea pedis y la onicomicosis afectan principalmente los espacios interdigitales y el primer dedo, se presentan en el 2,8% de los pacientes y, al igual que en la población general, más del 90% son debidas a Trichophyton rubrum y Trichophyton mentagrophytes24.
Las infecciones por cándidas son relativamente más frecuentes que en la población no diabética. Las manifestaciones más frecuentes son la vulvovaginitis candidiásica, la balanitis y la estomatitis angular, presentándose en más del 5% de los pacientes diabéticos8. En un estudio realizado en niñas diabéticas entre 2 y 15años se aisló Candida sp. en el 56% de los cultivos de la vulva25. En los pacientes con infecciones micóticas es importante realizar una monitorización estricta de las cifras de glucemia y de la hemoglobina glucosilada, debido a que si la diabetes no está estable, va a ser muy difícil controlar la infección.
BacteriasLa infección por estafilococos es más frecuente en los pacientes diabéticos insulinodependientes que en los no insulinodependientes, existiendo una relación directa entre susceptibilidad y severidad de la infección y control de la glucemia26. Las infecciones más frecuentes son foliculitis e impétigo, además del estado de portador en orificios naturales. En niños es rara la presentación de forúnculos, ántrax y fascitis necrosante4.
Otras infecciones que se pueden presentar en niños y adolescentes diabéticos son eritrasma, mucormicosis y otitis externa maligna, aunque son entidades descritas usualmente en pacientes mayores con cierto grado de inmunosupresión4.
Microangiopatía y neuropatíaLos cambios relacionados con el compromiso vascular y nervioso del paciente diabético son más tardíos que los anteriores, debido a que estos son producto del deterioro de las estructuras por hiperglucemia mantenida además de isquemia de los vasa nervorum en el caso de los nervios periféricos27 y una forma de arterioesclerosis en la microvasculatura consistente en disminución de la elasticidad y de la función vasomotora endotelial de las arterias periféricas28; por tanto, su presencia es más frecuente en la segunda década de la vida.
Los hallazgos en las extremidades inferiores son una disminución de la temperatura y una apariencia moteada en los pies, acompañada de atrofia cutánea y pérdida del pelo en pies y piernas, además de distrofia de las uñas. Otros hallazgos observados son anhidrosis, como resultado de insuficiencia vascular severa o disfunción autonómica, y mala cicatrización de las heridas, debido a insuficiencia vascular y neuropatía, que se observarían principalmente en adolescentes mayores o adultos jóvenes4.
Aunque característicamente son lesiones del paciente diabético adulto mayor, las alteraciones estructurales y funcionales que van a predisponer al pie diabético, como son la aparición de callosidades, uñas largas, ampollas y piel seca, se pueden observar en pacientes jóvenes29. La identificación de estos factores predisponentes es importante para llevar a cabo medidas de prevención, buscando reducir la incidencia de pie diabético y la prevalencia de amputación de miembros inferiores en pacientes adultos diabéticos30.
Cambios cutáneos que se producen con mayor frecuencia en los diabéticosOrigen desconocidoExiste un grupo de entidades de origen desconocido que se asocian o se observan con más frecuencia en los pacientes diabéticos. Entre ellos se incluyen la necrobiosis lipoidea, el granuloma anular, la dermopatía diabética, la bullosis diabeticorum, la colagenosis reactiva, el escleroderma diabeticorum, el prurito y la piel amarilla. En este artículo revisaremos la necrobiosis lipoidea, el granuloma anular y la dermopatía diabética, debido a que las otras manifestaciones son poco frecuentes y existen pocos casos infantiles publicados en la literatura.
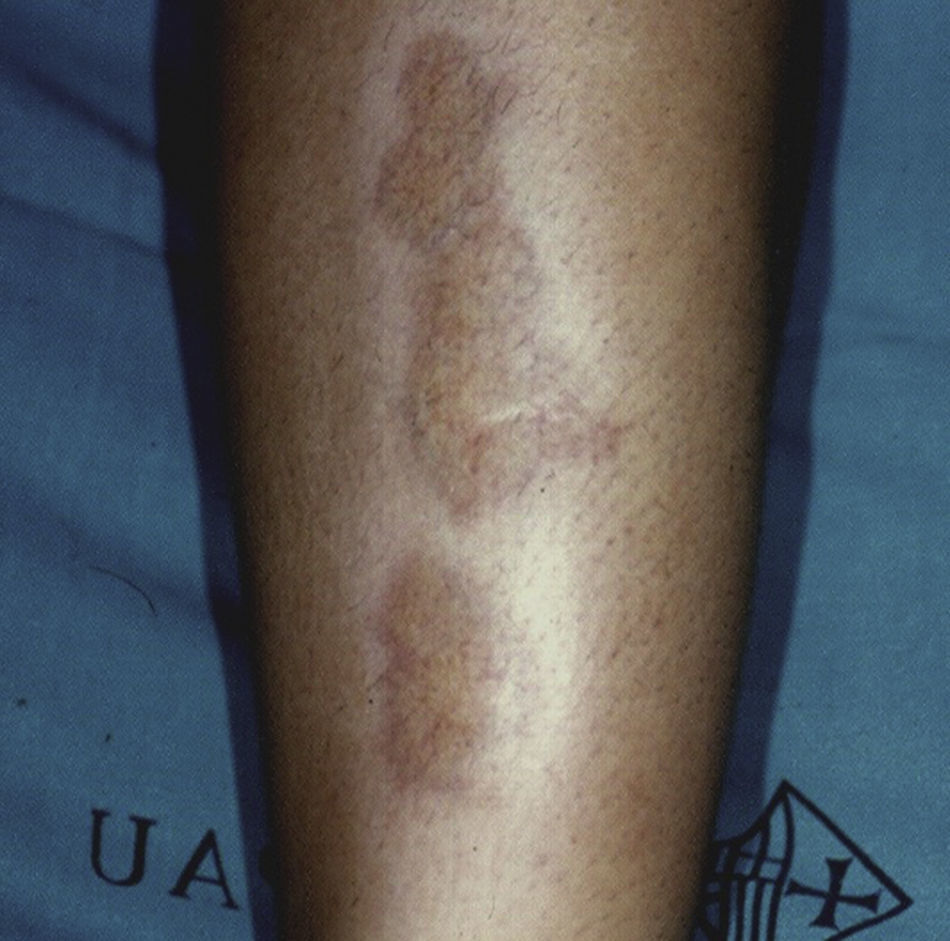
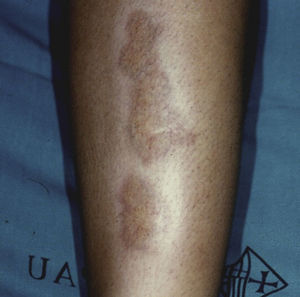
Necrobiosis lipoideaLa necrobiosis lipoidea es una enfermedad rara, más frecuente en mujeres, con una prevalencia del 0,3% en pacientes adultos diabéticos; es mucho menos frecuente en niños, en los que la prevalencia disminuye al 0,06%31,32. Su presencia se relaciona con mayor frecuencia de retinopatía y nefropatía en los pacientes diabéticos33. Clínicamente se presenta como placas asintomáticas, color amarillo-naranja o rojo-café, bilaterales, simétricas y localizadas en los miembros inferiores, principalmente en la cara anterior de la tibia (fig. 3); en casos aislados pueden estar localizadas en los miembros superiores34. Histopatológicamente se caracteriza por vasculitis necrosante neutrofílica en la fase temprana, y en estadios tardíos, degeneración amorfa y hialinización del colágeno dérmico (necrobiosis). El tratamiento consiste en un buen control de los niveles de glucemia. Se han ensayado numerosos tratamientos con éxito relativo, como el uso tópico o intralesional de corticoides, pentoxifilina, retinoides tópicos e inhibidores de la calcineurina35.
Granuloma anularEl granuloma anular es un trastorno inflamatorio benigno de origen desconocido caracterizado por la degeneración del tejido conectivo con un infiltrado inflamatorio compuesto de forma predominante por histiocitos. A pesar de no estar definido su origen, en adultos se observa una importante asociación con enfermedades sistémicas, particularmente enfermedades reumatológicas y diabetes36. En niños no se ha podido establecer esta asociación, pero existen casos aislados descritos donde confluyen estas 2 entidades, pudiéndose recomendar la evaluación de factores de riesgo para otras comorbilidades y la realización de estudios en los casos en que estos estén presentes37.
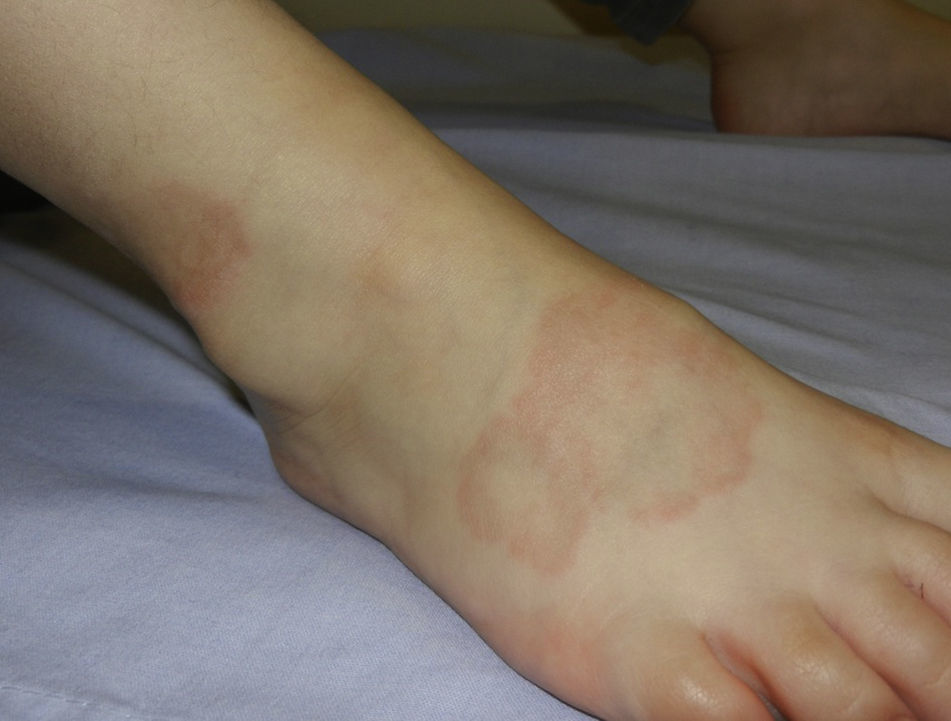
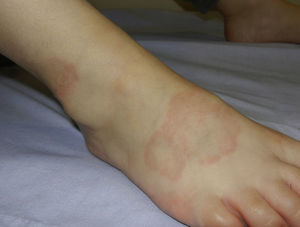
Se manifiesta a cualquier edad, pero es observado con mayor frecuencia en niños y adolescentes38. En niños las formas más frecuentes son la localizada y la subcutánea. La forma localizada se observa clínicamente como pápulas rojo pálido o violáceas, firmes, de superficie lisa, organizadas en placas en forma de anillo con un centro ligeramente deprimido e hiperpigmentado, que pueden ser únicas o múltiples. La forma subcutánea o profunda consiste en un nódulo, fijo, localizado en las piernas (fig. 4), el cuero cabelludo, las palmas o los glúteos39. Otras formas de presentación menos frecuentes son: la generalizada, caracterizada por una erupción difusa compuesta por pápulas, y la perforante, observada como pápulas umbilicadas con una escama o costra central o salida de tejido conectivo necrobiótico del centro.
En algunos pacientes el granuloma anular puede coexistir con la necrobiosis lipoidea. Hay autores que proponen, debido a su similitud histológica, que el granuloma anular constituiría una fase temprana de la necrobiosis lipoidea40.
El tratamiento a menudo no es necesario, ya que la mayoría de estas lesiones se resuelven de forma espontánea en un plazo de 2años. El tratamiento puede llevarse a cabo por razones estéticas41, donde las opciones terapéuticas van a depender de la forma clínica de presentación. Así, las formas localizadas se pueden manejar con corticoides tópicos de alta potencia, inhibidores de calcineurina, crioterapia o láser de colorante pulsado42, y las formas generalizadas con una de las diferentes terapias sistémicas que incluyen dapsona, retinoides, niacinamida, antibióticos, antipalúdicos, terapia fotodinámica y fototerapia, todas con un éxito terapéutico relativo43-45.
Dermopatía diabéticaLa dermopatía diabética es el hallazgo cutáneo más frecuente en los pacientes diabéticos adultos, con una incidencia que varía entre el 9 y el 55% de los pacientes, pero bastante poco frecuente en niños46. Consiste en áreas de aspecto atrófico, de color café con leche, ligeramente deprimidas, bien definidas, de tamaño usualmente inferior a 1cm, que se localizan de forma bilateral y asimétrica en la cara anterior de las piernas y, ocasionalmente, en los muslos, los brazos y los maléolos laterales4. Aunque la etiopatogenia no es clara, se reconoce que sus características clínicas son debidas a depósitos de hemosiderina y melanina47.
Los hallazgos histológicos en la epidermis incluyen atrofia de las crestas interpapilares, hiperqueratosis moderada y, en grado variable, pigmentación de la basal. En la dermis papilar se observan telangiectasias, proliferación fibroblástica y edema, además de microangiopatía hialina, extravasación de eritrocitos, depósitos de hemosiderina y un infiltrado perivascular moderado compuesto por linfocitos, histiocitos y, de forma característica, plasmocitos46.
El tratamiento de estas lesiones es inefectivo y no recomendado, ya que estas son asintomáticas y su evolución variable, pudiendo persistir indefinidamente o involucionar de forma espontánea48.
El hallazgo de esta patología obliga a estudiar al paciente para descartar la presencia de DM, debido a que si bien no es patognomónica, es una alteración muy específica de esta enfermedad. Por otro lado, su presencia en pacientes diabéticos constituye un signo de mal control de la diabetes46.
Asociados a enfermedades autoinmunesLa incidencia de enfermedades autoinmunes es mayor en niños con DM1 y en sus familiares, y esto al parecer ocurre por la presencia de autoanticuerpos circulantes contra órganos específicos20. Por tanto, un adecuado interrogatorio durante la historia clínica podría ser útil para el diagnóstico temprano de estas enfermedades. Las más relacionadas son las enfermedades autoinmunes del tiroides, la enfermedad celíaca y la insuficiencia suprarrenal primaria.
HipotiroidismoEl hipotiroidismo primario, secundario a la presencia de anticuerpos antitiroideos, ocurre en aproximadamente el 3-8% de los pacientes con DM149, y cerca del 25% de los niños diabéticos tienen autoanticuerpos positivos contra el tiroides, especialmente en niñas50. Esta patología se debe sospechar en los pacientes que presenten bocio asintomático, incremento exagerado de peso, sequedad en la piel, intolerancia al frío, letargia, cansancio exagerado y bradicardia. El diagnóstico se realiza al demostrar la presencia de autoanticuerpos, niveles disminuidos de tiroxina libre y elevados de TSH. Necesita tratamiento médico con reemplazo de levotiroxina. Usualmente no modifica los requerimientos de insulina o control de la glucemia20.
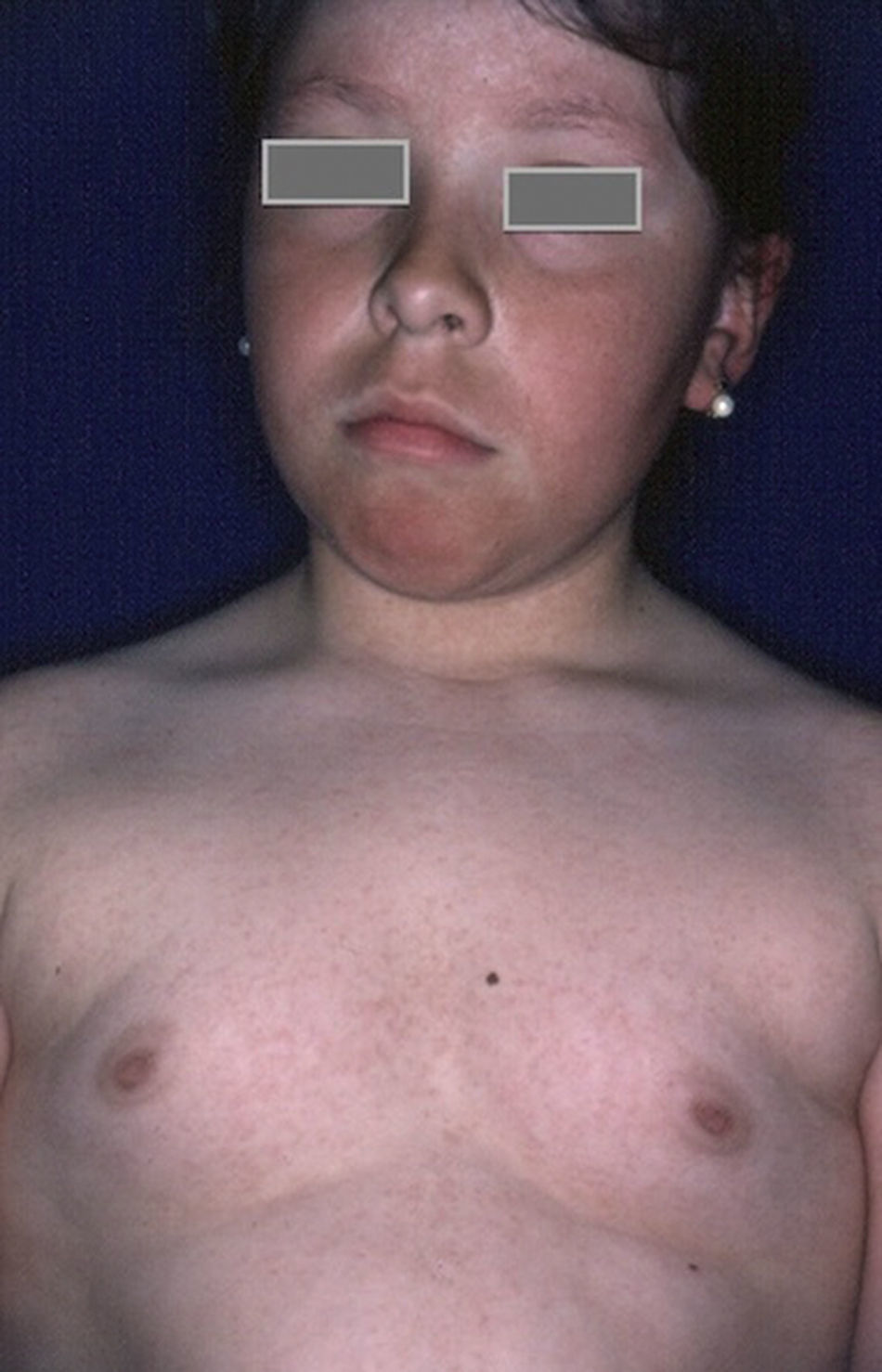
HipertiroidismoLa asociación entre diabetes e hipertiroidismo es mucho menos frecuente que la asociación entre diabetes e hipotiroidismo; sin embargo, es más frecuente que en la población general, y su presencia puede ocurrir como estado inicial de enfermedad de Graves o tiroiditis de Hashimoto51. Se debe sospechar en pacientes con pobre control de los niveles de glucemia a pesar de un tratamiento adecuado, y que además presenten pérdida importante de peso, sin modificación de la dieta, incremento de la sudoración e irritabilidad, temblores, taquicardia, intolerancia al calor y el característico aumento del tamaño del tiroides y exoftalmos20. El tratamiento antitiroideo se realizará por endocrinología según el caso.
Enfermedad celíacaLa prevalencia de enfermedad celíaca en niños y adolescentes diabéticos es del 1 al 10%, siendo mayor el riesgo en cuanto más precoz sea el inicio de la diabetes52. En la mayoría de casos la enfermedad celíaca es asintomática, no necesariamente asociada a retraso del crecimiento o pobre control de la diabetes; sin embargo, cuando se presentan estas situaciones se recomienda descartar su presencia20. Debe sospecharse también en cualquier niño que presente signos y síntomas gastrointestinales como diarrea, dolor abdominal, flatulencia, dispepsia, aftas recurrentes o anemia. La enfermedad celíaca se asocia con episodios de hipoglucemia y reducción de los requerimientos de insulina53. El diagnóstico y el tratamiento se realizarán con el soporte de gastroenterología pediátrica.
Enfermedad de AddisonLa insuficiencia suprarrenal primaria o enfermedad de Addison se produce por la disminución de la función o disfunción de la corteza suprarrenal, con producción deficiente de glucocorticoides, mineralocorticoides y andrógenos, acompañándose de niveles elevados de hormona liberadora de corticotropina (ACTH) y de actividad de la renina plasmática. La prevalencia en los países desarrollados es de 110-144 casos por millón de habitantes54. Los pacientes diabéticos tienen un riesgo más alto de esta entidad, encontrando positividad para autoanticuerpos antisuprarrenales en más de 2% de los pacientes diabéticos55. Se debe sospechar en los pacientes diabéticos con incremento de la pigmentación de la piel que además refieran descenso no explicado de las unidades de insulina, pérdida de peso, hiponatremia e hipercalemia20. El diagnóstico y el manejo se deben realizar por parte del endocrinólogo pediatra.
VitíligoLa prevalencia global de vitíligo corresponde al 0,1-4%, iniciándose aproximadamente en la mitad de los casos en pacientes menores de 20años56. La asociación entre vitíligo y DM1 es frecuente, ocurriendo concomitantemente vitíligo en cerca del 6% de los niños diabéticos20 y encontrando diabetes en el 0,6% de los pacientes con vitíligo57. Las formas de vitíligo generalizadas y resistentes al tratamiento son las que se asocian con mayor frecuencia56.
Manifestaciones cutáneas secundarias al síndrome de resistencia a la insulinaEl número creciente de casos de síndrome de resistencia a la insulina y el desarrollo de DM2 en el mundo ha disparado las alertas sobre esta epidemia en los últimos años. En el año 2007, el grupo Search de investigación de diabetes afirmó que anualmente en Estados Unidos se diagnostican 3.700 niños y adolescentes con DM2, en su mayoría con edades entre 10 y 19años58. Aunque la etiología y la fisiopatología de este síndrome no son motivo de esta revisión, es importante entender que el estado de resistencia a la insulina consiste en un efecto biológico menor de lo esperado de una cantidad determinada de insulina, el cual es seguido por hiperinsulinemia compensatoria para mantener los niveles normales de glucosa y la homeostasis de los lípidos59, convirtiéndose en una colección de factores de riesgo para diabetes, enfermedades del corazón y del sistema nervioso central.
Las manifestaciones cutáneas más frecuentes son los fibroepiteliomas y la acantosis nigricans (AN), que se describen más adelante en esta revisión, presentes hasta en un tercio de los pacientes; además, queratosis pilar, hirsutismo y signos de hiperandrogenismo, en los que se incluyen seborrea y acné, los cuales se acentúan por la presencia de obesidad, agudizando también la severidad de los episodios infecciosos y de las alteraciones en las extremidades en la vida adulta, como hiperqueratosis plantar y úlceras, entre otras60.
La presencia de manifestaciones clínicas y de factores de riesgo en los pacientes debe motivar al examinador para evaluar factores de riesgo ambientales, como la educación en la casa, la presencia de padres obesos, los hábitos de vida tanto de los padres como de los niños, las actividades al aire libre y la comida, a fin de realizar un diagnóstico temprano y un tratamiento a través de cambios de estilo de vida, alimentación y uso de tratamientos farmacológicos como metformina e insulina, en los casos que sea necesario3.
Cambios cutáneos relacionados con la terapia con insulinaAnte el aumento de la incidencia de diabetes en el mundo y en la población infantil se ha observado un inicio más temprano del tratamiento con insulina, ya sea por bomba de infusión continua o inyecciones múltiples61. La prevalencia de complicaciones cutáneas secundarias a la inyección de insulina es variable, encontrando lipoatrofia y lipohipertrofia en el 1,8% en algunas series y entre el 29 y el 48% en otras, respectivamente8. En la mayoría de los casos son reacciones cutáneas sin la importancia clínica necesaria para suspender el tratamiento62. Los hallazgos clínicos más observados en niños canadienses que utilizan bombas de infusión de insulina son cicatrices menores de 3mm, eritema sin nódulos asociados, nódulos subcutáneos y lipohipertrofia62. De forma menos frecuente también se puede observar enrojecimiento, ampollas e infección local en el sitio de inyección61.
ObesidadLa obesidad consiste en una enfermedad crónica caracterizada por un incremento de peso debido a una acumulación anormal o excesiva de grasa. En los niños el sobrepeso y la obesidad se pueden definir de dos maneras. En la primera el índice de masa corporal (IMC) es corregido según sexo y edad, considerando sobrepeso si el IMC es mayor a 25 y obesidad cuando es mayor a 3063. En la segunda forma, utilizada con mayor frecuencia, se define sobrepeso a los pacientes que están entre los percentiles 85 y 95, y obesidad a aquellos en percentil mayor a 95, según las tablas de la International Obesity Task Force (IOFT)64.
Actualmente se conoce que en el grupo etario de niños y adolescentes estadounidenses, uno de cada 6 presenta sobrepeso65. Aunque la prevalencia exacta de los hallazgos cutáneos no se conoce, actualmente está demostrado que todos están relacionados directamente con la severidad y la duración de la obesidad66, siendo mayor la incidencia cuando se asocien con diabetes y/o síndrome de resistencia a la insulina67.
Los hallazgos cutáneos se pueden clasificar en 3 grupos, que consisten en las alteraciones de la fisiología de la piel, los cambios cutáneos asociados a la obesidad y las enfermedades cutáneas relacionadas con obesidad, las cuales se reúnen en la tabla 2 de esta revisión.
Manifestaciones cutáneas en niños obesos
| Cambios fisiológicos de la piel | Dermatosis asociadas a obesidad | Enfermedades dermatológicas exacerbadas por obesidad | Complicaciones tratamiento |
| Piel secaIntolerancia al calorSudoración excesivaEritema local en áreas de fricción | Acantosis nigricansAcrocordones o fibroepiteliomasEstríasQueratosis pilarHiperqueratosis plantar | Infecciones cutáneas:a. Hongosb. BacteriasPsoriasisDermatitis atópica | Reacción liquenoideEritema ab igne |
Las alteraciones fisiológicas de la piel, presentes en el paciente obeso, son múltiples, y entre ellas están la mayor actividad de sudoración, la alteración de la barrera epidérmica, con mayor pérdida transepidérmica de agua y, por tanto, piel seca68; la alteración de la función y estructura del colágeno; la mayor actividad de las lipoquinas y resistencia a leptina, probablemente debido al desequilibrio en la producción de citoquinas por parte de los adipocitos; y por último la producción de factor de necrosis tumoral alfa, factor de crecimiento transformante beta, interleucina 1 (IL-1), interleucina 6 (IL-6) y leptina por parte de los adipocitos, generando un estado proinflamatorio69.
La leptina merece especial atención, debido a que es una proteína producto del gen de la obesidad, sintetizada en especial en los adipocitos y que presenta una fuerte asociación con la obesidad y resistencia a la insulina70. Es considerada un factor de crecimiento, debido a que in vitro estimula la proliferación de distintos tipos celulares71, por lo que su defecto sería el responsable de la disminución de la cicatrización69. Se ha encontrado una relación directa entre los niveles de leptina, la obesidad, la resistencia a la insulina y el desarrollo de fibroepiteliomas71.
Otros efectos fisiológicos de la obesidad en la piel incluyen el incremento de los pliegues fisiológicos, la disminución de la sensibilidad, la disminución de la reactividad de la microvasculatura y la inhibición de la circulación linfática66; todos están relacionados directamente con la severidad y la duración de la obesidad, siendo probablemente los agentes causales de las dermatosis secundarias72.
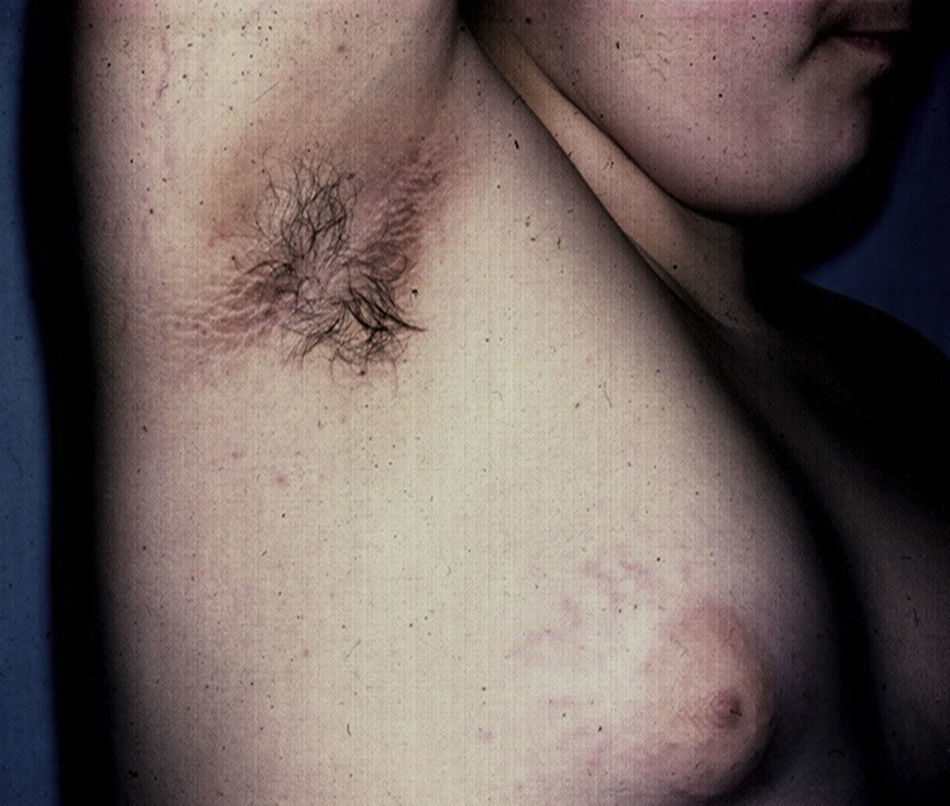
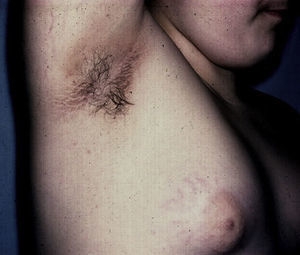
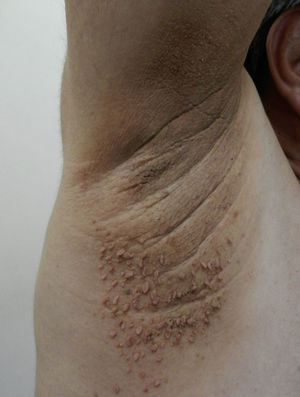
Cambios cutáneos asociados a obesidad en niñosAcantosis nigricansLa AN es la manifestación dermatológica más frecuente, presentándose en el 66% de adolescentes con sobrepeso73 y en el 56-92% de los niños y adolescentes con DM2, motivo por el cual se considera un marcador clínico importante74. Se presenta como parches o placas aterciopeladas pigmentadas, en ocasiones de superficie hipertrófica y verrugosa, de forma bilateral y simétrica, y se localiza en las axilas (fig. 5), la cara posterior de cuello, las áreas de flexión de las extremidades superiores e inferiores, el ombligo, las ingles y los pliegues inframamarios, entre otros75. La AN es, además, el hallazgo temprano más frecuente en niños que presentan obesidad y/o síndrome de resistencia a la insulina. El tratamiento en la mayor parte de los casos consiste en disminuir de peso y mantener controlados los niveles de glucemia.
La AN se puede presentar, y es de gran utilidad para el diagnóstico, en los niños que muestran formas sindrómicas. En la AN tipoA (síndrome HAIR-AN) se observa hiperandrogenismo asociado a ovarios poliquísticos y signos de virilización, episodios de acné, seborrea e hirsutismo. En la AN tipoB, más frecuente en mujeres y poblaciones mayores, con un rango de edad de 12 a 60años4, se observa un hiperandrogenismo importante y la asociación con otras enfermedades autoinmunes, principalmente lupus eritematoso76, y la AN puede ser periocular. Otras formas sindrómicas más raras son los síndromes de Berardinelli-Seip (congénito) o de Lawrence (adquirido), que consiste en la ausencia completa de grasa subcutánea y lipodistrofia generalizada debido a estados de resistencia a la insulina extrema e hiperandrogenismo77.
Un hecho interesante de la identificación de la AN es que motiva a consultar al especialista, llevando a la discusión sobre la modificación del estilo de vida, pudiendo mejorar los factores de riesgo del paciente78.
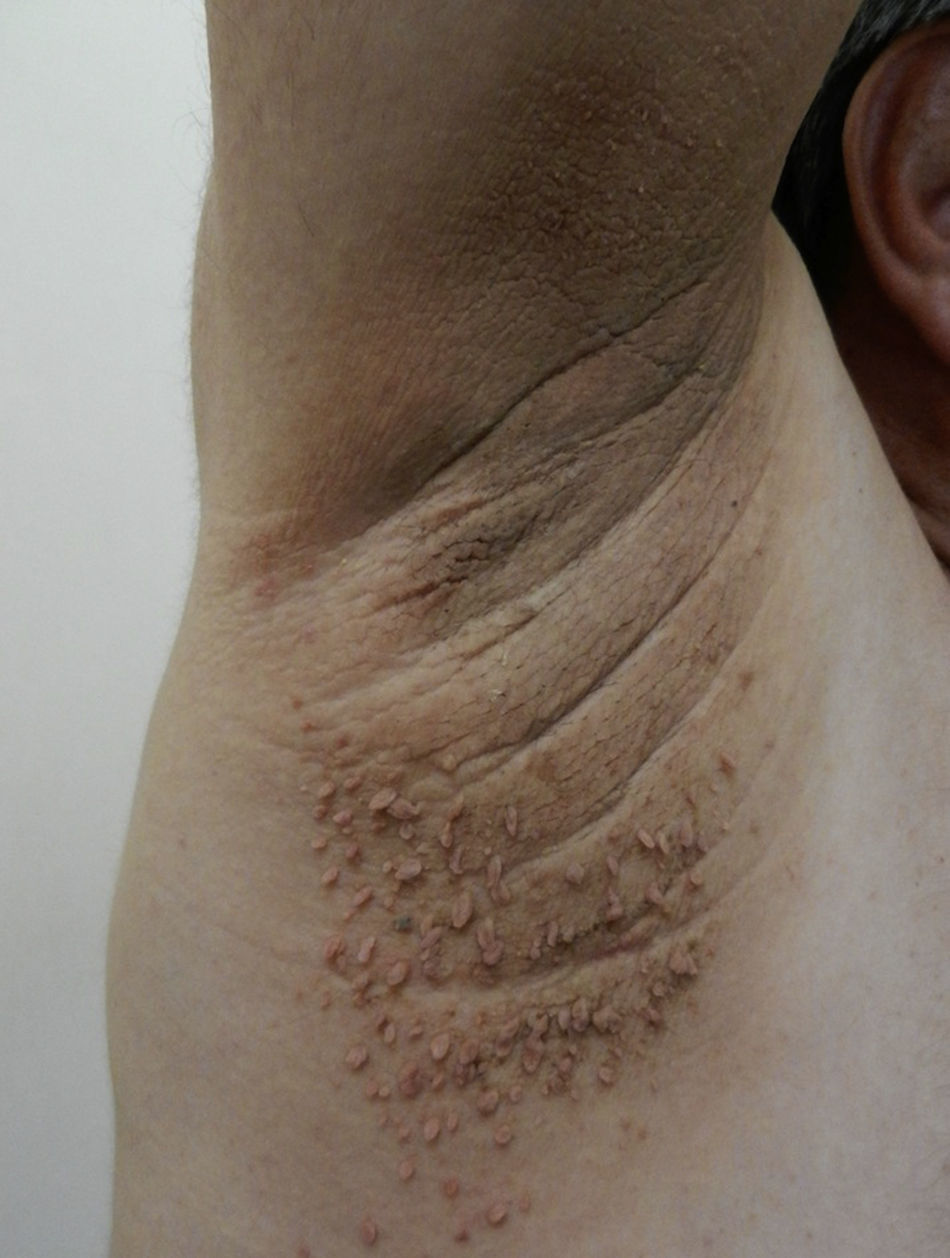
AcrocordonesLos acrocordones, fibroepiteliomas o fibromas pedunculados consisten en pápulas pediculadas blandas color café, localizadas con frecuencia en el cuello, la axila (fig. 6) y las ingles y que se asocian con AN. Existen pocos estudios de incidencia de esta manifestación en niños. El origen definitivo es desconocido; sin embargo, tiene una fuerte asociación al frote excesivo de la piel, al desequilibrio hormonal, a hipertensión, al síndrome metabólico y a la obesidad en adultos79. Se ha visto que los pacientes que tienen más de 10 fibroepiteliomas son usualmente obesos16 y tienen niveles elevados de leptina71. Las opciones terapéuticas existentes son la escisión simple con tijera fría, la electrodisecación y la crioterapia.
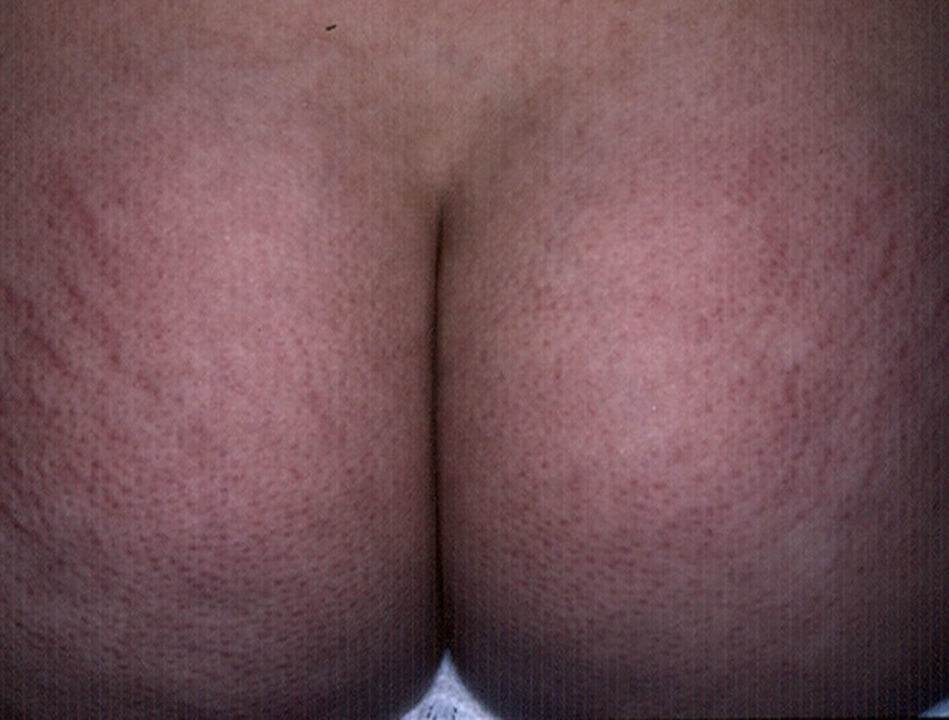
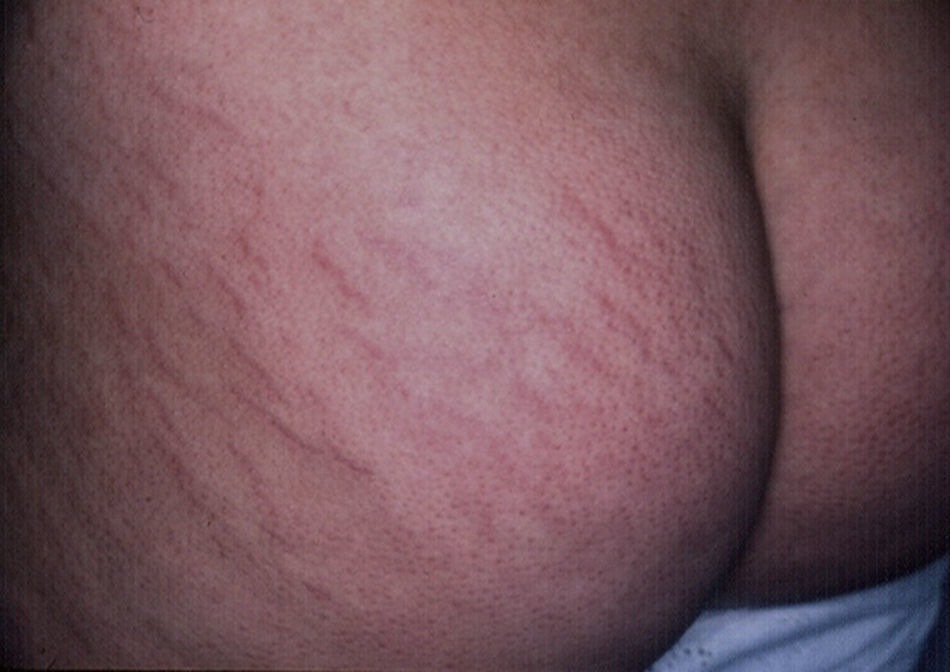
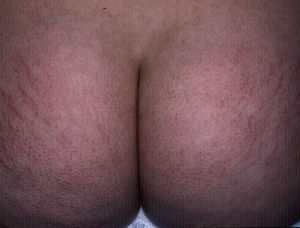
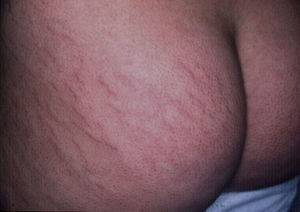
EstríasAl igual que sucede con los acrocordones, su presencia se relaciona directamente con el grado de obesidad en los niños16, con una incidencia de hasta el 40% en niños con obesidad moderada a severa80. Consisten en placas lineares atróficas distribuidas perpendicularmente a las fuerzas mayores de tensión. Se localizan de forma predominante en la región mamaria, los glúteos (fig. 7), el abdomen y los muslos17. En la fase inicial son eritematosas, cambiando a violeta y finalmente convirtiéndose en placas blanquecinas deprimidas. Las opciones terapéuticas son numerosas, entre ellas la tretinoína, sola o combinada con ácido glicólico, la microdermoabrasión, las luces de colorante pulsado (PDL) y los láser fraccionados (CO2 y Erbium); ninguna ha demostrado un éxito mayor que las otras81.
Hiperqueratosis plantarEn el paciente obeso la alteración de la forma del pie consiste en la pérdida del arco plantar, una huella más ancha y con mayor presión evidente durante la bipedestación y la marcha66. La hiperqueratosis plantar es secundaria a mecanismos físicos de presión, es un hallazgo asociado a la cronicidad y a la severidad de la obesidad16 y constituye una lesión precursora de pie diabético cuando se asocian a DM30.
Enfermedades cutáneas exacerbadas por obesidadA diferencia de las numerosas enfermedades dermatológicas asociadas a obesidad en el paciente adulto, en los niños estas asociaciones son pocas, haciendo falta estudios para demostrarlas. Las asociaciones más comunes son el intertrigo, la psoriasis y la dermatitis atópica. Otras entidades en las cuales la obesidad podría ser un factor etiológico o de riesgo para su presentación son hidradenitits supurativa82, livedo reticularis83, cutis verticis gyrata84 y quiste pilonidal85.
Obesidad e infeccionesSon las complicaciones más frecuentes del paciente obeso. Los factores de riesgo son diversos, como previamente se ha mencionado, e incluyen una piel con la barrera epidérmica alterada, con microambientes húmedos y macerados, con limitación en la movilidad y en las actividades básicas de higiene.
El intertrigo es la manifestación más frecuente, consiste en un enrojecimiento importante con secreción y ocasional olor en los pliegues, requiere tratamiento médico con antibióticos tópicos y en algunos casos corticoides de baja potencia para disminuir los síntomas; igualmente, requiere gran colaboración por parte del paciente, modificando las medidas de higiene y el uso de sustancias secantes para disminuir la fricción. Es frecuente la complicación por sobreinfección con levaduras, principalmente Candida albicans, requiriendo además tratamiento con antimicóticos tópicos.
Entre otras infecciones encontradas están las paquioniquias, forunculosis y ántrax, causadas por estafilococos, y el eritrasma, causado por el Corynebacterium minutisimi. Así mismo los pacientes obesos muestran mayor tendencia a celulitis de las extremidades y úlceras vasculares por el linfedema y la insuficiencia venosa.
Obesidad y psoriasisLa asociación de obesidad y psoriasis se describió inicialmente en 1986, cuando se observó mayor prevalencia de obesidad en un grupo de mujeres con psoriasis que en el grupo de mujeres sanas86. Actualmente se ha demostrado que existe un sustrato fisiopatológico común, tal como las vías de inflamación y un exceso de citoquinas87. Hay que tener en cuenta que la obesidad es una enfermedad inflamatoria crónica de bajo grado. Debido a la elevación de citoquinas proinflamatorias, principalmente el factor de necrosis tumoral alfa, la interleucina 6 (IL-6) y proteínas de fase aguda tales como la proteína C reactiva (PCR), se podría explicar la asociación con psoriasis. Al coexistir con otras entidades patológicas, haría parte entonces del síndrome metabólico88.
A nivel mundial, los niños con psoriasis tienen exceso de adiposidad y un aumento de la adiposidad central, independientemente de la gravedad de la psoriasis89. La identificación temprana de este factor de riesgo metabólico y la educación en cuanto a factores modificables (alimentación saludable, mantenimiento de un peso adecuado y actividad física) constituyen un pilar fundamental en el tratamiento de estos pacientes y una intervención primordial en el pronóstico de los pacientes con psoriasis90.
Obesidad y dermatitis atópicaExiste una importante asociación entre obesidad, dermatitis atópica y asma bronquial, especialmente cuando la obesidad se inicia antes de los 5años y es prolongada91. El mecanismo fisiopatogénico no es completamente entendido, aunque en parte puede ser explicado por la alteración de la respuesta inflamatoria en las personas obesas y a la síntesis de mastocitos por el tejido adiposo blanco, los cuales se correlacionan con el incremento de los niveles de leptina y mayor sensibilización a alérgenos72. Lo más importante de esta asociación es que el paciente obeso atópico presentará brotes más severos y requerirá un esfuerzo terapéutico mayor92.
Obesidad e hidradenitis supurativaLa hidradenitis supurativa en una enfermedad inflamatoria crónica y recurrente de la piel. Se inicia en la pubertad y se caracteriza por lesiones profundas y dolorosas, localizadas en las glándulas apocrinas de las áreas con pelo del cuerpo, principalmente axilas, región inguinal y región anogenital93. Es considerada una enfermedad poco común, con una prevalencia global del 1% y con una relación de presentación hombre-mujer de 1:3,3. Actualmente se acepta que su origen es por un defecto en la unidad pilosebácea y no en las glándulas sudoríparas94, tomando como evento primario en la patogénesis hiperqueratosis del infundíbulo, produciendo oclusión del folículo, y la sobreinfección bacteriana por estafilococo, Escherichia coli y estreptococos, como evento secundario. Un factor de riesgo adicional a la obesidad es el tabaquismo, con una relación directa dosis/efecto, observado principalmente en casos severos82.
ConclusionesEn definitiva, la diabetes y la obesidad son 2 enfermedades sistémicas importantes, cada vez más frecuentes, con un notorio compromiso de la piel. Es esencial como dermatólogos estar al tanto de las manifestaciones cutáneas, para realizar un diagnóstico temprano, ayudando a prevenir las secuelas, y continuar con la descripción de las existentes y nuevas asociaciones.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Al Servicio de Dermatología del Hospital de la Santa Creu i Sant Pau.