La pandemia por COVID ha causado hoy en día millones de afectados, continuando su aumento a nivel mundial. Junto con la afectación los órganos diana clave (aparato respiratorio, anosmia, diarrea, fiebre, etc.), se han descrito reacciones inmunológicas tardías en los rellenos dérmicos por ácido hialurónico (AH), fundamentalmente a nivel facial. Estas alteraciones aparecen tanto en pacientes positivos para el virus, independientemente de la sintomatología sistémica, como en pacientes que han recibido vacunación frente al SARS-CoV-2. Aunque las reacciones suelen ser autolimitadas y autoresolutivas, es importante saber diagnosticarlas y en ocasiones establecer tratamiento con corticoides, hialuronidasa y/o antibióticos. Aunque no son graves, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) las ha clasificado como evento adverso serio. Los mecanismos que originan están reacciones no están completamente dilucidados. Parece que son reacciones de hipersensibilidad retardada tipo IV, favorecidas por estímulos inmunológicos que se activan en presencia de la COVID o de otros virus como la gripe. Sin embargo, dado que los rellenos presentan cada vez mayor durabilidad y a que la pandemia continúa su curso, existiendo nuevas vacunas en desarrollo, es esencial la realización de estudios que describan la evolución a largo plazo tanto de los rellenos de AH, como de otros bioimplantes. Así mismo, es esencial alentar a los médicos de que reporten este tipo de reacciones, aunque no revistan gravedad con el objetivo de poder realizar un registro fidedigno de ellas.
SARS-CoV-2 has caused millions of infections and deaths worldwide and case numbers continue to rise. Besides the effect of the virus on key organs — leading to respiratory illness, anosmia, diarrhea, and fever and other complications — delayed inflammatory reactions to hyaluronic acid dermal fillers, mainly in the face, have also been reported to occur after confirmed SARS-CoV-2 infections and in vaccinated individuals. While delayed inflammatory reactions tend to be self-limiting, they should be diagnosed and treated with corticosteroids, hyaluronidase, and/or antibiotics when necessary. The inflammation is generally not severe, yet these complications are classified as serious adverse events by the US Food and Drug Administration. They appear to be delayed type IV hypersensitivity reactions triggered by the immune system in the presence of SARS-CoV-2 or other viruses, such as those causing influenza, although the underlying mechanisms have not been fully elucidated. Because the longevity of dermal fillers is increasing, while the pandemic continues to evolve and new vaccines are under development, the long-term effects on hyaluronic acid fillers and other bioimplant materials should be studied. Physicians must also be encouraged to report these reactions, however mild, to ensure accurate records.
El ácido hialurónico (AH) es un glucosaminoglicano que forma parte de la matriz extracelular. Es segregado por múltiples células como fibroblastos, sinoviocitos, células endoteliales, células del músculo liso, células adventicias y ovocitos1. Forma parte de las matrices tisulares y celulares, y estabiliza los componentes celulares de la dermis, regulando el balance osmótico, la proliferación celular, adhesión y migración2.
Su estructura molecular es idéntica en todos los organismos, y es considerado biológicamente inerte, haciendo mínimo el riesgo de inmunogenicidad debido a la ausencia de epítopos proteicos2,3.
Su biocompatibilidad y estabilidad en el lugar del implante junto con la relación coste-efectividad lo convierten prácticamente en el relleno dérmico (RD) ideal1,2. Además, debido a la expansión mecánica de los tejidos tras su inyección, activa los fibroblastos estimulando la neocolagenogénesis1. Pese a encontrarnos inmersos en una pandemia, el número de tratamientos estéticos no quirúrgicos continúa aumentando en nuestro país. De estos, más del 35,5% son infiltraciones de AH4.
El abandono del AH de origen bovino y la mejora en las técnicas de obtención a través de biosíntesis bacteriana desde cepas estreptocócicas (Streptococcus equi o Streptococcus zooepidemicus) ha disminuido de forma importante el desarrollo de reacciones adversas. Sin embargo, los aditivos necesarios para su estabilización y reticulación y la posibilidad de contaminación con proteínas o ARN bacteriano durante su producción hacen que el riesgo no se elimine completamente1,5,6.
El porcentaje de reacciones adversas varía entre 0,02-0,4%5,7, reportándose series de hasta 4,25%, asociadas fundamentalmente a AH de bajo peso molecular (BPM)2,3,7,8.
Desde el primer caso de neumonía reportado en Wuhan en Diciembre 2019 por el nuevo coronavirus SARS-CoV-2, la pandemia ha originado más de 207.780.000 de infectados a nivel mundial9,10.
Se han publicado casos clínicos describiendo reacciones inflamatorias tardías (RIT) de rellenos de AH en pacientes con contacto con SARS-CoV-2 o tras desarrollar COVID11,12, así como alteraciones de los rellenos dérmicos secundarios a la vacunación13,14. Previamente a la pandemia ya se habían descrito RIT de los rellenos en relación con cuadros catarrales o tras la vacunación por gripe1,2,11,12.
Debemos tener en cuenta que las mejoras en la síntesis y producción del AH cada vez dotan a los rellenos de una mayor durabilidad, pudiéndose mantener en determinadas regiones faciales hasta cinco años, por lo que previsiblemente estas alteraciones provocadas por COVID tenderán a aumentar.
Material y métodosEn este artículo se lleva a cabo una revisión de los mecanismos fisiopatológicos y de la sintomatología de las RIT de los rellenos dérmicos asociadas a la infección por COVID-19. Junto con ello, se realiza también un análisis de las alteraciones más frecuentes de los rellenos dérmicos que se han descrito secundarias a las campañas de vacunación, así como de su diagnóstico y tratamiento.
Para ello, se ha realizado una revisión bibliográfica de la literatura actual. Se llevaron a cabo búsquedas en PubMed con las siguientes palabras: «Fillers AND COVID», «Dermal Fillers AND COVID» y «Hyaluronic Acid AND COVID», obteniendo en total 77 resultados, de los cuales se analizaron 42 artículos. La búsqueda tuvo lugar hasta el 28 de agosto de 2021.
ResultadosSe aceptaron para la revisión todas las publicaciones que relataban casos clínicos o pequeñas series de casos describiendo alteraciones de rellenos dérmicos tras infección por COVID.
Munavalli et al.11 fueron los primeros en describir estas alteraciones en varios pacientes, describiendo cómo realizaron el diagnóstico, tratamiento y el outcome que tuvieron. Asimismo, relata el uso de lisinopril como tratamiento innovador en estas reacciones.
Posteriormente, otros autores han descrito casos similares, y la propia Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha reconocido la existencia de estas reacciones de carácter inmunológico relacionadas con la COVID y la vacunación12, e incluso alteraciones de prótesis mamarias tras años de su implante27.
DiscusiónLas RIT secundarias a los rellenos dérmicos de AH se clasifican en función del tiempo que tardan en aparecer: Tempranas, de 14 días hasta un año tras el relleno, o tardías, cuando aparecen más de un año tras la realización del procedimiento15. Algunos autores las diferencian en tempranas (primera semana), intermedias (entre la semana y el mes) o tardías (a partir del mes). En la práctica clínica es difícil definir la etiología de las reacciones intermedias y tardías, pero su tratamiento suele ser similar e independiente de la etiología7.
Aunque no están claros los factores que pueden producirlas, podrían estar favorecidas por activadores inmunológicos (como anticuerpos frente a AH, o restos de proteínas o ARN bacteriano que contaminen el AH tras su producción), bacterias que se arrastren al interior desde la piel en el momento de la inyección originando biofilms, productos de baja calidad e infecciones bacterianas (sinusitis, procedimientos dentales) o víricas (fundamentalmente las desarrolladas con cuadros gripales o vacunación de la gripe)2,7,11,15.
Las mejoras en la reticulación y estabilización del AH durante los últimos años han conseguido rellenos mucho más resistentes a la degradación enzimática, aumentando su longevidad. Actualmente podemos encontrar rellenos que perduran entre dos y cinco años en determinadas zonas faciales, por lo que previsiblemente estas reacciones aumentarán en los próximos años7,11.
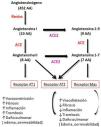
Fisiopatológicamente, la invasión de las células por el SARS-CoV-2 se produce mediante la unión de su proteína de membrana larga (S) al dominio I de la enzima convertidora de la angiotensina 2 (ACE2). Esta proteína, de 1.273 aminoácidos, protruye la cubierta viral y es la responsable del característico aspecto de «corona» del virus. A través de ella, el virus se ancla a la célula produciendo la fusión celular, la liberación del ARN al citoplasma celular y la infección de la nueva célula11,16,17. Algunos autores han demostrado que el SARS-CoV-2 solamente puede entrar a las células que expresan ACE217. Hay que destacar que la ACE no sólo es la diana del nuevo coronavirus sino también de varios CoV y de virus influenza18.
La ACE2 presenta una amplia distribución por todos los tejidos, siendo particularmente abundante en el corazón, vasos (endotelio vascular y músculo liso), intestino, pulmón (epitelio traqueal y bronquial, neumocitos tipo II, macrófagos), riñón, testículos y cerebro16. La piel, fundamentalmente en fibroblastos y queratinocitos, también presenta una concentración relativamente alta, así como el tejido adiposo, donde se asientan la mayoría de los rellenos faciales11.
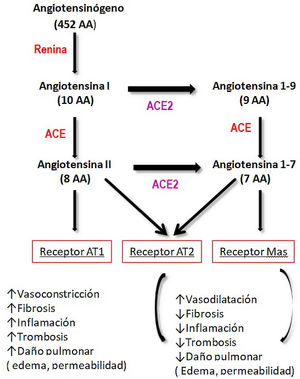
La ACE2 juega un papel esencial en la regulación de la tensión arterial y los mecanismos antiateroescleróticos18. Al unirse el SARS-CoV-2 a ACE2, modifica su actividad fisiológica, alterando el balance entre ACE/ACE2 y angiotensina II/angiotensina1–7, dando lugar a un aumento de angiotensina II y de su unión al receptor AT1, y favoreciendo los efectos deletéreos (vasoconstricción, fibrosis, inflamación, trombosis, daño pulmonar con edema y aumento de la permeabilidad)16,17 (fig. 1).
Vías de metabolización de angiotensina16.
Modificado de: Verdecchia, et al. Eur J Intern Med. 2020.
Junto a esto, la COVID origina un aumento en la expresión de mediadores inflamatorios (fundamentalmente IL-6, IL-2, IL-8, MCP-1, IP-10), un reclutamiento exagerado de células inflamatorias, junto con un déficit de en la respuesta de interferón y la producción de autoanticuerpos17.
Se cree que las reacciones de hipersensibilidad que dan lugar a las RIT son de tipo IV, iniciadas por linfocitos T y mediadas por CD4. Se pueden iniciar por infecciones víricas que activen a los macrófagos13, habiéndose descrito una prevalencia estacional coincidiendo con otoño e invierno o posteriores a infecciones gripales2.
Por otra parte, el grado de activación del sistema inmunológico va a depender del peso molecular del AH. Mientras el AH de alto peso molecular (APM) ejerce una acción fundamentalmente antiinflamatoria, el de BPM, o menor de 500 kDA actúa como proinflamatorio y puede actuar como una señal endógena, activando el propio sistema inmune2,3. Además, la menor concentración y viscosidad aumenta la inmunogenicidad debido a que el incremento de la tasa de metabolismo y degradación aumenta la zona de exposición de AH de BPM y de fragmentos de AH con efecto proinflamatorio3. De esta manera, los RD originan HA de BPM debido a la degradación del producto y debido a los agentes de unión 2.
El AH actúa como el ligando principal de CD44, una glicoproteína expresada en las células de los mamíferos que interviene en procesos de señalización celular. Este ligando se encuentra incrementado en infecciones virales. Su unión al AH produce la activación y el reclutamiento de los linfocitos2.
Algunos autores han sugerido también que las respuestas inflamatorias sistémicas, como las producidas por cuadros gripales, pueden favorecer la degradación de los rellenos dérmicos debido a la producción de radicales libres, dando lugar a fragmentos de AH de BPM que actúan como ligandos de CD44. Además, el aumento de AH de BPM origina un reclutamiento linfocitario al lugar del relleno donde más alta es la concentración de AH.
Por tanto, aunque el proceso de sensibilización no está aclarado completamente3, parece que la propia presencia de los rellenos constituye un factor de riesgo para el desarrollo de reacciones de hipersensibilidad en presencia de una infección sistémica y esta parece ser la causa del edema de los rellenos de AH tras la infección por SARS-CoV-22
Actualmente las modificaciones en las moléculas de AH para conseguir más durabilidad de los rellenos, suponen mayor presencia de impurezas, que asocian mayor aumento de las reacciones de hipersensibilidad13. Esto se ha documentado también en el AH empleado en otras técnicas médicas19.
La incapacidad de que se produzca una fagocitosis total de los fragmentos de AH, junto con la formación de biofilm y la activación de las células T que ocurren frecuentemente tras los bioimplantes, puede originar formación de granulomas y fibrosis. La alta expresión de ACE2 en la piel tiene un papel esencial para mantener una inmunidad adecuada. La alteración en la ACE libre producida por el virus, aumenta la cantidad de ATII y el desarrollo de la respuesta proinflamatoria también a nivel dérmico19.
Como se ha comentado previamente, los niveles de ACE2 son elevados en los fibroblastos y los queratinocitos, siendo especialmente abundantes en el endotelio de la dermis media y profunda y en la microvascularización subcutánea. Es sabido que los rellenos de AH estimulan la angiogénesis, por lo que es posible que los niveles de ACE2 estén aumentados alrededor de las zonas donde se han realizado rellenos de forma puntual o crónica, aumentándose las posibilidades de presentar reacciones tardías tras la infección aguda por SARS-CoV-2 o tras la vacunación11.
La COVID también produce la activación del complemento especialmente en el tejido graso subcutáneo, causando alteraciones en la microvasculatura, denudación del endotelio celular, reduplicación de la membrana basal y microtrombosis20.
Las características individuales también influyen en el desarrollo de RIT. La combinación de los haplotipos HLA-B*08 y DR1*03 han demostrado un cuádruple aumento de la probabilidad de aparición de eventos adversos tardíos tras los rellenos dérmicos5,19,21.
Las RIT se suelen manifestar como edema, alteraciones en la coloración de la piel (fundamentalmente eritema), induración del tejido o nódulos que pueden ser dolorosos7,15,22.
Según el estudio realizado por la Sociedad Internacional de Dermatología y Cirugía Estética, el 15% de los pacientes presentaron tumefacción de los rellenos13. Munavalli et al. fueron los primeros autores en describir alteraciones de los rellenos faciales en los pacientes en contacto con COVID o vacunados en enero de 2021. Las pacientes presentaron sensación de quemazón e hinchazón en las zonas con rellenos de AH, así como edema facial, eritema y aumento de la sensibilidad. Algunas describieron una mejoría transitoria durante un par de días, pero con el desarrollo posterior de un mayor enrojecimiento y nódulos indurados que, en ocasiones, evolucionaron a edema intermitente. Las pacientes progresaron favorablemente, aunque requirieron tratamiento médico con corticoides, antibiótico, hialuronidasa y en uno de los casos se empleó lisinopril11.
Tras el inicio de las campañas de inmunización se comenzaron a comunicar reacciones inflamatorias asociadas a la vacunación con Pfizer BioNTech (BNT162b2) y Moderna (mRNA-1273)14,23. Respecto a los casos recogidos durante los ensayos clínicos, se describieron 414 reacciones en los individuos vacunados desde diciembre 2020 a febrero 202114. La sintomatología apareció entre las 12 y las 24 horas postvacunación. Estas reacciones fundamentalmente consistieron en erupciones vesiculares, urticariformes, maculares y papulares, o hinchazón de los rellenos dérmicos faciales (nueve casos), pernios o sabañones (ocho casos), varicela zoster (10 casos), herpes simple (cuatro casos) y cuatro erupciones inespecíficas en lactantes de madres vacunadas. Las reacciones fueron generalmente menores14.
Los autores atribuyeron las reacciones a hipersensibilidad retardada, mediada por linfocitos T, y se asociaron a la presencia de excipientes como neomicina, timersol o polietilenglicol, por lo que no se consideraron contraindicaciones para continuar la vacunación con dosis posteriores14 y a la estimulación de la hipersensibilidad por un desencadenante inmunológico, ya descrito previamente tras enfermedades víricas y vacunación gripal14,23. Respecto a este estudio, los autores recogen entre sus limitaciones un seguimiento incompleto y un sesgo de información debido a la tendencia a comunicar fundamentalmente reacciones graves14.
La FDA reconoció el edema de rellenos faciales como un efecto colateral de aparición en aquellos pacientes que habían recibido previamente rellenos dérmicos. Fue reconocido como un efecto grave pese a que los tres casos descritos durante la fase III del ensayo de Moderna, y se resolvieron tras tratamiento con corticoides y antihistamínicos12,23. La FDA estableció que la alteración en los rellenos puede ser causada por la respuesta inflamatoria debida a la interacción entre la respuesta inmune provocada tras la vacunación y el RD12. En este registro no se identificaron complicaciones posteriores ni secuelas y los pacientes respondieron de forma adecuada a corticoides tópicos, antihistamínicos y analgésicos. Se precisaron antibióticos de forma puntual si se consideró que el paciente estaba desarrollando una celulitis.
Aunque el tratamiento fue siempre individualizado, la mayoría de los casos se trataron inicialmente con metilprendisolona a 1 mg/kg entre ocho y 14 días, antibiótico (doxicilina fundamentalmente, aunque se describen tratamientos con trimetoprim-sulfametoxazol), en pautas de entre una y dos semanas y hialuronidasa, precisando dosis repetidas en ocasiones debido al aumento del edema tras la primera inyección. Además, en los casos con una peor respuesta, se añadió 5-fluoracilo, corticoides en pautas largas y antihistamínicos11,12, aunque estos tienen un valor limitado8. Los corticoides orales constituyen la terapia inicial para las RIT secundarias a la vacunación19.
Es importante reseñar que previo al tratamiento con hialuronidasa se recomienda la realización de una prueba de sensibilización con 0,1 mL8.
Las recidivas en las inflamaciones fueron frecuentes y se indica que los pacientes deben ser avisados de ello8. Algunos pacientes pueden presentar RIT en los rellenos por COVID-19 incluso aunque no presenten la sintomatología sistémica propia de este22.
Munavalli et al. describen también el empleo exitoso de lisinopril oral a bajas dosis (5 mg), con desaparición del edema entre 24 y 48 horas11,24,25. El lisinopril se ha descrito como beneficioso para reducir las RIT producidas por la vacunación, y se ha propuesto como una medicación para administrar previa a la inmunización en pacientes con antecedentes de RIT tras rellenos con AH o que hayan presentado alteraciones de los rellenos con la primera dosis de la vacuna19. Su beneficio se explica porque al bloquear la produccion de ACE I, se disminuye la producción de ATII y se reduce el sustrato para ACE2, compensando así la acción que ejerce la COVID. Además, lisinopril, al tener un inicio de acción rápido, disminuye la secrección de aldosterona por la corteza adrenal, lo que aumenta la excrección de sodio y, por lo tanto, la pérdida de agua. Como consecuencia, existe una rápida resolución del edema facial asociado a las RIT25. Sin embargo, actualmente no existen estudios que prueben su beneficio19,25.
Naouri et al. describieron algunos casos de formación de granulomas en pacientes que recibieron interferón (citocinas). En este contexto, el granuloma puede ser originado por la tormenta de citocinas originada por SARS-CoV-222. Previo a la pandemia se reportaron tasas de complicaciones inmunológicas en los rellenos entre 0,8 y 0,9%22.
Las RIT asociadas al SARS-CoV-2 generalmente son autoresolutivas en días o semanas8,22. En nódulos menores de 0,5 cm sin dolor, la recomendación es vigilancia. En los de mayor tamaño, sin mejoría o dolorosos con edema y eritema, sí se recomienda tratamiento. Suelen ser de naturaleza inflamatoria, pero hay que descartar un proceso infeccioso que pueda ser provocado por biofilms y microorganismos atípicos. Si el nódulo fluctúa hay que realizar cultivos para bacterias aeróbicas y anaeróbicas, micobacterias y hongos8.
Ghasemi et al. describen en su documento varios casos similares: una paciente tuvo síntomas tras realizarse el relleno dos días después de la vacunación con Moderna12. En los casos de pacientes que tuvieron Reacción en Cadena de la Polimerasa (PCR) positiva para COVID, la sintomatología fue más tardía, dos semanas posteriores. La resolución de los nódulos se produjo en seis semanas11.
Michon reporta también en una publicacion de junio del 2021 dos casos de RIT tras vacunación con Pfizer. La primera paciente presentó enrojecimiento e hinchazón en la zona de la ojera donde había recibido un relleno con AH seis meses antes sin incidencias. Desarrolló también síntomas gripales como cansancio, cefalea, mialgias y anorexia que se solucionaron los días posteriores. El evento se resolvió espontáneamente el quinto día8. La segunda paciente recibió la primera dosis de Pfizer nueve meses tras la realización de un total face. Unos días después de la vacunación, presentó enrojecimiento e hinchazón facial intermitente que duraba aproximadamente un día, de localización principal en las mejillas e infraorbitaria. Tres semanas después presentó un empeoramiento en la zona de la ojera con hinchazón, pero sin eritemas ni nódulos. Se realizó tratamiento con hialuronidasa, presentando la paciente resolución completa del cuadro8.
Aunque no es el objeto de esta revisión, cabe destacar que también se han descrito alteraciones en implantes mamarios tras la vacunación con Pfizer, Astra Zeneca y Janssen26. La mayoría de los casos presentaron una evolución óptima con tratamiento analgésico y antiinflamatorio, aunque uno de ellos desarrolló una infección que precisó lavado quirúrgico y retirada de la prótesis26. Restifo reportó un caso de contractura capsular de una prótesis mamaria en una paciente 20 días después de la segunda dosis de Pfizer27.
Parece que la duración de las RIT secundarias a COVID están relacionadas con la cantidad de relleno inicial, con la técnica (bolos /no bolos), y con la duración del relleno25. Además, varias citocinas inflamatorias originadas por la COVID-19 son potentes inductoras del metabolismo del AH28. En el síndrome de distrés respiratorio está bien establecida la existencia de una alteración en la síntesis y en los depósitos de AH28. La despolimerización de AH presente el las células epiteliales de la vía aérea inicia la cascada inflamatoria que lleva a la producción de citocinas29. Además, las citocinas proinflamatorias estimulan la exudación del AH en la propia vía aérea29. Por lo tanto, está claramente reportado que el SARS-CoV-2 interactúa con el AH, modificándolo.
Aunque el marzo del 2020 se publicaron guías para los rellenos dérmicos, la situación de pandemia las ha modificado en cierta medida. El empleo de asepsia estricta y la profilaxis ante situaciones de riesgo infeccioso son la clave para la seguridad del paciente durante estos tratamientos. Mientras continuemos en pandemia, sin duda lo ideal sería la realización de test serológicos que determinen la inmunidad21.
Goodman et al. propusieron un modelo de manejo en la consulta de Medicina estética en situación de pandemia que consta de 7 puntos: a) Cuestionario de salud para el paciente, con preguntas de screening y de contactos de riesgo. b) Uso de telemedicina siempre que sea posible. c) Identificar los pacientes de riesgo para desarrollar COVID grave (fumadores, diabéticos, obesos, añosos o con otras comorbilidades), intentando posponer el tratamiento estético hasta que haya disminuido el riesgo. d) Evitar los tratamientos combinados, ya que requieren mayor tiempo e implican mayor riesgo, así como considerar realizarlos de forma escalonada. e) Mantener las medidas de distanciamiento social y desinfección periódica de la sala de espera. f) Toma de temperatura sin contacto. g) Incidir en la importancia del lavado de manos los días posteriores al tratamiento, ya que los pacientes frecuentemente se tocan las zonas faciales infiltradas. h) Uso adecuado de equipos de protección personal. i) Si el riesgo de transmisión es alto, habrá que valorar diferir el tratamiento hasta que el riesgo disminuya21.
Además de estos principios, los autores insisten en que siempre es necesario tener hialuronidasa preparada en caso de que el paciente presentara signos de oclusión vascular. La piel debería ser desinfectada con alcohol o povidona iodada preferiblemente. La presión de inyección debe ser la mínima necesaria, e inyectar lentamente, masajeando posteriormente para asegurar la distribución homogénea del relleno21.
Se recomienda esperar al menos tres semanas desde la vacunación con COVID-19 para realizar rellenos, a fin de evitar el pico de respuesta inmune que es a los 21 días8.
En conclusión, la verdadera etiología de las reacciones inmunológicas tardías que aparecen con relación a los rellenos de AH y a la infección por SARS-CoV-2 o a los anticuerpos generados tras la vacunación, permanece sin dilucidar. Las reacciones inmunológicas tardías secundarias a la vacunación son autolimitadas y menores, por lo que la posibilidad de complicaciones de los rellenos faciales en ningún caso debe desalentar a la vacunación. Se recomienda esperar al menos tres semanas desde la vacunación con COVID-19 para realizar rellenos y así evitar el pico de respuesta inmune producida a los 21 días. Se recomienda evitar rellenos en pacientes con combinación de HLA B*08 y DRB1*03 conocida. En la entrevista con diversos médicos estéticos se ha recogido su inquietud por el aumento de RIT, que previamente a la COVID no se producían. Su sensación subjetiva es que estas se deben a la vacunación o a la propia enfermedad. Como estas reacciones no precisan tratamiento o se solucionan con corticoides a bajas dosis, la mayoría de los casos no se reportan, por lo que no existen registros fiables. Resaltamos la importancia de la selección adecuada del paciente y su seguimiento posterior, y de que los procedimientos estéticos sean realizados por médicos con formación adecuada capaces de diagnosticar y tratar las posibles complicaciones. El paciente debe ser consciente de los riesgos al realizarlos por profesionales no cualificados.
FinanciaciónEste proyecto no ha recibido financiación para su realización.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.