El riesgo de infección por Mycobacterium tuberculosis se halla aumentado en los pacientes con enfermedades inflamatorias crónicas y en tratamiento inmunosupresor, en particular con terapia antifactor de necrosis tumoral α. La detección de la infección tuberculosa latente y el tratamiento preventivo dirigido a reducir el riesgo de progresión a tuberculosis activa es obligatoria en este grupo de pacientes. Este documento de consenso multidisciplinar actualiza la opinión de expertos y establece recomendaciones para el diagnóstico y tratamiento de la infección tuberculosa latente en estos pacientes, según los conocimientos actuales en terapias biológicas.
Patients with chronic inflammatory diseases being treated with immunosuppressive drugs, and with tumor necrosis factor inhibitors in particular, have an increased risk of infection by Mycobacterium tuberculosis. Screening for latent tuberculosis infection and preventive therapy to reduce the risk of progression to active tuberculosis are mandatory in this group of patients. This updated multidisciplinary consensus document presents the latest expert opinions on the treatment and prevention of tuberculosis in candidates for biologic therapy and establishes recommendations based on current knowledge relating to the use of biologic agents.
La estimación actual es que un tercio de la población mundial es portadora de la infección latente por Mycobacterium tuberculosis1, una infección que puede reactivarse principalmente por situaciones que comprometan la inmunidad del huésped. La incidencia estimada de infección tuberculosa latente (ITL) en nuestro medio en pacientes psoriásicos tratados con fármacos antifactor de necrosis tumoral α (anti-FNT) es del 29%2. Si consideramos que, en las mejores condiciones, solo el 10% de los infectados desarrollarán tuberculosis (TB) activa a lo largo de la vida3,4, pero que hay factores que pueden elevar significativamente este porcentaje, la infección latente se convierte en un firme obstáculo para la eliminación de la TB en el mundo. Las medidas de salud pública y, en definitiva, el manejo clínico de la infección tuberculosa podría mejorar si se tuviese un mejor conocimiento de los estados latente y reactivado de M. tuberculosis.
Por otro lado, en esta última década, el desarrollo de las terapias biológicas ha supuesto un gran cambio en el tratamiento de algunas enfermedades dermatológicas inflamatorias crónicas, fundamentalmente en la psoriasis, pero también en la hidrosadenitis supurativa tras la reciente aprobación de adalimumab para su tratamiento. En 1998, la Food and Drug Administration5 aprobó el uso del infliximab para aquellos pacientes resistentes al tratamiento inmunomodulador convencional y desde entonces se han comercializado más de 20 nuevos fármacos para el tratamiento de las enfermedades inflamatorias mediadas inmunológicamente (EIMI), en los que el FNT-α y sus receptores juegan un papel clave en las respuestas inflamatorias aguda y crónica6.
El FNT es importante en la respuesta inmune, lo que señala que los fármacos que lo inhiben podrían aumentar el riesgo de infecciones y la reactivación de la TB.
La vigilancia posterior a la comercialización de los primeros fármacos biológicos autorizados (infliximab y etanercept) muy pronto reveló la aparición de casos de TB asociados7. A nivel nacional, desde febrero de 2000 se organizó un sistema de vigilancia activa de recogida de datos en BIOBADASER (Base de Datos de productos Biológicos de la Sociedad Española de Reumatología)8 y en octubre de 2008, el registro español de tratamientos sistémicos en psoriasis (BIOBADADERM) como estrategia de farmacovigilancia9.
La evidencia de los casos notificados mostró una importante asociación entre terapia con infliximab y aumento de riesgo de TB activa. Ello obligó muy pronto a establecer en nuestro país directrices y recomendaciones como la publicada en 2003 por GETECCU (Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa)10, para la prevención de la TB en los pacientes candidatos a infliximab.
El diagnóstico y tratamiento preventivo con isoniazida (INH) durante 9 meses de los pacientes con ITL ha sido bien establecido con el fin de reducir la probabilidad de progresión a TB activa11,12 y se ha podido demostrar que la introducción de protocolos de cribado de la ITL en los pacientes candidatos a terapia anti-FNT ha reducido la incidencia de TB en más del 78%13. No obstante, la continua observación de casos, incluso después de un tratamiento preventivo con INH14, obliga a la actualización de protocolos y a la búsqueda de mejoras en sensibilidad y especificidad de las pruebas de diagnóstico y tratamiento en esta población, que presenta un alto riesgo de progresión a TB activa15.
Objetivos del documentoLa existencia de abundante y reciente información sobre las nuevas terapias biológicas y la falta de unas directrices consensuadas entre las diferentes sociedades en nuestro país justificó la necesidad de un documento de consenso, publicado en el año 2016, que pretendía recabar la información existente y las recomendaciones de directrices anteriores basándose en la evidencia científica disponible y en el consenso de un grupo de expertos16. El objetivo del presente documento es actualizar y ampliar la información de dicho documento y adaptarlo al paciente dermatológico.
MetodologíaEn la redacción del documento han participado expertos designados por las diferentes sociedades científicas (Academia Española de Dermatología y Venereología, Sociedad Española de Neumología y Cirugía Torácica, Sociedad Española de Patología Digestiva, Sociedad Española de Reumatología y Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica) con especial dedicación al estudio y control de los pacientes candidatos a terapias biológicas y especial experiencia en este campo. Se han consultado las últimas ediciones de las directrices nacionales e internacionales sobre terapias biológicas, diagnóstico y tratamiento de ITL y bases de datos de Medline y Cochrane hasta julio de 2017. Con la información obtenida se establecen recomendaciones basadas en la clasificación de la Infectious Diseases Society of America17, así como en las categorías de potencia18 (tabla 1).
Grados de recomendación18
| Recomendaciones según categorías de potencia | Recomendaciones según calidad científica | |||
|---|---|---|---|---|
| A | Buena potencia | Apoya la recomendación | Grado I | Recomendación basada en al menos un ensayo clínico bien diseñado, controlado y aleatorizado |
| B | Potencia moderada | Apoya la recomendación | Grado II | Recomendación basada en al menos un ensayo clínico bien diseñado pero no aleatorizado, en estudios de cohortes, múltiples series o resultados muy evidentes de ensayos no controlados |
| C | Escasa potencia | No permite apoyar ni rechazar la recomendación | Grado III | Recomendación basada en la opinión de expertos en estudios descriptivos o en la experiencia clínica |
En la actualidad, los agentes biológicos con indicación aprobada en nuestro país para la psoriasis son los siguientes: infliximab, etanercept, adalimumab, ustekinumab, secukinumab e ixekizumab19-31. Así mismo, adalimumab ha sido recientemente aprobado para el tratamiento de la hidrosadenitis supurativa32. No se dispone de otros agentes biológicos con indicación aprobada para enfermedades específicamente dermatológicas. En la tabla 2 se resumen las principales indicaciones de cada biológico y la fecha de aprobación en nuestro país19-24.
Tipo de agente biológico, indicación y fecha de aprobación
| Tratamiento | Tipo de agente biológico | Indicación. Fecha de autorización |
|---|---|---|
| Infliximab | Anticuerpo monoclonal IgG1 humano-murino quimérico anti-FNT α producido en células en hibridoma murino mediante tecnología de ADN recombinante | Adultos con psoriasis en placas de moderada a grave que no han respondido o que tienen contraindicación a otra terapia sistémica. Agosto de 1999 |
| Etanercept | Dímero de fusión del dominio extracelular soluble del receptor 2 de FNT tumoral humano y el dominio Fc de la IgG1 humana mediante técnicas de ADN recombinante a partir de un cultivo de células de OHC | Adultos con psoriasis en placas de moderada a grave que no han respondido o que tienen contraindicación a otra terapia sistémica. Febrero de 2000 |
| Psoriasis en placas crónica grave en niños a partir de 6 años que no estén controlados o sean intolerantes a otras terapias sistémicas. Febrero de 2009 | ||
| Adalimumab | Anticuerpo monoclonal humano recombinante anti-FNT α producido en células de OHC | Adultos con psoriasis en placas de moderada a grave que no han respondido o que tienen contraindicación a otra terapia sistémica. Septiembre de 2003 |
| Psoriasis en placas crónica grave en niños a partir de 4 años que no estén controlados o que sean intolerantes a otras terapias sistémicas. Abril de 2015 | ||
| Pacientes de al menos 12 años de edad con hidrosadenitis supurativa activa de moderada a grave que no responda adecuadamente a otros tratamientos convencionales sistémicos. Septiembre de 2015 | ||
| Ustekinumab | Anticuerpo monoclonal anti-p40 (subunidad de IL12/23) humano que se produce en una línea celular del mieloma de ratón utilizando tecnología de ADN recombinante | Adultos con psoriasis en placas de moderada a grave que no han respondido o que tienen contraindicación a otra terapia sistémica. Enero de 2009 |
| Secukinumab | Anticuerpo monoclonal recombinante anti-IL17 íntegramente humano, tipo IgG1/κ producido en células OHC | Tratamiento de la psoriasis vulgar moderada a grave en adultos candidatos a tratamientos sistémicos. Marzo de 2016 |
| Ixekizumab | Anticuerpo monoclonal recombinante anti-IL17 i¿ntegramente humano, tipo IgG1/κ producido en células OHC | Tratamiento de la psoriasis vulgar moderada a grave en adultos candidatos a tratamientos sistémicos. Marzo de 2017 |
FNT: factor de necrosis tumoral α; OHC: ovario de hámster chino.
En la actualidad están emergiendo nuevas opciones terapéuticas para el tratamiento de la psoriasis como brodalumab33 (antagonista del receptor de IL17), guselkumab34, tildrakizumab35 y risankizumab36 (anti-IL23) y tofacitinib37 (inhibidor de las janus cinasas 1 y 3). Igualmente, los biológicos ya conocidos han mostrado su efectividad en enfermedades diferentes a la psoriasis (sarcoidosis, necrobiosis lipoídica, granuloma anular, pitiriasis rubra pilaris), para alguna de las cuales posiblemente vean aprobada su indicación en un futuro próximo.
Tuberculosis y terapia biológicaLa corticoterapia en las enfermedades sistémicas y los protocolos de inmunodepresión en la prevención del rechazo del trasplante han evidenciado desde hace tiempo que la TB es un problema real para los pacientes tratados con fármacos inmunosupresores38 (tabla 3). El desarrollo de TB activa en esta población es motivo evidente de preocupación: el diagnóstico puede retrasarse al quedar enmascarado por una presentación atípica7,39, los pacientes pueden presentar más efectos adversos debido a la propia enfermedad de base o a las interacciones farmacológicas y no debe olvidarse el potencial de transmisión de la TB al entorno, incluyendo otros pacientes inmunodeprimidos que reciben atención médica similar en áreas de tratamiento compartidas.
Fármacos inmunosupresores potencialmente inductores de tuberculosis
| Clasificación Efecto | Fármacos | Indicaciones | Riesgo teórico de TB |
|---|---|---|---|
| Linfoablativos Destrucción del tejido linfoide | Alquilantes Ciclofosfamida Fludarabina | Quimioterapia Enfermedades sistémicas | ± |
| Antimetabolitos Inhiben la síntesis de las purinas, pirimidinas Bloqueo de la expansión de LT activados | Micofenolato mofetil Azatioprina, Metotrexato Leflunomida | Prevención del rechazo del trasplante Enfermedades sistémicas | + |
| Antiproliferantes Controlan la entrada en fase S del ciclo celular por fijación al receptor de la rapamicina | Sirolimus Everolimus | Prevención del rechazo del trasplante | + |
| Anticalcineurina Inhibe la primera señal de activación del LT | Ciclosporina A Tacrolimus | Prevención del rechazo del trasplante | + |
| Corticoides Inhiben toda la reacción inmunoinflamatoria | Prednisona Metilprednisolona | Enfermedades sistémicas Prevención del rechazo del trasplante Oncología Asma, neumonitis por hipersensibilidad, fibrosis intersticial difusa | ++ |
| Anti-FNT Inhiben citocinas proinflamatoria FNT | Infliximab Adalimumab Etanercept Golimumab Certolizumab | Enfermedades sistémicas | +++ |
FNT: factor de necrosis tumoral α; LT: linfocito T; TB: tuberculosis.
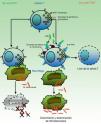
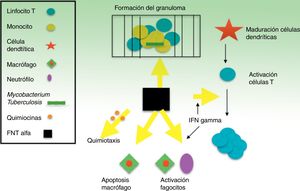
El FNT es un potente modulador de la respuesta inflamatoria precoz frente a una gran variedad de estímulos físicos, ambientales, infecciosos o inmunológicos. Específicamente, el FNT es clave en la defensa frente a M. tuberculosis y, junto con interferon-γ (IFN-γ) y otras citocinas relacionadas, juega un papel fundamental en el desarrollo y mantenimiento del granuloma como estructura que compartimenta y contiene al bacilo tuberculoso durante la infección40,41 (fig. 1). La inhibición del FNT y su red reguladora es la base biológica que parece sustentar el incremento medio de la incidencia de TB en 4-5 veces en pacientes con infección tuberculosa que reciben infliximab8. También se han comunicado casos de TB con otros inhibidores del FNT considerados de menor afinidad, como etanercept, una proteína de fusión que se une a la porción soluble del receptor FNT, y adalimumab, un anticuerpo monoclonal como infliximab, pero totalmente humano42. Solo de forma excepcional, e incluso sin clara relación causal, ustekinumab, un inhibidor de la proteína p40 de las IL12 y 23, se ha relacionado con la posible reactivación de una TB latente43,44. Por otro lado, la inhibición de IL17, en modelos in vitro, no parece reactivar la ITL45-47.
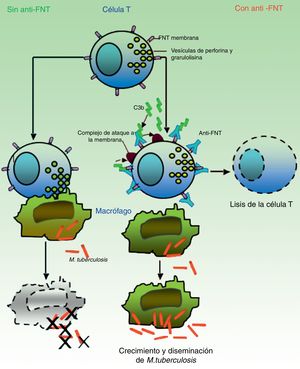
Se cree que es el granuloma la estructura que contribuye al control de los bacilos intramacrofágicos, al proporcionar un entorno local en el que las células presentadoras de antígeno (CPA) y los linfocitos interactúan para suprimir su crecimiento y proliferación7. Gran parte del trabajo para dilucidar los mecanismos de reactivación de la TB se ha centrado en el papel del FNT en la formación y mantenimiento de estas estructuras. Bruns et al.48 han descrito un mecanismo adicional para explicar la susceptibilidad a la progresión de la TB en los individuos tratados con infliximab. A partir de células de pacientes con prueba de tuberculina positiva, identificaron un subconjunto de linfocitos T efectores, denominados linfocitos T efectores de memoria CD8+ (TEMRA), que son células de memoria ricas en granulisina, una proteína con propiedades antimicobacterianas, y descubrieron que dichas células TEMRA se agotan selectivamente por el efecto del infliximab en pacientes con artritis reumatoide (fig. 2).
En ausencia de anti-FNT-α, las células T citotóxicas efectoras de memoria (TEMRA) liberan los gránulos con enzimas citolíticas (perforina, granulolisina) que destruyen los macrófagos infectados por M. tuberculosis así como los bacilos intra- y extracelulares. En presencia de anti-FNT-α, el FNT transmembrana de los TEMRA queda ligado a este anticuerpo, favoreciendo la apoptosis linfocitaria. La depleción de linfocitos T citotóxicos impide, por tanto, el control del crecimiento y permite la diseminación de M. tuberculosis.
Fuente: Adaptado de Miller y Ernst.41.
La inmunidad celular es fundamental para el control de la infección tuberculosa y, desde hace tiempo, se ha reconocido que las células T CD4+ son importantes mediadores de la inmunidad frente a M. tuberculosis. En fechas más recientes han ganado importancia las células CD8+ específicas, pero su significado sigue sin estar completamente dilucidado, en especial, en seres humanos. Se cree que los CD8+ limitan de manera directa el crecimiento de micobacterias al provocar la muerte de las células infectadas49,50 y también de manera indirecta, a través de la secreción de citocinas que promueven la activación de los macrófagos y de quimiocinas que coordinan el reclutamiento de otras células. Otros estudios indican que los CD8+ son, probablemente, menos importantes durante la fase aguda de la infección por M. tuberculosis, pero indispensables durante la fase crónica y, por lo tanto, pueden ayudar a prevenir la reactivación de la TB51,52. Al evaluar la contribución de los CD8+ a la inmunidad frente a M. tuberculosis, es importante tener en cuenta que los ratones no expresan granulisina, la proteína citolítica que, en humanos, contribuye a la muerte de M. tuberculosis49. En ese sentido, los estudios en el modelo murino pueden subestimar la importancia de las propiedades antimicobacterianas de los CD8+ si se extrapola su papel a la inmunidad humana. Los estudios en humanos son más limitados en número, pero experimentos in vitro muestran que las células TEMRA exhiben una gran avidez por las tinciones específicas para granulisina y muestran los niveles más altos tanto en citotoxicidad como en actividad antimicobacteriana en comparación con otros subconjuntos de células T53.
El experimento de Bruns et al.48 va más allá de la definición de las células TEMRA como meras efectoras de importancia antimicobacteriana potencial, e intenta explicar las consecuencias del bloqueo del FNT sobre ellas a partir de las observaciones sobre el crecimiento de M. tuberculosis en cultivo celular. Con estas observaciones se describe lo que parece un nuevo mecanismo capaz de neutralizar el FNT y que facilita la progresión de infección latente a TB activa. Estudios previos en el modelo animal habían revelado incrementos variables en la carga bacilar en ausencia de FNT54. Los resultados de estos estudios indicaban que el FNT contribuye al control directo de las micobacterias intramacrofágicas y a la supresión indirecta del crecimiento micobacteriano, al modular la formación o mantenimiento de los granulomas.
Riesgo de tuberculosis con los agentes anti-FNTLa infección tuberculosa está causada, en general, por la inhalación de bacilos viables que, por lo general, persisten en un estado inactivo conocido como ITL, aunque algunas veces pueden progresar rápidamente originando la enfermedad tuberculosa activa. Las personas con ITL permanecen asintomáticas y no son fuente de contagio. En la mayoría de los individuos, la infección inicial por M. tuberculosis queda contenida por las defensas del huésped y la infección permanece latente. Sin embargo, esta situación presenta el potencial de convertirse en una enfermedad en cualquier momento.
El riesgo de reactivación tuberculosa con la utilización de los anti-FNT depende de 2variables: el efecto inmunomodulador del tratamiento y la prevalencia subyacente de infecciσn tuberculosa, o de personas con riesgo de infectarse, en una determinada población. En la tabla 4 se recogen los datos de incidencia publicados en la primera década de utilización de los anti-FNT para el tratamiento de la artritis reumatoide, lo cual no es un modelo necesariamente aplicable al enfermo dermatológico38,55-57.
Incidencia y riesgo relativo de tuberculosis en la artritis reumatoide antes y después de la introducción de los agentes anti-FNT-α. Impacto de las recomendaciones
| Incidencia/100.000 y RR de tuberculosis | España Gómez-Reino et al. (20038), Carmona et al. (2005)13 | EE. UU. Wolfe et al. (2004)55 | Suecia Askling et al. (2005)57 | Korea Seong et al. (2007)56 |
|---|---|---|---|---|
| En la población general (RR) | 25 (1) | 6,2 (1) | 4-14a(2) | 67 (1) |
| En la AR (RR) | 110 (4,7) | 6,2 | 118 | 257(4) |
| En la AR con anti-FNT (RR acumulado) | 20 (4,7×5) | 24,5 (4) | 8 (2×4) | 36 (4×9) |
| En la AR con anti-TNF-α con recomendaciones (RR) | 117(4,7) | 6,2 (1) | ||
| Eficacia | Probada | Probada | Probada |
AR: artritis reumatoide; FNT: factor de necrosis tumoral; RR: riesgo relativo; TB: tuberculosis.
El hecho de haber realizado un tratamiento previo de la infección latente no es totalmente protector58 y no se ha concretado un período estándar para la reactivación, sino que varía según el fármaco empleado59. El grupo italiano multidisciplinar para la detección de TB en pacientes bajo terapia biológica (SAFEBIO) concluye en sus guías que etanercept es la molécula de menor riesgo de reactivación de ITL de todos los anti-FNT12.
Existe, además, evidencia de que la exposición a más de un fármaco anti-FNT supone el doble de riesgo relativo que estar expuesto a un solo fármaco para el desarrollo de infecciones graves60.
Reiniciación de tratamiento biológico tras la reactivación de tuberculosisEn la cohorte de Ozguler et al. de 2.754 pacientes tratados con fármacos biológicos, se identificaron 22 casos de TB activa durante el tratamiento; uno de los pacientes falleció en el período de un mes por una TB miliar. En 16 de los 21 pacientes restantes (76%), tras la inicial suspensión del tratamiento, se reinició terapia biológica: etanercept en 6 casos y rituximab en 5 casos fueron los fármacos más empleados. De ellos, en 4 pacientes el tratamiento se reinició mientras estaba en curso la terapia anti-TB, y en 12 de ellos al finalizarla. La mediana de seguimiento después de reiniciar el tratamiento biológico fue de 53 meses (rango 40-75). Solo uno de los pacientes que había reiniciado tratamiento biológico presentó una segunda reactivación, la cual fue tratada adecuadamente con terapia anti-TB con un seguimiento posterior de 33 meses de mantenimiento de tratamiento biológico sin nueva reactivación de la infección. Los autores concluyen que el reinicio del tratamiento con fármacos anti-FNT, incluso durante el tratamiento de la TB, parece una opción viable en pacientes que habrían desarrollado de manera previa una infección tuberculosa durante el tratamiento con anti-FNT, lo cual no excluye un cuidadoso seguimiento y control61.
El grupo francés RATIO publicó los resultados de seguimiento de 21 pacientes que habían desarrollado TB mientras recibían anti-FNT62. En 4 de los pacientes fue necesario reiniciar la terapia biológica (3 de ellos durante el tratamiento anti-TB) y no hubo ninguna recurrencia de la infección tras un seguimiento medio de 42,7 meses. Aislandis et al. publicaron una serie de 5 pacientes con artritis reumatoide que habían desarrollado TB mientras recibían anti-FNT. En 3 de los pacientes fue necesario reiniciar la terapia biológica, en todos ellos después de finalizar el tratamiento anti-TB, y no hubo ninguna recurrencia de la infección tras un seguimiento medio de 24 meses63.
Por tanto, parece que, es posible el reinicio de terapia biológica en casos de reactivación de TB tras un margen de seguridad adecuado después de iniciar el tratamiento antituberculoso.
Técnicas de diagnóstico de la infección tuberculosa latenteLa investigación de una posible infección tuberculosa entre las personas candidatas a tratamientos biológicos debería comenzar con la evaluación del riesgo potencial de exposición a M. tuberculosis. Los grupos de mayor riesgo están resumidos en la tabla 5.
Grupos de mayor riesgo de conversión a tuberculosis activa
| Personas en contacto reciente con pacientes con enfermedad tuberculosa |
| Personas nacidas, o que viven, en países con elevada prevalencia de TB, o que viajan con frecuencia a estas áreas por motivos comerciales, familiares o humanitarios |
| Residentes y trabajadores de instituciones cerradas como prisiones, albergues para personas sin recursos económicos y centros sociosanitarios de todo tipo |
| Abuso de alcohol y otros tóxicos, sin olvidar también que los pacientes fumadores desarrollan con más frecuencia TB que los no fumadores |
| Trabajadores sanitarios, en particular aquellos que atienden a pacientes con TB activa |
| Personas con lesiones radiológicas sugestivas de TB antigua, especialmente si, como en el caso de los tuberculín positivos, nunca han recibido tratamiento |
| Las edades extremas de la vida, las enfermedades inmunosupresoras y otras comorbilidades se han relacionado habitualmente con un riesgo incrementado de TB. En este grupo encontramos la infección por el VIH, las enfermedades autoinmunes y la situación postrasplante, pero también las neumopatías (silicosis), la insuficiencia renal crónica, la gastrectomía, la diabetes y algunos tumores como los de cabeza y cuello |
TB: tuberculosis; VIH: virus de la inmunodeficiencia humana.
En ausencia de una prueba gold standard para el diagnóstico de la infección tuberculosa, el manejo actual de los pacientes con enfermedades autoinmunes candidatos a tratamiento con anti-FNT incluye realizar una anamnesis dirigida sobre antecedentes de TB o infección latente, tratadas o no con anterioridad, evaluar el riesgo de exposición a posibles casos activos, buscar evidencia de una TB previa en la radiografía de tórax y realizar una prueba de detección de ITL (prueba de la tuberculina [PT] o pruebas basadas en la liberación de interferón γ [interferon-γ release assay, IGRA])64.
Prueba de la tuberculinaLa PT es la medida de una respuesta de hipersensibilidad retardada a la inoculación intradérmica del derivado proteico purificado, una mezcla de más de 200 proteínas de M. tuberculosis. Dado que los antígenos contenidos en el derivado proteico purificado se encuentran también en otras micobacterias, la vacunación con bacilo de Calmette y Guerín (BCG) puede ser causa de falsos positivos de PT. Además, la sensibilidad de la PT está comprometida en pacientes en tratamiento inmunosupresor, entre los que se produce una alta tasa de falsos negativos65. Estudios en pacientes con artritis reumatoide han demostrado que la tasa de falsos negativos de PT puede llegar hasta el 40%66. En ocasiones se indica la repetición de la PT para aumentar su sensibilidad debido al efecto booster (efecto empuje) sobre falsos negativos, pero también disminuye su especificidad, ya que aumenta el número de falsos positivos debido a la vacunación con BCG y a la exposición a micobacterias no tuberculosas67. Inconvenientes logísticos, incluida la necesidad de la visita de lectura o la subjetividad del observador al registrar el resultado de la prueba, también limitan la eficiencia de la prueba.
Según algunos autores, puesto que casi todos los pacientes candidatos a tratamiento con anti-FNT están recibiendo (o han recibido) otro tratamiento inmunosupresor, la PT no sería la exploración ideal para el cribado de la ITL en los pacientes con enfermedades inflamatorias7.
En los pacientes en los que la PT ha sido positiva nunca debe repetirse, ya que seguirá siendo positiva en la mayoría de los casos. La repetición de la prueba tiene un potencial riesgo de reacción grave y ninguna utilidad clínica.
Pruebas basadas en la liberación de interferón gammaLa secuenciación del genoma de M. tuberculosis permitió identificar mejor los genes involucrados en su patogenia y conocer la presencia de regiones de diferencia genética. En la región conocida como región RD1 se secretan unas proteínas propias de M. tuberculosis (ESAT-6 y CFP-10) que se comportan como antígenos específicos, inductores de la respuesta inmunitaria de tipo Th-1 con producción de IFN-γ en las personas infectadas por M. TB. Esta región, ausente en todas las cepas de M. bovis-BCG y casi en todas las micobacterias no tuberculosas, a excepción de M. kansasii, M. marinum y M. szulgai, está presente en todos los M. tuberculosis virulentos conocidos.
Las técnicas IGRA se fundamentan, por tanto, en la detección en la sangre periférica de individuos infectados del IFN-γ liberado por las células T sensibilizadas como respuesta a la estimulación in vitro con los antígenos específicos de M. tuberculosis. De estos IGRA hay en la actualidad 2kits comercializados.
- -
QuantiFERON®-TB-Gold in tube (Cellestis Ltd., Carnegie, Australia)68 que determina la producción total de IFN-γ en los individuos infectados por medio de una técnica ELISA. Un valor igual o superior a 0,35 UI/ml se considera positivo.
- -
T-SPOT.TB® (Oxford Immunotec Ltd., UK)69 que fue desarrollado por Lalvani a finales de los años noventa. Se trata de un procedimiento más laborioso que requiere una separación previa de las células monocitarias antes de incubarlas con los antígenos ESAT-6 y CFP-10. Su lectura se hace por medio de la técnica del Elispot, en la cual cada punto visible (o spot) representa una célula T secretora de IFN-γ. A partir de 6 spots el resultado se considera positivo.
Ambas técnicas incorporan controles positivos y negativos capaces de detectar falsos resultados debidos a anergia y problemas inmunológicos (informados como resultados indeterminados)70. En la mayoría de las guías el hallazgo de resultados indeterminados, más frecuentes en EIMI, aconsejan repetir las técnicas, que en muchos casos se confirman como negativas71,72.
La utilización de los IGRA presenta diversas ventajas respecto a la PT:
- 1.
Evita la subjetividad en la interpretación de los resultados.
- 2.
La determinación se puede repetir si es necesario.
- 3.
La obtención de los resultados no necesita visita de lectura a las 48-72 h.
- 4.
Es de fácil estandarización y aplicación en el laboratorio.
- 5.
Permite la inclusión de controles positivos al detectar los pacientes anérgicos.
- 6.
Respeta la privacidad del paciente.
Entre los inconvenientes, el más importante es el coste económico, superior al de la PT. Para minimizarlo, la obtención de resultados, en función de la capacidad del laboratorio, puede demorarse de forma razonable hasta agrupar el mayor número de muestras posibles. En cualquier caso, su implantación representa una mejora diagnóstica y un ahorro de recursos sanitarios. Por su mayor especificidad disminuye los falsos positivos de la PT y, por tanto, los gastos derivados de ello como radiografías, visitas médicas y tratamientos de la infección tuberculosa innecesarios. Por otra parte, parece tener mayor sensibilidad que la PT en aquellos individuos con alteraciones de la inmunidad celular con mayor riesgo de desarrollar la TB73,74.
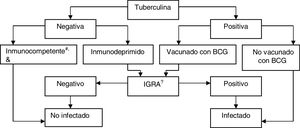
Interpretación de los resultados en pacientes candidatos a tratamientos biológicosLos IGRA son utilizados como pruebas rutinarias de diagnóstico de la infección latente en los Estados Unidos de América, Canadá, Australia, Japón y en algunos países de Europa occidental (Reino Unido, Italia, Alemania, Suiza). Algunos países los utilizan en lugar de la PT, mientras otros los utilizan en combinación con ella. En nuestro país se recomienda complementar la PT con IGRA para descartar falsos positivos de la tuberculina en los candidatos a recibir quimioprofilaxis si han estado vacunados con BCG (para descartar un falso positivo de la tuberculina) y en aquellos con prueba cutánea negativa y sospecha de inmunosupresión (para descartar un falso negativo de la tuberculina)75 (fig. 3).
BCG: bacilo de Calmette-Guerin; IGRA: prueba basada en la liberación de interferón.
a Consideramos inmunocompetentes a los pacientes con una cifra de CD4+ ≥ 500 cel/ml.
b En los casos de inmunodepresión severa (<200 CD4+) se deberá evaluar individualmente la probabilidad de estar infectado de verdad.
c La determinación de IGRA se puede repetir periódicamente (en función del riesgo individual de cada paciente) sin que se produzca efecto booster.
Fuente: Adaptado de Normativa de Diagnóstico y Tratamiento de la Tuberculosis de la Sociedad Española de Patología del Aparato Respiratorio (SEPAR)75.
A pesar de los numerosos estudios publicados en los últimos años, los datos sobre el rendimiento de estas pruebas son limitados y controvertidos74-80. Los datos procedentes de estos estudios concluyen que: a) la concordancia entre PT e IGRA es más pobre y débil en pacientes con enfermedades inflamatorias sistémicas que en sujetos sanos, debido a la menor prevalencia de PT positiva entre los primeros66,81-86; b) la magnitud de la respuesta tuberculínica es significativamente menor entre los pacientes que entre los controles sanos66; c) la discordancia PT+ e IGRA− se observa entre personas vacunadas y d) la discordancia PT− e IGRA+ se observa con frecuencia entre los que reciben tratamiento con corticoides82 (tabla 6).
Resultados de las pruebas de cribado de infección tuberculosa latente en pacientes con enfermedades inflamatorias sistémicas
| Estudio | Prueba | N.° de pacientes | Hallazgos |
|---|---|---|---|
| Ponce de León et al. (2005)65 | QF-In Tube | 101 | El porcentaje de positivos a la PT fue significativamente menor en pacientes con enfermedad inflamatoria que en controles sanos y la induración tuberculínica también fue significativamente menor |
| Pratt et al. (2007)70 | QF-Gold | 101 | 98 pacientes (4 de ellos con QF-G positivo) recibieron tratamiento con anti-FNT sin haber documentado casos de TB activa en un seguimiento de 30 meses |
| Takahashi et al. (2007)81 | QF-Gold | 14 | La concordancia entre el estudio convencional (PT, radiografía de tórax, historia) y QF-G fue moderada (64,3%) |
| Cobanoglu et al. (2007)84 | QF-In Tube | 68 | La concordancia entre PT y T-SPOT fue baja en controles sanos (64%) y muy baja en pacientes con enfermedades inflamatorias (47%) |
| Sellam et al. (2007)85 | T-SPOT.TB | 7 | La concordancia entre PT y T-SPOT en pacientes con infección tuberculosa documentada (alteraciones radiológicas, TB anterior) fue moderada (71%) |
| Boccino et al. (2008)79 | QF-In Tube, T-SPOT.TB | 66 | 8/15 pacientes con enfermedades inflamatorias y factores de riesgo para TB resultaron positivos para PT, QF y T-SPOT. Los restantes 7 fueron negativos para PT, pero positivos para QF o T-SPOT. 31/35 pacientes sin factores de riesgo resultaron negativos para todas las pruebas |
| Matulis et al. (2008)83 | QF-In Tube | 142 | QF-IT se asoció más estrechamente con tener factores de riesgo para TB. La concordancia entre PT y T-SPOT fue baja (64%) |
| Vassilopoulos et al. (2008)82 | T-SPOT.TB | 70 | La concordancia entre PT y T-SPOT fue moderada (72%). En el análisis multivariado la vacunación BCG se asoció con un mayor % de PT+ y los corticoides con un mayor % de T-SPOT+ |
| Santin et al. (2012)73 | QF-In Tube, T-SPOT.TB | 6514 | Metaanálisis (38 estudios). IGRA: capacidad limitada para descartar TB en pacientes VIH+. Los resultados positivos están influidos por la carga de enfermedad de la población estudiada |
FNT: factor de necrosis tumoral; IGRA: prueba basada en la liberación de interferón; PT: prueba tuberculínica; TB: tuberculosis; QF: Quantiferon; VIH: virus de la inmunodeficiencia humana.
Debido a la vulnerabilidad de estos pacientes frente a la TB cuando se hallan en tratamiento anti-FNT, parece prudente realizar las 2pruebas en paralelo (PT e IGRA) para maximizar la sensibilidad diagnóstica del cribado, al menos, hasta que la evidencia de la utilidad de los IGRA en esta población se haya consolidado. Es importante mencionar que cuando se realizan las 2pruebas de manera secuencial, los IGRA deben realizarse en primer lugar por el efecto booster causado por la PT87,88. Se desconoce cuánto tiempo persiste el efecto y si depende de la cantidad de derivado proteico purificado administrado o de sus características.
Dado que algunos pacientes con infección latente pueden tener falsos negativos para los IGRA y verdaderos positivos para la PT, y viceversa, la estrategia de cribado dual debería permitir a los clínicos ofrecer tratamiento preventivo a todos los pacientes con infección latente (tabla 7).
Interpretación de las pruebas de cribado en pacientes inmunodeprimidos
| Immunodeprimido | ||
|---|---|---|
| No tener en cuenta la vacuna BCG | ||
| PT < 5mm | PT ≥ 5 mm | |
| IGRA negativo (IN) | No ITL | ITL |
| IGRA positivo (IP) | ITL | ITL |
| IGRA indeterminado (II) | ?a | ITL |
aLos inmunodeprimidos con una o las 2 pruebas de cribado positivas deberían recibir tratamiento de la ITL con cualesquiera de las pautas recomendadas. Los resultados dudosos o indeterminados deberían repetirse (complementar PT con IGRA o T-SPOT.TB).
IGRA: prueba basada en la liberación de interferón; ITL: infección tuberculosa latente; PT: prueba tuberculínica.
Los resultados de los IGRA en pacientes que se hallan en tratamiento con anti-FNT siguen siendo difíciles de interpretar. Una estrategia propuesta ha sido repetir las pruebas después del inicio de la terapia biológica para detectar falsos negativos. Los datos disponibles en estudios recientes89-91 muestran conversiones y reversiones en ambas pruebas relacionadas con problemas de reproducibilidad y cambios en el estado inmune de los pacientes. Dicha variabilidad desaconseja la repetición de los test para el seguimiento de los pacientes durante el tratamiento.
Tratamiento de la infección tuberculosa latenteLa identificación y tratamiento de la ITL reduce en gran medida la probabilidad de reactivación y, así, tiene el potencial de proteger la salud de los individuos infectados además de impedir que nuevas personas puedan infectarse, al reducir el número de posibles fuentes de infección92,93.
Después del tratamiento de la ITL, la durabilidad de la protección contra la reactivación es variable y depende de la prevalencia de la TB del área y el riesgo de reexposición. Se asume que el tratamiento de la ITL puede conferir protección de por vida contra la enfermedad y, así, entre los esquimales de Alaska, por ejemplo, se ha demostrado el efecto protector de la isoniacida (INH), que persiste durante más de 20 años94,95.
El tratamiento de la infección latente solo se iniciará una vez que la TB activa haya sido excluida.
Los regímenes para el tratamiento de la ITL incluyen INH durante 9 meses, rifampicina en monoterapia (RIF) durante 4meses o INH con RIF durante 3meses96.
Isoniacida durante 9 mesesLa dosis utilizada es de 5mg/kg/día de INH con un máximo de 300mg al día en adultos. En niños por debajo de los 16 años, la dosis utilizada debe ser de 10mg/kg/día. La eficacia de INH para la reducción de la incidencia de TB activa (en comparación con el placebo) es del 60 al 90%. Sin embargo, debido a que no todos los pacientes completan el curso del tratamiento, la eficacia del tratamiento es solo alrededor del 60% de media94.
El único estudio que compara la eficacia de diferentes duraciones del tratamiento con INH demostró en la pauta de 6meses una eficacia del 65%, mientras que en la pauta de 12 meses de tratamiento fue del 75% (sin llegar a la significación estadística con la primera). Por extrapolación de los datos de los ensayos aleatorizados, la duración óptima del tratamiento con INH para la ITL se ha determinado que es de 9meses, ya que en este mismo estudio se vió en la curva de eficacia un valor similar a partir de los 9 meses94,97.
El efecto secundario más importante de la INH es la hepatitis, con una incidencia del 8%, la mayoría de los casos asintomáticos y con leves incrementos en las enzimas del hígado, que no suelen superar 10 veces el valor normal o inicial98,99. El factor de riesgo más importante para el desarrollo de hepatitis inducida por INH es el consumo de alcohol. Los pacientes deben ser advertidos de abstenerse de consumir alcohol mientras estén tomando INH. La neuropatía periférica se presenta hasta en un 2% de los pacientes que toman INH100. Está causada por la interferencia en el metabolismo de la piridoxina y se puede prevenir con el suplemento de piridoxina (25 a 50mg al día). Esto es especialmente importante para los pacientes con condiciones que pueden predisponer a la neuropatía (incluyendo la diabetes, uremia, alcoholismo, malnutrición o infección por el virus de la inmunodeficiencia), así como en el embarazo y en pacientes con historia previa de convulsiones. La piridoxina también se debe administrar a los bebés de madres lactantes que reciben INH. En nuestro país existen formulaciones de INH que ya incluyen la vitamina B6, por lo que este problema queda minimizado.
El régimen de tratamiento preferido para la mayoría de las personas con ITL es INH diaria durante 9meses, según lo recomendado por el Center of Disease Control (CDC)92,101. Un curso de 6meses de tratamiento con INH también proporciona una protección sustancial. En el contexto de dificultades con la adherencia, los clínicos pueden optar por concentrar los esfuerzos en garantizar 6meses de terapia. Sin embargo, los regímenes más cortos de 9meses no se recomiendan para los niños o para los pacientes con lesiones fibróticas en la radiografía de tórax ni en pacientes inmunodeprimidos. Para los pacientes con mala adherencia al tratamiento, la terapia de observación directa puede ser el enfoque óptimo, buscando pautas de administración de una vez a la semana o 2veces por semana.
Rifampicina durante 4 mesesLa dosis habitual es de 10mg/kg/día con un máximo de 600mg al día. La eficacia de RIF para la reducción de la incidencia de TB activa se estima que es similar a la de la INH102,103. Aunque los datos son limitados, la RIF parece ser bien tolerada, con una baja tasa de hepatotoxicidad102. Los inconvenientes para la adopción del uso rutinario de RIF para el tratamiento de la infección latente de TB incluyen la posibilidad de infradiagnosticar casos de TB activa que podrían resultar posteriormente en recaídas con cepas resistentes a la RIF. Aunque este extremo también podría suceder en los casos tratados con INH, sorprende que la incidencia haya sido muy baja104. También las interacciones con otros fármacos y el precio han sido factores de preocupación en el caso de RIF. Así, existen interacciones importantes y potencialmente prolongadas con otros fármacos, incluyendo la warfarina, anticonceptivos orales, algunos antihipertensivos, antiarrítmicos, antidepresivos y anticonvulsivos, metadona, y la clase de los inhibidores de proteasa de los medicamentos antirretrovirales105,106.
Isoniacida y rifampicina durante 3 mesesLos datos sobre el uso de la INH y RIF son limitados, pero algunos estudios han mostrado que es una pauta efectiva, adherente y bien tolerada107. Un metaanálisis de estudios pequeños indica que es igualmente eficaz y no más tóxico108 que la pauta de 9 meses con INH. En un estudio prospectivo aleatorizado en individuos infectados por el virus de la inmunodeficiencia humana, un régimen de 3meses de INH y RIF diaria brindó protección del 60%109.
Finalmente, la combinación de RIF con pirazinamida no debe ser utilizada para el tratamiento de la ILT, debido a la posibilidad de hepatotoxicidad grave96.
Tratamiento de la infección tuberculosa latente en cepas multifarmacorresistentesPara los pacientes expuestos que se supone que están infectados por micobacterias resistentes a múltiples fármacos, el tratamiento de la ITL debe ser individualizado, basado en el perfil de sensibilidad del caso índice110,111. Deben elegirse siempre 2fármacos a los que el organismo sea sensible, por ejemplo, una combinación de pirazinamida más etambutol o una fluoroquinolona con actividad antituberculosa (como levofloxacino)112. La duración del tratamiento no se ha definido, si bien de 6 a 12 meses parece lo más razonable. Los pacientes con ITL por cepas multifarmacorresistentes deben recibir tratamiento estrechamente monitorizado y ser controlados de cerca por el riesgo de hepatotoxicidad. En el caso de cepas multifarmacorresistentes extremas, con resistencia a múltiples fármacos, la profilaxis de los contactos puede ser muy dificultosa y no existen pautas ensayadas fuera de los fármacos de primera línea.
Monitorización del tratamiento de la infección tuberculosa latenteLos pacientes en tratamiento por ITL deben ser supervisados mensualmente respecto a datos clínicos o analíticos de hepatitis. Deben ser educados sobre los síntomas de la hepatitis e instruidos sobre cómo suspender el medicamento y consultar de forma rápida para reducir el riesgo de progresión a enfermedad grave113.
El tratamiento de la ITL se debe interrumpir en los pacientes sintomáticos con niveles de transaminasas séricas superiores a 3veces el límite superior de lo normal o en pacientes asintomáticos con niveles de transaminasas séricas de más de 5veces el límite superior de lo normal. No se debe reanudar dicho tratamiento bajo ningún concepto.
Un problema clásico es la continuación del tratamiento de la ITL después de haber iniciado un tratamiento completo por sospecha de TB activa, que finalmente no se confirma (cultivos o histología negativa). El tiempo de la terapia de combinación de la fase inicial administrada se puede aplicar a la duración total de tratamiento para la ILT. Las opciones posteriores incluyen la interrupción del tratamiento si RIF y pirazinamida se han dado por lo menos 2meses, continuando el tratamiento con RIF hasta un total de 4meses (con o sin INH), o continuar el tratamiento con INH hasta un total de 9meses114.
En el caso de las pautas con INH (9 o 6meses), el tratamiento puede reanudarse donde se dejó si se perdieron menos de 3meses. El tratamiento para la ITL se reiniciará desde el principio si pasan más de 3meses. Para el tratamiento de la ITL con pautas de 3o 4meses, el tratamiento puede reanudarse donde se dejó, si faltan menos de 2meses para finalizarlo.
Tratamiento de la infección tuberculosa latente en pacientes candidatos a terapias biológicasEl CDC recomienda el tratamiento de la ITL de todos los pacientes que estén planeando tomar un inhibidor de FNT que tienen una PT positiva (resultado de ≥5mm de induración) o una técnica IGRA positiva115,116 y en el caso de pacientes con PT o IGRA negativo, pero en los que hay evidencia de enfermedad tuberculosa pasada en la radiografía de tórax (por ejemplo, fibrosis regional con o sin adenopatías hiliares) o si hay constancia epidemiológica de la exposición previa a la TB (por ejemplo, después de haber tenido contacto estrecho con un caso de TB).
Los pacientes candidatos a recibir anti-FNT con indicación para el tratamiento de la ITL, en general, deben recibir terapia estándar, es decir, INH durante 9meses. La recomendación sobre cuál debe ser la duración de la terapia de la ITL antes de comenzar un anti-FNT no se ha establecido, pero la mayoría de los autores proponen que los pacientes deben recibir al menos un mes de tratamiento para ITL antes de comenzar la terapia anti-FNT, siempre que sea posible14,117.
El tratamiento de la ITL no protegerá contra la TB en el caso de una infección recientemente adquirida, excepto, quizás, durante el tiempo que se administra el tratamiento. Por lo tanto, los pacientes que toman anti-FNT deben evitar exposiciones a TB (por ejemplo, las exposiciones ocupacionales, tales como centros de salud con alta prevalencia de TB, refugios para desamparados, las prisiones, los viajes a las regiones de alta prevalencia de la TB). El tratamiento de la infección latente con INH tampoco protegerá frente a la reactivación de la infección por cepas resistentes a la INH118. No existen estudios que permitan recomendar las pautas combinadas de tratamiento de la ITL en estos pacientes, si bien la pauta de RIF más INH ha sido utilizada por grupos de expertos en una gran parte de los pacientes, sin haber detectado casos de TB activa después de su inicio.
Recomendaciones del documento de consensoEn la tabla 8 se resumen las recomendaciones del panel de expertos de las sociedades científicas participantes en este documento de consenso multidisciplinar. Su objetivo es orientar a los especialistas en Dermatología para evaluar el riego a desarrollar TB y prevenirla mediante el diagnóstico y tratamiento de la ITL.
Recomendaciones finales con grado de evidencia
| Todos los pacientes candidatos a terapias biológicas deben ser estudiados para detectar el diagnóstico de ITL por constituir uno de los grupos de mayor riego en desarrollar enfermedad tuberculosa8,9 | AIII | |
| El riesgo a enfermar de estos pacientes parece ser dependiente también del fármaco anti-FNT utilizado: el infliximab y adalimumab son los de mayor riesgo detectado8,42 | AIIII | |
| Los métodos diagnósticos de la ITL se basan en75: | La búsqueda activa de antecedentes de TB en la historia clínica del paciente así como de contactos de TB activa | AIIII |
| La radiografía de tórax que detecte posibles lesiones antiguas de TB. En caso de duda, se aconseja completar estudio con TAC torácica, dado que es superior a la radiografía de tórax en la detección de signos radiológicos precoces de TB activa o de lesiones antiguas | ||
| La realización simultánea de IGRA y de la PT. Cualquier positividad de una de estas pruebas se considera indicativa de ITL | ||
| Los pacientes diagnosticados de EIMI tienen un mayor número de resultados falsos negativos con la PT y los IGRA71,72 | AIIII | |
| No hay evidencia de que la repetición de la PT (efecto booster) mejore la sensibilidad de la prueba en las EIMI y sí que reduzca su especificidad, por lo que en la actualidad, con la utilización de los IGRA, no se recomienda su realización67 | CIII | |
| La realización de los IGRA debe hacerse antes de la PT, por el efecto booster detectado sobre los IGRA87,88 | AIIII | |
| La especificidad y sensibilidad de las 2 técnicas de IGRA para el diagnóstico de ITL es similar en los pacientes con EIMI; al ser la sensibilidad del T-SPOT.TB algo mayor en pacientes tratados con corticoides, su utilización debería ser considerada en dichos pacientes73,74 | BIII | |
| Los resultados indeterminados siempre deben confirmarse con una segunda determinación que, en la mayoría de los casos, suele ser negativa71,72 | AIIII | |
| La negatividad de la PT y de los IGRA no descarta la ITL66,66,70,82. | AIIII | |
| Se aconseja tratamiento preventivo en todos los pacientes candidatos a terapias que presenten alguna de las pruebas diagnósticas sospechosas de ITL, después de excluir TB activa92,93,96,115,116 | AIII | |
| La monitorización del tratamiento debe hacerse mensualmente. En caso de hepatoxicidad a INH, se recomienda pauta de RIF 4 meses113 | AIIII | |
| Un período de 4 semanas de tratamiento de la ITL se considera seguro (por la mayoría de los expertos) para iniciar el tratamiento anti-FNT61 | AIIII | |
| El estudio y cribado de la ITL, después del inicio del tratamiento anti-FNT y durante su mantenimiento, como estrategia de diagnóstico de falsos negativos iniciales no se halla apoyado por la evidencia existente hasta la actualidad. Solo se aconseja repetir estudio de cribado si hay cambios en la sintomatología clínica o potencial exposición al Mycobacterium tuberculosis por viajes en zonas de alta endemia88-91 | AIIII | |
| Si el paciente se diagnostica de enfermedad tuberculosa activa, debe suspenderse el tratamiento anti-FNT; se aconseja posponer su reinicio hasta que todo el ciclo de tratamiento antituberculoso se haya completado. No hay evidencia de que la duración del tratamiento de la enfermedad por TB deba ser modificado en este contexto61 | AIIII | |
| Los pacientes que han completado de forma correcta el tratamiento de su enfermedad tuberculosa no parecen tener mayor riesgo de recaídas cuando se inicia el tratamiento anti-FNT94,95 | AIIII | |
EIMI: enfermedades inflamatorias mediadas inmunológicamente; FNT: factor de necrosis tumoral α; IGRA: prueba basada en la liberación de interferón; INH: isoniazida; ITL: infección tuberculosa latente; PT: prueba tuberculínica; RIF: rifampicina; TB: tuberculosis.
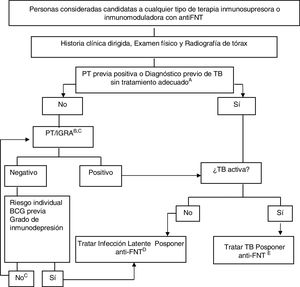
En la figura 4 se muestra el algoritmo propuesto para la evaluación de la infección tuberculosa en pacientes candidatos a terapias biológicas119,120.
Algoritmo provisional para la evaluación de la infección tuberculosa en pacientes candidatos a tratamientos con anti-FNT.
a El tratamiento adecuado para TB se define como ≥6 meses de tratamiento con fármacos de primera línea, incluidos ≥2 meses de la asociación rifampicina+isoniacida+pirazinamida+etambutol. El tratamiento adecuado para la infección latente puede haberse hecho con ≥6 meses de isoniacida, 3 meses de isoniacida+rifampicina o 4 meses de rifampicina sola.
b El riesgo de infección latente se deduce de ponderar factores como la exposición conocida a un caso contagioso, la edad, el país de origen y la historia laboral y social, incluidos los viajes a países endémicos y la exposición reiterada a colectivos de riesgo (instituciones cerradas, personas sin techo, usuarios de drogas).
c En personas infectadas muchos años antes, la PT puede ser negativa y positivizarse por una segunda PT (fenómeno booster). Con la disponibilidad de los IGRA, parece más práctico utilizarlos como prueba complementaria en lugar de realizar una segunda PT, tanto en personas de más de 60 años como en inmunosuprimidos por diferentes causas, con independencia de la edad.
d No hay datos concluyentes para establecer un período seguro entre el inicio del tratamiento de la infección latente y el del anti-FNT. Cuatro semanas de retraso se considera una práctica habitual y segura por la mayoría de los expertos.
e Debe completarse en tratamiento de la TB activa antes de iniciar el tratamiento de la terapia biológica. Para la interpretación y ampliación de este algoritmo, ver texto.
Anti-FNT: anti-factor de necrosis tumoral α; BCG: bacilo de Calmette-Guerin; IGRA: Prueba basada en la liberación de interferón; PT: prueba tuberculínica; TB: tuberculosis.
Fuente: Adaptado de Winthrop120.
Esteban Daudén Tello declara ser miembro de los Advisory Boards, consultor, de ser receptor de becas, de recibir apoyo a la investigación, de participar en ensayos clínicos y de percibir honorarios por impartir ponencias, con las siguientes compañías farmacéuticas: Abbvie (Abbott), Amgen, Janssen-Cilag, Leo Pharma, MSD, Pfizer, Novartis, Celgene y Lilly.
Carlos Taxonara Samso declara ser consultor y conferenciante para MSD, AbbVie, Jannsen, Takeda y Pfizer.
Francisco Javier López Longo declara haber sido contratado como ponente y de forma puntual por Abbvie, Actelion, Bristol-Myers-Squibb, GSK, MSD, Pfizer, Roche Farma y UCB y de haber recibido financiación para investigación de Abbvie y GSK.
El resto de los autores declaran no tener ningún conflicto de intereses.
Documento de Consenso de la Academia Española de Dermatología y Venereología (AEDV), Sociedad Española de Neumología y Cirugía Torácica (SEPAR), Sociedad Española de Patología Digestiva (SEPD), Sociedad Española de Reumatología (SER) y Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC).