Se supone que todas las revistas científicas intentan mantener siempre unos niveles altos de calidad y que sus lectores, tanto clínicos como investigadores, confían en que la información publicada en ellas es precisa y cierta. También se asume que los estudios para publicar son enviados en su forma completa y que se tienen en cuenta aspectos como la duplicidad de publicación y la verdadera autoría de los artículos. Sin embargo, existe la certeza de que al menos en dermatología muchos ensayos clínicos publicados tienen una calidad variable y frecuentemente pobre1, 2. De hecho, muchos de esos estudios clínicos no incluyen ninguna descripción de características tan importantes como la distribución aleatoria de los grupos de tratamiento o las características del grupo control, que son elementos esenciales en cualquier ensayo clínico. Esta descripción inadecuada de los estudios clínicos puede ser debida en la mayoría de los casos a simple desidia o descuido, pero en cualquier caso representa una pérdida de tiempo para aquellos que buscan información válida derivada de los ensayos clínicos, ya que éstos son una de las mejores pruebas científicas disponibles para recomendar tratamientos e intervenciones sanitarias3. En otras ocasiones, la presencia de defectos o la ausencia de determinada información puede indicar un intento de mostrar que una particular intervención es mejor de lo que es en realidad. Esto ocurre, por ejemplo, cuando se da más importancia a ciertos aspectos del estudio con poca relevancia, cuando no se realiza el análisis final sobre la base de los datos originales o si no se declaran posibles conflictos de interés.
En definitiva, si los ensayos clínicos tienen una metodología inadecuada o, especialmente, si la descripción final del ensayo no contiene determinada información, los lectores no pueden juzgar adecuadamente la validez del estudio y la evidencia científica para recomendar sus resultados es muy reducida4. Además, la información no contenida en la publicación significa que aquellos que realicen revisiones sistemáticas sobre un tratamiento o intervención concreta se ven forzados a excluir el estudio por una información inadecuada. Habitualmente alrededor de un tercio de los ensayos clínicos dermatológicos son excluidos de las revisiones sistemáticas porque faltan datos relevantes5.
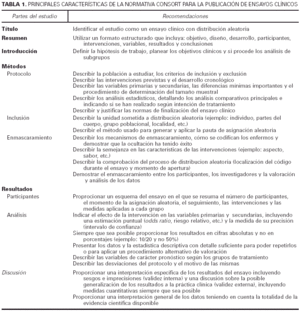
La declaración CONSORT (Consolidated Standards of Reporting Trials) es un enunciado de normas establecido en 1996 para la publicación de ensayos clínicos6, 7. Desde hace relativamente poco tiempo la mayoría de las publicaciones dermatológicas internacionales, entre las que se encuentran: Archives of Dermatology, British Journal of Dermatology, Clinical and Experimental Dermatology y Journal of the American Academy of Dermatology se han comprometido a seguir esta normativa explícita que recoge los aspectos básicos para mejorar la forma de describir los ensayos clínicos en las publicaciones, sin suponer ningún obstáculo para aquellos que realizan un buen trabajo científico. Los principales puntos de la normativa CONSORT se muestran en la tabla 1. Aunque la mayoría de estas especificaciones son familiares para los autores habituales de ensayos clínicos, su disposición ordenada y en forma de listado puede ser útil para evitar posibles omisiones de aspectos importantes, incluso en el caso de estudios bien realizados.
Se han identificado a nivel mundial cerca de 200 revistas especializadas de dermatología8 y por tanto existe un largo camino antes de que todas ellas cumplan unos estándares adecuados y completos para la descripción de los ensayos clínicos publicados. La declaración CONSORT solamente representa un modelo a seguir, pero también es importante que basándose en esta normativa, los consejos editoriales de las revistas realicen el seguimiento y soliciten las correcciones necesarias en los estudios clínicos que se remiten para publicar. En nuestro caso, si queremos que los ensayos clínicos publicados en Actas Dermo-Sifiliográficas puedan determinar también cambios significativos en la práctica clínica dermatológica es necesario que estos estudios se publiquen de forma completa, sistemática y con suficiente detalle.