INTRODUCCION
La cirugía micrográfica de Mohs ocupa en la actualidad un lugar relevante en el tratamiento del cáncer de piel, tanto en Estados Unidos como en Europa, donde se ha desarrollado mucho durante los últimos años. Es un método extremadamente eficaz que permite el control paso a paso a través de los cortes sucesivos del cien por cien de los márgenes del tumor, lo que hace de ella una técnica que obtiene los más elevados porcentajes de curación de todos los métodos de tratamiento, bien sea para epiteliomas basocelulares como para epiteliomas espinocelulares1. El potencial de la técnica se ha visto incrementado con considerable éxito en el tratamiento de otros tipos de tumores, como veremos en el apartado «Tumores cutáneos: modalidades de tratamiento». Además de la extirpación completa del tumor, este método tiene la extraordinaria ventaja adicional de no precisar márgenes de seguridad a ciegas. Debido a que la mayoría de los cánceres de piel ocurren en la cara, esta es una gran ventaja para el enfermo, ya que permite el ahorro de tejido sano y mejores posibilidades de reconstrucción posquirúrgicas.
Para practicar la cirugía de Mohs es necesario tener conocimientos de biología tumoral, de histopatología en cortes horizontales y dominar la técnica quirúrgica. Por estas razones, creemos que el dermatólogo se encuentra en una situación privilegiada para realizar correctamente esta técnica.
TUMORES CUTANEOS: MODALIDADES DE TRATAMIENTO
El cáncer de piel es el tumor más frecuente en seres humanos. En Estados Unidos en el año 2001, han diagnosticado más de 1,3 millones de nuevos casos2. Además, entre el 35 y el 50 % de los pacientes con un tumor de piel desarrollarán un segundo tumor primario en el plazo de 5 años3. En una visión global, los tumores cutáneos representan un grupo muy heterogéneo de neoplasias tanto clínica como histológicamente y, por supuesto, en cuanto a su pronóstico. Ante un enfermo con cáncer de piel la finalidad terapéutica es eliminar el tumor respetando al máximo la piel sana y conservando la funcionalidad y la estética. El tratamiento debe ser individualizado, de acuerdo con factores derivados del tipo de tumor, del paciente y del médico.
Factores derivados del propio tumor. El tipo de tumor, la definición de los márgenes, su patrón de crecimiento, si es primario o recurrente, la aparición o no sobre lesión previa (por radioterapia o inflamación crónica), el tamaño del tumor, la localización anatómica, el tipo histológico, el grado de diferenciación, la profundidad de invasión y la existencia o no de afectación vascular o perineural. El perfil obtenido con estos datos, permite clasificarlos como de alto grado o bajo grado (tabla 1). Los tumores de alto grado tendrán más probabilidades de recidivas y metástasis que los de bajo grado y requerirán por tanto tratamientos más agresivos.
Factores derivados del enfermo. Son la expectativa de vida del enfermo, enfermedades-condicionantes de vida, inmunosupresión y consideraciones estéticas.
Factores derivados del tratamiento. Son el porcentaje de curaciones con cada tratamiento, habilidad y entrenamiento del cirujano en esa técnica, preservación de la funcionalidad, morbilidad de la técnica, coste y consideraciones estéticas.
No hay trabajos prospectivos aleatorizados que hayan comparado las distintas técnicas de tratamiento de los cánceres de piel. La comparación de los resultados de la literatura médica es por tanto difícil, debido a la falta de homogeneidad de las series, unas veces prospectivas y otras retrospectivas, a veces limitadas a una sola zona topográfica, mientras que otras no analizan los resultados con respecto al tamaño, localización o histología del tumor. Algunos estudios limitan a 3 años el seguimiento, otros lo hacen a 5 años y los menos a 10 años. Estos últimos estudios suelen ser los que presentan mayores índices de recidivas, como es lógico. En una revisión1 del porcentaje de recidivas en epiteliomas basocelulares primarios tratados con distintas técnicas, dos tercios de las recurrencias ocurrieron en los 3 años siguientes al tratamiento, y el 18 % ocurrió entre el quinto y el décimo año.
En general, los tumores de bajo grado pueden ser tratados con técnicas como la cirugía convencional, crioterapia, radioterapia o curetaje y electrocoagulación. Los de alto grado son tratados con cirugía convencional, radioterapia experta o cirugía de Mohs. Un estudio4 en el que se repasa la bibliografía publicada entre 1970 y 1997 acerca del tratamiento de los epiteliomas basocelulares con las distintas técnicas terapéuticas, encuentra que, de las casi 300 series localizadas, sólo 18 de ellas eran amplias, prospectivas y con un seguimiento de más de 5 años. Algo similar ocurre en la revisión del tratamiento de epiteliomas basocelulares de la Cochrane5. El autor de una de las series6, referida al curetaje y la electrocirugía, comenta en un artículo posterior que cuando la técnica era realizada por un residente el porcentaje de recidivas era del 18,8 %. Tras una enseñanza más a fondo y la supervisión de los casos, el porcentaje disminuyó al 9,6 %. Las estadísticas del autor en su consulta privada eran del 5,7 %. Estos datos ponen de manifiesto que tan importante es la técnica que se utilice como quien la realice. Todas estas variables podrían explicar las diferencias existentes en el porcentaje de recidivas en las distintas series de tratamiento con una determinada técnica.
Los tratamientos de los tumores cutáneos se dividen en técnicas quirúrgicas y no quirúrgicas.
Técnicas quirúrgicas
Se dividen en destructivas y escisionales.
Técnicas quirúrgicas destructivas
Curetaje y electrocoagulación. Es una técnica cómoda, barata y suele obtener buenos resultados funcionales y estéticos. Sus inconvenientes son que no puede realizarse estudio histopatológico de los bordes y los propios del cierre por segunda intención. Con una buena indicación y en manos expertas consigue un porcentaje de curaciones de hasta el 97 % en epiteliomas basocelulares primarios de bajo riesgo7. Este porcentaje disminuye mucho si el epitelioma es recurrente o de alto riesgo. En una revisión de la literatura médica desde el año 1947 resulta que el tratamiento de epiteliomas basocelulares primarios con esta técnica tiene un porcentaje de curación a 5 años del 92,3 %1. Una revisión similar en epiteliomas basocelulares recidivantes muestra un porcentaje de curaciones a 5 años del 60 %8.
Crioterapia. Presenta las mismas ventajas e inconvenientes que el curetaje y la electrocoagulación. La forma de utilización es muy variable, utilizando técnicas abiertas o cerradas, de uno, dos o tres ciclos y empleando o no agujas termopares. Al igual que ocurre con el curetaje y la electrocoagulación, los resultados son difícilmente homogeneizables. En general, sus indicaciones son similares a las del curetaje y la electrocoagulación. Se obtienen muy buenos resultados si se realiza una buena indicación9,10. Sin embargo, sus resultados son inferiores en casos de recurrencias1. En un estudio francés11 se realizó un ciclo de crioterapia con criodos en 358 carcinomas basocelulares, y se observó una tasa de recidivas a los 5 años del 9 %. En un estudio sueco en el que realizan curetaje y crioterapia con dos ciclos en epiteliomas basocelulares y espinocelulares, encuentran una sola recidiva en 81 tumores al cabo de 5 años12. En una revisión reciente de tratamiento de epiteliomas basocelulares la incluye como una de las terapias de elección, junto con la cirugía escisional y la cirugía de Mohs, en los epiteliomas basocelulares13.
Láser. Hay pocos estudios amplios acerca del porcentaje de curación con esta técnica. Sus indicaciones son tumores de bajo riesgo. Presenta las mismas ventajas e inconvenientes que las técnicas antes descritas, si bien parece que el tiempo de cicatrización y el resultado estético es a veces superior.
Técnicas quirúrgicas escisionales
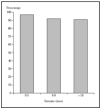
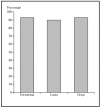
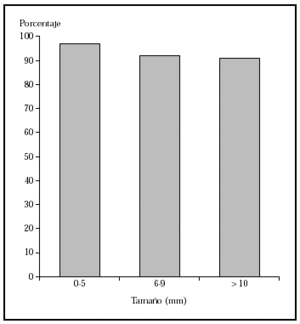
Cirugía escisional. Es una técnica quirúrgica muy efectiva, que permite el estudio histopatológico de la pieza extirpada. Sin embargo, el estudio histológico normal analiza menos del 2 % de la pieza. El margen clínico de la extirpación es variable, dependiendo de las características del tumor. Un estudio demuestra que en los epiteliomas basocelulares esclerosantes primarios con una resección de 3 mm de margen se curaría el 66 %, con 5 mm, el 82 %, y con 13-15 mm, más del 95 % de los casos14. En caso de epiteliomas menores de 20 mm y bien delimitados, un margen de 4-5 mm lograría la extirpación completa en más del 95 % de los casos15 (fig 1).
Fig. 1.--Porcentaje global de curación de epiteliomas basocelulares primarios con cirugía según el tamaño. Tomada de Rowe et al1.
Técnicas no quirúrgicas
Radioterapia. Es una terapia destructiva muy utilizada en el tratamiento, sobre todo del carcinoma basocelular. También se utiliza ampliamente como adyuvante de la intervención quirúrgica en determinados tumores sensibles a la radioterapia. Su principal inconveniente es la falta de control de los márgenes. Un estudio reciente que trata epiteliomas basocelulares y espinocelulares recidivantes con radioterapia encuentra un porcentaje de curación a los 5 años del 83 %16. Las revisiones clásicas ofrecen unos porcentajes de curación a los 5 años del 91,3 %1 en los epiteliomas basocelulares primarios y del 90,2 % en los recurrentes8,17.
Otros tratamientos. Otras modalidades no quirúrgicas de tratamiento en epiteliomas de bajo riesgo son: imiquimod5,18, interferón intralesional19, retinoides sistémicos20 y terapia fotodinámica21-23.
CIRUGIA DE MOHS. ASPECTOS HISTORICOS
La técnica nació en 1932 cuando el cirujano norteamericano Frederic E. Mohs (fallecido el 2 de julio de 2002) era estudiante de segundo año de Medicina y trabajaba en el departamento de Zoología de la Universidad de Wisconsin bajo la dirección del genetista Michael Guyer. El Dr. Guyer inyectaba platino coloidal en tumores de ratas y verificaba que impedía el crecimiento tumoral. Frederic Mohs decidió inyectar diversos productos químicos y observar sus efectos al microscopio. Así fue cómo descubrió que la inyección de una solución de cloruro de cinc al 20 % producía una fijación del tejido, manteniendo intacta su arquitectura. Esta fijación in situ permitía el control histológico de la pieza. Más tarde se dio cuenta de que los cortes verticales no eran una buena solución y optó por realizar cortes horizontales que permitían observar todo el borde profundo al tiempo que elaboraba un mapa en el que registraba el lugar del que provenía cada una de las muestras y así poder reintervenir sólo las zonas afectadas de tumor. Así, lo esencial del método estaba descubierto: escisión en estadios con cortes horizontales, con elaboración de un mapa y control histológico. En ese momento se le denominó quimiocirugía, porque se pensaba que era más importante la fijación con la pasta de cloruro de cinc que el control microscópico. Fue complicado encontrar un vehículo adecuado para el cloruro de cinc, pero finalmente Mohs desarrolló una fórmula con estibonita y Sanguinaria canadiensis que permitía una difusión homogénea del cloruro de cinc. La fórmula final fue: estibonita, 40 g; Sanguinaria canadiensis, 10 g, y cloruro de cinc saturado, 34,5 ml24. En el año 1936 el cirujano inicia con esta técnica el tratamiento de tumores en pacientes25. La aplicación de la pasta era muy dolorosa y obligaba a respetar un mínimo de 24 h de intervalo entre cada estadio. La reconstrucción tras el último estadio debía esperar algunas semanas. En el año 1941, Mohs presenta los resultados, muy favorables, tras el tratamiento de 440 pacientes con el método de fijación con la pasta de cloruro de cinc26. Los porcentajes de curación con esta técnica a los 5 años eran del 96,6 % en los epiteliomas basocelulares y del 94,8 % en los espinocelulares27. Mohs observó que en el tratamiento de tumores localizados en los párpados no podía utilizar la pasta, por el riesgo de provocar úlceras corneales. En estos casos utilizaba la técnica en fresco sin el uso de la pasta fijadora28. En 1966, Tromovitch comenzó a usar la técnica en fresco que Mohs utilizaba para los tumores localizados en los párpados en tumores de otras localizaciones. Publicó sus resultados en 1974 demostrando un porcentaje de curaciones similar al obtenido con la pasta29. A partir de ese momento, el uso de la pasta se redujo drásticamente, ya que el método en fresco era más cómodo para el enfermo y ofrecía la ventaja de una reconstrucción inmediata del defecto. Este hecho fue de gran importancia, ya que hasta entonces la gran mayoría de los casos se dejaban cicatrizar por segunda intención y no siempre se conseguían buenos resultados estéticos. En 1983, Zitelli publica un artículo en el que se especifican claramente cuáles son las áreas anatómicas en las que puede esperarse un buen resultado estético tras la cicatrización por segunda intención30.
En 1966, Perry Robins crea el primer curso de especialización en cirugía de Mohs de un año de duración, funda la sociedad internacional de cirugía dermatológica y la revista Journal of Dermatologic Surgery and Oncology y realiza una incansable labor de promoción de la técnica en todo el mundo. En este momento el American College of Mohs Micrographic Surgery and Cutaneous Oncology tiene con 600 miembros. El Dr. Antonio Picoto aprendió la técnica con el Dr. Perry Robins en Nueva York y fue el pionero en Europa en el desarrollo y difusión de la técnica. El 6 de abril de 1990 fue fundada en Estoril la European Society of Micrographic Surgery que tiene en la actualidad 40 asociados. La mayor dificultad para la expansión de la técnica en Europa estriba en el hecho de que muchas compañías aseguradoras europeas no la contemplan dentro de sus baremos.
INDICACIONES DE LA CIRUGIA DE MOHS
Actualmente en Estados Unidos un 30 % de los tumores cutáneos no melanoma son referidos para tratamiento con cirugía de Mohs31,32. Si bien la técnica se utilizó en un principio para el tratamiento de epiteliomas basocelulares y espinocelulares, el número de indicaciones crece día a día. Además de las indicaciones que se repasan, es importante saber que el ahorro de tejido sano que se consigue con esta técnica es tan importante que en muchos casos de tumores no agresivos su indicación viene dada por esta cualidad de la cirugía de Mohs. El porcentaje de tejido sano que se puede ahorrar en comparación con la cirugía clásica es del 180 % en los tumores primarios y del 347 % en los recidivante33.
Tumores epiteliales
Epitelioma basocelular
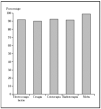
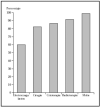
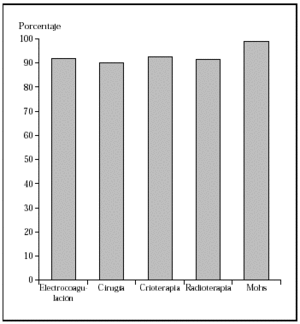
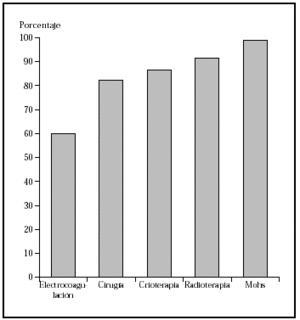
Los epiteliomas basocelulares pueden dividirse, desde el punto de vista oncológico, en alto y bajo grado (tabla 1)34. Los factores pronósticos que identifican a uno u otro tipo son: la localización17,35, el tamaño14,15,17,36, la definición o no de los márgenes14,36, el tipo histológico14,36,37, ser primario o recurrente14,36,37 y el estado inmunológico38. Los de bajo grado pueden tratarse mediante las técnicas ya mencionadas, con buenos porcentajes de curación. Sin embargo, los de alto grado deben ser tratados con la técnica que más probabilidades de curación tenga, como la cirugía de Mohs. En una revisión global de tratamiento de epiteliomas basocelulares con cirugía de Mohs desde el año 1947 se encontró un porcentaje de curaciones a 5 años del 99 %1 (fig. 2). En una serie similar desde 1945 de tratamiento de epiteliomas basocelulares recidivantes, el porcentaje de curaciones a 5 años fue del 94,4 %8 (fig 3).
Fig. 2.Porcentaje global de curación de epiteliomas basocelulares primarios con distintas técnicas quirúrgicas. Tomada de Rowe et al1.
Fig. 3.--Porcentaje global de curación de epiteliomas basocelulares recurrentes con distintas técnicas quirúrgicas. Tomada de Rowe et al8.
En un estudio de epiteliomas basocelulares tratados con cirugía de Mohs, sólo 78 de 434 enfermos tratados precisaron más de un estadio. Los que tenían invasión perineural (8/434) fueron los que precisaron más pases, con una media de 5,3 estadios39.
Las indicaciones de la cirugía de Mohs en epiteliomas basocelulares son:
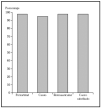
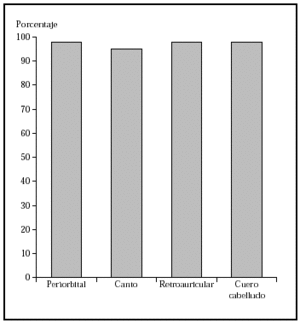
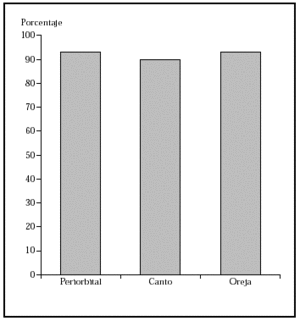
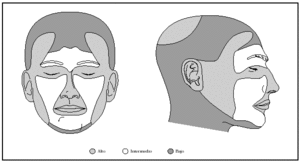
1. Por localización: en o alrededor de párpados, orejas, nariz, labios, pliegue nasolabial, frente, cuero cabelludo y zonas de fusión de pliegues embrionarios (figs. 4-6).
Fig. 4.--Porcentaje global de curación de epiteliomas basocelulares primarios en distintas localizaciones con la cirugía de Mohs. Tomada de Rowe et al1.
Fig. 5.--Porcentaje global de curación de epiteliomas basocelulares recurrentes en distintas localizaciones con la cirugía de Mohs. Tomada de Rowe et al1.
Fig. 6.--Riesgo relativo de recidivas y metástasis por lugar anatómico. Modificada de Martínez et al2.
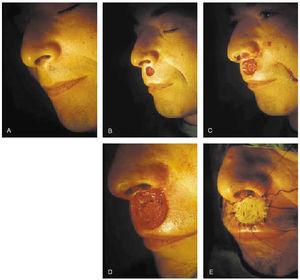
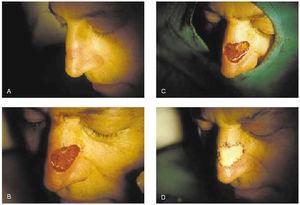
2. Subtipos histológicos: esclerosante, infiltrativo, micronodular (fig. 7).
Fig. 7.--Extirpación de epitelioma basocelular esclerosante de labio superior mediante cirugía de Mohs. Se precisaron tres pases para su completa extirpación. Cierre del defecto con injerto de piel total.
3. Recurrencias.
4. Tamaño: mayor de 2 cm.
5. Afectación perineural.
6. Márgenes mal definidos en zona de riesgo.
Epitelioma escamoso
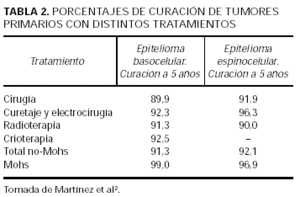
Los epiteliomas espinocelulares se dividen en de alto o bajo grado dependiendo de los factores que influyen en su capacidad metastásica y de recidiva. Estos factores son: la localización (además de las mismas localizaciones que en el basocelular hay que añadir los espinocelulares del periné, sacro, planta del pie y los que aparecen sobre lesiones crónicas), el diámetro mayor de 2 cm, la profundidad superior a 4 mm o los que se extienden por el tejido celular subcutáneo, los histológicamente mal definidos (grados 3 y 4 de Broders), los recidivantes y los que aparecen en pacientes inmunodeprimidos40-42. En los espinocelulares de alto riesgo, la cirugía de Mohs es la técnica que consigue mejores porcentajes de curación. Se obtienen con ella unos resultados de un 96,9 % de curación para los epiteliomas espinocelulares primarios frente al 92 % con las otras técnicas (tabla 2). En los recidivantes este porcentaje disminuye al 90-93 % con la cirugía de Mohs y al 76 % con las otras técnicas40. La presencia de metástasis microscópicas sin continuidad con el tumor primario en epiteliomas espinocelulares de alto riesgo puede explicar que el porcentaje de curaciones no sea tan elevado como lo es en los basocelulares. Por esta razón, en algunos casos de alto riesgo, se practica un pase adicional de cirugía de Mohs cuando la tumoración ya se ha extirpado43. Las técnicas complementarias como la biopsia del ganglio centinela pueden aportar información pronóstica adicional44,45.
Enfermedad de Bowen
El carcinoma espinocelular in situ puede responder bien a tratamientos poco agresivos. Sin embargo, debido a que la tumoración se puede extender por el folículo hasta el tejido celular subcutáneo y que en ocasiones afecta a zonas donde es importante respetar el tejido sano, es conveniente realizar cirugía de Mohs46.
Melanoma
Existe una gran controversia sobre si el lentigo maligno, el lentigo maligno melanoma y el melanoma deben ser tratados mediante la cirugía de Mohs. Algunos autores opinan que los melanocitos atípicos son difícilmente visibles en preparaciones en fresco teñidas con hematoxilina-eosina47,48; otros, en cambio, opinan lo contrario49. La técnica más aceptada es la cirugía de Mohs modificada en la que los cortes tangenciales son incluidos en parafina (v. «Variantes de la técnica»)50. Otros autores proponen la realización de cortes verticales con inclusión en parafina para el estudio del 100 % de los márgenes periféricos del lentigo maligno melanoma de la cara51.
Un estudio comparó la extirpación con cirugía convencional con márgenes y la extirpación con cortes periféricos en parafina (cirugía micrográfica modificada) en melanomas in situ e invasivos. Con cirugía convencional recidivan 8 de 28 casos y con la técnica de los cortes periféricos en parafina no hay recidivas en los 20 casos tratados52.
Se ha estimado que en el melanoma in situ los cortes en fresco tienen una sensibilidad y especificidad del 59 y 81 %53. Sin embargo, la utilización de técnicas inmunohistoquímicas parece mejorar estos porcentajes. Un estudio utilizó un marcador inmunohistoquímico (MART-1) para la identificación de células de melanoma en cirugía de Mohs en fresco y observó una correlación del 100 % al compararlo con los cortes en parafina54. Este marcador parece ser más sensible y específico que el HMB-4555,56 si bien algunos autores siguen utilizando este último57.
En las revisiones recientes se admite que la cirugía de Mohs obtiene unos resultados similares o mejores que la cirugía convencional para la extirpación de melanomas, siempre que sea realizada por cirujanos expertos. Se considera de especial utilidad en localizaciones en las que es importante el ahorro de tejido sano58,59.
Tumores anexiales
Carcinoma anexial microquístico
La tasa de recidivas con cirugía convencional es del 47 %60. La extirpación quirúrgica con márgenes de incluso 5 cm puede presentar recidivas61. Debido a que con frecuencia se localiza en la cara y a que tiene afinidad por los nervios, la cirugía de Mohs parece ser la mejor opción. En un estudio el tratamiento con radioterapia local recidivaron dos de dos; con cirugía, 16 de 27, y con cirugía de Mohs, uno de seis61. Friedman et al62 presentan 11 enfermos tratados con cirugía de Mohs sin recidivas tras 5 años de seguimiento. Snow et al63 presentan 13 casos tratados con cirugía de Mohs sin recidiva y recopilan los datos de la bibliografía encontrando 73 casos de esta tumoración que fueron tratados con cirugía de Mohs con sólo 4 recidivas.
Carcinoma adenoide quístico
El tratamiento con cirugía convencional tiene un porcentaje de recidivas del 64 %. Se han informado 2 casos tratados con cirugía de Mohs sin recidivas64, al igual que un caso de recurrencia tratado con Mohs sin recidiva a los 18 meses65.
Enfermedad de Paget extramamaria
La cirugía convencional tiene un porcentaje de recidivas de un 20-40 %66,67. Este elevado número de fracasos puede ser debido a los bordes imprecisos del tumor o a su carácter multicéntrico68. La extirpación con cirugía de Mohs muestra unos porcentajes de recidiva del 0 % en la serie inicial de Mohs69 y del 8 % en una serie más amplia67.
Carcinoma mucinoso ecrino
Este tumor suele localizarse habitualmente en la región periorbitaria. Con la cirugía convencional con márgenes de hasta 2 cm, el porcentaje de recidivas es del 28 %. En este tipo de tumor, la cirugía de Mohs obtiene un menor porcentaje de recidivas y permite el ahorro de tejido sano, tan necesario en la zona periorbitaria70.
Carcinoma sebáceo
Tumor de localización ocular o extraocular. Se caracteriza por ser multicéntrico y tener diseminación pagetoide. Si bien no existen grandes series que permitan comparar los tratamientos, parece aceptado que la cirugía de Mohs es el tratamiento de elección de este tipo de tumor71, con un porcentaje de curaciones del 88 %72. Debido a su carácter multicéntrico es recomendable realizar un nuevo pase de cirugía de Mohs una vez eliminado todo el tumor72.
Porocarcinoma
El porcentaje de recidivas locales es del 14 %, de metástasis regionales del 19 % y de metástasis a distancia del 13 %73. La extirpación con cirugía de Mohs logra unos porcentajes de curación que alcanzan el 100 %74.
Tumores dérmicos
Dermatofibrosarcoma protuberans
El dermatofibrosarcoma protuberans (DFSP) es un sarcoma con baja tendencia a las metástasis y alta propensión a las recidivas locales. El tratamiento clásico consiste en la extirpación con márgenes amplios entre 2 y 5 cm75. Revisando la literatura de las series que realizan extirpaciones amplias, el porcentaje de recidivas con esta técnica en más de 500 enfermos es de aproximadamente el 20 %, variando entre el 0-60 %76.
En un estudio multiinstitucional americano se practicó cirugía de Mohs en 58 pacientes afectados de DFSP, y sólo se observó una recidiva (2 % recurrencias). En este trabajo se estudian los márgenes necesarios para la extirpación completa del tumor y se determina que si se hubiera realizado cirugía convencional, tendrían afectación en los bordes en las siguientes proporciones: en las extirpaciones con 1 cm quedaría tumor en el 70 % de los casos; con 2 cm en el 40 %, con 3 cm en el 15,5 % y con 5 en el 5 % e, incluso, extirpaciones de 10 cm de margen no conseguirían extirpar en su totalidad algunos tumores77.
Con la cirugía de Mohs el porcentaje de recidivas en el tratamiento del DFSP es muy inferior al de la cirugía clásica, y en la actualidad constituye la técnica de elección para el tratamiento de este tipo de patología78. El porcentaje de recidivas con cirugía de Mohs varía poco entre las series. En la serie de Huether et al79 encuentran que 1 de 33 casos recidivan (3 %) con un seguimiento medio de 3,8 años. Picoto et al80, en un reciente artículo muestran su experiencia con cirugía convencional y cirugía de Mohs. Encuentran 2/13 recidivas con cirugía convencional y 1/7 en cirugía de Mohs. El porcentaje de recidivas es similar con ambas técnicas (15 %). En una revisión reciente de la literatura sobre dermatofibrosarcoma protuberans Robins et al80 encuentran un total de 221 pacientes tratados con cirugía de Mohs con una tasa de recurrencias global del 2,3 %. Presentan 20 casos correspondientes a la Universidad de Nueva York y Miami en un período de 13 años sin presentar recurrencias. Algunos autores realizan la técnica comenzando la extirpación con cirugía de Mohs en fresco y una vez extirpado el tumor hacen otro pase que se fija en parafina para estudio con monoclonales CD3481,82.
Fibroxantoma atípico
Huether et al79 presentan 29 casos de fibroxantoma atípico tratados con cirugía de Mohs. Seis de los casos eran recidivas de cirugía previa y ninguno presentó nueva recurrencia. De los 23 casos primarios, en dos (6,9 %) se produjo recidiva tras el tratamiento con un seguimiento medio de 3,3 años79. Davis et al83 en su serie de 44 enfermos, tratan 19 casos con cirugía de Mohs sin recidivas tras un seguimiento de 30 meses. De los 25 casos tratados con cirugía con márgenes entre 0,3 y 2,6 tiene el 12 % de recidivas tras 73 meses.
Leiomiosarcoma
Tumor que en su forma cutánea o superficial se puede clasificar según su origen en dérmico o subcutáneo. El pronóstico es dependiente de la localización dérmica o subcutánea84. El tratamiento habitual es la cirugía con amplios márgenes de seguridad. Si bien el porcentaje de recidivas locales tras el tratamiento es similar en ambos, rondando el 40-60 % de los casos, el porcentaje de metástasis es muy diferente. Los localizados a nivel dérmico rara vez metastatizan, mientras que los localizados a nivel subcutáneo lo hacen entre el 30 y el 60 % de los casos85. Huether et al presentan 7 casos de leiomiosarcomas tratados con cirugía de Mohs. Tres de los casos eran recidivas de cirugía previa y uno presentó nueva recurrencia tras el tratamiento. De los 4 casos primarios ninguno presentó recidiva tras el tratamiento con un seguimiento medio de 4,3 años. La tasa global de recidivas fue del 14 %79.
Histiocitoma fibroso maligno
En una amplia serie, Kearney et al86 informan de una tasa de recidivas tras cirugía convencional del 71 % en histiocitomas fibrosos malignos superficiales. Otra gran serie, en la que realizan extirpaciones amplias o amputaciones, encuentran un porcentaje de recidivas del 44 %87. Tras el tratamiento con cirugía de Mohs en 20 casos sólo refieren dos recidivas con un seguimiento de 3 años88. Huether et al79 presentan 7 casos de histiocitoma fibroso maligno tratados con cirugía de Mohs. Dos de los casos eran recidivas de cirugía previa y uno presentó nueva recurrencia tras el tratamiento. De los 5 casos primarios dos presentaron recidiva tras el tratamiento con un seguimiento medio de 3,8 años. La tasa global de recidivas fue del 43 %.
Angiosarcoma
El angiosarcoma de cabeza y cuero cabelludo es el más frecuente dentro del grupo de los cutáneos. La cirugía, incluso con amplios márgenes, tiene un porcentaje de fracasos muy elevado con una supervivencia libre de enfermedad a los 5 años del 24 %89. Existen pocos casos tratados con cirugía de Mohs, alguno con buenos resultados90 y otro con metástasis linfáticas91. La radioterapia tras la cirugía mejora el control local de la enfermedad89.
Carcinoma de células de Merkel
La extirpación con margen de 0,5 cm asegura la recidiva en el cien por cien de los 38 casos estudiados92. Si la extirpación quirúrgica se realiza con 2,5 cm de margen el porcentaje de recidiva disminuye al 49 % de 41 casos93. Si se realiza extirpación con márgenes entre 0,5 y 2,5 cm y radioterapia posterior, el porcentaje de recidiva es del 39 %92. Con la cirugía de Mohs el porcentaje de recidiva es del 16 % de 25 casos y si se añade radioterapia poscirugía es del 0 % de 20 enfermos, si bien esta diferencia no parece significativa al igual que la supervivencia entre los dos grupos94.
Evitar la recidiva local parece que aumenta la supervivencia. Así, entre 35 enfermos controlados durante 2 años, la supervivencia fue del 86 % entre los que no tuvieron recidivas y del 36 % entre los que sí las tuvieron95. Debido a que se observan ganglios en la presentación en el 20 % de los casos y aparecen a lo largo de la enfermedad en un 50 % de los casos parece tener sentido la realización de la biopsia del ganglio centinela96. En un estudio de 33 enfermos, a 11 se les realizó linfadenectomía profiláctica, con una supervivencia a los 2 años del 100 %. La supervivencia de los 22 enfermos a los que no se les realizó fue del 35 %97. Dos estudios valoran la utilidad de la biopsia del ganglio centinela98,99. De los 30 enfermos tratados, 26 tienen el ganglio centinela negativo y ninguno de ellos presentó recidivas tras 10 meses de seguimiento. De los 4 casos positivos, dos de ellos tenían afectación de otros ganglios.
Con las limitaciones de los datos de la literatura médica creemos que el tratamiento debe ser biopsia de ganglio centinela y cirugía con márgenes de 2,5 cm o cirugía de Mohs seguida de radioterapia.
La utilización de la cirugía de Mohs tiene gran importancia en el tumor de Merkel debido a que más de la mitad de los casos se localizan en la cabeza y en esta localización es importante el ahorro de tejido sano.
Otras posibles indicaciones100
Otras posibles indicaciones de este tipo de cirugía pueden ser el adenocarcinoma apocrino101, el tumor de células granulosas102, el espiroadenocarcinoma103, la adenomatosis erosiva del pezón104 y la fibromatosis digital infantil105.
TÉCNICA DE LA CIRUGIA MICROGRAFICA DE MOHS
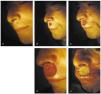
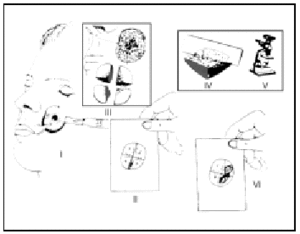
La técnica de la cirugía de Mohs consiste en realizar de forma sistemática y ordenada una secuencia que en conjunto se denominan «pase» o «estadio». Al final de cada pase podremos saber si el tumor ha sido completamente extirpado o si, por el contrario, hay persistencia tumoral, en cuyo caso será necesario realizar un nuevo pase y así sucesivamente hasta completar la extirpación del tumor. La secuencia es la siguiente (fig. 8):
Fig. 8.--Esquema de la técnica: I, extirpación del tumor; II, mapa de la pieza; III, corte en secciones y tinción de los bordes no cutáneos; IV, cortes en el criostato; V, estudio al microscopio, y VI, esquema final con afectación en los cuadrantes 2 y 3. Reintervención de esa zona tumoral (segundo pase).
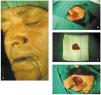
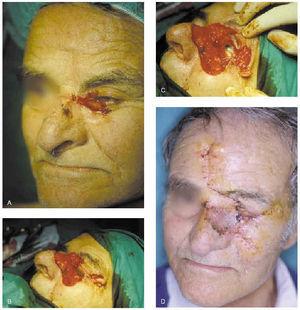
1. Curetaje de la lesión y escisión tangencial de los bordes en forma de plato con poco espesor y que este sea homogéneo (fig. 9).
Fig. 9.--A: epitelioma basocelular recidivante extirpado mediante cirugía de Mohs. B: curetaje del tumor y primer pase de cirugía de Mohs. C: y D: detalle del segundo pase y resultado final.
2. Mapeo de la pieza quirúrgica:
a) Para ello debe dibujarse la pieza extirpada a tamaño real sobre una figura que represente la zona en la que se localiza el tumor. Se utilizan fotocopias de diseños anatómicos en las que debe constar la identificación del enfermo, la fecha y el número del estadio o pase. Sobre el dibujo de la pieza tumoral se pintan las secciones que se van a cortar posteriormente.
b) La muestra, tras realizar marcas orientadoras en el quirófano, se divide en secciones de aproximadamente 1 cm de lado.
c) Cada sección es marcada con colorante negro y verde en los bordes no cutáneos. Cada sección se coloca en la placa de Petri o sobre un papel de filtro humedecido en el que consta un número de localización que coincide con el numero del mapa de la figura.
d) En el mapa se le asigna al colorante negro (tinta china) un punteado y al colorante verde un trazo continuo.
e) En cada pase se realiza un nuevo mapa.
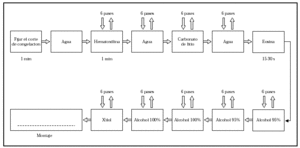
3. Corte de la pieza. El criostato se prepara a una temperatura entre 25 y 30 °C con cortes de 6 m de espesor. Cada una de las secciones es invertida de forma que el fondo de la pieza quede en la parte de arriba. El tejido es colocado sobre OCT y presionado ligeramente con el extractor de calor, para obtener una superficie lisa y uniforme. Al cortar cada una de las secciones debe intentarse que los primeros cortes sean útiles ya que, si se profundiza mucho, se obtienen falsos positivos.
Problemas que pueden surgir y posibles soluciones106:
Si el tejido se pega a la hoja ésta deberá ser enfriada.
Cuando el tejido se enrolla, el tejido debe ser enfriado.
Cuando el tejido se fragmenta, está excesivamente frío.
Si el tejido se congela muy despacio, los cristales de hielo pueden dejar agujeros.
Si el extractor de calor se pega al tejido, al aplanarlo, lubricarlo con aceite.
Si el tejido tiene un agujero, cortar a 10 m.
Es conveniente elevar el borde cutáneo antes de presionar con el extractor de calor.
4. Tinción de las secciones con hematoxilina-eosina y/o azul de toluidina y estudio al microscopio (figs. 10 y 11).
Fig. 10.--Técnica de hematoxilina-eosina rápida.
Fig. 11.--Técnica de azul de toluidina.
5. Extirpación en un nuevo pase de la lesión residual hasta encontrar un plano libre de tumor tanto lateralmente como en profundidad (fig. 12).
Fig. 12.--Técnica de la cirugía de Mohs. A: mapa de localización y primer pase de la extirpación. B: corte en secciones de la pieza y tinción de los bordes. C: congelación de cada una de las secciones. D: cortes en el criostato de cada sección. Se estudian en el microscopio. E: resultado con fondo y bordes afectados. Se pinta en rojo la zona del mapa con persistencia tumoral. F: segundo pase de cirugía de Mohs. Nuevo mapa de localización. G: resultado con bordes libres. Se pinta en el mapa con color azul. Reconstrucción del defecto creado. Fin de la intervención.
Cualquier error en el método puede provocar un fallo de la técnica. Los errores más frecuentes que desembocan en la aparición de falsos positivos o falsos negativos son107:
a) Errores en el corte tangencial de la pieza tumoral:
Lograr un corte homogéneo en determinadas áreas geográficas, como los pliegues de fusión, o en zonas donde una parte del corte contiene cartílago y otra parte grasa, puede ser dificultosa.
El grosor del corte debe ser homogéneo ya que, si es demasiado grueso, no se congela bien y, si es demasiado fino, puede fragmentarse.
En tumores recidivantes o los incompletamente extirpados, debe retirarse primero la cicatriz y realizar la cirugía de Mohs sobre tejido no artefactado, ya que podría ocurrir que la tumoración persistiera por debajo de esta zona.
b) Errores en el mapeo:
El éxito de la técnica depende de un mapeo meticuloso108. Es de especial importancia la fragmentación, el pintado y la numeración de cada una de las secciones, ya que un error llevaría a reintervenir zonas libres de tumor y viceversa109.
c) Errores en el corte en el criostato:
Para la validación de la pieza, debe ser observado el 100 % de los bordes. En caso de que esto no ocurra se debe profundizar hasta lograr la visión de esa zona oscura, obviando el resto de la pieza que ya se ha valorado.
Un problema común en el corte es la dificultad de cortar el tejido adiposo. Afortunadamente, cuando un epitelioma basocelular infiltra la grasa, induce su propia estroma de forma que es fácilmente observable.
d) Errores en la lectura de los cristales:
Las dudas que puedan surgir debido a la presencia de gran infiltrado inflamatorio, presencia de anejos dudosos, infiltración perineural, etc., pueden ser resueltos en su gran mayoría realizando tinciones inmunohistoquímicas o un nuevo pase de cirugía de Mohs.
El diagnóstico de tumores poco habituales o difíciles de interpretar, como el carcinoma de células de Merkel, tumores anexiales, sarcomas de tejidos blandos, etc., puede requerir las habilidades de un patólogo experto.
El porcentaje de complicaciones quirúrgicas en la cirugía de Mohs, en la serie de Cook, es del 1,64 % (22/1.343) y en su mayoría son problemas de hemostasia110. Los inconvenientes de la técnica pueden resumirse en el coste de tiempo, la necesidad de personal entrenado (en cirugía y patología), las necesidades de material y de espacio físico. Las limitaciones de la técnica son: tumores no valorables en examen en fresco; tumores con un patrón de crecimiento discontinuo, y tumores con invasión ósea o en otras cavidades.
CIERRE DEL DEFECTO QUIRURGICO
Tras la extirpación del tumor debe plantearse el cierre del defecto quirúrgico. Las posibilidades son cuatro: cierre por segunda intención, cierre directo, injertos y colgajos111,112. El cierre por segunda intención o granulación consiste en dejar que la herida cierre por sí sola. En determinados casos se obtienen buenos resultados, tanto funcionales como estéticos. Es muy útil en pequeños defectos superficiales que asientan sobre plano óseo y áreas cóncavas, como el canto interno del ojo o el surco nasogeniano, o en las cirugías tumorales con altas posibilidades de recidiva o en heridas infectadas. Tiene la desventaja del largo tiempo de curación, la tendencia a producir retracciones y que el resultado estético es impredecible.
El cierre directo es a menudo la más fácil y la mejor de las opciones. Permite una pronta reconstrucción, deja una cicatriz mínima y la curación es rápida. Se debe realizar si existe poca tensión entre los bordes de la herida y cuando el defecto no es excesivamente largo. Se debe tratar de enmascarar la cicatriz en las líneas de tensión de la piel relajada.
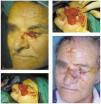
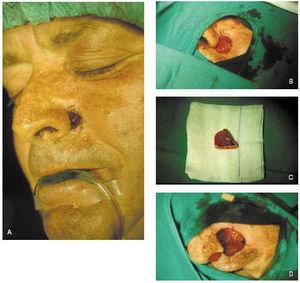
El cierre con injerto de piel consiste en la colocación de piel que se ha extraído de la zona donante y es llevada a la zona receptora sin conexión vascular entre ambas. Según su grosor pueden ser de piel total o parcial. Las indicaciones del cierre con injerto son el cierre de grandes áreas o cuando tenemos la necesidad de controlar las posibles recidivas de un tumor agresivo. El cierre con injerto del defecto cutáneo tras la cirugía de Mohs puede retrasarse 12 o 14 días con mejores resultados que el cierre inmediato113 (fig. 13).
Fig. 13.--A: epitelioma basocelular esclerosante en nariz. B: primer pase. Bordes afectados. C: segundo pase. Bordes libres. D: cierre del defecto mediante injerto de piel total.
El cierre con un colgajo cutáneo consiste en llevar piel de la zona donante a la receptora, manteniendo su propio aporte sanguíneo. Sus indicaciones son el cierre de los defectos que no se solucionan con cierre directo, los defectos de espesor total y aquellos que de otra manera dejarían unos déficit funcional o estético inaceptables. En las heridas sobre hueso o cartílago sin periostio o pericondrio, al tener un soporte vascular deficiente, no debe colocarse un injerto, sino que deben ser reconstruidas mediante un colgajo (fig. 14).
Fig. 14.--A: epitelioma basocelular esclerosante afectando el canto interno del ojo. B y C: se precisaron cuatro pases de cirugía de Mohs. En los dos últimos pases la afectación se localizó a nivel de la grasa periférica del recto interno. D: reconstrucción mediante colgajos de avancerotación de mejilla, transposición glabelar bilobulado e injerto en la zona nasal. Buen resultado funcional del párpado.
Un estudio de 994 epiteliomas basocelulares recidivantes demuestra que el tipo de cierre quirúrgico influye de manera significativa en el tiempo que transcurre hasta la recidiva. El cien por cien de las recidivas que se produjeron sobre un injerto laminar de piel ocurrieron en los 2 años siguientes a la cirugía inicial. En los casos en los que se realizó cierre directo esto ocurrió en el 87 %, mientras que si el cierre se realizó con un colgajo, sólo el 26 % de las recidivas aparecieron en los primeros 2 años. Así, los basocelulares recurrentes que se resolvieron con colgajos son más difíciles de tratar. Los autores recomiendan tratar los tumores agresivos mediante injertos laminares y después de 2 años de evolución puede realizarse una cirugía reconstructiva114.
VARIANTES DE LA TÉCNICA
Desde sus orígenes, la técnica de la cirugía de Mohs ha sufrido modificaciones. El cambio de usar la pasta fijadora a la técnica en fresco supuso una revolución. Desde entonces, han aparecido modificaciones que han sido más o menos criticadas e, incluso, algunos autores consideran que muchas de estas variantes no deben ser denominadas cirugía de Mohs.
Mohs fijado en parafina: «slow-Mohs»
La técnica del corte, el mapeo y el fraccionamiento es similar al Mohs en fresco. Sin embargo, la pieza se fija en formol y se procesa en parafina. La lectura de las laminillas histológicas y la reintervención son diferidas en el tiempo. Esta técnica es muy utilizada en Inglaterra y Alemania, ya que puede realizarse con la estructura habitual presente en un hospital115. Su principal ventaja es que la calidad de los cortes en parafina es superior a la de los cortes en fresco, y su desventaja, el tiempo de realización, de varios días, con todos los inconvenientes que esto representa. El coste de realizar las secciones histológicas para una cirugía de Mohs en fresco es cuatro veces superior a realizar las secciones en parafina116.
En ocasiones, esta técnica se utiliza combinada con el Mohs en fresco. Se realiza la extirpación de la tumoración en fresco y una vez libre de tumor se realiza un nuevo pase que se fija en formol117.
Técnica de Breuninger
Esta técnica fue descrita por Helmut Breuninger en 1984118. Breuninger la utilizó inicialmente para el tratamiento de epiteliomas basocelulares y posteriormente en espinocelulares, dermatofibrosarcoma protuberans, Bowen, lentigo maligno y otros tumores cutáneos. La técnica consiste en la extirpación en bloque de la tumoración con 2-5 mm de margen clínico y con un ángulo de 90° respecto a la superficie, y consiguiendo un fondo uniforme. La pieza se fija en formol. Posteriormente, se realiza un afeitado muy fino del fondo y un corte en todo el borde periférico de la pieza extirpada. Tanto el fondo como la periferia se estudian al microscopio y en caso de persistencia tumoral se reinterviene119. En un estudio con un seguimiento de 6 años el porcentaje de recidivas en epiteliomas basocelulares primarios fue del 0,5 %, para recidivantes fue del 5,6 % y en epiteliomas espinocelulares primarios del 4,8 %, mientras que en los recidivantes fue del 37 %. En el dermatofibrosarcoma protuberans el porcentaje de recidivas fue del 0 % con 41 casos tratados. En lentigos malignos fue del 0,8 % y lentigo maligno melanoma del 1,1 %120.
PITE
Abreviatura de Peripheral In-continuity Tissue Examination fue descrita por el cirujano plástico americano Hagerty y consiste en el estudio periférico de los márgenes y el fondo de la pieza tumoral similar a la técnica de Breuninger pero, en lugar de fijarlos en parafina, se realiza en fresco. El autor presenta una corta serie de epiteliomas basocelulares y no indica seguimiento121.
Una variante de esta técnica es la utilizada por Anderson51 para el tratamiento de lentigo maligno. Este autor utiliza un bisturí de doble hoja separada 2-4 mm con el cual extirpa la periferia de la lesión sin tocar el tumor. Tras procesar toda la periferia en parafina y reintervenir en las zonas residuales, procede a extirpar la masa tumoral y reconstruir el defecto.
INNOVACIONES
Inmunohistoquímica
La utilización de las técnicas inmunohistoquímicas en cirugía de Mohs no es novedosa. Con la perspectiva del paso del tiempo, estas técnicas laboriosas han demostrado que tienen una utilidad menos amplia de la que en un principio se creía. Su utilidad son aquellos casos seleccionados en los que puedan existir células tumorales en el seno de una gran inflamación, casos en los que exista infiltración perineural, casos de diseminación pagetoide de carcinomas y melanomas y para ayudar a identificar márgenes dudosos en el dermatofibrosarcoma protuberans82.
Un reciente estudio, en el que se efectúa una tinción inmunohistoquímica con citoqueratinas en la última preparación de la extirpación de epiteliomas basocelulares, encontró que en el 2 % de los enfermos que son negativos en las preparaciones de hematoxilina-eosina en fresco son positivos en las tinciones con las citoqueratinas122.
Los anticuerpos más utilizados son82:
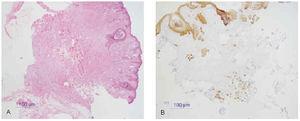
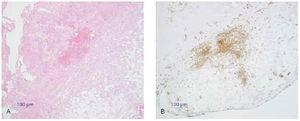
1. Carcinoma basocelular: Ber-EP4, citoqueratinas (fig. 15).
Fig. 15.--A: epitelioma basocelular (tinción con hematoxilina-eosina). B: inmunohistoquímica con citoqueratinas AE1-AE3.
2. Carcinoma espinocelular: citoqueratinas.
3. Paget extramamario: antígeno carcinoembrionario (CEA), citoqueratinas.
4. Dermatofibrosarcoma protuberans: CD34 (fig. 16).
Fig. 16.--A: dermatofibrosarcoma protuberans (tinción con hematoxilina-eosina). B: inmunohistoquímica con CD34.
5. Melanoma: S-100, HMB-45, MART-1.
Microscopia confocal
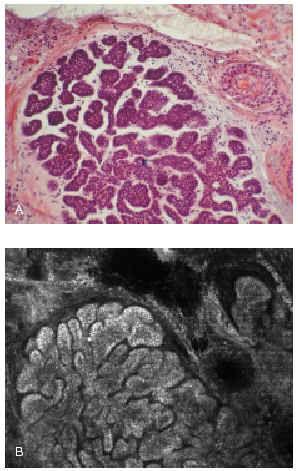
El microscopio confocal es un método óptico no invasivo que permite observar la morfología celular en secciones de 0,5-1 μ llegando hasta la dermis papilar en la piel humana. Este sistema óptico puede diferenciar las células del epitelioma basocelular de las normales. Si bien en alguna publicación se ha demostrado la utilidad de este microscopio para sustituir al estudio histopatológico de la pieza tumoral, el propio autor reconoce que existen dificultades técnicas para aplicar el microscopio al lecho tumoral y poder observar la localización de las células tumorales residuales123 (fig. 17).
Fig. 17.--A: epitelioma basocelular sólido. Visión de la tinción de hematoxilina-eosina al microscopio. B: visión del mismo corte con el microscopio confocal. (Cortesía de Milind Rjadhyaksha y Salvador González, Harvard Medical School, Boston, EE.UU.).
Nuevos sistemas de procesado de muestras
Según una reciente estadística124, algo más del 50 % de los laboratorios de Estados Unidos que procesan muestras de cirugía de Mohs lo hacen con sistemas automáticos (Linistainer® es el más empleado). Esto permite un ahorro de tiempo de alrededor del 30 % y una mejora en la calidad del 20-30 %. A la pregunta de cuántos de ellos utilizaban métodos inmunohistoquímicos en cortes de congelación de forma habitual, sólo 13 de 108 respondieron afirmativamente.
Otras
Pueden utilizarse ordenadores para ayudar en el mapeo de la pieza125. En cuanto al ganglio centinela, aunque no es una innovación en la cirugía de Mohs, se hace constar aquí porque se trata de una técnica complementaria que puede utilizarse en muchos tumores cutáneos como factor predictivo de la evolución45.
CONCLUSIONES
En el tratamiento de los tumores cutáneos es difícil realizar una comparación rigurosa de las técnicas de tratamiento. En un estudio «ideal», el mismo médico tendría que tratar el mismo tumor tantas veces como técnicas quisiera comparar. A pesar de ello, las estadísticas a largo plazo indican que la técnica de la cirugía de Mohs es la que mayores porcentajes de curación consigue, a pesar de que los enfermos que son tratados bajo esta modalidad suelen ser los de peor pronóstico. ¿Se deben tratar por tanto todos los tumores cutáneos con esta modalidad de tratamiento? Evidentemente no; sólo han de tratarse los de alto riesgo o aquellos en los que, por su localización, sea importante el ahorro de tejido sano.