La dermatitis atópica (DA) es una de las enfermedades cutáneas más prevalentes, pero existen importantes lagunas en la comprensión de su impacto sobre la calidad de vida (CdV) y la salud mental de los pacientes, así como los gastos directos que les ocasiona. La evidencia científica sobre la carga multidimensional de la DA procede habitualmente de estudios en los que se utilizan exclusivamente resultados informados por los pacientes.
MétodosEn este contexto, se diseñó el estudio MEASURE-AD, de tipo transversal, multicéntrico e internacional, con resultados informados por los pacientes y por los facultativos con el fin de describir dicha carga multidimensional en adultos con DA moderada o grave.
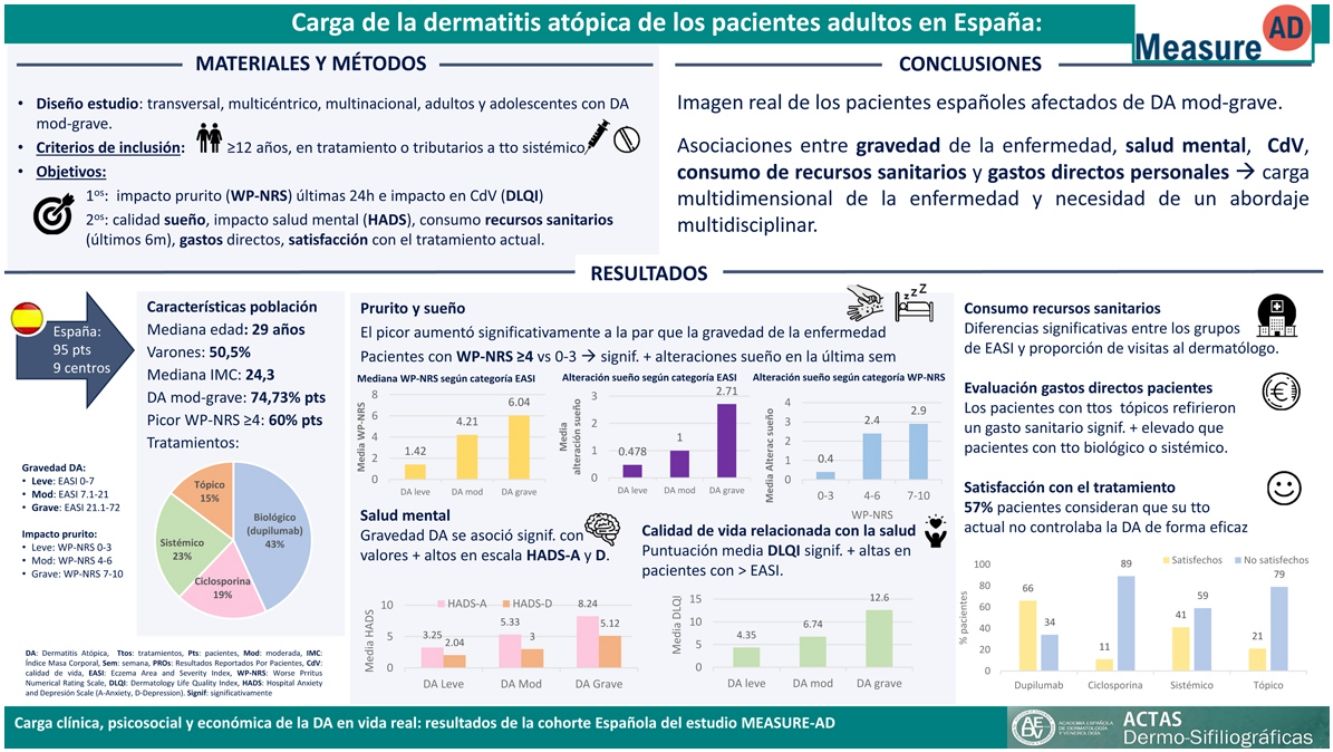
ResultadosEn este artículo se presentan los resultados de la cohorte española. Los adultos con DA moderada o grave y EASI entre 21,1 y 72 presentaron una carga significativamente más alta de la enfermedad, síntomas muy intensos, como el prurito y las alteraciones del sueño, afectación de la salud mental y la CdV y mayor consumo de recursos sanitarios y gasto directo que los pacientes con puntuación EASI entre 0-7 o 7,1-21.
ConclusionesEl estudio aporta información para comprender mejor la carga que supone la enfermedad y nos permite identificar qué aspectos conviene mejorar en el manejo de la DA.
Atopic dermatitis (AD) is one of the most prevalent skin diseases, but there are numerous knowledge gaps surrounding the impact this disease has on quality of life (QoL), mental health, and out-of-pocket expenses involved in the management of AD. The available scientific evidence on the multidimensional burden of AD is usually based on studies with measures reported by patients themselves.
MethodsIn this context, the MEASURE-AD trial was developed as a cross-sectional, multicenter, multinational trial using patient- and physician-reported measures to characterize the multidimensional burden of AD in adults with moderate-to-severe AD.
ResultsThis paper presents the results of the Spanish cohort. We found that Spanish adults with moderate-to-severe AD and high EASI score (21.1-72) had a significantly increased disease burden, high severity of symptoms such as itch and sleep disturbances, impaired mental health and QoL, higher use of health care resources, and more out-of-pocket expenses than patients with low EASI scores (0-7 or 7.1-21).
ConclusionsThis study provides information to better understand disease burden, and identify aspects to be improved in the management of AD.
La dermatitis atópica (DA) es una enfermedad inflamatoria crónica de la piel que cursa en forma de brotes y se caracteriza por prurito intenso, sequedad y eccemas1,2. Afecta tanto a los niños como a los adultos y es una de las enfermedades cutáneas más prevalentes del mundo3. La prevalencia en adultos españoles varía entre el 0,028%4 y 0,085%, aunque los últimos datos indican que está infraestimada6. A pesar de situarse entre las enfermedades cutáneas más incapacitantes7–9, su impacto en los pacientes adultos, especialmente en casos moderados y graves, sigue sin conocerse bien9,10. De hecho, se ha descrito como la carga que supone la enfermedad para el paciente guarda una relación directa con los signos y síntomas físicos, como el prurito9,11, y una relación indirecta con la afectación del sueño12,13, la salud mental14,15 y las actividades cotidianas, todo contribuyendo al deterioro de la calidad de vida (CdV)16. Asimismo, se ha descrito el gran impacto para la salud pública que presenta la DA desde el punto de vista económico ya que se asocia a importantes costes directos e indirectos, así como a un elevado consumo de recursos sanitarios9,10,17,18.
En general, las investigaciones tradicionalmente han prestado más atención a los signos y síntomas de la DA que a su impacto en la CdV y otros efectos indirectos. Esta información a menudo proviene de resultados informados por los propios pacientes (PROs)10, aunque recientemente se han observado discrepancias entre los PROs de la DA informados por los pacientes y por los facultativos6.
Teniendo en cuenta esta situación, se realizó el estudio MEASURE-AD que incorporó resultados informados por los pacientes y por los médicos, con el fin de obtener una descripción más objetiva de la carga multidimensional de la DA y de minimizar los sesgos en los PROs19. En este artículo se presentan los resultados correspondientes a la cohorte española del estudio MEASURE-AD, que nos permiten describir la carga multidimensional de la enfermedad, los patrones de tratamiento y la utilización de recursos sanitarios en los pacientes adultos españoles con DA moderada y grave.
Materiales y métodosDiseño del estudio y pacientesEl estudio MEASURE-AD es un estudio transversal, multicéntrico y multinacional en el que se incluyeron pacientes adultos y adolescentes con DA moderada y grave tras la obtención del consentimiento informado19. El estudio fue realizado de acuerdo con la Declaración de Helsinki, las directrices para las Buenas Prácticas de Farmacoepidemiología (GPP) de la Sociedad Internacional de Farmacoepidemiología (ISPE), así como con las normas de buenas prácticas clínicas y la legislación y normativa vigente. Se reclutó a pacientes con DA que acudían a un control regular en su clínica o consulta de dermatología, a lo largo de un período de 6 meses y de forma consecutiva para intentar controlar el sesgo de selección. Se incluyeron pacientes que dieron su consentimiento para participar, mayores de 12 años con diagnóstico confirmado de DA, que estaban recibiendo o eran tributarios de tratamiento sistémico y se disponía de sus antecedentes farmacológicos de los últimos 6 meses. Los participantes en ensayos intervencionistas fueron excluidos.
TratamientosEn el momento de la inclusión se recopiló la información sobre los tratamientos actuales y anteriores. Los tratamientos evaluados incluyen los medicamentos comercializados con indicación terapéutica para la DA en el momento de la realización del estudio. Estos tratamientos se clasificaron de forma excluyente y jerárquica en cuatro grupos: 1.o) productos tópicos (corticoides e inhibidores de la calcineurina); 2.o) tratamiento sistémico clásico (incluido el tratamiento inmunomodulador y excluida la ciclosporina); 3.o) ciclosporina; y 4.o) tratamiento biológico (dupilumab).
Gravedad de la dermatitis atópicaSe estratificó a los pacientes según la gravedad de la DA mediante el índice de gravedad y área del eccema (EASI)20: ausente (0); casi ausente (0,1 a 1,0); leve (1,1 a 7,0); moderada (7,1 a 21,0); grave (21,1 a 50,0); y muy grave (50,1 a 72,0)20–22. A efectos de este análisis, los intervalos del EASI se han reagrupado en tres categorías: EASI-0-7; EASI-7,1-21; y EASI-21,1-7222.
Variables resultadoEn la visita de estudio, se documentaron los PROs y los resultados informados por los facultativos mediante la respuesta a un cuestionario con escalas validadas y preguntas independientes para describir la carga multidimensional de la DA, sobre gravedad y control de la enfermedad, calidad del sueño, CdV, satisfacción con el tratamiento, gastos directos y consumo de recursos sanitarios.
Los objetivos primarios incluyeron, 1) evaluar el impacto del prurito mediante la escala numérica del peor prurito (WP-NRS) en las últimas 24 horas categorizada en WP-NRS-0-3, WP-NRS-4-6 y WP-NRS-7-10, y 2) determinar el impacto de la DA en la CdV usando el índice de calidad de vida en dermatología (DLQI)23,24.
Los objetivos secundarios comprendieron: 1) determinar la calidad del sueño, evaluada según la respuesta a la pregunta «En la última semana, ¿cuántas noches le costó dormir?», con una escala comprendida entre el 1, que corresponde a «poco, una noche», y el 7, que significa «mucho, todas las noches de la semana»; 2) medir el impacto en la salud mental a través de la escala hospitalaria de ansiedad y depresión (HADS)25; 3) estimar el consumo de recursos sanitarios mediante el número de visitas y consultas de dermatología en los últimos 6 meses debido a la DA; 4) evaluar los gastos directos medidos como el desembolso individual promedio anual en atención sanitaria, productos de higiene y autocuidado, y 5) determinar la satisfacción de los pacientes con sus tratamientos actuales, agrupando las respuestas en dos categorías: completamente de acuerdo y otros (parcialmente y totalmente en desacuerdo).
Análisis estadísticoLa población de estudio se caracterizó mediante estadísticas descriptivas de centralidad y dispersión para variables cuantitativas (mediana/rango o media/desviación típica) y proporciones y frecuencias para variables categóricas. Los pacientes se agruparon según el grado de satisfacción con sus tratamientos en dos grupos y en tres grupos conforme a la puntuación EASI. Se compararon las variables categóricas con pruebas χ2 y análisis multinomiales, y las variables continuas con la prueba de Kruskal-Wallis y prueba de Wilcoxon. Se corrigieron valores de p con Holm-Bonferroni. El análisis fue realizado empleando el programa informático R (v4.1.1, R Bioconductor).
ResultadosCaracterísticas de la población estudiadaEl análisis está integrado por 95 pacientes de los 9 centros españoles que participaron en el estudio MEASURE-AD. La mediana (rango) de edad fue de 29 años (16-66) y el 50,5% eran varones. La mediana (RIC) del índice de masa corporal fue de 24,3 (16,8-42,8).
Según el EASI, cerca del 75% de los pacientes presentaban DA moderada o grave en el momento de su inclusión. Del total, el 25,26% de los pacientes tenían un EASI-0-7, el 20% tenían un EASI-7,1-21 y el 54,73% tenían un EASI-21,1-72.
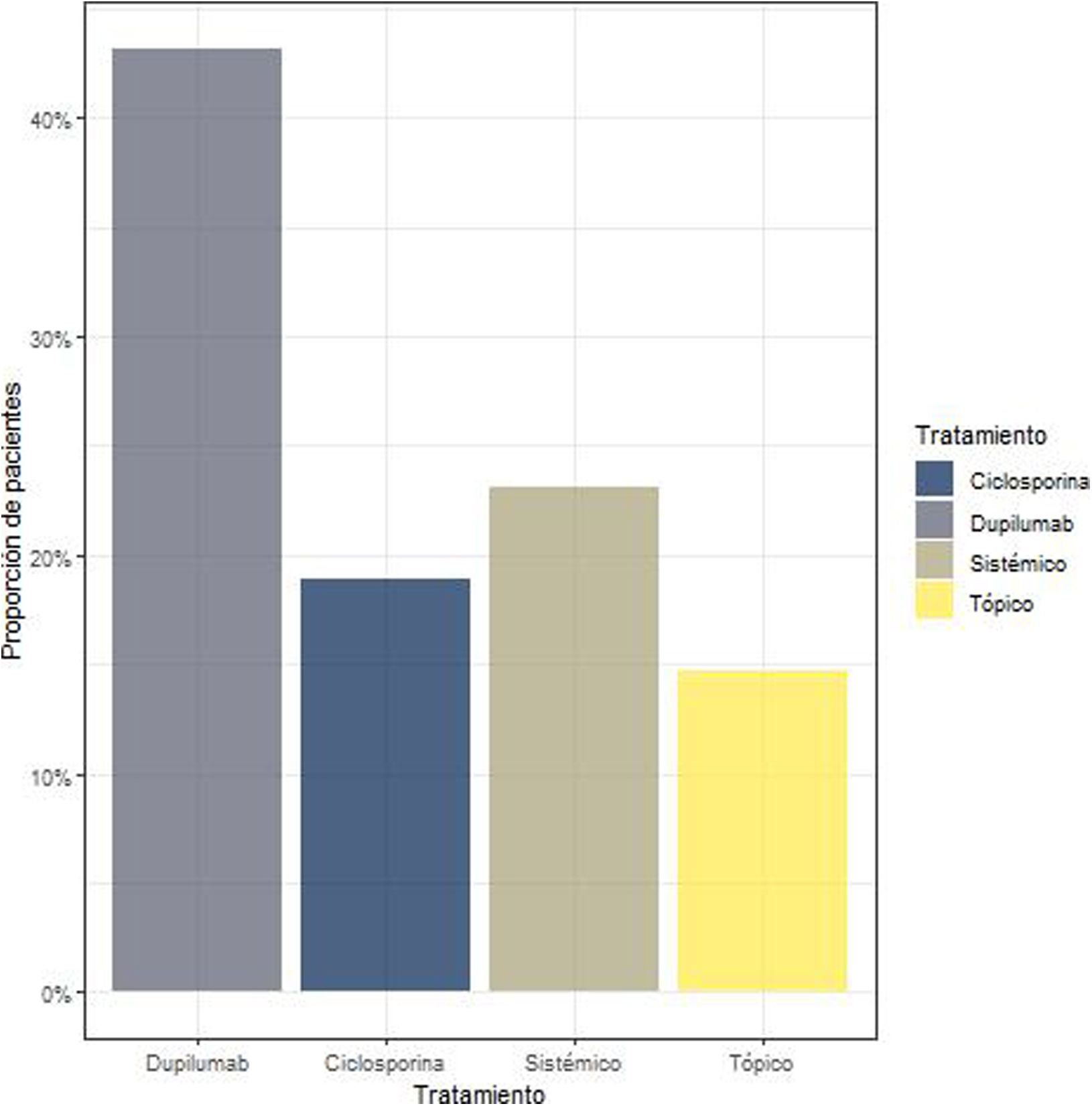
En relación con los tratamientos que seguían en el momento de su inclusión, el 43,15% seguía tratamiento biológico, el 18,94% ciclosporina, el 23,15% tratamiento sistémico y el 14,73% tratamiento tópico (fig. 1).
La exposición total media (DT) a cada tratamiento (previo y actual) fue de 100,9 días (211,2) en el caso del biológico, 315,0 días (729,6) de ciclosporina, 982,1 días (1548,8) de tratamiento sistémico y 696,6 días (1031,8) de tratamiento tópico.
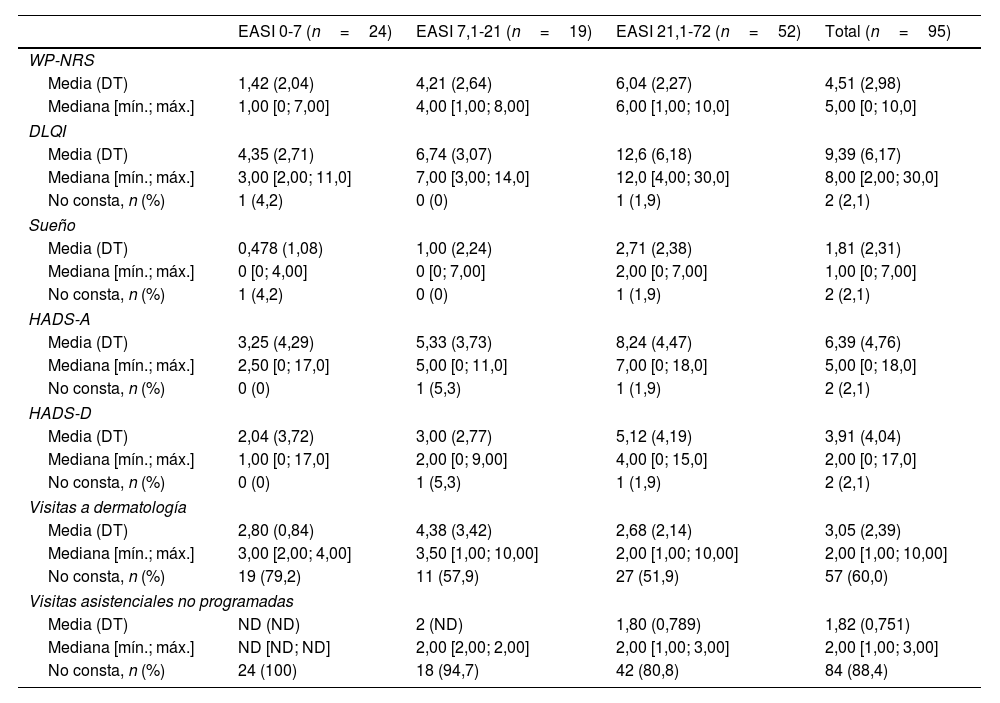
Descripción de la carga de enfermedad relacionada con el prurito, el sueño y la salud mentalPrurito y sueñoEl prurito aumentó significativamente a la par que la gravedad de la enfermedad valorada con el EASI (tabla 1) (p<0,001) (fig. 2A). Los pacientes con EASI-21,1-72 tuvieron más prurito que los pacientes con EASI-7,1-21 (p=0,013) y EASI-0-7 (p<0,001), y los pacientes con EASI-7,1-21 refirieron más prurito que los pacientes con EASI-0-7 (p<0,001).
Análisis de las variables por subgrupos definidos según la puntuación del EASI
| EASI 0-7 (n=24) | EASI 7,1-21 (n=19) | EASI 21,1-72 (n=52) | Total (n=95) | |
|---|---|---|---|---|
| WP-NRS | ||||
| Media (DT) | 1,42 (2,04) | 4,21 (2,64) | 6,04 (2,27) | 4,51 (2,98) |
| Mediana [mín.; máx.] | 1,00 [0; 7,00] | 4,00 [1,00; 8,00] | 6,00 [1,00; 10,0] | 5,00 [0; 10,0] |
| DLQI | ||||
| Media (DT) | 4,35 (2,71) | 6,74 (3,07) | 12,6 (6,18) | 9,39 (6,17) |
| Mediana [mín.; máx.] | 3,00 [2,00; 11,0] | 7,00 [3,00; 14,0] | 12,0 [4,00; 30,0] | 8,00 [2,00; 30,0] |
| No consta, n (%) | 1 (4,2) | 0 (0) | 1 (1,9) | 2 (2,1) |
| Sueño | ||||
| Media (DT) | 0,478 (1,08) | 1,00 (2,24) | 2,71 (2,38) | 1,81 (2,31) |
| Mediana [mín.; máx.] | 0 [0; 4,00] | 0 [0; 7,00] | 2,00 [0; 7,00] | 1,00 [0; 7,00] |
| No consta, n (%) | 1 (4,2) | 0 (0) | 1 (1,9) | 2 (2,1) |
| HADS-A | ||||
| Media (DT) | 3,25 (4,29) | 5,33 (3,73) | 8,24 (4,47) | 6,39 (4,76) |
| Mediana [mín.; máx.] | 2,50 [0; 17,0] | 5,00 [0; 11,0] | 7,00 [0; 18,0] | 5,00 [0; 18,0] |
| No consta, n (%) | 0 (0) | 1 (5,3) | 1 (1,9) | 2 (2,1) |
| HADS-D | ||||
| Media (DT) | 2,04 (3,72) | 3,00 (2,77) | 5,12 (4,19) | 3,91 (4,04) |
| Mediana [mín.; máx.] | 1,00 [0; 17,0] | 2,00 [0; 9,00] | 4,00 [0; 15,0] | 2,00 [0; 17,0] |
| No consta, n (%) | 0 (0) | 1 (5,3) | 1 (1,9) | 2 (2,1) |
| Visitas a dermatología | ||||
| Media (DT) | 2,80 (0,84) | 4,38 (3,42) | 2,68 (2,14) | 3,05 (2,39) |
| Mediana [mín.; máx.] | 3,00 [2,00; 4,00] | 3,50 [1,00; 10,00] | 2,00 [1,00; 10,00] | 2,00 [1,00; 10,00] |
| No consta, n (%) | 19 (79,2) | 11 (57,9) | 27 (51,9) | 57 (60,0) |
| Visitas asistenciales no programadas | ||||
| Media (DT) | ND (ND) | 2 (ND) | 1,80 (0,789) | 1,82 (0,751) |
| Mediana [mín.; máx.] | ND [ND; ND] | 2,00 [2,00; 2,00] | 2,00 [1,00; 3,00] | 2,00 [1,00; 3,00] |
| No consta, n (%) | 24 (100) | 18 (94,7) | 42 (80,8) | 84 (88,4) |
DLQI: índice de calidad de vida en dermatología (Dermatology Life Quality Index); DT: desviación típica; EASI: índice de gravedad y área del eccema (Eczema Area and Severity Index); HADS: escala hospitalaria de ansiedad y depresión (Hospital Anxiety and Depression Scale); HADS-A: subescala de ansiedad de la HADS; HADS-D: subescala de depresión de la HADS; ND: no disponible; WP-NRS: escala numérica de valoración del peor prurito (Worst Pruritus Numerical Rating Scale).
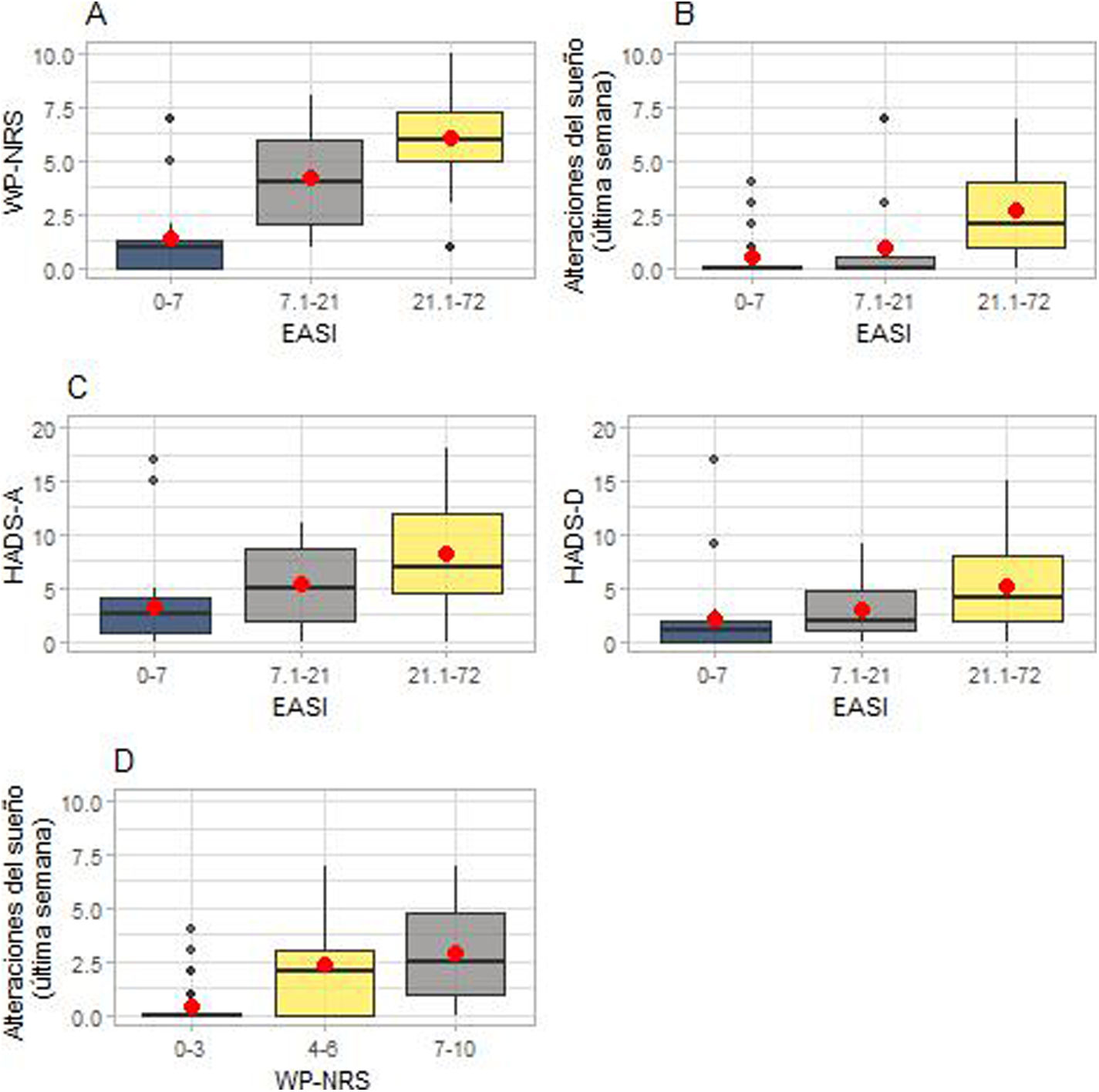
Repercusión de la dermatitis atópica sobre el prurito, la calidad del sueño y la salud mental. En (A) están representadas las diferencias entre las medianas de la puntuación WP-NRS (escala numérica de valoración del peor prurito) en relación con cada grupo EASI (índice de gravedad y área del eccema). En (B) están representadas las alteraciones del sueño en cada grupo EASI. En (C) están representadas las diferencias en las medianas de las puntuaciones de las subescalas de la HADS (escala hospitalaria de ansiedad y depresión) en cada grupo EASI. En (D) están representadas las alteraciones del sueño en cada grupo WP-NRS.
Además, la calidad del sueño difirió significativamente entre los distintos grupos EASI (p<0,001). Los pacientes con un EASI-21,1-72 refirieron una peor calidad del sueño que los pacientes con un EASI-7,1-21 (p=0,001) y un EASI-0-7 (p<0,001), mientras que no se detectaron diferencias significativas entre el grupo de EASI-7,1-21 y el de EASI-0-7 (p=0,672) (fig. 2B).
Al analizar la asociación entre los tres grupos WP-NRS y las alteraciones del sueño se observaron diferencias significativas (p<0,001). De los 95 pacientes, el 32% tenían una puntuación WP-NRS de 7-10, el 28% tenían 4-6 y el 40% tenían 0-3. Los pacientes con puntuaciones WP-NRS de 7-10 (p<0,001) y de 4-6 (p<0,001) refirieron más alteraciones del sueño que los pacientes con puntuaciones de 0-3, si bien no hubo diferencias entre el grupo de WP-NRS-4-6 y el grupo de WP-NRS-7-10 (p=0,29) (fig. 2D).
Salud mentalLa gravedad de la DA se asoció con puntuaciones más altas en la escala HADS-A (p<0,001). Los pacientes con EASI-21,1-72 presentaban puntuaciones de la HADS-A significativamente más altas que los pacientes con EASI-7,1-21 (p=0,038) y EASI-0-7 (p<0,001). Los pacientes con EASI-7,1-21 también mostraron puntuaciones significativamente más altas que los pacientes con EASI-0-7 (p=0,038) (fig. 2C). Según la escala HADS-A, los síntomas aparecen cuando la puntuación es ≥825. En nuestra población, 34/93 pacientes (36,5%) tenían una puntuación ≥8, de los cuales el 74% (25/34) son del grupo de EASI-21,1-72.
La gravedad de la DA también se asoció con puntuaciones más altas en la escala HADS-D. En efecto, los pacientes con EASI-21,1-72 tenían puntuaciones de la HADS-D más altas que los pacientes con EASI-0-7 (p=0,001). No hubo diferencias significativas entre los pacientes con EASI-21,1-72 y EASI-7,1-21, ni entre los pacientes con EASI-7,1-21 y EASI-0-7 (fig. 2C). En total, 18/93 pacientes (19,35%) tenían una puntuación ≥8, de los cuales el 83% (15/18) estaban en el grupo de EASI-21,1-72.
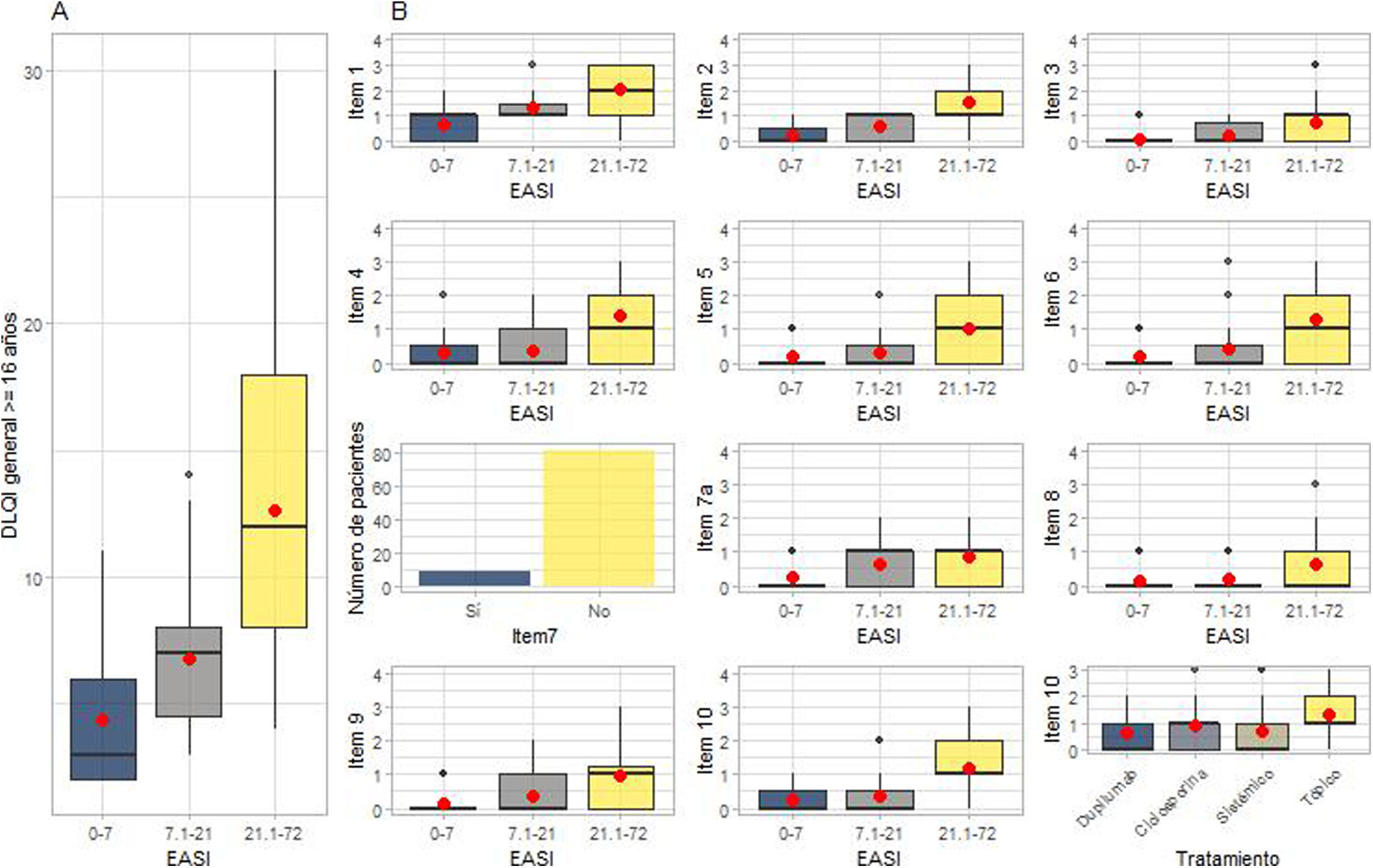
Calidad de vida relacionada con la saludLas medianas de las puntuaciones del DLQI fueron significativamente más altas entre los pacientes con mayores valores del EASI (tabla 1). Los pacientes con puntuaciones EASI-21,1-72 presentaron puntuaciones significativamente más altas que los pacientes con EASI-7,1-21 (p<0,001) y EASI-0-7 (p<0,001). A su vez, los pacientes con EASI-7,1-21 mostraron puntuaciones significativamente más altas que los pacientes con EASI-0-7 (p=0,005) (fig. 3A).
Repercusión de la dermatitis atópica sobre la calidad de vida según el DLQI.
En (A) están representadas las diferencias entre las medianas de la puntuación del DLQI (índice de calidad de vida en dermatología) en relación con cada grupo EASI (índice de gravedad y área del eccema). En (B) se representa el análisis de las preguntas por separado, en cada uno de los grupos EASI y, en el caso de la pregunta 10, por tipo de tratamiento.
DLQI: índice de calidad de vida en dermatología (Dermatology Life Quality Index); EASI: índice de gravedad y área del eccema (Eczema Area and Severity Index).
El significado de cada pregunta es: pregunta 1, síntomas y sensaciones; pregunta 2, vergüenza e incomodidad; pregunta 3, actividades cotidianas; pregunta 4, vestuario; pregunta 5, actividades sociales y ocio; pregunta 6, deporte; preguntas 7 y 7a, trabajo y estudio; pregunta 8, problemas con la pareja o las amistades; pregunta 9, dificultades sexuales; y pregunta 10, tratamientos.
Los pacientes con EASI-21,1-72 también informaron de que la DA afectaba significativamente a todos los ítems individuales del DLQI (p<0,001) (fig. 3B). No se detectaron diferencias entre los grupos de tratamiento en el análisis de la pregunta 10 del DLQI: «Durante los últimos siete días, ¿el tratamiento de su piel ha sido un problema para usted?» (fig. 3B).
Consumo de recursos sanitariosGlobalmente, 18/95 pacientes (18,94%) acudieron a visitas que no estaban programadas durante el período estudiado. De ellos, 15 (83,33%) tenían EASI-21,1-72 y 3 (16,7%), EASI-7,1-21. En total, 65/95 pacientes (68,24%) habían acudido a un dermatólogo: 42 pacientes (63,64%) tenían EASI-21,1-72, 14 (21,21%) tenían EASI-7,1-21 y 9 (13,63%) tenían EASI-0-7. Se observan diferencias significativas entre los grupos EASI y la proporción de visitas al dermatólogo (p<0,001).
Evaluación de los gastos directos de los pacientesLa media mensual de los gastos directos relacionados con la atención médica de los pacientes fue de 44,74€, lo cual representa un gasto anual de 536,80€; si se añade el gasto directo anual a las necesidades diarias de higiene y cuidado personal (424,32€), el promedio anual por paciente asciende a casi 1000 euros (964,20€).
Las únicas diferencias significativas en los gastos directos se asociaron con los tratamientos. Así, los pacientes que tenían tratamientos tópicos refirieron un gasto sanitario significativamente más elevado que los pacientes que estaban con un tratamiento biológico (p=0,013) o un tratamiento sistémico (p=0,009).
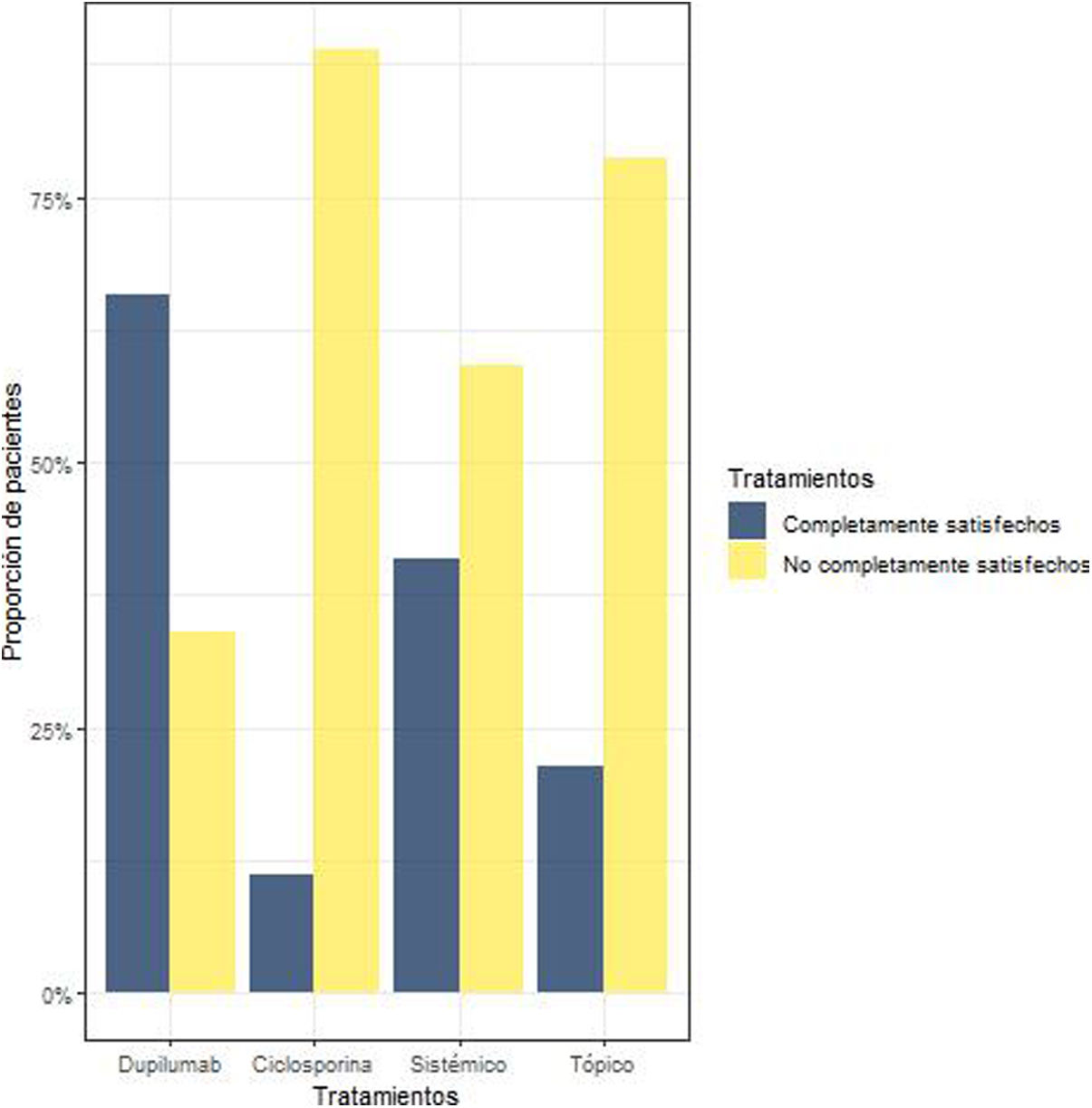
Satisfacción con el tratamientoUn 57% de los pacientes (54/95) consideraban que su tratamiento actual no controlaba la DA lo suficiente, por lo que no se encontraban completamente satisfechos (tabla 2, fig. 4). El 30% de estos pacientes tomaban ciclosporina; el 26% tratamiento biológico; el 24%, tratamiento sistémico; y el 20%, tratamiento tópico. De los 41 pacientes que seguían tratamiento biológico, el 66% estaban completamente satisfechos. Por su parte, se declararon satisfechos con el tratamiento actual el 11,11% de los que tomaban ciclosporina, el 41% de los que recibían tratamiento sistémico y el 21,3% de los tratados con productos tópicos.
Las hipótesis se compararon entre los pacientes «completamente satisfechos» y los «no completamente satisfechos» con cada tratamiento. Se observó que los pacientes tratados con biológico estaban más satisfechos (p=0,008), mientras que los tratados con ciclosporina consideraron que el tratamiento era insuficiente para conseguir el control adecuado de la DA (p<0,001). No se observaron diferencias significativas en el grupo de tratamiento sistémico (p=0,365). Finalmente, los pacientes del grupo con tratamientos tópicos consideraron mayoritariamente que no están completamente satisfechos con su tratamiento (p=0,008).
DiscusiónEste estudio en vida real describe la carga multidimensional de la DA en pacientes españoles con DA moderada y grave. Los resultados indican que, en España, los adultos con DA y un EASI de entre 21,1 y 72 sufren una carga significativa de la enfermedad, presentan prurito más intenso, alteraciones del sueño, un mayor deterioro de la salud mental y de la CdV, consumen más recursos sanitarios y tienen mayores gastos directos. En relación con la calidad del sueño, la depresión y la CdV, no se aprecian diferencias significativas entre el grupo de pacientes con un EASI 7-21,1 y el grupo con EASI-0-7.
El prurito, que constituye el síntoma principal de la DA, se relaciona con el deterioro de la CdV y con las alteraciones del sueño, tal como se había observado previamente12,26. Asimismo, la intensidad del prurito es mayor cuanto mayor es el EASI, afectando al sueño, las actividades cotidianas y la CdV, tal como reflejan las puntuaciones del DLQI y sus subescalas, en consonancia con trabajos anteriores10,27.
Los pacientes con DA arrastran una enorme carga psicosocial y económica. La DA puede estar asociada a estrés psicológico, disminución de la autoestima y falta de sueño10,12,28,29. Estos problemas se ven acentuados por las lesiones visibles, la estigmatización y el prurito, lo que contribuye a los efectos psicosociales adversos y al mayor consumo de recursos sanitarios26,30. Es importante destacar que estudios previos28,29,31–33 han demostrado que la DA se relaciona con la depresión, ansiedad y un mayor riesgo de ideas suicidas33. En esta cohorte española, la ansiedad (37%) supera a la depresión (20%)31,32, destacando la importancia de evaluar la salud mental, especialmente en casos graves de la enfermedad.
En nuestro país, las consecuencias económicas que tiene la DA para los pacientes son sustanciales. Cerca del 20% de los pacientes necesitaron consultas médicas no programadas, a pesar de seguir un tratamiento, y el 70% había visitado a especialistas en los 6 meses previos, cifras consistentes con investigaciones anteriores que señalan un mayor uso de servicios no programados y de urgencia34,35. Además, el gasto directo relacionado con la DA en nuestra población asciende por término medio hasta los 1000 euros al año, cifra superior a estudios previos36,37, posiblemente debida a diferencias en el diseño de los estudios y en los sistemas sanitarios regionales35–39.
La satisfacción con el tratamiento es una cuestión preocupante, ya que más de la mitad de los pacientes no consideran que su tratamiento actual controle de forma eficaz la DA. Esto puede influir en la CdV y el consumo de recursos sanitarios. En particular, los pacientes que toman ciclosporina o siguen tratamientos sistémicos perciben un efecto terapéutico insuficiente, destacando la necesidad de encontrar una farmacoterapéutica efectiva para mejorar la CdV y reducir el impacto de la enfermedad. En el momento del estudio, el dupilumab era la única terapia avanzada que estaba autorizada en DA.
Una de las fortalezas de este estudio radica en el uso de resultados informados tanto por los pacientes como por los facultativos, así como escalas validadas para determinar la gravedad de la DA, la afectación de la salud mental y la CdV. La puntuación del EASI ha permitido estratificar a los pacientes según la gravedad de la enfermedad, como forma de orientar el abordaje multidimensional. No obstante, el diseño transversal y el reclutamiento en clínicas dermatológicas limitan su alcance, ya que pueden haberse quedado fuera pacientes tratados en otros ámbitos.
ConclusionesEn suma, el presente análisis del estudio MEASURE-AD ofrece una imagen real de lo que viven los pacientes españoles afectados de DA moderada y grave; revela asociaciones entre la gravedad de la enfermedad, la salud mental, la CdV, el consumo de recursos sanitarios y los gastos directos personales. Todo ello subraya la carga multidimensional que tiene la enfermedad y la necesidad de darle un abordaje multidisciplinario, en el que se tenga en cuenta la salud mental integrando otras especialidades médicas. Por último, es imprescindible que se sigan investigando y desarrollando nuevas estrategias terapéuticas y asistenciales eficaces para minimizar las cargas económicas y psicosociales de la DA.
FinanciaciónAbbVie ha financiado los estudios y ha participado en el diseño, la investigación, los análisis, la recogida e interpretación de los datos y la revisión y aprobación de su publicación. Todos los autores han tenido acceso a los datos pertinentes y han participado en la redacción, la revisión y la aprobación de este artículo. Los autores no han percibido honorarios ni remuneraciones de otro tipo por su trabajo.
Conflicto de interesesJuan Francisco Silvestre ha prestado servicios de asesoría y ha percibido honorarios como ponente en actividades de formación de Sanofi Genzyme, Regeneron, AbbVie, Galderma, Ely Lilly, Leo Pharma, Pfizer y Novartis. Asimismo, ha sido investigador principal en ensayos clínicos patrocinados por AbbVie, Amgen, AstraZeneca, Bristol Myers Squibb, Eli Lilly, Galderma, Incyte, Leo Pharma, Novartis y Pfizer, ajenos al trabajo presentado aquí.
Ricardo Ruiz Villaverde ha prestado servicios de asesoría y ha percibido honorarios como ponente en actividades de formación de Janssen, AbbVie, Almirall, Amgen, Lilly, MSD, Sanofi y UCB. Asimismo, ha sido investigador principal en ensayos clínicos patrocinados por Janssen, AbbVie, Almirall, Amgen, Lilly, MSD, Sanofi y UCB.
Bibiana Pérez García ha prestado servicios de asesoría y ha percibido honorarios como ponente en actividades de formación de Sanofi, Genzyme, Regeneron, AbbVie, Boehringer Ingelheim, Lilly, Galderma, Leo Pharma, Pierre Fabre, Meda Pharma y FAES Pharma. Asimismo, ha sido investigadora principal en ensayos clínicos patrocinados por AbbVie, Sanofi, Lilly, Galderma y FAES Pharma, ajenos al trabajo presentado aquí.
Pedro Herranz ha prestado servicios de asesoría, ha percibido honorarios como ponente en actividades de formación o ha sido investigador principal en ensayos clínicos de los siguientes laboratorios: AbbVie, Almirall, Bristol Myers Squibb, Eli Lilly, Galderma, Leo Pharma, Janssen, Novartis, Pfizer y Sanofi Genzyme (todo ello ajeno al trabajo presentado aquí).
Javier Jesús Domínguez Cruz ha prestado servicios de asesoría y ha percibido honorarios como ponente en actividades de formación de Sanofi, AbbVie, Almirall, Lilly, Jansen, Novartis, Leo Pharma y Galderma. Asimismo, ha sido investigador principal en ensayos clínicos patrocinados por Sanofi, AbbVie, Leo Pharma y Almirall, ajenos al trabajo presentado aquí.
Rosa Izu Belloso ha prestado servicios de asesoría y ha percibido honorarios como ponente en actividades de formación de Almirall, Sanofi Genzyme, AbbVie, Galderma, Ely Lilly, Leo Pharma, Pfizer y Novartis. Asimismo, ha sido investigadora principal en ensayos clínicos patrocinados por Almirall, AbbVie, Eli Lilly, Galderma, Leo Pharma, Novartis y Pfizer, ajenos al trabajo presentado aquí.
Maurizio Gentile es empleado de AbbVie.
Comunicación de datosAbbVie mantiene un compromiso con la comunicación responsable de datos de los ensayos clínicos que patrocina; ello incluye permitir el acceso a datos anonimizados, individuales y agrupados por ensayos (conjuntos de datos de análisis), así como otros documentos (protocolos e informes de ensayos clínicos), siempre que los ensayos no formen parte de un expediente de registro en curso o previsto. También se incluyen las solicitudes de datos relativos a ensayos clínicos de productos e indicaciones no autorizados.
Los datos de este ensayo clínico pueden solicitarlos investigadores acreditados que participen en investigaciones rigurosas e independientes; serán facilitados tras revisarse y aprobarse una propuesta de investigación y un plan de análisis estadístico, previa formalización de un acuerdo de cesión de datos. Las solicitudes pueden presentarse en cualquier momento y los datos permanecerán accesibles durante un período de 12 meses, sin perjuicio de que se concedan sucesivas prórrogas. En el siguiente enlace se puede obtener más información sobre el proceso o enviar una solicitud: https://www.abbvie.com/our-science/clinical-trials/clinical-trials-data-and-information-sharing/data-and-information-sharing-with-qualified-researchers.html
Deseamos agradecer a la Dra. Laura Vilorio Marqués (Medical Statistics Consulting, Valencia) la asistencia técnica y analítica brindada en la redacción de este manuscrito.