El carcinoma epidermoide cutáneo (CEC) metastásico ganglionar es una entidad de baja incidencia: 2,4% en varones y 1,1% en mujeres1, que frecuentemente constituye un desafío terapéutico. Clásicamente el tratamiento sistémico de los casos irresecables se ha basado en platinos e inhibidores del factor de crecimiento epidérmico, combinados o no con radioterapia. Sin embargo, recientes estudios sitúan cada vez más a los inhibidores del punto de control inmunitario como la alternativa más eficaz y segura para el tratamiento de la enfermedad localmente avanzada o metastásica. Describimos el caso de una paciente con CEC metastásico ganglionar y respuesta completa objetiva tras 6 meses de tratamiento con pembrolizumab.
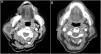
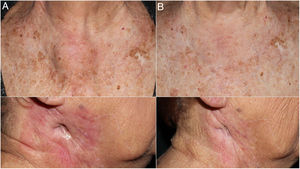
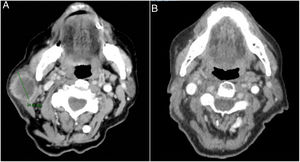
Se trata de una mujer de 83 años que se intervino de CEC moderadamente diferenciado e infiltrante de 8mm de espesor, sin invasión linfovascular ni perineural y márgenes respetados, en la rama mandibular derecha. La expresión del ligando de muerte celular programada (PD-L1) fue del 30% en células tumorales. Como antecedentes personales destacó el diagnóstico de un carcinoma ductal infiltrante de mama sin progresión y sin realizar tratamiento para ello. Tres meses tras la intervención desarrolló un conglomerado adenopático metastásico en el ángulo mandibular derecho de 4,5cm que se confirmó de carcinoma espinocelular, mediante punción aspiración con aguja fina. Se realizó radioterapia con intención curativa, con progresión de la enfermedad ganglionar y aparición de una masa de hasta 8cm cervical anterior. Ante la irresecabilidad de la enfermedad y su progresión a pesar de la radioterapia, con un ECOG de 0, se solicitó el uso de pembrolizumab off-label. Inició pembrolizumab a dosis de 2mg/kg cada 3 semanas, con una rápida disminución del tamaño tumoral tras 4 ciclos y presentando remisión completa clínica y radiológica de forma mantenida durante 6 meses (figs. 1 y 2). El tratamiento fue bien tolerado, presentando únicamente un síndrome similar a la polimialgia reumática, que cedió con analgésicos e hidroxicloroquina 200mg/12h. De forma paralela, el carcinoma ductal de mama no experimentó modificaciones en las mamografías de control.
El papel de la inmunoterapia en el cáncer cutáneo está cada vez más en auge. Los inhibidores de PD-1 están aportando resultados muy prometedores para el tratamiento del CEC localmente avanzado y metastásico1–5, con hasta un 60% de respuestas según las últimas revisiones, tratándose en su mayoría de respuestas parciales4. Recientemente ha sido aprobado cemiplimab, un anticuerpo contra el receptor de muerte celular programada 1 (PD-1) con indicación por la EMA y la FDA para el CEC localmente avanzado. Pembrolizumab es un anticuerpo monoclonal anti-PD-1 indicado en adyuvancia de melanoma iii resecado, melanoma avanzado, linfoma de Hodgkin, carcinoma urotelial, cáncer de pulmón no microcítico y carcinoma de células escamosas de cabeza y cuello. Su mecanismo de acción es a nivel de la sinapsis inmunológica, inhibiendo la acción coinhibidora del PD-1, favoreciendo así la destrucción tumoral por los linfocitos T CD8 intratumorales6. Existen estudios acerca de la expresión de PD-1 y PD-L1, así como el tipo de infiltrado inflamatorio intratumoral y su relación con las características tumorales7 y la respuesta al tratamiento8.
No está claro si existe un punto de corte en la expresión del PD-1 y el PD-L1 en células tumorales del CEC y su relación con la respuesta a fármacos anti-PD-1, aunque parece ser que existe una correlación positiva7,8. Del mismo modo, también se ha relacionado la expresión de PD-L1 con la presencia de características de alto riesgo, como el patrón infiltrativo, la invasión perineural y la inmunosupresión7. Hasta ahora los resultados publicados son en su mayoría respuestas parciales4, aunque también se han descrito respuestas completas (tabla 1), por lo que el tiempo de mantenimiento del tratamiento aún no está claro1–3. No obstante, se trata de un tratamiento con un buen perfil de seguridad, lo cual es de especial importancia al tratarse, en su mayoría, de pacientes de edad avanzada4,9. Los efectos inmunomediados pueden aparecer durante el tratamiento o incluso meses después de su suspensión. Los más frecuentes son los cutáneos, seguidos de colitis, hepatitis, efectos endocrinológicos, neumonitis o artritis10. Por lo general, los efectos inmunomediados suelen ser leves (grado 1-2), pudiendo llevarse a cabo un manejo ambulatorio con dosis de corticoides orales de 0,5-1mg/kg/día de prednisona. En casos de mayor gravedad (grado 3) sería necesario el ingreso hospitalario, la suspensión temporal de la inmunoterapia y el tratamiento con corticoides sistémicos intravenosos de 1-2mg/kg/día, valorando asociar terapia inmunosupresora si a las 48-72h no hubiese respuesta10. Se ha presentado un caso de CEC localmente avanzado en una persona de edad avanzada, con respuesta completa tras el tratamiento con pembrolizumab, como primera línea sistémica.
Revisión de casos de carcinoma epidermoide avanzado tratados con anti-PD1 en la literatura
| Referencia | Edad y sexo | Tumor | Fármaco | Ciclos | Respuesta | Intervalo libre de progresión |
|---|---|---|---|---|---|---|
| Chang, 2016 | 70, M | CEC-LA | Pembrolizumab | 6 | RC | 5 meses |
| Borradori, 2016 | 79, M | CEC-M | Pembrolizumab | NE | RP | 7 meses |
| 65, F | CEC-LA | Pembrolizumab | NE | EE | 4 meses | |
| 61, F | CEC-LA | Nivolumab | NE | RP | 7 meses | |
| 66, F | CEC-M | Nivolumab | NE | RP | 6 meses | |
| Winkler, 2017 | 74, F | CEC-LA | Pembrolizumab | 4 | RP | 5 meses |
| Lipson, 2016 | 54, F | CEC-M | Pembrolizumab | NE | RP | NE |
| Stevenson, 2017 | 70, M | CEC-LA | Pembrolizumab | 4 | RC | 11 meses |
| Sellah, 2018 | 81, M | CEC-LA | Nivolumab | 8 | RC | 10 meses |
| 41, M | CEC-LA | Nivolumab | 8 | RC | 5 meses | |
| 83, M | CEC-LA | Nivolumab | 4 | RP | 2 meses | |
| Degache, 2017 | 80, M | CEC-LA | Pembrolizumab | >6 | RP | NE |
| 76, M | CEC-LA | Pembrolizumab | >3 | RP | NE | |
| Ravulapati, 2017 | 74, M | CEC-LA | Pembrolizumab | 7 | CR | 5 |
| Delein, 2017 | 48, F | CEC-M | Pembrolizumab | >3 | RP | >3 meses |
| Blum, 2017 | 66, M | CEC-LA | Nivolumab | 39 | RP | 2 años |
| 72, M | CEC-LA | Nivolumab | 39 | RC | 2 años | |
| 81, F | CEC-LA | Nivolumab | 13 | RP | 12 meses | |
| Van Baar, 2019 | 88, F | CEC-LA | Pembrolizumab | 4 | RC | 12 meses |
| Liu, 2019 | 72, M | CEC-M | Pembrolizumab | NE | RP | 16 meses |
| Venkatesh, 2019 | 56, M | CEC-LA | Pembrolizumab | 9 | RC | NE |
| Nuestro caso | 83, F | CEC-LA | Pembrolizumab | 4 | RC | >3 meses |
CEC-LA: carcinoma epidermoide cutáneo localmente avanzado; CEC-M: carcinoma epidermoide cutáneo metastásico; F: femenino; M: masculino; NE: no especificada; RC: respuesta completa; RP: respuesta parcial.
Los autores declaran no tener ningún conflicto de intereses.