INTRODUCCION
El carcinoma basocelular es un tumor cutáneo con tendencia a infiltrar por contigüidad siguiendo un patrón tridimensional, y del que existen varios tipos clínicos e histológicos. La escisión quirúrgica con márgenes predeterminados, las técnicas destructivas (electrodesecación y crioterapia), y la radioterapia son las tres opciones terapéuticas reconocidas generalmente como más eficaces1. Sin embargo, en los últimos años se ha evaluado la eficacia de nuevos tratamientos biológicos para el carcinoma basocelular2,3, entre los que cabe destacar el interferón alfa-2b (IFN-α2b) intralesional, la terapia fotodinámica y el imiquimod (IMQ) por vía tópica.
El IMQ es un modificador de la respuesta inmunitaria con un contrastado poder antiviral y antitumoral en modelos animales3. Su actividad resulta de la inducción de IFN-α y otras citocinas (principalmente interleucina [IL-12] e IFN-Υ). Se ha realizado un estudio dosis-respuesta no comparativo de carcinomas basocelulares tratados con crema de IMQ, mediante la pauta que se ha demostrado más eficaz y segura en los estudios previamente publicados4-7.
MATERIAL Y MÉTODOS
El objetivo de este estudio ha sido evaluar la curación clinicohistológica de carcinomas basocelulares menores de 2 cm de diámetro mayor a las 8 semanas de finalizar el tratamiento con crema de IMQ al 5 %, y la seguridad de este tratamiento.
Pacientes
Se incluyeron carcinomas basocelulares primarios menores de 2 cm de diámetro mayor, confirmados histológicamente mediante biopsia en sacabocados (2 mm), atendidos consecutivamente en la Unidad de Dermatología del Hospital Universitario Infanta Cristina de Badajoz en los últimos 12 meses. En un corte transversal se incluyeron todos aquellos casos evaluados a las 8 semanas de concluir el tratamiento.
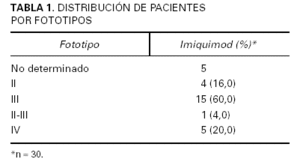
Se trataron 30 pacientes, de los que 17 eran varones (56,7 %), con un total de 42 carcinomas basocelulares, pues 7 pacientes tenían más de uno. Uno de ellos presentaba dos nodulares y tres superficiales, todos ellos en el tronco. La edad media fue de 65,11 años (desviación estándar [DE], 18,95; límites, 26-90), estadísticamente mayor en los pacientes con carcinomas basocelulares nodulares (75,78 años; DE, 7,79) que en aquéllos con carcinomas superficiales (55,43 años; DE, 21,14). La distribución por fototipos se expone en la tabla 1. El 34 % tenía antecedentes de otro u otros tumores cutáneos.
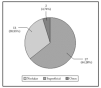
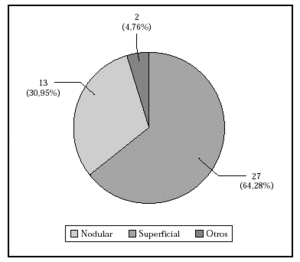
En total, se trataron 42 carcinomas basocelulares: 27 superficiales, 13 nodulares y dos de otro tipo (uno pigmentado y otro morfeiforme). El porcentaje de los distintos tipos de carcinomas basocelulares se expone en la figura 1. La distribución por tamaños se expone en la tabla 2. Todos los carcinomas basocelulares mayores de 1,5 cm fueron del tipo superficial. Las localizaciones más frecuentes fueron la cara (40,5 %, en particular las mejillas, la frente y la nariz), y la espalda (33,4 %) (tabla 3). Todos los tipos nodulares se localizaron en cara, y el 41,2 % de los superficiales en la espalda.
Fig. 1.--Tumores tratados, por tipos de tumor.
Pauta
Tras obtener consentimiento verbal, se prescribió crema de IMQ al 5 % (Aldara®, 3M Pharmaceuticals; 1 sobre de 250 mg de crema contiene 12,5 mg de IMQ), con la recomendación de aplicar una fina película que cubriera la zona de lesión aparente, 2 veces al día, 3 veces por semana, durante 8 semanas.
Evaluación de la eficacia
Se definió la curación clínica al finalizar el tratamiento, como la ausencia de signos clínicos de carcinoma basocelular (borde, superficie e induración). Y se definió la curación clínica e histológica (mediante biopsia en sacabocados de 2 mm, guiada por la fotografía inicial) como la ausencia de lesiones a las 8 semanas del final del tratamiento.
Se analizaron las diferencias en 2 grupos de edad (mayor o menor de 60 años) y de fototipo (II/III o IV) y en las distintas variables tumorales (tipo nodular o superficial, tamaño mayor o menor de 1 cm, y localización en cabeza o tronco y extremidades).
Evaluación de la toxicidad (seguridad)
Se realizaron controles cada 2 semanas durante el tratamiento, valorando con una puntuación de 0 (ausencia) a 3 (reacción grave que interfería en la actividad diaria) los siguientes síntomas y signos: prurito, dolor, eritema, erosiones y úlceras. En cada control se fotografió la lesión y se preguntó al paciente por el cumplimiento del tratamiento, la forma y la pauta de aplicación. Se registraron también otros efectos secundarios distintos de los tipificados en el estudio.
Análisis estadístico
Los datos se introdujeron en una base de datos en sistema SAS versión 8,1. Las comparaciones de variables cuantitativas se realizaron mediante el test de Wilcoxon, con un error α = 0,05 bilateral para considerar diferencias como estadísticamente significativas. La asociación de variables cualitativas se exploró mediante el test de Cochran-Mantel-Heanszel y el test exacto de Fisher. Para el análisis de datos pareados cualitativos se empleó el test de McNemar.
RESULTADOS
Análisis de eficacia
Pacientes. Mostraron curación clínica al finalizar el tratamiento 25 pacientes (83,3 %). Cabe señalar que 4 pacientes no consintieron la realización de una segunda biopsia. Los 7 pacientes que presentaban más de un carcinoma basocelular obtuvieron curación clínica e histológica de todas sus lesiones.
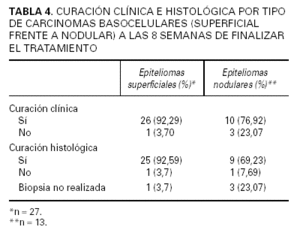
Carcinoma basocelular. Se obtuvo curación clínica global en 37 de 42 carcinomas (88 %), tanto al finalizar el tratamiento como 8 semanas después. Por tipos de tumor, la curación clínica se demostró en 26 de los 27 superficiales (96,29 %), y en 10 de los 13 nodulares (76,9 %).
A las 8 semanas de la finalización del tratamiento, se obtuvo curación histológica en el 83,3 % (35/42) de los tumores, aunque en 4 pacientes no se obtuvo consentimiento para la segunda biopsia. La curación clínica e histológica por tipos de tumor (nodular o superficial) se expone en la tabla 4. No se detectaron diferencias estadísticamente significativas entre los índices de curación clínica (p = 0,1039) e histológica (p = 0,5211) de ambos tipos de tumor. Tampoco se demostraron diferencias entre los grupos de tamaños (menores o mayores de 1 cm), ni en las distintas localizaciones (cabeza y cuello o tronco y extremidades).
De los 4 carcinomas basocelulares que no pudieron ser biopsiados, uno era superficial, que presentaba curación clínica y tres eran nodulares, en dos de los cuales había signos de persistencia clínica, aunque estos pacientes no autorizaron la escisión quirúrgica y fueron tratados con radioterapia. De los otros 2 tipos de carcinoma basocelular, sólo el morfeiforme mostró curación clínica e histológica a las 8 semanas.
Análisis de seguridad
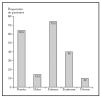
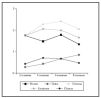
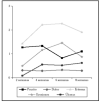
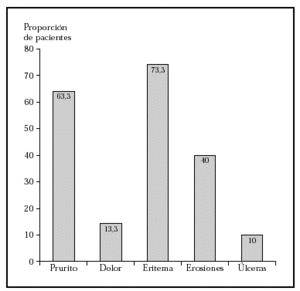
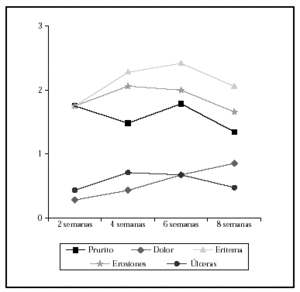
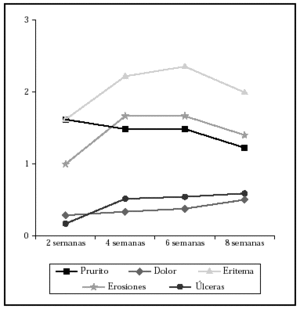
En el primer control a la segunda semana la proporción de los síntomas y la inflamación fue: prurito (63,3 %), dolor (13,3 %), eritema (73,3 %), erosiones (40 %) y úlceras (10 %) (fig. 2), proporciones que se mantuvieron sin diferencias significativas a lo largo de las 8 semanas del tratamiento (fig. 3). Las puntuaciones del prurito en la sexta semana (p = 0,0228) y de las erosiones en la segunda (p = 0,0096) y cuarta (p = 0,0399) semanas de tratamiento fueron significativamente mayores en los carcinomas basocelulares localizados en cabeza y cuello que en los de tronco y extremidades (figs. 4 y 5). Sólo en el grupo de pacientes con lesiones en tronco y extremidades se produjo un aumento significativo en la puntuación del eritema durante la sexta (p = 0,00313) y la octava (p = 0,0156) semana de tratamiento (figs. 4 y 5).
Fig. 2.--Efectos secundarios a la segunda semana de tratamiento.
Fig. 4.--Evolución de los síntomas durante el tratamiento en los carcinomas basocelulares de cabeza y cuello.
Fig. 3.--Evolución de los síntomas durante las 8 semanas de tratamiento.
Fig. 5.--Evolución de los síntomas en los carcinomas basocelulares del tronco y extremidades.
En el subgrupo de pacientes con fototipos II/III se produjo un aumento en la puntuación del eritema durante las semanas de tratamiento cuarta (p = 0,0039), sexta (p = 0,0078) y octava (p = 0,0215) semanas, y de las erosiones en la cuarta (p = 0,0059). El 40 % de los pacientes presentaron reacciones adversas locales diferentes a las valoradas inicialmente, que consistieron en distintos grados de inflamación perilesional (17 %), impetiginización, un caso de conjuntivitis irritativa y otro de aparición de pústulas satélites. No se observaron reacciones adversas sistémicas. Dos pacientes (6,6 %) precisaron reducir la dosis a 1 aplicación/día, desde la segunda semana, como consecuencia de los efectos secundarios locales.
DISCUSION
El presente estudio está diseñado de acuerdo con los resultados obtenidos en dos trabajos previos4,5. Ambos demostraron una eficacia comparable a la obtenida mediante el tratamiento quirúrgico. En el primero4, un estudio piloto aleatorizado a doble ciego, se trataron 35 pacientes con carcinoma basocelular (7 nodulares y 28 superficiales) en tronco o extremidades (ninguno localizado en la cara), con una superficie de 0,5-2 cm2, 24 de los cuales recibieron crema de IMQ al 5 % en 5 pautas diferentes durante 10-16 semanas, y el resto placebo. Se obtuvo curación del cien por cien de las lesiones tratadas con 2 aplicaciones/día (7/7; media, 10 semanas), 1 aplicación/ día (4/4; media, 13 semanas), y 2 aplicaciones/día 3 veces a la semana (4/4; media, 14,5 semanas). Ninguno de los carcinomas basocelulares nodulares siguió esta última pauta. Todos los pacientes presentaron reacciones locales tolerables. Sólo los pacientes con una pauta diaria presentaron efectos adversos graves o sistémicos (fatiga, cefaleas u otros).
El segundo ensayo5 es un estudio multicéntrico, de fase II, dosis-respuesta, abierto, que incluía 99 pacientes con carcinoma basocelular de tipo superficial tratados con crema de IMQ al 5 % mediante 3 regímenes diferentes, durante 6 semanas. Se excluyeron los localizados en cara, región anogenital, manos y pies. Se incluyeron tumores con una superficie entre 0,5 y 2 cm2. Se demostró curación en el 87,9 % (29/30) de los carcinomas tratados con 1 aplicación/día, en el 73,3 % (29/33) de los tratados con 2 aplicaciones/día 3 veces a la semana, y en el 69,7 % (23/33) de los que recibieron 1 aplicación/día 3 veces a la semana. No se observaron diferencias estadísticas entre las 3 ramas del estudio. Todos los pacientes presentaron al menos una reacción adversa local, y el prurito y el eritema fueron las más frecuentes. El dolor y la exudación se relacionaron con la dosis recibida. Se observó correlación entre la gravedad de la erosión y la respuesta completa. Sólo en un paciente tuvo que suspenderse el tratamiento por intolerancia.
Los resultados obtenidos en nuestra serie son comparables a los observados en la literatura médica. Por primera vez hemos incluido pacientes con carcinoma basocelular de tipo nodular en el régimen de 2 aplicaciones/día, 3 veces a la semana. Destacamos la curación clínica e histológica de un carcinoma basocelular morfeiforme en cara. La revisión de los casos que no respondieron no permite determinar ningún dato predictivo: un carcinoma basocelular superficial en espalda mayor de 1,5 cm de diámetro; tres nodulares de tamaños variable en cara (frente, mejillas y nariz), y uno pigmentado en tronco de 1 cm de diámetro. Dado que un grado moderado de prurito y eritema debe considerarse esperable, cabe destacar el hecho de que 2 de los 3 carcinomas de tipo nodular no curados y el pigmentado no presentaron ningún tipo de reacción inflamatoria local. No puede afirmarse si se trata de una ausencia idiosincrásica de respuesta o de una falta de cumplimiento del tratamiento.
La mayor intensidad de los efectos secundarios observados en los carcinomas basocelulares de cabeza y cuello probablemente se relaciona con la mayor incidencia en estas localizaciones de otras lesiones premalignas (queratosis actínicas o enfermedad de Bowen), con frecuencia clínicamente inaparentes, pero que reaccionan a la crema de IMQ. En cuanto a las secuelas del tratamiento, en nuestro estudio la más común fue un área de hiper o hipopigmentación en la zona tratada, que había mejorado sustancialmente a los 5 meses de finalizar el tratamiento. En 4 de 30 pacientes (16 %) se apreciaron quistes de milium en la zona tratada. De los 25 pacientes curados, 24 se manifestaron satisfechos con el resultado estético.
De los pacientes curados, 20 (66,7 %), con un total de 26 carcinomas basocelulares (61,9 %) fueron revisados a los 3 meses de la segunda biopsia, y 8 de ellos, con 13 carcinomas (30,9 %), 3 meses después (6 meses tras la segunda biopsia). En ninguno de ellos se observó recidiva clínica. El presente estudio no contempla la resección completa de la zona tratada, lo cual es sin duda criticable al ser posible la persistencia del tumor en el área no biopsiada. Pensamos que solamente el seguimiento clínico durante un período de al menos 3 años puede certificar o no la curación de las lesiones. De momento, no existe ningún estudio con un seguimiento a largo plazo. También es posible que un tratamiento más prolongado obtenga respuestas en los carcinomas basocelulares no curados que presentaron inflamación.
Por último, deseamos señalar que se han publicado casos aislados de la eficacia del IMQ en un carcinoma basocelular superficial gigante8, en superficiales múltiples en el cuero cabelludo9, y en los del síndrome del nevo basocelular10. En estos casos el tratamiento no quirúrgico representa, sin duda, la opción terapéutica más adecuada.
CONCLUSIONES
El IMQ al 5 % en crema aplicado en pauta intermitente semanal es una alternativa terapéutica eficaz, generalmente bien tolerada, para los carcinomas basocelulares nodulares y superficiales menores de 2 cm, en la pauta de aplicación 2 veces al día, 3 veces a la semana, durante 8 semanas. El tratamiento es administrado por el propio paciente en su domicilio y, por lo tanto, es un procedimiento cómodo. Los resultados cosméticos son excelentes en la mayoría de los casos.
AGRADECIMIENTO
Este trabajo fue presentado como Póster en el XXX Congreso Nacional de Dermatología y Venereología celebrado en Madrid, en mayo de 2002 y no ha recibido financiación de ningún tipo. Los autores agradecen a los Laboratorios 3M Pharmaceuticals la colaboración prestada en el estudio estadístico.