Realizamos una revisión de los melanomas múltiples primarios que se han diagnosticado en nuestro servicio a lo largo de los últimos 32años (1987-2019) con el objetivo de tener mejor caracterizada nuestra población de pacientes con melanoma y poder ofrecerles un seguimiento más estrecho mediante la elaboración de un protocolo de seguimiento personalizado.
MetodologíaEstudio observacional, descriptivo y retrospectivo de los melanomas primarios múltiples diagnosticados en un hospital de tercer nivel entre enero de 1987 y marzo de 2019. Se recogieron las características clínicas, epidemiológicas e histológicas de los melanomas primarios, así como de los subsecuentes melanomas, y se realizó un análisis descriptivo de las mismas.
ResultadosSe incluyeron 31 pacientes (15 hombres y 16 mujeres), con una media de edad de 67años (intervalo: 36-85años). La mediana de tiempo transcurrido desde el diagnóstico del primer melanoma primario y el del segundo melanoma fue de 2años (intervalo 0-4años). La mediana del número de melanomas por paciente fue de 2 (entre 2 y 6). Del total de 31 pacientes, 25 padecieron 2 melanomas (80%), 4 de ellos 3 melanomas (13%), y 2 pacientes presentaron 5 y 6 melanomas primarios, respectivamente. Los segundos melanomas primarios o subsecuentes eran menos invasivos comparados con los primeros. La mediana de índices de Breslow fue de 1mm en los primeros (entre 0,67 y 4mm) y de 0,5mm (0,32-2,42mm) en los segundos.
ConclusionesLos melanomas subsecuentes son más finos que los primeros melanomas diagnosticados. Se encontró un aumento de la frecuencia en los dos últimos años de melanomas múltiples primarios. Estos datos resaltan la importancia del seguimiento estrecho y a largo plazo de estos pacientes.
We reviewed all cases of multiple primary melanoma diagnosed at our department over a 32-year period (1987-2019) to better characterize this subgroup of patients and develop a tailored protocol to offer them closer follow-up.
MethodsRetrospective, observational, descriptive study of patients diagnosed with multiple primary melanoma at a tertiary care hospital between January 1987 and March 2019. We collected clinical, epidemiologic, and histologic characteristics of primary and subsequent melanomas and performed a descriptive analysis.
ResultsThirty-one patients (15 men and 16 women) with a median age of 67years (range, 36-85years) were included. Second primary melanomas were diagnosed after a median of 2years (range, 0-4years). The median number of melanomas per patient was 2 (range, 2-6). Twenty-three of the 31 patients, 25 had 2 primary melanomas (80%), 4 had 3 melanomas (13%), and 2 patients each had 5 and 6 primary melanomas. Subsequent melanomas were less invasive than the initial primary melanomas. Median Breslow thickness was 1mm (range, 0.67-4mm) for the first primary melanoma and 0.5mm (range, 0.32-2.42mm) for subsequent melanomas.
ConclusionsSubsequent melanomas are thinner than primary melanomas. We observed an increase in the number of cases of multiple primary melanoma diagnosed in the last 2years of our study. Our findings highlight the importance of close, long-term follow-up of patients.
Los pacientes con un melanoma diagnosticado tienen un riesgo mayor de desarrollar nuevos melanomas, lo que se conoce con el nombre de melanoma múltiple primario (dos o más melanomas distintos que se desarrollan en un mismo paciente)1.
Las series retrospectivas señalan una frecuencia de melanoma múltiple primario del 0,2-8,6%2,3. Slingluff et al.2, en su serie de 283 pacientes, señalan que el riesgo de tener un segundo melanoma primario en un periodo de 10años es del 5%. En la serie de DiFronzo et al., con 1.482 pacientes con melanoma, el 4% fueron diagnosticados de un segundo melanoma en los 5años siguientes. Actualmente la tasa de incidencia más aceptada es del 3,4% a los 10años4.
Según las distintas series, hasta el 70% de los melanomas subsecuentes se diagnostican en los dos primeros años tras el diagnóstico del primer melanoma5. Los melanomas subsecuentes se clasifican en sincrónicos, cuando se diagnostican simultáneamente o dentro de los 3 primeros meses, o metacrónicos, cuando se diagnostican después de los 3 primeros meses del diagnóstico del inicial5. Los sincrónicos suponen el 30% de los casos2,3.
Se ha demostrado que los melanomas subsecuentes son más finos que la lesión inicial2-4,6. Un estudio reciente muestra que los hombres mayores de raza blanca tienen más riesgo de padecer melanoma múltiple primario6. El sitio más frecuente es la cabeza y el cuello, lo que sugiere un papel de la exposición solar6. Además, se ha visto que los pacientes con melanoma primario múltiple tienen un pronóstico peor que los que solo tienen un melanoma7.
Por todo lo anteriormente expuesto, nos planteamos revisar los pacientes diagnosticados de melanoma múltiple en nuestro hospital en estos 32años y caracterizar sus características clínicas e histológicas.
Material y métodosSe realizó un estudio observacional, descriptivo y retrospectivo de pacientes con melanoma múltiple primario en un hospital de tercer nivel. Se realizó un análisis del registro de melanomas y una revisión de las historias clínicas y los informes anatomopatológicos desde enero de 1987 hasta marzo de 2019.
El estudio fue revisado por el comité ético del hospital considerando que el proyecto se limita al uso secundario de información previamente obtenida en el curso de la asistencia médica, bajo la responsabilidad del mismo equipo profesional. La investigación fue realizada de acuerdo con la declaración de Helsinki.
Se identificaron 33 pacientes con melanoma múltiple primario. Se obtuvieron datos demográficos, clínicos e histológicos.
Criterios de inclusión: pacientes con melanoma primario múltiple diagnosticados en el hospital entre 1987 y 2019.
Criterios de exclusión: pacientes sin datos sobre la histología del tumor o con melanomas en los que no se tenía información del primario por regresión histológica completa. Se excluyeron los melanomas extracutáneos (mucosos y uveales).
Las variables epidemiológicas y clínicas (tabla 1) que se analizaron fueron: edad al diagnóstico, año de diagnóstico, sexo, fototipo según la clasificación de Fitzpatrick, quemaduras solares en la infancia con ampollas macroscópicas (recogido según historia clínica), antecedentes familiares de melanoma, presencia de nevus melanocíticos (escasos o múltiples >50) o atípicos, período de tiempo transcurrido entre el diagnóstico del primer melanoma y los sucesivos, antecedente de otro tipo de neoplasias no melanoma, antecedente de nevus congénito gigante o enfermedades genéticas que supongan una alteración en la reparación del ADN y la localización del tumor primario. Las lesiones se agruparon en cinco regiones anatómicas: cabeza y cuello, tórax, miembro superior, miembro inferior, mano/pie.
Variables epidemiológicas y clínicas estudiadas
| Variable | Cuantitativa/cualitativa | Descripción |
|---|---|---|
| Edad al diagnóstico | Cuantitativa | Años del paciente |
| Año de diagnóstico | Cuantitativa | Año |
| Sexo | Cualitativa | Hombre/mujer |
| Fototipo (I-VI) Fitzpatrick | Cualitativa | I-VI |
| Quemaduras solares | Cualitativa | Sí/no |
| Antecedentes familiares primer grado melanoma | Cualitativa | Sí/no |
| Presencia de nevus múltiples > 50 | Cualitativa | Sí/no |
| Tiempo entre el melanoma primario y los subsecuentes (meses) | Cuantitativa | Meses |
| Localización del melanoma primario | Cualitativa | 1: cabeza y cuello2: tórax3: miembro superior4: miembro inferior5: manos/pies |
| Antecedente de otras neoplasias | Cualitativa | Sí/no |
| Antecedentes de nevus congénito gigante o alteraciones reparación ADN | Cualitativa | Sí/no |
Las variables anatomopatológicas (tabla 2) que se analizaron fueron el espesor tumoral según el índice de Breslow, el nivel de invasión de Clark, la ulceración, el número de mitosis, el subtipo anatomo-clínico de melanoma (melanoma de extensión superficial, nodular, lentigo maligno melanoma y lentiginoso acral), la presencia histopatológica de nevus asociado y la regresión.
Variables anatomopatológicas que se recogieron
| Variable | Cuantitativa/cualitativa | Descripción |
|---|---|---|
| Breslow | Cuantitativa | mm |
| Clark | Cualitativa | I-IV |
| Ulceración | Cualitativa | Sí/no |
| Número de mitosis | Cualitativa | < 1 mitosis/mm2: No> 1 mitosis /mm2: Sí |
| Tipo de melanoma | Cualitativa | Extensión superficial: 1Melanoma nodular: 2Lentigo maligno melanoma: 3Melanoma acral: 4 |
| Nevus asociado | Cualitativa | Sí/no |
| Regresión | Cualitativa | Sí/no |
Se realiza una descripción de las características histológicas de los melanomas primarios y los subsecuentes. La descripción estadística del tiempo de seguimiento se presentó mediante la mediana e intervalo utilizando el método de Kaplan Meier.
ResultadosSe identificaron 33 pacientes con melanomas múltiples primarios en un hospital de tercer nivel de 1987 a 2019 de una población de referencia de 1.018. Se excluyeron 2pacientes debido a insuficiente información clínica e histológica (uno de ellos por imposibilidad de acceso al informe anatomopatológico del primer melanoma primario y el otro porque el diagnóstico histológico del primer melanoma fue de melanoma con regresión histológica completa y no se disponía de las características histopatológicas necesarias para su estudio).
En total se incluyeron en el análisis 31 pacientes: 16 (52%) mujeres y 15 (48%) hombres. La mediana de edad era 67años (36-85).
La mediana del tiempo transcurrido entre el diagnóstico del primer melanoma primario y el del segundo fue de 2años (rango: 0-12años). El 39% presentaron melanomas sincrónicos y el 61%, metacrónicos. Doce pacientes (39%) presentaron melanomas sincrónicos y 19 pacientes (61%), metacrónicos.
El 61% de los pacientes con melanoma múltiple presentaron el segundo melanoma durante los 3 primeros años después del primer diagnóstico.
La mediana del número de melanomas fue de 2 (rango de 2 a 6). Del total de 31 pacientes, 25 padecieron 2 melanomas (80%), 4 de ellos 3 melanomas (13%), y 2 pacientes 5 y 6 melanomas, respectivamente (tabla 3)
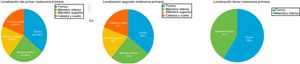
Las regiones afectadas con mayor frecuencia por los primeros melanomas primarios fueron el tronco (13/31; 42%) y los miembros inferiores (8/31; 26%) (fig. 1). En los segundos y terceros melanomas el tronco volvía a ser la localización más frecuente (11/31 [36%] y 25/31 [80%], respectivamente). En 12/31 (39%) pacientes coincidían en la misma área el primer y el segundo melanoma primario.
En cuanto a la presencia de nevus atípicos, clínicamente se encontraba especificada como presente en 10 de los 31 pacientes (32%). En 6 pacientes (19%) se recogían antecedentes familiares de melanoma, siendo solo 2 pacientes (7%) si se consideraban exclusivamente los de primer grado. Además, 20/31 (65%) de los pacientes presentaban múltiples nevus adquiridos (>50), dato recogido como antecedente en la historia clínica
Ninguno de los pacientes presentaba nevus congénitos gigantes (>20cm) ni enfermedades con déficit en la reparación del ADN.
En 5 (16%) pacientes con melanomas múltiples primarios se encontraron antecedentes de otros cánceres no cutáneos (próstata, mama, adenocarcinoma de sigma y carcinoma papilar de tiroides).
En cuanto al estudio histológico, en los primeros melanomas primarios los subtipos más habituales fueron el melanoma de extensión superficial (16/28; 58%) y el lentigo maligno melanoma (3/28; 10%). En los segundos melanomas, 17/28 (61%) presentaban un subtipo de melanoma de extensión superficial y 8/28 (29%) eran de tipo lentigo maligno. En los terceros melanomas primarios el subtipo más frecuente fue el lentigo maligno (1/3; 40%) (tabla 4).
Características histopatológicas de los melanomas múltiples primarios
| Primer melanoman = 28 | Segundo melanoman = 28 | Tercer melanoman = 3 | |
|---|---|---|---|
| In situ (%) | 39 | 58 | 60 |
| Invasivos (%) | 61 | 35 | 20 |
| Localización | 42% tronco26% miembro inferior16% miembro superior16% cabeza y cuello | 35% tronco25% miembro inferior19% cabeza y cuello19% miembro superior | 80% tronco20% cabeza y cuello |
| Variante | |||
| Espesor de Breslow (media) | 0,80 mm | 0,47 mm | 0,49 mm |
| Nivel Clark (media) | 2,3 | 1,75 | 2 |
| Índice mitótico | 23% más de 1 mitosis/mm226% menos de 1 mitosis/mm2 | 10% más de 1 mitosis/mm236% menos de 1 mitosis/mm2 | 0% más de 1 mitosis/mm240% menos de 1 mitosis/mm2 |
| Regresión | 26% sin regresión32% con regresión | 39% sin regresión32% con regresión | 44% con regresión |
| Ulceración (% con melanomas con ulceración) | 13% | 7% | 0% |
| Nevus melanocítico previo | 16% | 10% | 20% |
Los melanomas primarios subsecuentes invasivos eran menos invasivos comparados con los primeros. La mediana de índices de Breslow fue de 1mm (0,67-4mm) en los primeros y de 0,5mm (0,32-2,42mm) en los segundos (tabla 4). El 55% de los segundos melanomas primarios y el 80% de los terceros melanomas primarios presentaban un índice de Breslow menor que el primer melanoma primario. El porcentaje de melanoma in situ fue del 39% en los primeros melanomas, del 58% en los segundos melanomas y del 60% en los terceros.
La mayoría de los melanomas se desarrollaron de novo sobre piel sana. En 5/28 (16%) de los primeros melanomas primarios múltiples, en 3/28 (10%) de los segundos y en 1/3 (20%) de los terceros se identificó nevus previo (tabla 4).
Con respecto al número de mitosis, se clasificaron en dos grupos: más de una mitosis por mm2 o menos de una mitosis por mm2 (tabla 4). El 23% (6/28) de los primeros melanomas presentaban más de una mitosis por mm2, en contraposición con el 10% (3/28) de los segundos melanomas y ninguno de los terceros.
La ulceración estaba presente en 4/28 (13%) de los primeros melanomas primarios frente al 7% (2/28) de los segundos melanomas y ninguno de los terceros (tabla 4).
DiscusiónLos pacientes con un melanoma tienen un mayor riesgo de desarrollar un segundo melanoma, con una incidencia de melanoma primario múltiple que oscila entre el 0,2 y el 8,6%2,3 de los casos, siendo las tasas más aceptadas del 3,4%4.
En nuestra experiencia el desarrollo de un segundo melanoma primario es un hecho infrecuente (un 3% de los pacientes), aunque debe tenerse en cuenta.
Aunque existe controversia al respecto, se acepta que la mayoría de melanomas se desarrollan de novo y no como resultado de la malignización de nevus previos. En nuestra serie, en el 16% de los melanomas primarios se encontró un nevus asociado en el estudio anatomopatológico.
En cuanto a las características de los pacientes con melanoma múltiple primario en comparación con los que presentan un único melanoma, existe controversia en cuanto a los datos. Se ha descrito un incremento de incidencia en pacientes con un número elevado de nevus (RR: 9,8 si >100NMA), que se incrementa si estos son atípicos (RR: 3,8, p=0,001, para 1-5 nevus atípicos, y RR: 6,3, p=0,003, para 6 o más)8.
En nuestra serie, el 65% de los pacientes presentaban múltiples nevus adquiridos (>50NMA) y estaban registrados como atípicos en el 32% de nuestros pacientes, lo que va en línea con lo descrito hasta el momento, y en el 7% se recogen antecedentes de primer grado de melanoma
El 16% (5/31) de los pacientes asociaban otros cánceres no cutáneos, y sus localizaciones eran: próstata, mama, tiroides y recto (2). Ninguno de los pacientes ni sus familiares presentaba cáncer de páncreas.
En cuanto al intervalo de tiempo que se tarda en diagnosticar a un paciente con melanoma primario múltiple, en nuestra serie el 61% de los pacientes con melanoma múltiple primario presentaron el segundo melanoma durante los 3 primeros años después del diagnóstico del primer melanoma, y aproximadamente el 40% en un intervalo de 3meses después del primero. En la literatura revisada se describe que el 51-59% de los pacientes con melanoma múltiple presentan el segundo melanoma durante el primer año después del diagnóstico del primer melanoma, y aproximadamente el 30%, de uno a 3meses después del primero, por lo que se considera sincrónico9. Por lo tanto, nuestras tasas de melanoma múltiple primario sincrónico y metacrónico son similares a las descritas hasta el momento actual en la literatura2-4. En nuestra serie el periodo de tiempo más largo entre el diagnóstico del primer melanoma y el segundo fue de 12años, por lo que es importante incidir en que se debe realizar una exploración clínica completa en todas las visitas y durante un periodo >10años y no solamente en los primeros meses tras el diagnóstico del primer melanoma.
En nuestra serie la localización más frecuente fue el tronco, lo que difiere de una de las series más recientes descritas hasta ahora6, en la cual la localización más frecuente era cabeza y cuello; esto puede ser debido a los distintos hábitos de exposición solar dependiendo del área geográfica estudiada. En series con melanomas localizados en cabeza y cuello se han descrito concordancias de localización completas, lo cual puede ser explicado por la mayor influencia de las radiaciones solares en estas localizaciones6. En nuestra serie, en el 39% de los casos coincidían en la misma región el primer y el segundo melanoma primario. Esto concuerda con la hipótesis de un «efecto local de cancerización» (el campo de cancerización) cercano al lugar del primer tumor10.
La mediana de melanomas encontrada en nuestros pacientes fue de 2 (2-6), similar a la descrita en otras series10,11, aunque consideramos que el factor tiempo de seguimiento puede tener que ver con el número de melanomas, así como el hecho de que a los pacientes a los que ya se les ha extirpado un melanoma con frecuencia se les somete a extirpación de otros nevus con frecuencia displásicos y que, por la tanto, no llegan a convertirse en un segundo melanoma.
En cuanto a las características anatomopatológicas asociadas a un segundo melanoma primario, una de las más importantes es la tendencia a desarrollar un nuevo melanoma de menor grosor que el primero en las series descritas hasta el momento10,11.
Existen dos hipótesis para explicar por qué los melanomas subsecuentes son menos profundos: la primera es que la vigilancia estrecha de los pacientes lleva a la detección temprana de otro melanoma, y la segunda apoya el comportamiento biológico menos agresivo en pacientes con melanoma múltiple primario comparado con los pacientes con melanoma único12.
En nuestra serie los datos van en esta línea, ya que los segundos melanomas primarios tenían menor espesor de Breslow. El 55% de los segundos melanomas primarios y el 80% de los terceros melanomas primarios presentaban un índice de Breslow menor que el primer melanoma primario. El porcentaje de diagnóstico de melanoma in situ también se incrementa en cada uno de los melanomas primarios subsecuentes, siendo del 39% en los primeros melanomas in situ frente al 58% en los segundos melanomas y el 60% en los terceros.
Asimismo, el número de lesiones con ulceración se reducía conforme se diagnosticaban subsiguientes melanomas; no obstante, el 7% de los segundos melanomas seguían presentando ulceración.
Existen otros factores fundamentalmente genéticos que podrían contribuir al menor grosor de los melanomas subsecuentes, y se han identificado alteraciones funcionales en el gen CDKN2A (localizado en el cromosoma 9p21) que codifica para la proteína p16. Esta mutación se encuentra en el 8,3 al 15% de los pacientes con melanoma múltiple13. En nuestros pacientes con melanoma múltiple no se ha realizado estudio genético, aunque se está poniendo en marcha un proyecto conjuntamente con el servicio de oncología para llevarlo a cabo.
Recientemente se han descrito alteraciones en genes que regulan la inmunidad en línea germinal. Ferguson et al.14 estudiaron 41 variantes genéticas en 977 melanomas y encontraron diferencias estadísticamente significativas que sugerían que el estado inmunitario del paciente puede jugar un papel importante en el desarrollo de melanoma múltiple. Estos autores desarrollan la idea de que mutaciones en la línea germinal que afectan al sistema inmune pueden contribuir al desarrollo de melanoma múltiple primario, y que es importante disponer de estos biomarcadores en el seguimiento de estos pacientes, que muchas veces se ven sometidos a extirpaciones múltiples, lo cual tiene un impacto estético y emocional en el paciente. Entre los 41 alelos genéticos que estudian encuentran que el que mayor importancia tiene es el rs2071304, ya que los pacientes con melanoma que tienen esta mutación genética (lo que denominan alelo menor) tienen un 40% menos de riesgo de desarrollar un melanoma múltiple primario de forma estadísticamente significativa. El alelo menor de rs2071304 se ha correlacionado con una disminución de la expresión de SPI1, lo que haría que estos pacientes tuvieran un incremento de sensibilidad frente a los autoantígenos, lo que haría que mediante la estimulación del sistema inmune eliminaran los «micromelanomas», de modo que estos no se manifestaran clínicamente.
Un melanoma pone a los pacientes en situación de riesgo de desarrollar un segundo melanoma primario, y esto confiere un riesgo mucho mayor para el tercer melanoma; es por esto que se debe hacer un seguimiento muy estrecho y a largo plazo de estos pacientes.
Además, se ha visto también que los pacientes con más de un melanoma primario tienen peor pronóstico que los que presentan un solo melanoma7. Este dato se ha comprobado en un trabajo recientemente publicado15 en el que se estudian 56.929 pacientes y se insiste en que, debido a este peor pronóstico, las estrategias de seguimiento deben ser más estrechas en estos pacientes. Esto ha sido reproducido en series más recientes, como la publicada por Menzies et al.16. En nuestro caso no analizamos en la serie la supervivencia de nuestros pacientes, lo que puede ser interesante para futuros análisis.
Es interesante destacar el reciente artículo publicado por Pastor-Tomás et al.17, en el cual estudian los factores de riesgo de desarrollar un segundo melanoma en los pacientes que ya han tenido un melanoma. Incluyen en su estudio 1.447 pacientes y describen que el 3,8% de ellos desarrollan un segundo melanoma. Encuentran que el fototipo de piel claro, tener más de 100 nevus melanocíticos adquiridos y un elevado número de angiomas capilares se asociaban de forma significativa a un mayor riesgo de un segundo melanoma. Llama la atención este último punto, que no estaba descrito previamente y que relacionan con el daño solar asociado a susceptibilidad genética. También describen en su serie que los segundos melanomas son más finos que los primeros17.
Como limitaciones a nuestra serie hay que destacar que se trata de un estudio retrospectivo, descriptivo y con un escaso número de pacientes, así como que no se ha realizado un estudio estadístico más que descriptivo. Tampoco se ha estudiado la supervivencia de los pacientes con melanoma múltiple primario, lo cual sería interesante. Como hemos comentado anteriormente, tampoco hemos realizado estudios genéticos en estos pacientes, algo que tenemos previsto implementar en un futuro próximo por las repercusiones clínicas en nuestros pacientes.
ConclusionesAnalizamos las características clínicas e histológicas de nuestros pacientes con melanoma múltiple primario (n=31 pacientes). Los melanomas subsecuentes son más finos que los primeros diagnosticados, lo cual concuerda con las series descritas. Se encontró un aumento de la frecuencia en los dos últimos años de melanomas múltiples primarios. Estos datos resaltan la importancia del seguimiento estrecho y a largo plazo de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.