La biopsia del ganglio centinela (BGC) persigue la identificación de metástasis ganglionares subclínicas con una morbilidad mínima, una estadificación más precisa de los pacientes con melanoma, estimar el pronóstico de estos pacientes y adoptar el tratamiento más adecuado en cada caso.
ObjetivosAnalizar los resultados obtenidos con esta técnica en pacientes con melanoma cutáneo y el impacto de la misma en su supervivencia.
Material y métodosSe obtuvieron de forma retrospectiva los datos referentes a todos los pacientes a los que se les realizó esta técnica en el Hospital General Universitario Gregorio Marañón de Madrid durante 11 años (1997-2007). Se realizó un estudio epidemiológico descriptivo y un estudio analítico del impacto en la supervivencia.
ResultadosEn 42 de 238 casos (17,6 %) se encontró afectación del ganglio centinela por melanoma. El espesor tumoral y el tipo histológico nodular se asociaron a la presencia de micrometástasis ganglionares. Aunque el resultado del ganglio centinela no se asoció con una mayor supervivencia global, el tiempo libre de enfermedad fue significativamente inferior en los pacientes con ganglio centinela positivo, que además presentaron una mayor tasa de mortalidad por melanoma.
ConclusionesLa detección de micrometástasis ganglionares gracias a la BGC supone un marcador de agresividad y un importante factor pronóstico en los pacientes con melanoma. La información que nos aporta esta técnica nos permite una mejor estadificación, determinando la actitud diagnóstica y terapéutica a seguir en estos pacientes.
The aim of sentinel node biopsy (SNB) is to identify subclinical lymph node metastases using a procedure with minimal morbidity, establish more accurate staging in patients with melanoma, determine prognosis, and chose the most suitable treatment in each patient.
ObjectivesTo analyze the outcomes of SNB in patients with cutaneous melanoma, and the impact of this procedure on survival.
Material and methodsInformation was gathered retrospectively on all patients in whom this procedure was performed at Hospital General Universitario Gregorio Marañón, Madrid, Spain, over an 11-year period (1997-2007). Descriptive epidemiological analysis of the variables and survival analysis were performed.
ResultsSentinel node invasion by melanoma was present in 42 of 238 patients (17.6 %). Tumor thickness and nodular melanomas were associated with the presence of lymph node micrometastases. There were no differences in overall survival, but disease-free survival was significantly lower in patients with a positive SNB, who also had a higher melanoma-related mortality.
ConclusionsDetection of lymph node micrometastases by sentinel node biopsy is a marker of tumor aggressiveness and an important prognostic factor in melanoma patients. Information from SNB permits better staging and determines the diagnostic and therapeutic approach in these patients.
La biopsia del ganglio centinela (BGC) en el melanoma cutáneo se basa en la teoría de la diseminación linfática preferente de esta neoplasia, siendo los ganglios linfáticos regionales la localización inicial más común de las metástasis del melanoma cutáneo. En la mayoría de los casos, estas metástasis suelen estar limitadas al primer ganglio que recoge el drenaje linfático del tumor, denominado «ganglio centinela». Este concepto implica que en el caso de existir metástasis linfáticas tempranas, estas se localizarán primero en el ganglio centinela, y, por tanto, la ausencia de afectación de este puede excluir de forma casi definitiva la afectación del resto de la cadena ganglionar por el melanoma 1, lo que evita la necesidad de practicar una linfadenectomía 2.
En el diagnóstico precoz de las metástasis del melanoma, la ecografía de ultrasonidos es una técnica no invasiva de gran sensibilidad, pero incapaz de detectar micrometástasis 3. La misma limitación se encuentra en la tomografía por emisión de positrones (PET).
La BGC persigue la identificación de metástasis ganglionares subclínicas con una morbilidad mínima, lo que permite establecer una estadificación más precisa, un tratamiento adecuado y estimar el pronóstico de los pacientes con melanoma 4.
ObjetivosDesde 1997, la BGC forma parte del protocolo de actuación de la Unidad de Melanoma del Hospital General Universitario Gregorio Marañón. Esta unidad multidisciplinaria está formada por miembros de los servicios de Dermatología, Anatomía Patológica, Cirugía General, Oncología Médica, Oncología Radioterápica, Anestesiología y Medicina Nuclear.
Nuestro objetivo es mostrar los resultados obtenidos tras una experiencia de 11 años (1997–2007), reflejándolos de forma descriptiva y analizando el impacto de esta técnica en la supervivencia de los pacientes, así como su valor como factor pronóstico, y la influencia de otras variables en su resultado.
Material y métodosSe incluyeron los datos referentes a todos los pacientes diagnosticados de melanoma cutáneo mediante informe histopatológico, a los que se les realizó esta técnica durante el periodo comprendido entre el 1 de enero de 1997 y el 31 de diciembre de 2007.
Los criterios de selección de los pacientes para la realización de esta técnica han sido motivo de controversia 3. Aunque el factor determinante para su realización es el espesor tumoral igual o superior a 1 mm, un porcentaje importante (6 %) de pacientes con melanomas de menos de 1 mm de espesor han demostrado tener metástasis subclínicas al efectuarles la BGC 4. Por este motivo, además de incluir a pacientes con melanomas de 1 mm o más de espesor y sin evidencias de enfermedad metastásica en la exploración física, también consideramos de forma individual la realización de esta técnica en melanomas de espesor inferior a 1 mm que presentasen ulceración histológica, nivel de Clark IV o V, o signos histológicos de regresión.
Técnica de la biopsia del ganglio centinelaUna vez ingresado el paciente, el día previo al acto quirúrgico, que comprende la ampliación de márgenes o extirpación completa del tumor y la realización de la BGC durante la misma intervención, se realiza un estudio del drenaje linfático mediante una linfografía isotópica. Para ello, se inyecta una dosis variable (20–30 MBq) de Tc99-nanocoloide por vía intradérmica en el tumor o piel pericicatricial de la biopsia escisional. La distribución de este isótopo radiactivo se registra fotográficamente entre 1 y 2 horas después de su administración mediante una cámara gamma de alta resolución. El ganglio centinela se localiza como el correspondiente al primer lugar de acumulación persistente del marcador, y se marca en la piel señalando sus coordenadas en dos planos con un rotulador indeleble, pudiendo existir más de un ganglio centinela en función de las cadenas linfáticas de drenaje predominantes.
La utilización de una solución de metileno teñida de azul como marcador preoperatorio del ganglio centinela se realizó durante los primeros años de experiencia de esta técnica. Sin embargo, la posterior utilización del nanocoloide radiactivo ofrecía varias ventajas técnicas con respecto al azul de metileno, como la detección del ganglio centinela sin necesidad de identificar visualmente la coloración azul del ganglio, así como poder orientar intraoperatoriamente su localización y dirección mediante la sonda-contador de radiación gamma (Navigator®, Tyco Healthcare RMD, Watertown, MA, USA). Esta sonda también permite la identificación de un segundo o tercer ganglio centinela mucho mejor que con la utilización de azul de metileno. Otro inconveniente del empleo del colorante son los tatuajes permanentes que deja en la piel de los pacientes tras su inyección. Aun así, en algunos pacientes se realizó la BGC utilizando ambos métodos de identificación ganglionar para disminuir la tasa de falsos negativos.
Tras efectuar una anestesia general o regional del paciente, se procede al abordaje terapéutico del ganglio centinela, localizándolo de forma intraoperatoria con una sonda-contador de radiación gamma. Aquellos ganglios extirpados con una radiación 10 veces superior a la del lecho quirúrgico se consideran «ganglios centinela».
Dichos ganglios son fijados con formaldehído al 5 % y embebidos posteriormente en parafina para ser analizados mediante un estudio histopatológico rutinario con hematoxilina-eosina, e inmunohistoquímico con S-100, HMB-45 y Melan-A. Previamente los ganglios extirpados son seccionados siguiendo su eje mayor en al menos 4 bloques, cada uno de los cuales, una vez fijados en parafina, es seccionado a intervalos de 5 μm.
Análisis estadísticoSe realizó un estudio descriptivo de las variables relacionadas con la BGC, así como su relación con las características epidemiológicas (edad, sexo, año de diagnóstico), clínico-histológicas (localización, espesor tumoral, ulceración, tipo histológico) y evolutivas (estado vital, supervivencia global, desarrollo de metástasis, etc.) de cada paciente. Los valores de p inferiores a 0,05 se consideraron como significativos.
Además, se efectuó un estudio del impacto en la supervivencia del resultado de esta técnica mediante el método de Kaplan-Meier; y un análisis univariante y multivariante según la prueba de riesgos proporcionales de Cox.
El estudio descriptivo y analítico de estos datos fue realizado mediante el programa estadístico SPSS versión 12.0 (SPSS Inc, Chicago, IL, USA).
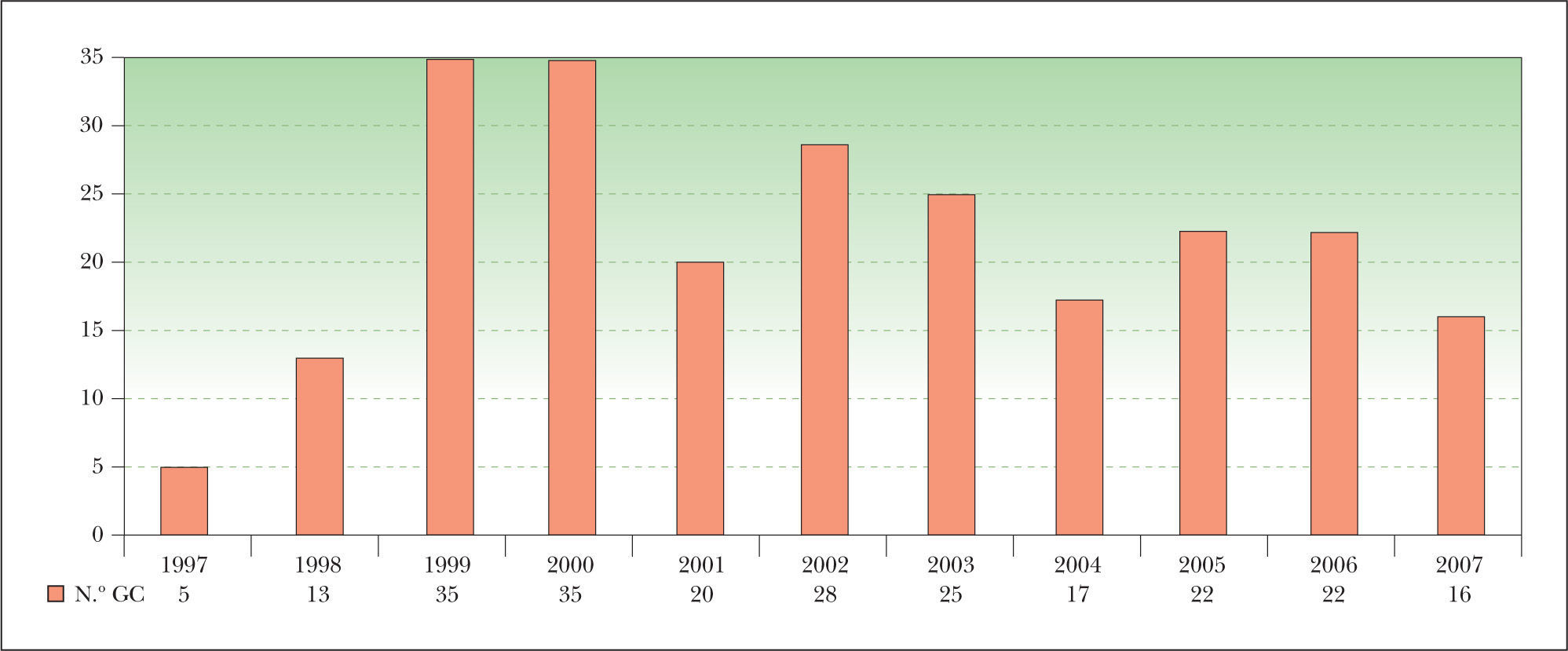
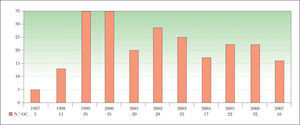
ResultadosEstudio descriptivoDurante el periodo de estudio, esta técnica fue realizada a 238 pacientes. En la figura 1 se muestra la distribución anual del número de pacientes a los se les realizó la BGC.
La edad media de estos pacientes fue de 53,54 años. La proporción por sexos fue de 1,07/1 a favor de los varones. En 32 casos (13,4 %) el melanoma tenía un espesor inferior a 1 mm. En 60 casos (25,2 %) existía ulceración histológica.
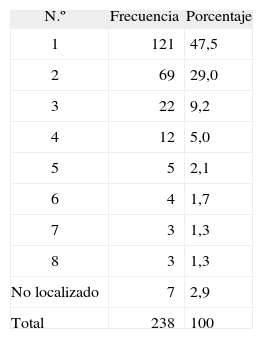
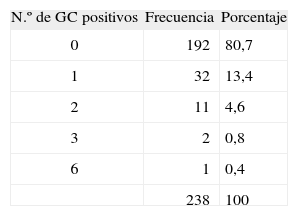
El número de ganglios analizados en cada paciente se muestra en la tabla 1. En la mayoría de los casos se detectó un solo ganglio centinela (47,5 %). En 7 casos (2,9 %) no se pudo localizar el ganglio centinela. El 88,7 % de los pacientes tenía localizados los ganglios centinela en una única cadena ganglionar.
En 42 pacientes (17,6 %) el ganglio o ganglios analizados mostraron la presencia de células neoplásicas en el examen histopatológico convencional y/o mediante técnicas inmuno-histoquímicas. En la tabla 2 se muestra el número de ganglios centinela con metástasis de melanoma por paciente.
Se realizó una linfadenectomía regional en 40 de los 42 pacientes con BGC positiva. Solamente en 11 casos (27,9 %) se encontraron ganglios colonizados por el melanoma.
Entre los pacientes con BGC negativa (189 casos), 13 (6,9 %) presentaron posteriormente metástasis ganglionares locorregionales.
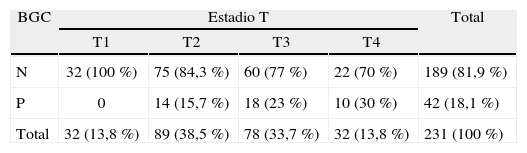
Factores predictores en el resultado del ganglio centinelaEl espesor tumoral, según los intervalos determinados por el estadio T, se asoció de forma significativa con la presencia de melanoma en el ganglio centinela (p = 0,02) (tabla 3).
Resultado de la biopsia del ganglio centinela en función del espesor en mm del melanoma
| BGC | Estadio T | Total | |||
| T1 | T2 | T3 | T4 | ||
| N | 32 (100 %) | 75 (84,3 %) | 60 (77 %) | 22 (70 %) | 189 (81,9 %) |
| P | 0 | 14 (15,7 %) | 18 (23 %) | 10 (30 %) | 42 (18,1 %) |
| Total | 32 (13,8 %) | 89 (38,5 %) | 78 (33,7 %) | 32 (13,8 %) | 231 (100 %) |
BGC: biopsia del ganglio centinela; N: negativo; P: positivo.
En esta tabla se han excluido los 7 casos en los que no se pudo identificar el ganglio centinela.
Respecto al tipo histológico de melanoma cutáneo primario, en 19 de los 75 (25 %) melanomas de tipo nodular el ganglio centinela fue positivo, mientras que solamente 15 de 113 (13,3 %) melanomas de extensión superficial tuvieron afectación del ganglio centinela (p = 0,04).
Ninguno de los otros factores epidemiológicos, clínicos o histológicos analizados (edad, sexo, localización, ulceración, etc.) se asoció de forma significativa con el resultado de esta prueba.
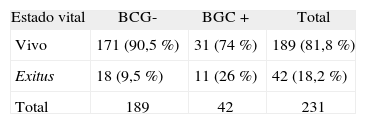
Análisis de la supervivenciaExisten diferencias notables en el estado vital de los pacientes al final del estudio en función del resultado de la BGC (tabla 4). El 90 % de los pacientes con ganglio centinela negativo continuaban vivos al final del estudio, habiendo fallecido solamente el 9,5 % a causa del melanoma. En cambio, la proporción de muertes por melanoma entre los pacientes con ganglio centinela positivo fue del 26 %. Estas diferencias, sin embargo, no fueron estadísticamente significativas (p = 0,07).
Estado vital al final del estudio en función del resultado de la biopsia del ganglio centinela
| Estado vital | BCG- | BGC+ | Total |
| Vivo | 171 (90,5 %) | 31 (74 %) | 189 (81,8 %) |
| Exitus | 18 (9,5 %) | 11 (26 %) | 42 (18,2 %) |
| Total | 189 | 42 | 231 |
BGC: biopsia del ganglio centinela.
En esta tabla se han excluido los 7 casos en los que no se pudo identificar el ganglio centinela.
El número de ganglios centinelas analizados en un mismo paciente no fue un factor que afectase a la supervivencia global (SG). El número de ganglios centinelas con metástasis por paciente se asoció con una SG inferior, pero tampoco fue un dato estadísticamente significativo.
El análisis univariante de la regresión de Cox para la SG mostró un riesgo de muerte 4 veces superior en los pacientes con BGC positiva (p < 0,05). En el análisis multivariante, en cambio, esta variable no se mostró como un factor independiente del resto de los factores pronósticos.
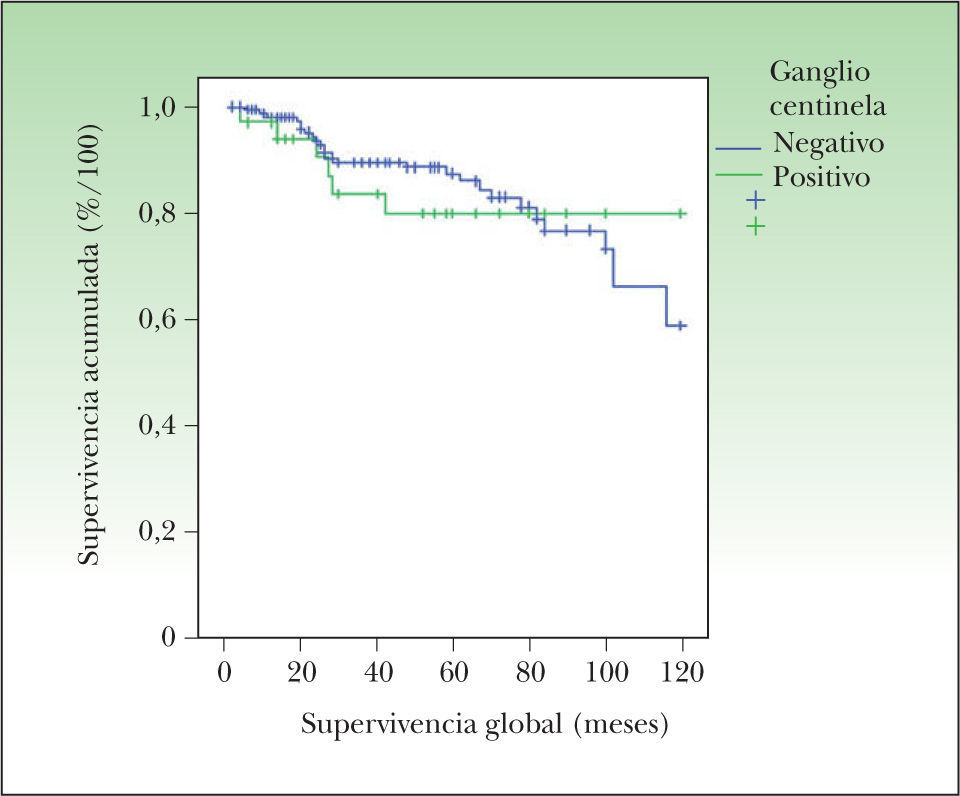
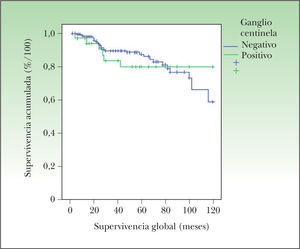
La SG según el método de Kaplan-Meier, ajustada por el resultado del ganglio centinela, no mostró diferencias estadísticamente significativas. En la figura 2 se muestra cómo la SG es algo inferior en los pacientes con BGC positiva, especialmente durante los primeros 5 años desde el diagnóstico, pero posteriormente esta diferencia desaparece. Existen dos factores que deben tenerse en cuenta a la hora de interpretar este gráfico:
- 1.
El seguimiento de los pacientes con ganglio centinela negativo fue menor que en los pacientes con ganglio centinela positivo, lo que disminuye falsamente la proporción de pacientes vivos con ganglio centinela negativo al final del estudio.
- 2.
Existe una proporción de pacientes con ganglio centinela negativo que desarrolló metástasis a distancia de forma muy tardía, probablemente por vía hemática, lo que también disminuye la tasa de supervivencia de los pacientes con ganglio centinela negativo a largo plazo.
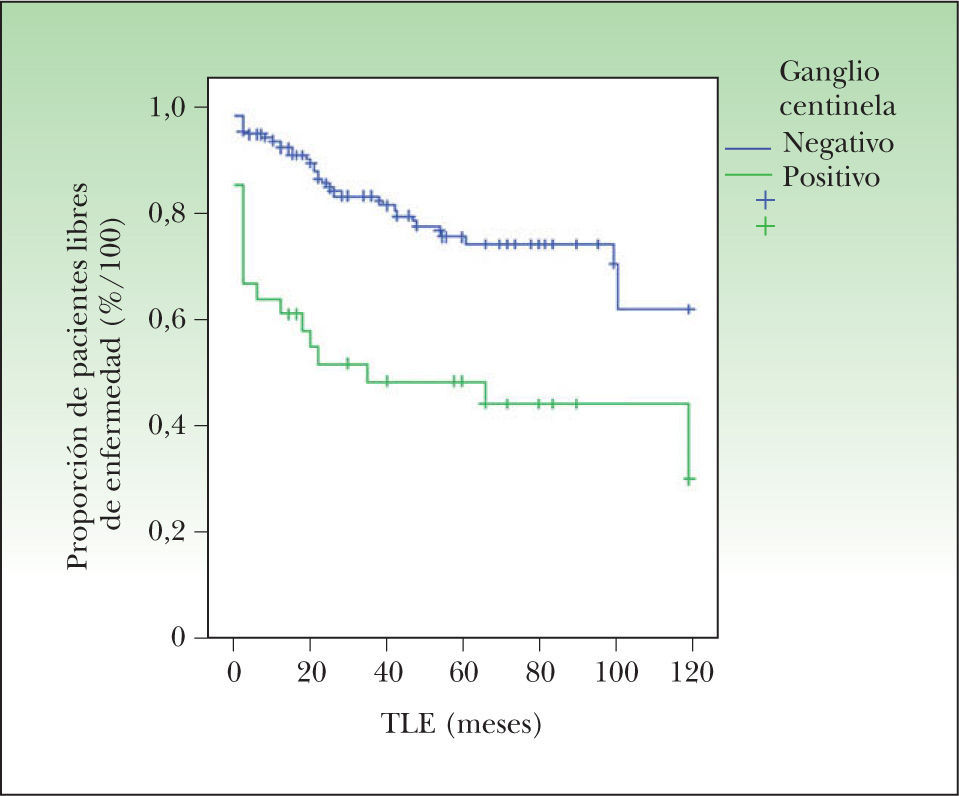
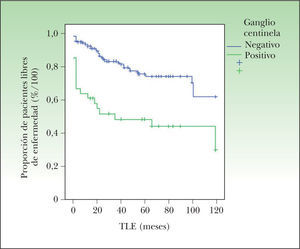
El tiempo libre de enfermedad sí fue significativamente superior en los pacientes con ganglio centinela negativo (92 ± 2 meses frente a 58 ± 10 meses; p < 0,001) (fig. 3).
DiscusiónLa presencia de metástasis linfáticas ganglionares es uno de los factores pronósticos más importantes en los pacientes con melanoma cutáneo. De hecho, la tasa de supervivencia a los 5 años del diagnóstico es un 40 % inferior en pacientes con metástasis ganglionares 5. La ausencia de células tumorales en el ganglio centinela excluye la presencia de metástasis en el resto de los ganglios regionales salvo por error en la detección 5–8. Su utilización en Oncología para la estadificación de tumores es cada vez más amplia, no solamente en otros tumores cutáneos no melanomas, sino también en diversas neoplasias ginecológicas, digestivas o pulmonares 9–14.
Existen al menos 4 motivos principales que aconsejan la realización de esta técnica:
- 1.
Proporcionar información del estado ganglionar subclínico con una mínima morbilidad. Esta información permite la estadificación correcta del paciente y nos ayuda a decidir nuestra actitud diagnóstico-terapéutica.
- 2.
Identificar a los pacientes que se beneficiarían de la realización de una linfadenectomía terapéutica.
- 3.
Identificar a los pacientes candidatos a tratamiento adyuvante (interferón alfa).
- 4.
Agrupar a estos pacientes en subgrupos más homogéneos respecto a su pronóstico a la hora de participar en ensayos clínicos.
Sin embargo, varios autores desaconsejan la realización de esta técnica, basándose en el carácter impredecible de las metástasis en el melanoma 15. La BGC permite una detección precoz de las metástasis linfáticas, pero no influiría en el comportamiento de las células de melanoma diseminadas por vía hemática, que atravesarían tan rápidamente el sistema linfático que podrían no ser detectadas en la BGC, sin por eso implicar que no existan células metastásicas a distancia 15,16. Por tanto, el número de muertes debido a las metástasis a distancia no se alteraría por esta técnica. Para estos autores, el compromiso ganglionar resultante de una BGC positiva sería un marcador de agresividad tumoral, no resultando fiable como marcador de enfermedad diseminada.
No obstante, la importancia que los datos obtenidos por la BGC tiene para establecer la posibilidad de diseminación del melanoma parece incuestionable 16,17. Si es positiva, nos encontraremos con la certeza de que el tumor ya se ha diseminado por vía linfática, y probablemente por vía hemática en algunos pacientes.
Por otro lado, la morbilidad de esta técnica es prácticamente nula, frente al alto porcentaje de complicaciones posoperatorias asociadas a la linfadenectomía selectiva (hasta un 39 %) 18, en muchos casos permanentes, como el linfedema crónico 19. Su mayor precisión frente a la linfadenectomía a la hora de determinar el ganglio centinela en zonas de drenaje linfático aberrante o discordante, como en melanomas de tronco y cabeza y cuello, también favorece el diagnóstico precoz de las micrometástasis ganglionares con una morbilidad inferior 20. Sin embargo, su utilidad en la práctica clínica rutinaria y sus indicaciones siguen siendo motivo de controversia 21–24.
La proporción total de pacientes con micrometástasis ganglionares en nuestro trabajo (17,6 %) fue similar a la obtenida por otros autores 3,16,25. Ninguna de las variables estudiadas como posible factor determinante del resultado de esta prueba, excepto el espesor tumoral y el tipo histológico, se asoció de forma estadísticamente significativa a una mayor proporción de micrometástasis.
En cuanto al papel de la BGC como factor pronóstico en los pacientes con melanoma, existen trabajos recientes con resultados contradictorios en cuanto a su impacto en la SG. Mientras algunos autores obtienen una SG superior en aquellos pacientes con BGC negativa 3,25, en otros trabajos esta diferencia no es significativa 15,16. Sin embargo, todos coinciden en señalar el importante factor de mal pronóstico que otorga la presencia de micrometástasis ganglionares.
Los resultados obtenidos en nuestra serie concuerdan con ambas posturas. La tasa de mortalidad fue significativamente superior en los pacientes con ganglio centinela positivo, pero los estudios de SG a largo plazo no permiten demostrar diferencias entre ambos grupos. El tiempo libre de enfermedad fue significativamente inferior en los pacientes con ganglio centinela positivo.
En conclusión, la detección de micrometástasis ganglionares gracias a la BGC es un marcador de agresividad y un factor pronóstico en los pacientes con melanoma. La información que nos aporta esta técnica nos permite una mejor estadificación, determinando la actitud diagnóstica y terapéutica a seguir en estos pacientes.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.