La molécula diana de la rapamicina en mamíferos es una cinasa perteneciente a la familia de fosfatidil-3-inositol que está involucrada en la regulación de diferentes procesos relacionados con el crecimiento y diferenciación celular, la angiogénesis y la modulación de la respuesta inflamatoria. En los últimos años hemos presenciado un profundo avance en el conocimiento de las bases moleculares de la vía de señalización de la molécula diana de la rapamicina en mamíferos y su implicación en multitud de enfermedades genéticas, inflamatorias o tumorales. El desarrollo de moléculas inhibidoras de esta vía ha propiciado una nueva posibilidad de abordaje terapéutico que ha permitido una mejora sustancial en muchas de estas enfermedades. En este artículo revisamos las implicaciones de la vía de la molécula diana de la rapamicina en mamíferos en las diferentes dermatosis con las que se ha relacionado, sus aplicaciones farmacológicas y las futuras direcciones que están tomando las diferentes líneas de investigación.
The member of the phosphatidylinositol 3-kinase family, mammalian target of rapamycin, is involved in modulating inflammatory response and regulating cellular processes associated with growth, differentiation, and angiogenesis. Recent years have seen major advances in our understanding of the mammalian target of rapamycin signaling pathway and the implication of this pathway in multiple genetic and inflammatory diseases and tumors. The development of the mammalian target of rapamycin inhibitors has given rise to new treatment approaches that have led to substantially improved outcomes in many diseases. In this article, we review the role of the mammalian target of rapamycin signaling pathway in the different skin diseases with which it has been associated, examine the therapeutic applications of drugs targeting this pathway, and provide an overview of current trends and future directions in research.
La molécula diana de la rapamicina en mamíferos (mTOR) es una serina/treonina cinasa que regula la vía de señalización molecular del fosfatidilinositol-3-cinasa (PI3K)/Akt. En 1965, una expedición canadiense a la isla de Pascua (Rapa Nui) aisló en muestras del suelo una bacteria que se denominó Streptomyces hygroscopicus. Se observó que uno de los productos de la fermentación producida por esta bacteria tenía propiedades antifúngicas, lo que llevó al desarrollo de la rapamicina (también denominada sirolimus). Posteriormente, esta molécula ha mostrado una potente actividad inmunosupresora, antiproliferativa y antiangiogénica a través de la inhibición de esta vía mTOR. La investigación sobre las vías moleculares implicadas en la regulación de mTOR ha avanzado considerablemente en las últimas décadas. Esto ha permitido una mejor comprensión de su fisiopatología y el desarrollo de nuevos fármacos inhibidores de mTOR con diferentes indicaciones terapéuticas.
El objetivo de este artículo es revisar el impacto de la vía de mTOR en la fisiopatología de las diferentes dermatosis con las que se ha relacionado, así como la seguridad y eficacia de los fármacos inhibitorios de esta vía que se encuentran disponibles en la actualidad o en fase de desarrollo.
Bases moleculares de la vía de mTORLa vía de mTOR es una vía de señalización molecular básica en la regulación del metabolismo, la proliferación y la diferenciación celular, así como en la modulación del sistema inmune y los mecanismos de autofagia1.
mTOR es una proteína incluida en la familia de la PI3K-cinasa que está formada por 5 dominios proteicos con diferentes funciones, entre las que destacan la unión a otras proteínas para formar complejos y su actividad cinasa. En 2002, Kim et al. descubrieron que mTOR formaba 2 complejos multiproteicos bien diferenciados tanto en su composición como en sus funciones de señalización molecular: los complejos de la molécula diana de la rapamicina en mamíferos-1 (mTORC1) y 2 (mTORC2)2.
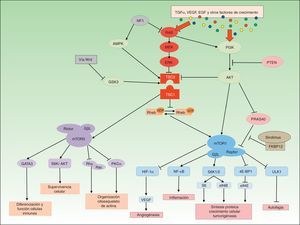
mTOR responde a diferentes tipos de señales, entre las que se incluyen factores de crecimiento, citocinas, mitógenos, insulina, aminoácidos y estrés celular. Estos mediadores producen una activación de la vía PI3K/Akt que lleva a la fosforilación de la proteína tuberina (TSC2), que se encuentra unida a la hamartina (TSC1) formando el complejo TSC1/TSC2. Esta fosforilación produce la rotura del complejo hamartina-tuberina, que deja de inhibir el paso de Rheb-GDP a Rheb-GTP y tiene como consecuencia la activación de mTORC1. La vía MAPK/ERK también activa mTORC1 a través de la disociación del complejo TSC1/TSC2. Otros factores que regulan a la baja esta vía son AMPK, PRAS40, HIF-1 o la vía Wnt a través de GSK3 (fig. 1).
La activación de mTORC1 tiene diferentes consecuencias en la homeostasis celular, siendo la principal su implicación en la regulación del crecimiento y proliferación celular. mTORC1 promueve la síntesis proteica, la biogénesis ribosomal, la transcripción de ARNm y la síntesis lipídica y de nucleótidos a través de diversos mediadores ribosomales como S6K y 4E-BP13. mTORC1 también interviene en la regulación de la autofagia, proceso de autodegradación de componentes celulares cuyo objetivo es mantener la homeostasis en condiciones normales o de estrés. mTORC1 inhibe a Ulk1, lo que lleva a una activación de los mecanismos de autofagia para obtener energía y eliminar orgánulos dañados4. La inhibición prolongada de estos mecanismos autofágicos se ha relacionado con el desarrollo de enfermedades neurodegenerativas, epilepsia y autismo por la acumulación intracelular de agregados proteicos. La vía de mTOR desempeña un papel fundamental en la regulación tanto del sistema inmune innato como del adquirido. mTORC1 y mTORC2 controlan la diferenciación, la maduración y la función de las células presentadoras de antígenos y de los linfocitos B y T a través del factor de transcripción NF-kB y GATA3, respectivamente, aunque se desconoce el mecanismo de acción concreto por el cual ambos complejos modulan el sistema inmune5. La actividad angiogénica que desempeña mTOR la realiza fundamentalmente a través de la traslación y la activación de HIF-1, molécula relacionada con la expresión de VEGF en situaciones de hipoxia celular y que mantiene a mTORC1 inactivo6. Aunque el conocimiento sobre las funciones moleculares del mTORC2 es menor, se ha relacionado con procesos de regulación de la supervivencia celular y la organización del citoesqueleto de actina a través de la vía Rho/rac.
La hiperactivación de esta vía de mTOR se ha relacionado con diferentes trastornos genéticos y enfermedades neurodegenerativas, metabólicas e inmunomediadas. Además, se ha involucrado en procesos de proliferación descontrolada, transformación maligna y quimiorresistencia en diferentes tipos de cáncer.
Fármacos inhibidores de mTOREl conocimiento y profundización en la vía de mTOR ha propiciado el diseño farmacológico de agentes dirigidos contra esta cascada de señalización molecular. Sirolimus fue el primer fármaco perteneciente a los inhibidores de mTOR (mTORi) que fue comercializado como agente inmunosupresor en pacientes trasplantados. Posteriormente se han desarrollado otros fármacos derivados, como everolimus y temsirolimus, que han añadido nuevas indicaciones en diferentes tipos de cáncer avanzado debido a su acción antiproliferativa (tabla 1).
Fármacos inhibidores de mTOR aprobados en la actualidad por la European Medicines Agency
| Fármaco | Aprobación EMA | Indicaciones | Vía de administración | Efectos adversos muy frecuentes (>10%) | Efectos adversos cutáneos |
|---|---|---|---|---|---|
| Sirolimus | Rapamune® (2001) | Profilaxis del rechazo en trasplante renal | Oral | Edema, cefalea, fiebre, HTA, TGI, anemia, trombocitopenia, hiperlipidemia, artralgias, diabetes, infecciones | (>10%): EPP; (<10%): alteración de la cicatrización, estomatitis, exantema, cáncer cutáneoa; (<0,1%): linfedema |
| Everolimus | Afinitor® (2009) | Cáncer de mama avanzado, CCR avanzado, tumores neuroendocrinos de origen pancreático | Oral | Infecciones, anemia, anorexia, hiperglucemia, hiperlipidemia, cefalea, neumonitis, epistaxis, TGI | (>10%): exantema, prurito, estomatitis; (<10%): EPP, xerosis, alteración ungueal, EDPP; (<0,1%): angioedema |
| Certican® (2003) | Profilaxis del rechazo en trasplante renal, cardiaco y hepático | Oral | Infecciones respiratorias, ITU, leucopenia, trombocitopenia, anemia, hiperlipidemia, diabetes, insomnio, cefalea, derrame pericárdico y pleural, HTA, disnea, TGI, edema | (<10%): EPP, exantema, estomatitis, cáncer cutáneo, angioedema, alteración de la cicatrización | |
| Votubia® (2011) | Angiomiolipomas renales asociados a TSC, SEGA asociado a TSC | Oral | Infecciones TRS, hiperlipidemia, amenorrea | (>10%): EPP, estomatitis; (<10%): exantema, xerosis, prurito, alopecia; (<0,1%): angioedema | |
| Temsirolimus | Torisel® (2007) | CCR avanzado, LCM (segunda línea) | Intravenoso | Anemia, trombocitopenia, leucopenia, TGI, edema, astenia, epistaxis, hiperglucemia, hiperlipidemia, infecciones, neumonía, disnea | (>10%): exantema, prurito, xerosis, estomatitis; (<10%): dermatitis, alteraciones ungueales, EPP, púrpura |
| Ridaforolimus | En estudio | Carcinoma endometrial avanzado, sarcomas metastásicos | Oral, intravenoso | Infecciones, fatiga, trombocitopenia, TGI, anemia, hiperlipidemia, cefalea, anorexia, disnea, neutropenia | (>10%): estomatitis, exantema |
CCR: carcinoma de células renales; EDPP: eritrodisestesia palmoplantar; EMA: European Medicines Agency; EPP: erupción papulopustulosa; HTA: hipertensión arterial; ITU: infecciones del tracto urinario; LCM: linfoma de células del manto; SEGA: astrocitoma subependimario de células gigantes; TGI: trastornos gastrointestinales; TRS: tracto respiratorio superior; TSC: complejo de la esclerosis tuberosa.
La asociación del uso de sirolimus con la aparición de cáncer cutáneo que aparece en la ficha técnica del fármaco puede deberse a un sesgo derivado de los ensayos pivotales que sirvieron para su aprobación, en los que el fármaco se asoció a ciclosporina y corticosteroides en comparación con placebo para valorar la eficacia y la seguridad en la prevención del rechazo del injerto. Esta aparición de carcinomas en determinados sujetos del grupo de exposición se podría deber a la acción carcinogénica de la ciclosporina fundamentalmente, como han puesto de manifiesto posteriores estudios en los que el uso de sirolimus en monoterapia no solo no ha mostrado promover la aparición de carcinomas cutáneos, sino que tiene un efecto protector frente a la aparición de estos58.
Fuente: Datos obtenidos de las fichas técnicas disponibles en http://www.ema.europa.eu
El mecanismo de acción de los mTORi se fundamenta en la inhibición de la actividad cinasa de mTOR a partir de la unión con la inmunofilina FKBP12. Esta inhibición producida por el complejo sirolimus/FKBP12 bloquea la activación de la síntesis proteica y provoca una detención en la fase G1 del ciclo celular. El resultado es una acción antitumoral (gracias a la activación de la apoptosis celular, la reducción de la expresión del VEGF y la inhibición de la migración y la invasión celular) e inmunomoduladora (consecuencia de la supresión de la activación y la proliferación de los linfocitos T y la disminución de la producción de anticuerpos).
La metabolización de sirolimus y el resto de los mTORi se realiza por mediación del citocromo 3A4, condicionante farmacocinético que hay que tener en cuenta por los múltiples fármacos que frecuentemente se emplean en la práctica clínica habitual dermatológica, y que van a interaccionar con los mTORi tanto inhibiendo su actividad (antifúngicos, macrólidos, ciclosporina, imatinib) como aumentándola (rifampicina, dexametasona).
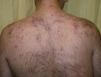
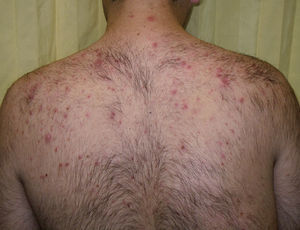
Los mTORi producen un amplio espectro de efectos adversos según el agente utilizado, la dosis y las enfermedades de base de los pacientes. De forma general podemos encontrar una mayor predisposición a infecciones, trastornos gastrointestinales, hematológicos y metabólicos (tabla 1). La toxicidad cutánea es un fenómeno que encontramos con frecuencia7. Las alteraciones dermatológicas más habituales son la estomatitis, los exantemas (fig. 2) y las alteraciones ungueales (tabla 2).
Erupción papulopustulosa en paciente con tratamiento con everolimus por astrocitoma subependimario de células gigantes asociado a esclerosis tuberosa. Esta erupción se asemeja clínicamente a la desarrollada con inhibidores del factor de crecimiento epidérmico. Se caracteriza por la aparición, 2-4 semanas tras el inicio del tratamiento, de pápulas y pústulas centrofoliculares, monomorfas, de prurito variable, sin comedones ni quistes, que asientan preferentemente en el tronco.
Efectos adversos cutáneos de los fármacos inhibidores de la vía de mTOR
| Toxicidad cutánea (frecuencia) | Características clínicas | |
|---|---|---|
| Frecuentes (>10%) | Estomatitis (25-44%) | Aftas superficiales Diagnóstico diferencial: estomatitis por quimioterapia (úlceras con pseudomembranas) |
| Exantemas (27%) | Morbiliformes Eccematosos Papulopustulosos | |
| Alteraciones ungueales (5-46%) | Paroniquias (+frecuente) Onicólisis Fragilidad ungueal Coloración amarillenta Lesiones granuloma piogénico-like Distrofia de las 20 uñas | |
| Poco frecuentes (<10%) | Alteración en la cicatrización Edema Prurito Xerosis Alopecia Hipertricosis Vasculitis leucocitoclástica |
Las propiedades antiproliferativas, inmunomoduladoras y antiangiogénicas de los mTORi han impulsado su uso fuera de indicación en multitud de enfermedades dermatológicas de origen genético (tabla 3), inflamatorio o tumoral.
Estudios sobre el uso de fármacos inhibidores de la vía de mTOR en trastornos genéticos asociados a manifestaciones cutáneas
| Genodermatosis | Diana molecular | Manifestaciones dermatológicas más frecuentes | Uso de mTORi | Estudios (año) |
|---|---|---|---|---|
| Complejo esclerosis tuberosa | TSC1, TSC2 | Máculas hipomelanóticas Angiofibromas faciales Fibromas periungueales Nevus del tejido conectivo | Everolimus oral y tópico, sirolimus oral y tópico | Wataya-Kaneda (2011, 2012, 201519), Salido et al.16 (2012), Foster et al.14 (2012), Koenig et al.15 (2012), etc. |
| Rasopatías | ||||
| Neurofibromatosis 1 | NF1 | MCL, efélides axilares e inguinales, neurofibromas, xantogranulomas | Sirolimus oral y tópico, everolimus oral | Weiss et al.23 (2015), Koenig (en ensayo) |
| Síndromes de poliposis hamartomatosas | ||||
| Síndrome de Peutz-Jeghers | STK11 (LKB1) | Lentiginosis mucocutánea | Everolimus oral | Klumpen et al.28 (2011) |
| Síndrome de poliposis juvenil | SMAD4, BMPR1A | Telangiectasia hemorrágica hereditaria (SMAD4) | Sirolimus oral | Skaro et al.29 (2006) |
| PHTS | ||||
| Síndrome de Cowden Síndrome de Lhermitte-Duclos | PTEN | Triquilemomas, fibromas, queratosis acrales, hemangiomas, MCL, lipomas | Sirolimus oral | Rajan (en ensayo) |
| Síndrome de Bannayan-Riley-Ruvalcaba | Lipomatosis Máculas pigmentadas en glande | |||
| Síndrome de Proteus Síndrome Proteus-like | Nevus del tejido conectivo, lipomatosis, malformaciones vasculares, nevus epidérmicos | Sirolimus oral | Marsh (2008) | |
| Síndrome Muir-Torre | MSH2, MLH1 (no relacionadas) | Tumores sebáceos, queratoacantomas, CBC diferenciación sebácea | Sirolimus oral | Levi (2007), Griffard (2011) |
| Paquioniquia congénita | K6a, K6b, K6c, K16, K17 | Queratodermia palmoplantar, hiperqueratosis subungueal, quistes epidérmicos, leucoqueratosis oral | Sirolimus tópico | Teng (en ensayo) |
| Síndrome de Birt-Hogg-Dubé | FLCN | Tricofoliculomas, tricodiscomas, fibromas | Sirolimus tópico | Gijezen et al.24 (2014) |
| Fibromas discoides múltiples familiares | No descritas | Fibromas discoides | Sirolimus tópico | Wee et al.25 (2013) |
CBC: carcinoma basocelular; MCL: máculas café con leche; mTORi: fármacos inhibidores de mTOR; PHTS: síndrome tumoral hamartomatoso asociado a PTEN.
El complejo de la esclerosis tuberosa (TSC) es una genodermatosis de herencia autosómica dominante caracterizada por la formación multisistémica de tumoraciones hamartomatosas. La patogenia de esta enfermedad se debe a mutaciones en los genes TSC1 y TSC2, que van a producir una activación constitutiva de mTORC1. Esta estimulación se traduce en una proliferación y diferenciación celular descontrolada cuya consecuencia son los hamartomas que aparecen a distintos niveles (cutáneos, cerebrales, renales, etc.) y que van a causar la clínica característica de estos pacientes. La implicación directa de la vía de mTOR en la patogenia de esta enfermedad ha hecho que diferentes mTORi hayan sido utilizados para paliar sus manifestaciones cutáneas y sistémicas. Los buenos resultados del uso oral de everolimus en el tratamiento de astrocitomas subependimarios de células gigantes8 y angiomiolipomas renales9 han permitido su aprobación en ficha técnica para estas indicaciones. Recientes estudios han demostrado también una buena eficacia y perfil de seguridad en el tratamiento de la linfangioleiomiomatosis10, indicación recientemente aprobada para sirolimus por la FDA11.
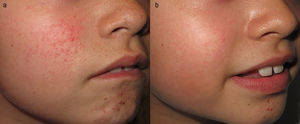
Dentro de las múltiples manifestaciones cutáneas del TSC, las máculas hipomelanóticas y los angiofibromas faciales (AF) son las más frecuentes. Clásicamente, el tratamiento de los AF se ha basado en técnicas destructivas locales como el láser de CO2 o la electrocoagulación, lo que está ligado a un elevado riesgo de secuelas12. La importante mejoría observada en los AF de un paciente en tratamiento con sirolimus oral13 ha llevado a la utilización de diferentes formulaciones tópicas para tratar estos tumores con concentraciones que varían del 0,015 al 1%14–17. De esta manera se han obtenido buenos resultados (fig. 3), minimizando los potenciales efectos adversos derivados de la administración sistémica de sirolimus. Tan solo en los pacientes en los que sirolimus se aplicó en forma de solución se observó irritación local (4,8% de los casos)18, resultando el resto de las formulaciones bien toleradas. Sirolimus también ha sido empleado tópicamente con buena respuesta en máculas hipomelanóticas19 y en un paciente con fibromas periungueales20. La formulación tópica de everolimus tan solo ha sido utilizada en un paciente aislado con AF21.
Neurofibromatosis tipo 1 y otras rasopatíasLas rasopatías son alteraciones del desarrollo debidas a mutaciones germinales en la vía RAS/MAPK, que se caracterizan por un amplio espectro de manifestaciones cutáneas y sistémicas22. Dentro de las rasopatías nos encontramos con la neurofibromatosis y los síndromes de Legius, Costello, Noonan, Leopard y cardiofaciocutáneo. La conexión de la vía RAS/MAPK con el eje PI3K-Akt-TSC-mTOR ha despertado el interés en los mTORi como posibles alternativas terapéuticas en estos pacientes. En un reciente ensayo clínico fase ii23, el uso de sirolimus oral ha mostrado una modesta disminución del crecimiento de los neurofibromas plexiformes con una toxicidad aceptable. Actualmente se encuentra en marcha un ensayo clínico fase ii sobre la administración oral de everolimus en pacientes con neurofibromatosis tipo 1, y ha finalizado otro ensayo fase i sobre el uso de sirolimus tópico para las manifestaciones cutáneas de esta rasopatía, sin que dispongamos de datos por el momento.
Síndrome de Birt-Hogg-DubéEl síndrome de Birt-Hogg-Dubé se caracteriza por mutaciones en el gen de la foliculina, el cual está implicado en la vía de mTOR. Estos pacientes presentan tricofoliculomas faciales, lesiones muy similares a los angiofibromas faciales del TSC. Sin embargo, el uso de sirolimus tópico no ha mostrado ningún beneficio en estos pacientes24.
Fibromas discoides familiares múltiplesInicialmente incluido dentro del espectro del síndrome de Birt-Hogg-Dubé, esta rara entidad se caracteriza por la aparición precoz en la región facial de tumores fibrovasculares denominados fibromas discoides. Existe un artículo publicado sobre la mejoría de las lesiones de 2 gemelos afectos de este trastorno tratados con sirolimus tópico al 1%25.
Paquioniquia congénitaLa paquioniquia congénita es un trastorno de herencia autosómica dominante que se caracteriza por la aparición de queratodermia palmoplantar focal dolorosa, hiperqueratosis subungueal, quistes epidermoides y leucoqueratosis oral. Presenta varias formas clínicas en función de las mutaciones que se presenten en los genes encargados de codificar las queratinas K6a, K6b, K6c, K16 o K17. Sirolimus ha demostrado inhibir la proliferación de queratinocitos mediante el bloqueo de la expresión de la queratina K6a, lo que clínicamente se ha relacionado con una mejoría ostensible de la queratodermia plantar observada en 3 pacientes tratados con sirolimus oral26. Estos datos han motivado la promoción de un ensayo clínico con sirolimus tópico para el tratamiento de esta queratodermia plantar.
Síndromes de poliposis hamartomatosasLos síndromes de poliposis hamartomatosas incluyen un grupo de trastornos genéticos de herencia autosómica dominante que se caracterizan por el desarrollo de pólipos hamartomatosos gastrointestinales, así como otras manifestaciones extradigestivas entre las que destacan diferentes alteraciones dermatológicas27. Dentro de los síndromes de poliposis hamartomatosas se incluye el síndrome tumoral hamartomatoso asociado a PTEN, que agrupa un grupo heterogéneo de trastornos clínicos que comparten una mutación germinal en PTEN, supresor del eje PI3K-Akt. En espera de datos, existe un ensayo clínico fase ii completado sobre el uso de sirolimus oral en pacientes con síndrome tumoral hamartomatoso asociado a PTEN.
Klumpen et al.28 trataron a un paciente con síndrome de Peutz-Jeghers que desarrolló un carcinoma pancreático con everolimus oral. Observaron una mejoría parcial del tumor y la desaparición de los pólipos colónicos, sin que se hiciera referencia al efecto sobre los lentigos del paciente.
En los casos en los que el síndrome de poliposis juvenil se asocia a mutaciones en SMAD4, puede asociarse al síndrome de telangiectasia hemorrágica hereditaria o Rendu-Osler-Weber, entidad en la que sirolimus provocó una remisión tanto de las lesiones cutáneas como de las intestinales en un paciente29.
Anomalías vascularesMalformaciones vasculares capilaresLas malformaciones vasculares capilares son malformaciones congénitas que pueden aparecer de forma esporádica o asociadas a síndromes genéticos como el síndrome de Sturge-Weber. Relacionadas con mutaciones en GNAQ, hasta un 70% de los casos asociados a síndrome de Sturge-Weber presentan una activación de la vía Akt30. Recientemente ha sido publicado un ensayo clínico fase ii en el que trataron a pacientes con malformaciones vasculares capilares asociadas a síndrome de Sturge-Weber con láser de colorante pulsado y rapamicina tópica. Las zonas tratadas con la terapia combinada mostraron una mayor respuesta en comparación con las tratadas con láser o placebo31.
Síndrome PHACEEl síndrome PHACE se caracteriza por la asociación de grandes hemangiomas faciales y otros trastornos vasculares subyacentes, como malformaciones cerebrales de la fosa posterior, anomalías de las arterias cerebrales y alteraciones cardiacas, aórticas y oculares. La gran deformación y los problemas funcionales producidos por estos hemangiomas, así como los problemas de seguridad observados con el uso de propranolol oral en algunos de estos pacientes, han motivado la búsqueda de otras alternativas terapéuticas. Existe un caso publicado con buena respuesta del componente cutáneo a sirolimus oral y sin complicaciones en el resto de las alteraciones vasculares32.
Hemangioendotelioma kaposiformeEl hemangioendotelioma kaposiforme es un tumor vascular infantil poco frecuente que puede infiltrar estructuras profundas, como músculo o hueso, y asociarse al fenómeno de Kassabach-Merrit, poniendo en peligro la vida del paciente. Sirolimus33 y everolimus34 han permitido la disminución o estabilización del tamaño de las lesiones, así como el control de los síntomas asociados (trombocitopenia, coagulopatía) en casos aislados de hemangioendotelioma kaposiforme refractarios a otros tratamientos.
Otras anomalías vascularesExisten casos clínicos publicados sobre el uso de sirolimus en otras anomalías vasculares, como las malformaciones linfáticas y venosas33, los linfangioendoteliomas benignos35, los hemangioendoteliomas asociados al síndrome de Maffucci36, el síndrome del nevus azul en tetina de goma37 o malformaciones vasculares complejas.
Enfermedades inflamatoriasEnfermedad injerto contra huéspedLa enfermedad injerto contra huésped (EICH) es una complicación que puede llegar a presentarse en un 80% de los trasplantes de precursores hematopoyéticos alogénicos. En un reciente metaanálisis, el tratamiento con sirolimus ha demostrado ser útil en la prevención del desarrollo de EICH aguda, sin mostrar una disminución del riesgo relativo con respecto a la forma crónica38. Tanto sirolimus39 como everolimus40 han mostrado eficacia en el control de los síntomas de la EICH crónica con bajas tasas de disfunción del injerto y microangiopatía trombótica. Sirolimus, además, ha mostrado resultados prometedores en pacientes con EICH aguda resistente a corticoides41. Sin embargo, los mTORi siguen siendo un tratamiento de segunda línea en la cura de la EICH aguda y crónica, por detrás de los corticoides, asociados o no a inhibidores de la calcineurina42,43. En un estudio realizado en 34 pacientes que presentaban formas esclerodermiformes de EICH crónica44, los mTORi mostraron un porcentaje de respuesta global del 76%, por lo que estos autores consideran a sirolimus y everolimus como una buena opción terapéutica en estas formas especialmente refractarias de la enfermedad.
Estos datos observados en pacientes con EICH crónica han llevado a la utilización de mTORi en enfermedades esclerosantes. Su et al.45 condujeron un ensayo clínico piloto en 18 pacientes con esclerosis sistémica difusa en el que sirolimus mostró una eficacia similar al metotrexato.
PsoriasisLa activación de la vía PI3K/Akt/mTOR en placas de psoriasis y piel perilesional46 ha llevado a teorizar sobre el potencial uso de los mTORi en esta enfermedad. Un ensayo clínico evidenció que la combinación de sirolimus a dosis subterapéuticas de ciclosporina (1,25mg/Kg) era tan eficaz como ciclosporina a dosis altas, presentando un mejor perfil de seguridad renal. Sin embargo, su uso en monoterapia no mostró mejoría en el tratamiento de la psoriasis47. El empleo de sirolimus tópico a concentraciones mucho mayores de las utilizadas en otras indicaciones (2,2-8%) tampoco ha demostrado una efectividad clínicamente relevante48. Tan solo existen 2 casos clínicos sobre el uso de everolimus oral en pacientes con psoriasis49,50. En ambos casos se combinó con otros inmunosupresores (ciclosporina y tacrolimus) que los pacientes estaban tomando previamente para evitar el rechazo del injerto.
Enfermedades ampollosas autoinmunesLa acción preventiva del uso de sirolimus en la aparición de acantolisis suprabasal en un modelo animal51 explicaría un posible efecto beneficioso del uso de los mTORi en el pénfigo vulgar. Sin embargo, la evidencia actual en enfermedades ampollosas se reduce a 3 casos de pénfigo oral tratados con sirolimus tópico sin mejoría52, y un caso de pénfigo vulgar tratado con sirolimus oral en combinación con dosis altas de inmunoglobulinas intravenosas durante la fase de mantenimiento53. Everolimus ha sido recientemente relacionado con la inducción de 2 casos de penfigoide ampolloso54, por lo que el posible papel beneficioso de los mTORi en enfermedades ampollosas autoinmunes está muy cuestionado.
Liquen plano oral erosivoTan solo existe un estudio clínico en pacientes con liquen plano oral erosivo, en el que Soria et al.55 trataron a 7 mujeres con sirolimus tópico. Obtuvieron una respuesta completa en 4 pacientes y parcial en 3, con buena tolerancia de la formulación.
Oncología cutáneaCáncer cutáneo no melanomaAunque existen casos aislados de pacientes con carcinomas basocelulares tratados con everolimus56, la prevención del cáncer cutáneo no melanoma es una de las principales utilidades atribuida a los mTORi. Existen múltiples ensayos clínicos que demuestran una disminución en la incidencia de cáncer cutáneo no melanoma en pacientes trasplantados en tratamiento con sirolimus en comparación con inhibidores de la calcineurina. Knoll et al. observaron en un metaanálisis que englobaba a 5.876 pacientes trasplantados procedentes de 21 ensayos clínicos una reducción del riesgo de desarrollo de cáncer cutáneo no melanoma del 56%, así como una disminución global del riesgo de cáncer de cualquier localización en pacientes en tratamiento con sirolimus. Este estudio evidenció una mayor disminución del riesgo en los pacientes tratados con otras terapias inmunosupresoras que posteriormente fueron sustituidas por sirolimus57.
MelanomaExisten 3 ensayos clínicos fase ii en pacientes con melanoma metastásico en los que everolimus ha sido administrado en combinación con otros agentes biológicos como bevacizumab58, o asociado a regímenes de mono (temozolamida)59 o poliquimioterapia (paclitaxel+carboplatino)60. Mientras la combinación con bevacizumab mostró un modesto beneficio, con tasas de respuesta del 12% y de enfermedad estable en el 58% de los casos, el uso de everolimus junto con agentes citostáticos no mostró ninguno.
Por su parte, la asociación de temsirolimus con sorafenib en pacientes con melanoma metastásico no mostró eficacia61, mientras que combinado con bevacizumab se consiguieron mejores resultados en pacientes con BRAF no mutado62.
Sarcoma de KaposiSirolimus ha mostrado una gran efectividad en el tratamiento de la afectación cutánea y visceral del sarcoma de Kaposi en pacientes trasplantados63, lo que ha llevado a algunos autores a considerarlo como el fármaco inmunosupresor de primera elección en este subgrupo de pacientes e incluso a utilizarlo de forma tópica64.
Sin embargo, la escasa experiencia en el uso de everolimus en pacientes con sarcoma de Kaposi suscita una mayor controversia. Aunque existen casos clínicos aislados en los que se obtiene una resolución completa de lesiones cutáneas y sistémicas65, un reciente ensayo clínico en 11 pacientes con sarcoma de Kaposi clásico ha mostrado una eficacia reducida66 con aparición de nuevas lesiones durante el tratamiento.
Linfomas cutáneos de células TEstudios in vitro han mostrado una activación excesiva de la vía mTOR en células de pacientes con síndrome de Sézary y linfomas cutáneos de células T, lo que apunta a los mTORi como una posible alternativa terapéutica.
Witzig et al. han publicado recientemente un ensayo clínico fase ii en el que trataron con everolimus oral a 16 pacientes con linfomas T67. Siete de ellos correspondían a micosis fungoides en estadios iiB (6) y iii (1), de los cuales 3 obtuvieron respuestas parciales (43%). Actualmente, existe un ensayo clínico fase ii en marcha sobre el tratamiento con everolimus de linfomas cutáneos de células T refractarios.
AntienvejecimientoEl impacto causado por el artículo publicado en 2009 en Nature sobre el aumento de la esperanza de vida observado en ratones a los que se les administraba sirolimus68 ha propiciado la apertura de un nuevo horizonte terapéutico de los mTORi: el envejecimiento celular. La vía de mTOR ha sido implicada en la regulación de mecanismos fisiológicos de geroconversión (paso irreversible de las células madre de su estado quiescente al de senescencia celular). Esta detención del ciclo celular lleva irremediablemente a un debilitamiento de los procesos de regeneración tisular y, con ello, al envejecimiento del organismo, por lo que el bloqueo selectivo de este paso propiciaría la permanencia de las células madre en estado quiescente, prolongando así su función regeneradora.
Nuevos inhibidores de mTOR y futuras líneas de investigaciónEn la actualidad, existen múltiples ensayos en marcha sobre el uso de mTORi en diferentes tipos de enfermedades dermatológicas (tabla 4). Además, están apareciendo nuevos fármacos inhibidores de mTOR, la mayoría de los cuales se encuentran en fases de desarrollo inicial. Ridaforolimus es el único con datos publicados de un ensayo fase iii en sarcomas metastásicos, en el que se observó un leve aumento del intervalo libre de progresión, pero sin un beneficio de la supervivencia global69.
Principales ensayos clínicos en marcha con inhibidores de mTOR en enfermedades dermatológicas
| Código NCT | Fármaco | Administración | Indicación | Fase clínica | Año inicio | Estado |
|---|---|---|---|---|---|---|
| NCT01031901 | Sirolimus | Tópica | Manifestaciones cutáneas de la neurofibromatosis tipo1 y TSC | Fase I | 2012 | Finalizado |
| NCT01853423 | Sirolimus | Tópica | Angiofibromas faciales en TSC | Fase I | 2013 | Selección de sujetos |
| NCT02057614 | Sirolimus | Tópica | Queratodermia plantar en paquioniquia congénita | Fase I | 2014 | Selección de sujetos |
| NCT02123966 | Sirolimus | Tópica | EICH crónica oral | Fase II | 2014 | Selección de sujetos |
| NCT02214706 | Sirolimus | Tópica | Malformaciones vasculares capilares (sirolimus+láser erbio +PDL) | Fase II | 2014 | Selección de sujetos |
| NCT00450320 | Sirolimus | Oral | Sarcoma de Kaposi asociado a VIH | Fase I | 2007 | Finalizado |
| NCT00779194 | Sirolimus | Oral | Lupus eritematoso sistémico | Fase II | 2008 | En curso |
| NCT00971789 | Sirolimus | Oral | Síndrome de Cowen y otros PTHS | Fase II | 2009 | Finalizado |
| NCT01313923 | Sirolimus | Oral | Pénfigo | Fase 0 | 2011 | Selección de sujetos |
| NCT00975819 | Sirolimus | Oral | Anomalías vasculares complejas | Fase II | 2009 | En curso |
| NCT01811667 | Sirolimus | Oral | Malformaciones vasculares complejas | Fase III | 2012 | Selección de sujetos |
| NCT02042326 | Sirolimus | Oral | Malformaciones arteriovenosas | Fase II | 2014 | Selección de sujetos |
| NCT02110069 | Sirolimus | Oral | Hemangiendotelioma kaposiforme | Fase II | 2014 | Selección de sujetos |
| NCT02509468 | Sirolimus | Oral | Anomalías vasculares de flujo lento | Fase II | 2014 | Selección de sujetos |
| NCT01637090 | Everolimus | Oral | Linfomas cutáneos de células T | Fase II | 2012 | Selección de sujetos |
| NCT01960829 | Everolimus | Oral | Melanoma metastásico | Fase II | 2013 | Selección de sujetos |
| NCT01997255 | Everolimus | Oral | Síndrome de Sturge-Weber | Fase II | 2013 | Selección de sujetos |
| NCT02332902 | Everolimus | Oral | Manifestaciones cutáneas de neurofibromatosis tipo 1 | Fase II | 2014 | Selección de sujetos |
EICH: enfermedad injerto contra huésped; PDL: láser de colorante pulsado; PTHS: síndromes tumorales hamartomatosos asociados a PTEN; TSC: complejo de la esclerosis tuberosa; VIH: virus de la inmunodeficiencia humana.
El modesto beneficio mostrado por los mTORi en los diferentes ensayos clínicos oncológicos realizados hasta la fecha evidencia una posible relación con los múltiples mecanismos de retroalimentación de mTORC1, tales como la activación de señales reflejas de las vías PI3K y RAS/MAPK. Para evitar estos mecanismos de escape propuestos, se están ensayando terapias combinadas con inhibidores de PI3K y otros agentes citostáticos70, o incluso desarrollando inhibidores duales PI3K/mTOR o mTORC1/mTORC2.
ConclusionesLa vía PI3K/Akt/TSC/mTOR es clave en multitud de procesos moleculares y se relaciona con gran cantidad de enfermedades de diferente naturaleza. Su impacto en dermatología ha aumentado exponencialmente en los últimos años al conocerse sus relaciones etiopatogénicas con diferentes dermatosis, abriéndose una nueva vía terapéutica con los mTORi, especialmente en sus formas de administración tópica. El esperanzador futuro de estos tratamientos dirigidos contra mTOR pasa por la investigación en diferentes campos, la optimización de las moléculas existentes, así como el desarrollo de nuevos agentes farmacológicos y su asociación con fármacos inhibidores de otras vías de señalización molecular asociadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al profesor José Carlos Moreno Giménez por la lectura crítica de este artículo.