En la última década se ha relacionado el penfigoide ampolloso (PA) con la presencia previa de comorbilidades, sobre todo enfermedades neurológicas y psiquiátricas. Disponemos en la bibliografía de series de casos, pequeños estudios de casos y controles y trabajos extensos con bases de datos poblacionales en distintos países asiáticos, de Europa continental y del Reino Unido que han confirmado esta asociación. Sin embargo, no existen datos en la población española.
Material y métodosEstudio observacional retrospectivo de casos y controles con matching 1:2. Se seleccionaron 54 pacientes con PA. Se compararon proporciones entre grupos para comorbilidades neurológicas, cardiopatía isquémica, diabetes, enfermedad pulmonar obstructiva crónica (EPOC) y neoplasias sólidas mediante regresiones logísticas univariantes. Se creó un modelo asociativo mediante regresión logística múltiple condicional.
ResultadosEn el grupo de casos aparece una proporción significativamente mayor de accidente cerebrovascular y/o accidente isquémico transitorio (ACVA y/o AIT) (odds ratio [OR] 3,06; intervalo de confianza 95% [IC 95%] 1,19-7,87], demencia (OR: 5,52; IC 95%: 2,19-13,93) y enfermedad de Parkinson (OR: 5; IC 95%: 1,57-15,94). Tomando los diagnósticos neurológicos en conjunto se advirtió una proporción significativamente mayor en casos (OR: 6,34; IC 95%: 2,89-13,91). Demencia y enfermedad de Parkinson se asociaron de forma independiente al PA en el análisis multivariante.
ConclusionesLos pacientes con PA de nuestra población presentan mayor frecuencia de ciertas comorbilidades neurológicas.
In the past 10 years, bullous pemphigoid has been associated with other comorbidities and neurologic and psychiatric conditions in particular. Case series, small case-control studies, and large population-based studies in different Asian populations, mainland Europe, and the United Kingdom have confirmed this association. However, no data are available for the Spanish population.
Material and methodsThis was an observational, retrospective, case-control study with 1:2 matching. Fifty-four patients with bullous pemphigoid were selected. We compared the percentage of patients in each group with concurrent neurologic conditions, ischemic heart disease, diabetes, chronic obstructive pulmonary disease, and solid tumors using univariate logistic regression. An association model was constructed with conditional multiple logistic regression.
ResultsThe case group had a significantly higher percentage of patients with cerebrovascular accident and/or transient ischemic attack (odds ratio [OR], 3.06; 95% CI, 1.19-7.87], dementia (OR, 5.52; 95% CI, 2.19-13.93), and Parkinson disease (OR, 5; 95% CI, 1.57-15.94). A significantly higher percentage of cases had neurologic conditions (OR, 6.34; 95% CI, 2.89-13.91). Dementia and Parkinson disease were independently associated with bullous pemphigoid in the multivariate analysis.
ConclusionsPatients with bullous pemphigoid have a higher frequency of neurologic conditions.
El penfigoide ampolloso (PA) es una enfermedad ampollosa subepidérmica que se presenta característicamente en ancianos1–4 y cuyo riesgo aumenta con la edad5. En el curso de la enfermedad a menudo aparece una erupción urticariforme pruriginosa sobre la que se desarrollan ampollas tensas. El mecanismo inmunológico se caracteriza por la producción de autoanticuerpos IgG dirigidos contra proteínas del hemidesmosoma en la unión dermoepidérmica, lo que da lugar al depósito de complemento (C3) y posteriormente a la formación de ampollas.
Estos antígenos son BP180 (BPAG2 o colágeno xvii), una proteína transmembrana con un largo dominio extracelular y BP230 (BPAG1), proteína de la familia de las plaquinas y que se localiza en el interior de la célula. Existen varias isoformas de BPAG1 localizadas en la piel (epitelial o BPAG1-e), músculo estriado (BPAG1-b) y sistema nervioso (BPAG1-a), la cual es muy similar a la forma epitelial6.
En los últimos años se ha descrito la asociación epidemiológica entre el PA y algunas enfermedades neurológicas como el accidente cerebrovascular (ACVA), algunas demencias y la enfermedad de Parkinson7–9. El mecanismo patogénico de esta asociación se desconoce actualmente, aunque un trabajo apunta a que puede existir una reactividad cruzada entre las isoformas epitelial y neural de BPAG1 tras el acontecimiento neurológico. Esto daría lugar a la exposición al sistema inmunológico de la forma neural, lo que desencadenaría la respuesta con autoanticuerpos contra la isoforma epitelial y, consecuentemente, la enfermedad ampollosa10. Este fenómeno se ha postulado al demostrarse experimentalmente que el suero de pacientes con PA y enfermedad neurológica reaccionaba contra extractos de piel y cerebro de ratones11. De esta forma podría explicarse la patogenia de la enfermedad ampollosa en pacientes con enfermedad neurológica previa.
A día de hoy no existen publicaciones que hayan comprobado esta asociación en pacientes de población española, motivo por el cual se ha llevado a cabo este estudio.
Pacientes y métodosSe diseñó un estudio retrospectivo, observacional, de casos y controles. Se seleccionaron todos los casos incidentes de PA registrados entre enero de 2002 y febrero de 2012. Para ello se revisó la base de datos de historias clínicas electrónicas del Servicio de Dermatología del Hospital Universitario Reina Sofía (Córdoba, España). Se incluyeron los casos diagnosticados clínicamente y con estudio anatomopatológico con inmunofluorescencia directa compatible.
Se recogieron la edad en el momento del diagnóstico, el sexo, la gravedad de la enfermedad cutánea y el diagnóstico de comorbilidades más allá de los 3 meses previos al PA. La gravedad del PA se entendió como enfermedad generalizada (2 o más áreas corporales afectas) o localizada. Las comorbilidades recogidas fueron diabetes mellitus, cardiopatía isquémica, enfermedad pulmonar obstructiva crónica (EPOC), historia de enfermedad cerebrovascular (ACVA y/o accidente isquémico transitorio [AIT]), demencia, enfermedad de Parkinson, enfermedad psiquiátrica, neoplasia sólida y la presencia de alguno de los diagnósticos neurológicos (demencia, ACVA, AIT, enfermedad de Parkinson). Las enfermedades psiquiátricas que se recogieron fueron el trastorno de ansiedad, la depresión, la esquizofrenia y el trastorno bipolar. Estas enfermedades debieron ser diagnosticadas o confirmadas en algún momento por un médico de atención primaria o un médico especialista.
Se seleccionaron 2 controles por cada caso de la misma base de datos, apareados por edad y sexo, que tuvieron que ser sometidos a una biopsia de piel durante el mismo año por otro motivo que no fuera la sospecha de una enfermedad ampollosa. Una vez detectados los posibles controles para cada caso se realizó un muestreo aleatorizado simple en cada grupo de edad y sexo, para lo que se usó un generador de números aleatorios. Se estudiaron las mismas comorbilidades que en los casos.
Se realizó estadística descriptiva de las variables, frecuencias y porcentajes para las variables cualitativas y media y desviación típica para las cuantitativas. La diferencia de medias se comprobó mediante la prueba «t» para datos independientes previa comprobación de normalidad de las distribuciones que así lo requirieran mediante la prueba de Shapiro-Wilk. Para la comparación de proporciones dentro del grupo de casos se utilizó la prueba Chi-cuadrado o la prueba exacta de Fisher (en el caso de encontrar alguna casilla de la tabla con frecuencias esperadas <5).
Se estimó la odds ratio (OR) cruda para cada comorbilidad entre ambos grupos con un intervalo de confianza del 95% mediante regresiones logísticas univariantes. Del mismo modo, se ajustaron las distintas OR obtenidas por edad y sexo. Se creó un modelo asociativo considerando como variable dependiente la presencia de PA. Las variables independientes consideradas fueron las distintas comorbilidades, excluyendo la variable de agrupación de comorbilidades neurológicas. Se utilizaron en un modelo de regresión logística múltiple condicional para un estudio de casos y controles con matching 1:2. Por medio del estadístico de Wald las variables con un valor de p≥0,15 fueron eliminadas una a una del modelo (procedimiento de selección metódica hacia atrás). Se utilizó la prueba de la razón de verosimilitud para comparar el modelo reducido con aquel que incluye todas las variables.
En todas las pruebas se tomó como significativo un valor de p<0,05. El software usado para llevar a cabo las pruebas fue IBM® SPSS® Statistics 19.0.0.1 (SPSS Inc, Chicago, Illinois).
ResultadosSe recogieron los datos de 56 pacientes con PA, 22 hombres (39,3%) y 34 mujeres (60,7%). La edad media de los varones diagnosticados fue de 80,79 años (desviación estándar [D]=7,71) frente a los 77,90 años (D=13,07) de las mujeres (p=0,354). Cuarenta y ocho de los casos (85,71%) tenían una edad superior a los 70 años. Seis presentaban enfermedad localizada (10,7%), mientras que el resto (89,3%) presentaban 2 o más localizaciones anatómicas afectadas por el PA.
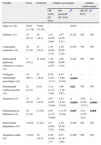
En la tabla 1 se recogen los datos referentes al análisis univariante y multivariante. Se detectó un aumento de la proporción de enfermedades neurológicas de casi 7 veces en los casos (OR=6,70; IC 95%: 3,27-13,71). De estas se observó un aumento significativo en los antecedentes de enfermedad cerebrovascular (OR=3,12; IC 95%: 1,23-7,94), demencia (OR=4,57; IC 95%: 2,07-10,09) y enfermedad de Parkinson (OR=5,87; IC 95%: 1,75-19,68) en los casos frente a los controles. No se detectaron diferencias significativas en las variables restantes. Al realizar ajuste por edad y sexo se mantuvieron los resultados significativos. Demencia (OR=5,94; IC 95%: 2,24-15,73) y enfermedad de Parkinson (OR=5,51; IC 95%: 1,57-19,3) se encontraron independientemente asociadas a PA en el análisis multivariante (tabla 1).
Análisis univariante y multivariante de variables estudiadas en casos y controles
| Variable | Casos | Controles | Análisis univariante | Análisis multivariante | |||
| OR cruda (IC 95%) | OR ajustadaa (IC 95%) | pb | OR (IC 95%) | pb | |||
| Edad (±1D) | 78,97 (11,19) | 79,04 (11,28) | – | – | 0,975 | – | – |
| Diabetes (%) | 23 (41,1) | 36 (32,1) | 1,47 (0,76–2,86) | 1,57 (0,76–3,21) | 0,221 | NS | NS |
| Cardiopatía isquémica (%) | 10 (17,9) | 15 (13,4) | 1,41 (0,59–3,37) | 1,39 (0,59–3,29) | 0,453 | NS | NS |
| Enfermedad pulmonar obstructiva crónica (%) | 9 (16,1) | 11 (9,8) | 1,76 (0,68–4,53) | 1,68 (0,68–4,18) | 0,261 | NS | NS |
| Cualquier enfermedad neurológica (%) | 34 (60,7) | 21 (18,8) | 6,70 (3,27–13,71) | 6,34 (2,89–13,91) | <0,0001 | – | – |
| Enfermedad cerebrovascular (%) | 12 (21,4) | 9 (8) | 3,12 (1,23–7,94) | 3,06 (1,19–7,87) | 0,02 | NS | NS |
| Demencia (%) | 21 (37,5) | 13 (11,6) | 4,57 (2,07–10,09) | 5,52 (2,19–13,93) | <0,0001 | 5,94 (2,24–15,73) | <0,0001 |
| Enfermedad de Parkinson (%) | 10 (17,9) | 4 (3,6) | 5,87 (1,75–19,68) | 5 (1,57–15,94) | 0,007 | 5,51 (1,57–19,3) | 0,008 |
| Enfermedad psiquiátrica (%) | 5 (8,9) | 5 (4,5) | 2,1 (0,58–7,57) | 2,19 (0,58–8,36) | 0,249 | NS | NS |
| Neoplasia sólida (%) | 5 (8,9) | 16 (14,3) | 0,59 (0,20–1,7) | 0,57 (0,19–1,69) | 0,308 | NS | NS |
Análisis multivariante: test de la razón de verosimilitud=24,003; p<0,0001; gl=2.
D: desviación estándar; NS: no significativo OR: odds ratio.
La prevalencia de las enfermedades neurológicas en España se estima entre el 13-16% de la población general12. En el caso de las demencias la prevalencia en la población española mayor de 70 años se sitúa en 10,9%13; en el de la enfermedad cerebrovascular algunos trabajos la estiman aproximadamente entre 4,9%14 y 7,5%15 en población mayor de 65 años.
Se han descrito en pacientes con PA diversos diagnósticos neurológicos como esclerosis múltiple, paresia de origen isquémico, síndrome de Shy-Drager y esclerosis lateral amiotrófica16–20.
En los últimos años se han publicado algunos trabajos que han detectado un aumento de la prevalencia de varias enfermedades neurodegenerativas en pacientes diagnosticados de PA. En 2005 Stinco et al. estudiaron la prevalencia de PA en pacientes hospitalizados por esclerosis múltiple y enfermedad de Parkinson y la compararon con la de una población hospitalizada por motivos traumatológicos. La prevalencia de PA fue significativamente más alta en el grupo de pacientes neurológicos21. Otro estudio no controlado pretendió determinar la prevalencia de enfermedades neurológicas en un grupo de 341 pacientes con PA. Ciento veintitrés pacientes (36%) presentaban al menos una comorbilidad neurológica diagnosticada previamente. La más frecuente fue la demencia (20%), la mayoría Alzheimer y demencia vascular, seguida del ictus (15%) y la enfermedad de Parkinson (9%). En menos del 5% aparecieron esclerosis múltiple, epilepsia, esclerosis lateral amiotrófica y siringomielia.
Estos hallazgos se han venido confirmando en varios estudios controlados. En uno de ellos se apreció una proporción de 46% (42 casos) de enfermedad neurológica en pacientes con PA, significativamente mayor que la presente en el grupo control. Demencia (13%) y enfermedad cerebrovascular (30%) se mostraron significativamente asociadas a PA con una probabilidad de 8 y 6 veces más respectivamente que en controles9. En otra de las publicaciones se apreció un porcentaje de pacientes con PA y enfermedad neurológica similar a otros estudios (42,7%). Esta fue la única variable de las estudiadas que resultó estadísticamente significativa22. Bastuji-Garin et al. observaron mayor prevalencia de encamamiento (38,5%), déficit cognitivo (42,7%), ictus (25,9%), enfermedad de Parkinson (14,3%) y trastorno bipolar (4%) en los casos, comorbilidades que, salvo el ictus, se mostraron como factores de riesgo independientes en el análisis multivariante realizado23.
Recientemente se ha publicado otro estudio de casos y controles en el que la proporción encontrada de enfermedad neurológica en los pacientes con PA ha sido sensiblemente menor (16%) que la observada en otras publicaciones. Sin embargo, las diferencias fueron significativas. Por otro lado los autores observaron mayor prevalencia de neoplasias en los casos, hecho que difiere de lo publicado hasta el momento. Estas diferencias pueden explicarse por la naturaleza de la población estudiada24.
Dada la información aportada por estos trabajos han aparecido 2 grandes estudios de casos y controles utilizando grandes bases de datos poblacionales en Asia7 y Reino Unido8 que han confirmado los hallazgos previos, lo que aporta mayor solidez a la evidencia hallada hasta el momento.
Tras revisar la bibliografía existente creemos que nuestro estudio es el primero que explora la asociación de ciertas comorbilidades con el PA en población española. Los resultados arrojan una mayor frecuencia de ciertas enfermedades neurológicas en pacientes con PA en nuestra población, lo cual es consistente con lo hallado en otras series publicadas hasta el día de hoy.
Sin embargo, el presente estudio tiene ciertas limitaciones, como son el escaso tamaño muestral, que probablemente no nos ha permitido encontrar mayores diferencias en las variables observadas entre grupos, como en el caso de las enfermedades psiquiátricas, que sí se encontraron asociadas en estudios de mayor volumen. Es posible que el estudio adolezca de un sesgo de información al haberse utilizado una base de datos de biopsias cutáneas para escoger a los controles. Al ser diversos los motivos para la realización de estas biopsias, las historias clínicas de los controles pudieran no estar correctamente dirigidas al objeto de nuestro estudio. Del mismo modo se ha podido incurrir en un sesgo de selección al seleccionarse los casos de una base de datos de pacientes de un hospital de referencia. Es posible que pacientes de PA de menor gravedad hayan escapado al no haber sido remitidos al centro, quedando controlados por sus médicos de atención primaria o en centros periféricos donde la historia clínica no se encuentra digitalizada. Pensamos que este hecho podría llevar a la sobreestimación de las asociaciones encontradas.
En conclusión, hemos hallado asociación de ciertas comorbilidades neurológicas con PA en nuestra población, lo que es concordante con lo observado en estudios previos. Sin embargo, a día de hoy, no se ha podido establecer si se trata únicamente de una asociación puramente estadística o si existe un nexo causal. En este caso sería plausible hablar de una reacción autoinmunitaria cruzada como causante del PA. El evento neurológico sería el causante de la destrucción de la barrera hematoencefálica y de la consecuente exposición de la isoforma neural de BP230, lo que desencadenaría la activación del sistema inmune6,11. Sea como fuere son necesarios nuevos estudios, probablemente de cohortes, que estimen en cada una de estas comorbilidades el riesgo relativo para el desarrollo posterior de PA.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.