INTRODUCCION
Tras el aparato digestivo, la piel es el órgano más frecuentemente afectado por las reacciones adversas a los medicamentos (RAM)1, y entre éstas, son las de naturaleza alérgica las que muestran una mayor incidencia. Cabe esperar, por consiguiente, que muchas de estas reacciones sean atendidas por los dermatólogos y, en su caso, publicadas en revistas especializadas. A este respecto Actas Dermosifiliográficas (ADS) es la revista dermatológica más antigua de nuestro país, y por ello presumimos que debería constituir una fuente adecuada para conocer el grado de interés de los dermatólogos españoles por el tema, razón por la que nos propusimos analizar todos los artículos publicados en la revista, así como todas las comunicaciones presentadas a las diferentes reuniones territoriales de la Academia, durante el periodo 1997-2002. Dado que, según la Ley del Medicamento, existe obligatoriedad por parte del personal sanitario de comunicar al Sistema Español de Farmacovigilancia todas las sospechas de reacciones adversas nuevas o graves, se verificó si las publicadas o comunicadas en ADS se hallaban registradas en FEDRA, base de datos de reacciones adversas de la Agencia Española del Medicamento.
MATERIAL Y MÉTODOS
Se revisaron todos los artículos y los resúmenes de comunicaciones a Congresos Nacionales o a las Secciones Territoriales de la Academia Nacional de Dermatología publicados en ADS entre enero de 1997 y diciembre de 2002, ambos incluidos. Los datos obtenidos fueron cargados en una base de datos confeccionada al efecto cuyas variables se tomaron de los epígrafes de las tarjetas amarillas del Sistema Español de Farmacovigilancia, las cuales se resumen en la tabla 1. Los datos disponibles fueron sometidos a codificación de acuerdo con los protocolos del Sistema Español de Farmacovigilancia (Buenas Prácticas de Farmacovigilancia)2, lo que permitió definir la categoría de causalidad y otras características de interés de la reacción publicada, de manera similar a como se hace con las tarjetas amarillas que se reciben habitualmente en los centros autonómicos. Por otro lado, se comprobó si las reacciones adversas publicadas habían sido comunicadas al Sistema Español de Farmacovigilancia, para lo que se llevó a cabo su identificación en la base de datos FEDRA, que contiene unos 65.000 registros homologados de todas las sospechas de reacciones adversas comunicadas al Sistema desde su creación en 1982. Por último, se intentó conocer mediante búsqueda experta en Medline si las comunicaciones a congresos habían sido posterior o anteriormente publicadas en otras revistas como trabajos completos.
RESULTADOS
Comunicaciones a congresos y a reuniones
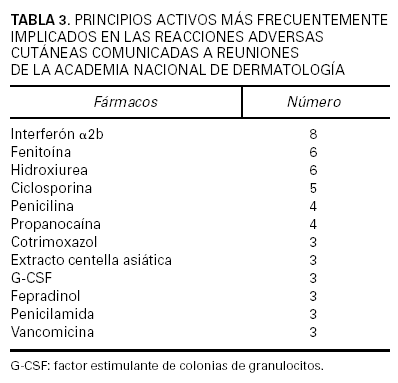
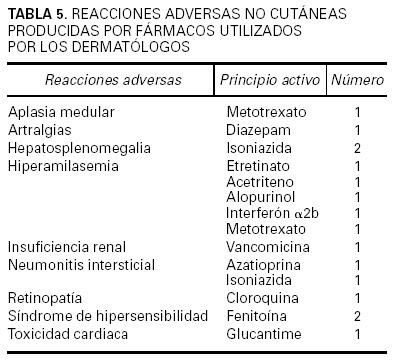
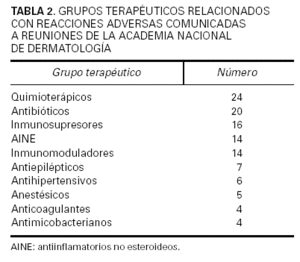
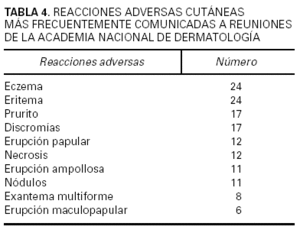
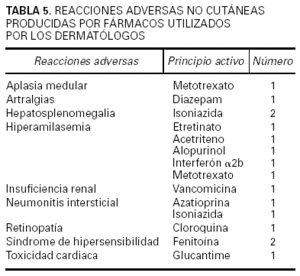
Se contabilizó un total de 2.220 comunicaciones, de las cuales 329 fueron de tema farmacológico clínico. De éstas, 182 correspondieron a casos clínicos relacionados con RAM, es decir, el 8,2 % del total de comunicaciones presentadas. Los fármacos implicados se hallan recogidos en las tablas 2 y 3, donde puede verse que los quimioterápicos anticancerosos, los antibióticos, los inmunomoduladores y los antiinflamatorios no esteroideos (AINE) fueron a los que más frecuentemente se imputó la causa de las reacciones adversas cutáneas descritas (tabla 4). Las reacciones eczematosas, las erupciones y el prurito fueron las más frecuentes. También se dieron a conocer reacciones adversas no cutáneas atribuidas a medicamentos que se habían utilizado para una enfermedad de la piel (tabla 5). En su mayor parte (53,3 %) los medicamentos implicados habían sido administrados por vía oral, si bien la vía tópica fue utilizada en una elevada proporción de pacientes (37,9 %).
En relación con las características demográficas de los pacientes, hubo un elevado número de comunicaciones en las que no se detallaba ni la edad (n = 46) ni el sexo (n = 36). La mayor parte de los pacientes eran adultos de menos de 75 años; los niños y los ancianos fueron los menos afectados por el problema. Por otro lado, hubo un mayor número de mujeres (n = 82) que de varones (n = 57).
Utilizando el manual de Buenas Prácticas de Farmacovigilancia de la Agencia Española del Medicamento para evaluar la calidad de las publicaciones sobre reacciones adversas, encontramos que la casi totalidad de las comunicaciones cumplen con el requisito de que la reacción adversa figure en el título del trabajo; sin embargo, en ninguna se indica que la reacción se ha comunicado al Sistema Español de Farmacovigilancia, lo cual constituye una deficiencia formal seria. Por otro lado, los resúmenes adolecieron de datos en algunos epígrafes de interés, especialmente en los datos personales de los pacientes, en la eventual existencia de tratamientos simultáneos, en la exclusión de causas alternativas y en la realización de pruebas diagnósticas.
Aplicando a los datos publicados el algoritmo de Karch y Lasagna, utilizado por el Sistema Español de Farmacovigilancia para categorizar el grado de causalidad y codificándolos conforme a sus protocolos, pudimos llegar a la conclusión de que en 57 de las 182 comunicaciones la reacción fue «definida»; en 49, «probable»; en 49, «posible», y en 13, «condicional». En 14 de ellas no fue posible proceder a la codificación por carencia de los datos necesarios. Por otro lado, nuestra evaluación permitió llegar a la conclusión de que 32 casos correspondieron a la categoría de «graves».
Para comprobar si los casos comunicados habían sido puestos en conocimiento del Sistema Español de Farmacovigilancia se verificó su identificación en la base de datos FEDRA de la Agencia Española del Medicamento. De los 182 casos publicados en ADS sólo se encontraron nueve en FEDRA, es decir, un 4,9 % del total. Además, de los 32 casos categorizados como «graves», solamente se hallaron tres en FEDRA y, entre ellos, no estaba incluido un caso de reacción adversa mortal. La trascendencia de estos datos viene dada por el hecho de que, según se indicó en la introducción, la actual normativa establece la obligatoriedad de la comunicación al Sistema de este tipo de reacciones.
Por último, tras la búsqueda practicada en Medline, las reacciones adversas descritas en las comunicaciones que estamos analizando fueron dadas a conocer como trabajo íntegro en otras revistas en un 13,7 % de los casos.
Artículos
Durante las fechas que cubre esta revisión, ADS publicó 60 artículos relacionados con el uso de medicamentos, de los cuales 40 hicieron referencia a reacciones adversas (un 66,6 %). Los fármacos implicados con más frecuencia fueron los anticancerosos, con predominio de los pacientes sometidos a poliquimioterapia; en segundo lugar lo fueron los antibióticos en general. De nuevo, la vía de administración más frecuentemente utilizada fue la oral, en casi la mitad de los casos. Los pacientes pertenecieron sobre todo al grupo de adultos menores de 75 años, y de nuevo también los niños y los ancianos fueron los menos afectados; al igual que en el caso de las comunicaciones a congresos, las reacciones adversas se observaron más a menudo en mujeres (61,5 %).
Los fármacos implicados y las reacciones detectadas se presentan en la tabla 6, en la que puede verse que, a pesar de la heterogeneidad de los cuadros descritos, las erupciones fueron el síntoma más frecuente. Hubo sólo un artículo en que se especificase haber comunicado el caso al centro de farmacovigilancia correspondiente.
En general, los datos de los casos publicados como artículos fueron más completos que los relatados en las comunicaciones, lo que permitió aplicar el algoritmo de Karch y Lasagna con mayor fiabilidad. En este caso, se llegó a la conclusión de que 15 de las reacciones adversas fueron «definidas» (37,5 %) y 20 «probables» (50 %). Por otra parte, 15 de los cuadros descritos se categorizaron como graves y, de ellos, sólo se hallaron cuatro en la base de datos FEDRA.
DISCUSION
Las reacciones adversas cutáneas constituyen el 19,8 %1 de un total de 65.000 registradas, aproximadamente, en la base de datos FEDRA desde el año 1982, superadas por un escaso margen por las digestivas (22,4 %). Ello representa unas 650 notificaciones/año, es decir, unas 3.900 durante el periodo cubierto por nuestra revisión. Aún considerando los indudables errores de este tipo de aproximaciones, salta a la vista que los 220 casos recogidos en ADS durante este periodo, aun en el supuesto de que todos hubiesen sido comunicados al Sistema, no habrían alcanzado más del 5 % del total, lo que es un indicador de que la contribución de los dermatólogos españoles al Sistema de Farmacovigilancia es cuantitativamente escasa. A la hora de analizar este hecho es obligado pensar que la mayoría de los enfermos con reacciones cutáneas son vistos por médicos no dermatólogos, quienes no los derivan a los especialistas. De hecho, cuando se analizan los medicamentos causantes de las reacciones publicadas en ADS, se comprueba que en su mayoría no pertenecen al vademécum habitual dermatológico.
Globalmente, las reacciones publicadas en ADS poseen un perfil semejante al dado a conocer en investigaciones epidemiológicas específicas. Es decir, al igual que en la mayoría de las publicaciones de otros autores3-5, las erupciones eritematosas polimorfas, alérgicas o no, fueron las que mostraron una mayor frecuencia, siendo los antibióticos, por otro lado, los agentes principalmente involucrados. Así mismo, la edad y sexo de los pacientes son similares a los descritos en la literatura médica.
Cabe destacar que la elevada proporción de casos en los que se pudo asignar la categoría de «definida» o «probable» es un indicador de buena calidad de las publicaciones aparecidas en ADS. Resulta, por ello, lamentable que, al no haber sido notificadas directamente al Sistema, éste no se haya podido beneficiar de su oportuno conocimiento. A este respecto, debe recordarse que la función primordial de los programas internacionales de farmacovigilancia es generar señales de alerta sobre la posible existencia de problemas de seguridad con determinados medicamentos. Su detección precoz es, por consiguiente, de extrema importancia. De esta manera, aunque el número de notificaciones realizadas por dermatólogos sea bajo, su importancia cualitativa es elevada.
Finalmente, el manual de Buenas prácticas de Farmacovigilancia incluye entre sus apartados uno dirigido a los Consejos de Redacción de las revistas científicas en el que se recomienda que todas las publicaciones que hagan referencia a casos clínicos presuntamente producidos por medicamentos, incluyendo las actas de Congresos, cumplan con el requisito de haber sido notificados al Sistema Español de Farmacovigilancia antes de ser publicados. Se intenta de este modo corregir la tendencia a publicar los casos interesantes sin notificarlos oficialmente. Afortunadamente, el Sistema Español de Farmacovigilancia prevé que los casos publicados y no comunicados sean también cargados en FEDRA, según un protocolo especial, para lo cual se precisa que sean los propios expertos del Sistema quienes deban distribuirse la tarea de revisar todas las revistas españolas, tal como hemos hecho y estamos haciendo nosotros con ADS. Es evidente que sería mucho mejor que las propias editoriales garantizaran, mediante el proceso de revisión habitual, que los casos que se les envían para su publicación han sido notificados, pues de ese modo el trabajo de los expertos podría centrarse en otras tareas con mayor eficiencia.