La alopecia areata (AA) es una alopecia no cicatricial de etiología autoinmune caracterizada por una respuesta organoespecífica de tipo celular mediada por linfocitos T CD4+ y CD8+. Estos podrían activarse por autoantígenos del bulbo piloso induciendo el proceso inflamatorio, que conduciría finalmente a la caída del cabello. Recientemente, y debido a la generalización del tratamiento con terapias biológicas, se ha detectado un número creciente de publicaciones sobre trastornos autoinmunes en relación con las mismas, entre ellos la propia AA.
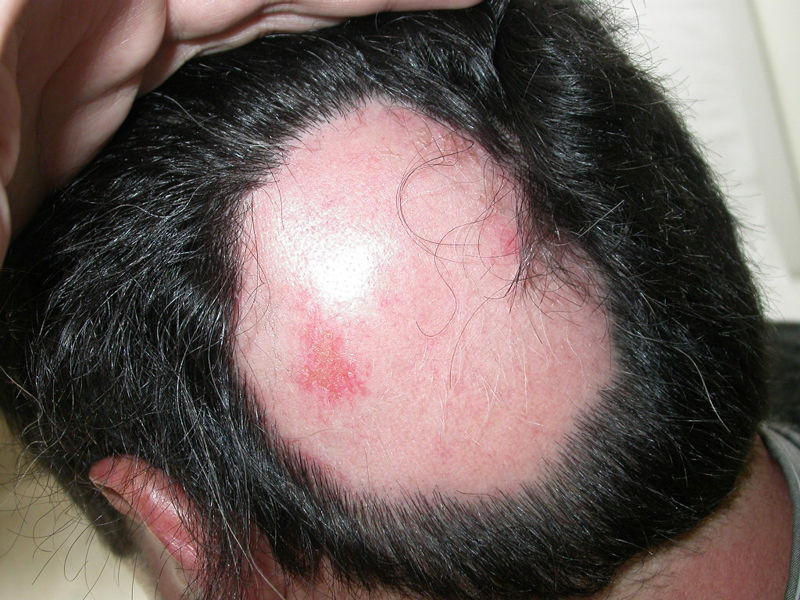
Un varón de 39 años con psoriasis en placas que realizaba tratamiento con adalimumab 40mg bisemanal durante el último año consultó por la aparición, en las últimas semanas, de dos placas de alopecia localizadas en el vértex (fig. 1). El paciente no tenía antecedentes familiares ni personales de AA ni refería ningún acontecimiento infeccioso, vacunal o estresante anterior al desarrollo de las lesiones. Con el diagnóstico de AA se suspendió el tratamiento con adalimumab y se pautó propionato de clobetasol 0,05% crema una vez al día. Después de 6 meses de seguimiento ambas placas de alopecia presentaban el mismo diámetro que en la primera consulta, a pesar de la suspensión del anti TNF- α.
Adalimumab es un anticuerpo monoclonal recombinante totalmente humanizado frente al TNF- α. Su uso está aprobado para trastornos como la artritis reumatoide, la espondilitis anquilosante, la enfermedad de Crohn, la psoriasis y la artritis psoriásica. El TNF- α es una citoquina con efectos proinflamatorios que forma parte de la inmunidad innata de nuestro organismo. Sin embargo, su neutralización por anticuerpos anti TNF- α, como adalimumab, se ha asociado a fenómenos y enfermedades autoinmunes como la esclerosis sistémica y el lupus eritematoso sistémico1. Aunque el papel del TNF- α en la fisiopatología de estos procesos es complejo, se ha demostrado que inhibe el crecimiento folicular in vitro2 y que es producido por las células mononucleares que rodean al folículo en la AA1, siendo, por tanto, una citoquina implicada en la caída del pelo. En este sentido los fármacos anti TNF- α y otras terapias biológicas se han utilizado en el tratamiento de la AA con resultados poco esperanzadores. Aunque se han descrito respuestas satisfactorias en algunos casos esporádicos, estudios más amplios no han podido demostrar efectos terapéuticos significativos con etanercept3, alefacept4 o efalizumab5.
Por el contrario, son cada vez más frecuentes los nuevos casos de AA en pacientes en tratamiento con anti TNF- α y otras terapias biológicas. Así, se han descrito casos de AA inducidos por etanercept, infliximab y adalimumab. García Bartels et al comunicaron el primer caso de AA inducido por adalimumab en una mujer de 23 años que desarrolló una alopecia universal dos meses después de iniciar dicho tratamiento6. Desde entonces se han descrito 7 pacientes más. Sólo dos tenían antecedentes previos de AA y tres desarrollaron una AA universal1,6–10. El tiempo transcurrido entre la introducción del anti TNF- α y el desarrollo de la alopecia osciló entre los dos meses y los dos años. La suspensión de adalimumab, cuando se hizo, no supuso la repoblación pilosa en ninguno de los casos durante el periodo de seguimiento, al igual que ocurrió en nuestro paciente.
Se desconoce de forma precisa el mecanismo por el cual el bloqueo del TNF- α podría inducir la AA. En 2005 De Bandt et al propusieron una hipótesis basada en un estudio de los casos de lupus eritematoso sistémico inducido por estos fármacos en Francia (22 casos)11. Según estos autores el TNF- α promovería la proliferación y función supresora de los linfocitos T CD4+ reguladores, responsables de mantener la tolerancia inmunológica y prevenir la autoinmunidad. De este modo la AA, así como otros procesos autoinmunes inducidos por fármacos anti TNF- α, podría desarrollarse por la inhibición de estos linfocitos T reguladores. Sin embargo, todos los casos de lupus se resolvieron tras la suspensión del anti TNF- α, al contrario de lo que podemos observar en la AA.
Presentamos un nuevo caso de AA asociado a tratamiento con adalimumab. Aunque no puede descartarse que se trate de una mera coincidencia, la descripción previa de otros casos de AA en pacientes tratados con adalimumab, así como el papel de los fármacos anti TNF- α como inductores de otras enfermedades autoinmunes, debe hacer pensar que esta relación entre AA y terapia con adalimumab es algo más que una simple asociación casual.