La relación entre la alopecia androgénica (AAG) y la enfermedad cardiovascular ha sido objeto de estudio por parte de algunos autores en las últimas décadas, y se han obtenido diferentes resultados en los distintos estudios epidemiológicos. El objetivo de este trabajo es conocer la prevalencia del síndrome metabólico y de la arteriosclerosis carotídea en los pacientes con AAG de inicio precoz.
Pacientes y métodosSe han estudiado 70 pacientes varones, 35 diagnosticados de AAG de inicio precoz (antes de los 35 años) y 35 controles atendidos por otras enfermedades dermatológicas. En ambos grupos se estudiaron los criterios de síndrome metabólico que propone la ATP-III (obesidad, trigliceridemia, cHDL, presión arterial sistólica, presión arterial diastólica y glucemia), la presencia de placa de ateroma y el grosor íntima-media carotídeo mediante ecografía Doppler. También se analizaron otros factores de riesgo cardiovascular, un estudio hormonal y de reactantes de fase aguda.
ResultadosEl 57,1% de los pacientes con AAG cumple criterios de síndrome metabólico frente al 14,3% del grupo control (p<0,0001). El 34% de los pacientes con AAG presentó placa de ateroma frente al 8,6% de los controles (p=0,018). Los valores de obesidad abdominal, presión arterial sistólica, trigliceridemia y glucemia analizados de forma independiente fueron estadísticamente superiores en el grupo de pacientes con AAG. Los niveles de testosterona y de la proteína transportadora de hormonas esteroideas fueron similares en ambos grupos; sin embargo, los niveles de insulina y aldosterona resultaron ser mayores en el grupo de pacientes con AAG (p<0,05).
ConclusionesLa elevada frecuencia con la que se presenta el síndrome metabólico y la ateromatosis carotídea en los pacientes con AAG hace necesario un cribado cardiovascular para detectar precozmente a aquellos individuos en riesgo e iniciar tratamiento preventivo antes de que se establezca la enfermedad cardiovascular.
The relationship between androgenetic alopecia and cardiovascular disease has been studied by some authors in the past, although the results of epidemiological studies have been variable. The objective of this study was to determine the prevalence of metabolic syndrome and carotid arteriosclerosis in patients with early-onset androgenetic alopecia.
Patients and methodsSeventy men were studied, 35 with diagnosis of early-onset (before 35 years of age) androgenetic alopecia and 35 control subjects who consulted for other skin conditions. In both groups, the criteria for metabolic syndrome according to the Adult Treatment Panel-III were studied (obesity, triglycerides, high-density lipoprotein cholesterol, systolic and diastolic blood pressure, and blood glucose), presence of atheromatous plaques, and carotid intima-media thickness using Doppler ultrasonography. Other cardiovascular risk factors, hormones, and acute-phase reactants were also analyzed.
ResultsCriteria for metabolic syndrome were met by 57.1% of the patients with androgenetic alopecia compared to 14.3% of the controls (P<0001). Thirty-four percent of the patients with androgenetic alopecia had atheromatous plaques compared to 8.6% of the controls (P=.018). In an independent correlation analysis, abdominal obesity, systolic blood pressure, triglycerides, and blood glucose levels were significantly greater among patients with androgenetic alopecia. Testosterone and sex hormone binding globulin levels were similar in the 2 groups whereas insulin and aldosterone levels were higher in patients with androgenetic alopecia (P<05).
ConclusionsThe high frequency of metabolic syndrome and carotid atheromatous plaques in patients with androgenetic alopecia suggests cardiovascular screening should be done to enable early detection of individuals at risk and initiation of preventive treatment before cardiovascular disease becomes established.
La alopecia androgénica (AAG) masculina es la forma más prevalente de alopecia y está determinada por 2 factores fundamentales: la herencia y la acción periférica de los andrógenos. La relación entre la AAG y la afectación cardiovascular ha sido objeto de estudio por parte de algunos autores en las últimas décadas, y se han obtenido diferentes resultados en los distintos estudios epidemiológicos. En algunos casos se encuentra un incremento del riesgo cardiovascular1,2, sobre todo en la alopecia de inicio precoz, que no se confirma en otros trabajos3. Lesko et al4, en un estudio de casos y controles, indican que la alopecia del vértex está asociada con el infarto de miocardio, y Lotufo et al5 muestran una asociación entre la gravedad de la alopecia y la enfermedad arterial coronaria. La mayoría de estos estudios considera el riesgo de infarto de miocardio o la mortalidad por causas cardíacas, sin analizar factores de riesgo cardiovascular de forma independiente.
Considerando la gran repercusión que tiene la enfermedad cardiovascular sobre la salud de la población en términos de morbimortalidad, y la importancia de la prevención primaria, creemos importante analizar la relación entre la AAG masculina y la enfermedad cardiovascular. Planteamos, para esto, un estudio de casos y controles para conocer la prevalencia de síndrome metabólico siguiendo los criterios de la pauta Adult Treatment Panel III (ATP-III)6 y de ateromatosis carotídea (placa de ateroma y grosor íntima-media [GIM]) en pacientes varones con AAG.
Pacientes y métodosSe trata de un estudio de casos y controles que incluye a 70 pacientes varones, 35 de ellos con AAG masculina y 35 controles, todos ellos diagnosticados en el Servicio de Dermatología del Hospital San Cecilio (Granada) en los días y las consultas seleccionadas al azar para tal efecto. El diagnóstico de AAG se basó en hallazgos clínicos, como alopecia de inicio precoz, disminución del diámetro y la densidad del pelo en la zona frontal o el vértex con mayor densidad sobre la zona occipital y presencia de cabellos miniaturizados y con diferente diámetro con dermoscopia. Los criterios de inclusión establecidos fueron edad entre los 35–55 años, AAG de inicio precoz (antes de los 35 años), grado de Ebling superior o igual a III y aceptación del paciente para participar en el estudio. Los criterios de exclusión fueron otros tipos de alopecia, tratamiento hormonal sustitutivo con testosterona o corticoides, presencia de hiperaldosteronismo, psoriasis, linfomas cutáneos u otros cánceres, excepto el cáncer cutáneo no melanoma, y el rechazo del paciente para participar en el trabajo. Los criterios de inclusión para los controles fueron edad entre 35–55 años y aceptación para participar en el estudio. Los criterios de exclusión para los controles fueron los mismos descritos anteriormente para los casos, y la presencia de AAG.
Se recogieron los siguientes datos: edad, antecedentes familiares de AAG, tratamientos que realiza o había realizado para la alopecia, tabaquismo, antecedentes familiares de enfermedad cardiovascular precoz (antes de los 55 años en el varón y antes de los 65 años en la mujer), antecedentes personales de enfermedad cardiovascular y consumo de fármacos (antidiabéticos orales, hipolipidemiantes y antihipertensivos). Se determinó el peso y la talla para confeccionar el índice de masa corporal (IMC, en kg/m2), el grado de alopecia según la escala de Ebling, el perímetro abdominal y la presión arterial, que se tomó en 2 mediciones en un intervalo de 10min y se consideró el valor medio.
Los niveles séricos de glucemia basal, triglicéridos, cHDL, LDL y total, testosterona, proteína transportadora de hormonas esteroideas (SHBG), aldosterona, insulina, proteína C reactiva (PCR), velocidad de sedimentación globular (VSG), fibrinógeno y dímero D (DD) se determinaron entre las 8.00 y las 9.00 a. m. tras un período de 10 h de ayuno. Las ecografías de carótidas se realizaron con un equipo Acuson Antares (Siemens®); se utilizó un transductor de 10–5MHz con programa de troncos supraaórticos y se estudió la presencia de placas de ateroma (se consideró como tal un GIM superior a 1,5mm) y el GIM en las carótidas comunes, el bulbo carotídeo y las carótidas internas; se consideró el valor medio para cada lado, derecho e izquierdo, tras 5 mediciones. Mediante el sistema Doppler se estudiaron las anomalías en los flujos carotídeos.
Para el análisis de las diferencias cualitativas entre las variables de estudio se utilizaron las tablas de contingencia con el estadístico de χ2 (Ji cuadrado) de Pearson, y la prueba exacta de Fisher cuando no se cumplieron las condiciones para aplicar la prueba anterior. En el caso de las variables cuantitativas se realizó un estudio de comparación de medias mediante la t de Student, previo análisis de la condición de normalidad con la prueba de Shapiro-Wilk y la prueba de Levene para el estudio de las variancias. La correlación entre variables se estudió mediante el coeficiente de correlación de Pearson y las técnicas de regresión exponencial. Los valores de p≤0,05 se consideraron estadísticamente significativos. Se utilizó el programa estadístico SPSS 15.0 para el análisis de los datos.
ResultadosDatos generalesSe estudiaron 35 pacientes varones caucásicos con AAG masculina (el 31,4% con grado III de Ebling, el 45,7% con grado IV y el 22,9% con grado V). El grupo control estaba formado por 35 pacientes varones con otras enfermedades dermatológicas comunes. La edad media de ambos grupos fue muy similar: 43 años (desviación estándar [DE] de 8,8) para el grupo control y 45,71 años (DE de 10,6) en el grupo de pacientes con AAG (p=0,25). El tiempo medio de evolución de la alopecia fue de 18,03 años (DE de 8,1). El 85,7% de los pacientes con AAG presentaba antecedentes familiares de alopecia frente al 17,1% de los controles (p<0,0001; odds ratio [OR]: 29; intervalo de confianza [IC] del 95%: 7,9–105,5). En cuanto al tratamiento para la alopecia, el 14,3% aplicaba minoxidil al 5% y sólo el 2,9% tomaba finasterida 1mg. No se observaron diferencias significativas en los valores de presión arterial entre los pacientes que utilizaban minoxidil. Los valores medios del peso, la talla, el IMC, el consumo de fármacos (antihipertensivos, antidiabéticos, hipolipidemiantes), los antecedentes personales y familiares de enfermedad cardiovascular, el sedentarismo y el tabaquismo se recogen en la tabla 1. La prueba de comparación de medias para muestras cuantitativas (t de Student) o la Ji cuadrado de Pearson para las cualitativas no mostró diferencias estadísticamente significativas, y se asumió,por tanto, que ambos grupos son similares en la distribución de todos estos parámetros.
Valores medios del peso, la talla, el índice de masa corporal, así como el consumo de fármacos (antihipertensivos, antidiabéticos, hipolipidemiantes), antecedentes personales y familiares de enfermedad cardiovascular, sedentarismo y tabaquismo en el grupo de pacientes con alopecia androgénica y controles
| Pacientes (AAG) | Grupo control | Valor p | |
| Peso, kg, media (DE) | 82,06 (13,8) | 83 (11,6) | 0,25 |
| IMC, kg/m2, media (DE) | 27,41 ( 3,6) | 27,15 (3,6) | 0,76 |
| Talla (DE), cm | 172,7 (8,4) | 174,9 (8,2) | 0,27 |
| Antihipertensivos, % | 17,1 | 11,4 | 0,24 |
| Antidiabéticos orales, %, | 8,5 | 2,8 | 0,60 |
| Hipolipidemiantes, % | 0 | 0 | – |
| Antecedentes personales coronarios, % | 0 | 0 | – |
| Antecedentes familiares de patología cardiaca (%) | |||
| Paternos | 11,4 | 5,7 | 0,21 (OR: 2,6; IC del 95%: 0,7–9,7) |
| Maternos | 8,5 | 2,8 | |
| Ambos | 5,7 | 2,8 | |
| Sedentarismo (%) | 48,5 | 40 | 0,63 |
| Tabaquismo (%) | 28,5 | 25,7 | 0,88 |
AAG: alopecia androgénica; DE: desviación estándar; IC: intervalo de confianza; IMC: índice de masa corporal; OR: odds ratio.
La prevalencia de síndrome metabólico se estableció siguiendo los criterios de la ATP-III6 (tabla 2). El 57,1% de los pacientes con AAG cumplía 3 o más de los criterios de síndrome metabólico frente al 14,3% del grupo control (p<0,0001; OR: 8; IC del 95%: 2,5–24,6%). En la tabla 3 se analizan las diferencias entre varones con AAG y el grupo control en todos los parámetros que comprenden el síndrome metabólico. Se realizó la t de Student para igualdad de medias y se observaron diferencias estadísticamente significativas en los valores medios de perímetro abdominal, hipertrigliceridemia, presión arterial sistólica y glucemia basal. Sin embargo, la media de los valores de la presión arterial diastólica y del cHDL fueron semejantes en ambos grupos (p>0,05). No se observaron diferencias significativas en los valores medios de cLDL (120,6 frente a 107mg/dl; p=0,096) ni en el colesterol total (198,7 frente a 184,2mg/dl; p=0,1) para pacientes con AAG y controles, respectivamente. Todas las variables del síndrome metabólico fueron independientes de la edad, el peso, la talla y el tiempo de evolución de la alopecia, salvo la obesidad abdominal, que se correlacionó positivamente con el peso (r=0,75; p<0,0001), el tiempo de evolución de la alopecia (r=0,24; p=0,037) y negativamente con el cHDL (r=−0,31; p=0,007). La presión arterial sistólica se correlacionó con la obesidad abdominal (r=0,36; p=0,02).
Criterios de la ATP-III de síndrome metabólico para varones
| Obesidad abdominal | >102cm |
| Trigliceridemia | >150mg/dl |
| Presión arterial sistólica | >130mmHg o tratamiento |
| Presión arterial diastólica | >85mmHg |
| cHDL | <40mg/dl |
| Glucemia | >110mg/dl o tratamiento |
Deben estar presentes 3 o más de los criterios para el diagnóstico de síndrome metabólico.
ATP-III: adult treatment panel III; cHDL: colesterol ligado a lipoproteínas de alta densidad.
Diferencias entre varones con alopecia androgénica y el grupo control en todos los parámetros que comprenden el síndrome metabólico
| Presencia de AAG | n | Media | DE | Valor p | |
| Obesidad abdominal (cm) | Sí | 35 | 103 | 8,5 | 0,039 |
| No | 35 | 98,6 | 8,7 | ||
| Hipertrigliceridemia (mg/dl) | Sí | 35 | 164,9 | 106,2 | 0,05 |
| No | 35 | 123,4 | 69,1 | ||
| cHDL (mg/dl) | Sí | 35 | 48,1 | 14 | 0,49 |
| No | 35 | 50,6 | 16,3 | ||
| PA sistólica (mmHg) | Sí | 35 | 135,5 | 16 | 0,049 |
| No | 35 | 125,9 | 23,3 | ||
| PA diastólica (mmHg) | Sí | 35 | 83,7 | 9,3 | 0,71 |
| No | 35 | 82,5 | 15,8 | ||
| Glucemia basal (mg/dl) | Sí | 35 | 105,7 | 42,9 | 0,04 |
| No | 35 | 89,8 | 16,6 |
AAG: alopecia androgénica; cHDL: colesterol ligado a lipoproteínas de alta densidad; DE: desviación estándar; PA: presión arterial.
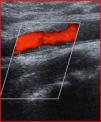
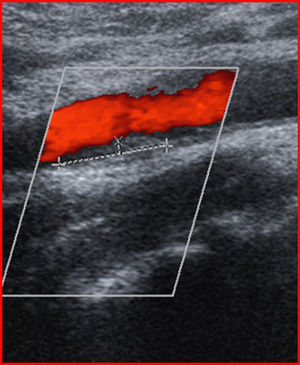
El 20% de los pacientes con AAG presentó placa de ateroma carotídea unilateral (fig. 1) y el 14,3% presentó placa de ateroma carotídea de forma bilateral. El 8,6% de los controles tenía placa de ateroma unilateral (p=0,018; OR: 5,5; IC del 95%: 1,4–21,9). Salvo en el 8,5% de los casos, en el que se halló una alteración del flujo sanguíneo (estenosis moderada-grave) y se completó el estudio con angiorresonancia magnética, en el resto, las placas de ateroma no producían alteración hemodinámica significativa (ausencia de estenosis). En el grupo de pacientes con AAG, el 46,5% de las placas se describió como fibroadiposas (hiperecogénicas-hipoecogénicas) y las restantes de tipo calcificadas (hiperecogénicas). El GIM carotídeo derecho e izquierdo fue estadísticamente superior en pacientes con AAG en relación con el grupo control (0,70 frente a 0,55mm; p<0,001 para el lado izquierdo y 0,69 frente a 0,60mm; p=0,022 para el lado derecho). La correlación entre el GIM derecho e izquierdo fue muy elevada (r=0,76; p<0,0001). El 60% de los pacientes con placa de ateroma tenía síndrome metabólico (p=0,027; OR: 3,65; IC del 95%: 1,1–11,9). Los pacientes con placa de ateroma presentaron valores significativamente superiores de obesidad abdominal (104,9 frente a 99,8cm; p=0,04), hipertrigliceridemia (190,5 frente a 130,8mg/dl; p=0,024), presión arterial diastólica (89,3 frente a 81,8mmHg; p=0,047) y glucemia (120 frente a 89,5mg/dl; p=0,001).
Parámetros de inflamación crónicaLos valores medios de fibrinógeno, DD y VSG fueron significativamente superiores en los pacientes con AAG (tabla 4); sin embargo, no hubo diferencias significativas en los valores medios de PCR. Los pacientes con síndrome metabólico presentaron valores medios significativamente más elevados de fibrinógeno (347 frente a 301,2mg/dl; p=0,042) y de VSG (12,6 frente a 7,2mm/h; p=0,03) y los pacientes con placa de ateroma presentaron valores significativamente superiores de DD (159,5 frente a 104,8ng/ml; p=0,043) y de VSG (13,9 frente a 6,4mm/h; p=0,027). Los valores medios de DD se correlacionaron positivamente con la obesidad abdominal (r=0,27; p=0,022) y las cifras de VSG se correlacionaron positivamente con la hipertrigliceridemia (r=0,46; p<0,0001).
Estudio comparativo en el grupo de pacientes con alopecia androgénica y el grupo control de parámetros de fase aguda
| Presencia de AAG | n | Media | DE | Valor p | |
| PCR, mg/dl | Sí | 35 | 0,39 | 0,57 | 0,83 |
| No | 35 | 0,36 | 0,65 | ||
| Fibrinógeno, mg/dl | Sí | 35 | 337,74 | 61,3 | 0,037 |
| No | 35 | 290,51 | 116,2 | ||
| DD, ng/ml | Sí | 35 | 157,2 | 108,3 | 0,046 |
| No | 35 | 109,4 | 87,4 | ||
| VSG, mm/h | Sí | 35 | 13,5 | 14,2 | 0,05 |
| No | 35 | 8,3 | 6,4 |
AAG: alopecia androgénica; DD: dímero D; DE: desviación estándar; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
Los niveles medios de insulina y aldosterona fueron significativamente más elevados en los pacientes con AAG (tabla 5). Sin embargo, no se encontraron diferencias en las cifras medias de testosterona ni SHGB. Los valores medios de insulina fueron significativamente superiores en los pacientes con síndrome metabólico (12,3 frente a 9μU/ml; p=0,020) y el resto de los parámetros hormonales no mostró diferencias entre estos grupos. El grupo de pacientes con placa de ateroma presentó también niveles superiores de insulina basal (13,3 frente a 8,9μU/ml; p=0,007), sin diferencias en relación con los restantes parámetros. La insulina se correlacionó de forma positiva con los valores de glucemia (r=0,54; p<0,0001). Los sujetos con AAG e hipertensos presentaron valores superiores de aldosterona respecto al grupo de alopécicos sin hipertensión. Sin embargo, los valores de aldosterona en el grupo de sujetos sin AAG fueron similares, independientemente de la presión arterial, y más bajos que en el grupo de pacientes con AAG.
Estudio comparativo en el grupo de pacientes con alopecia androgénica y el grupo control de parámetros hormonales
| Presencia de AAG | n | Media | DE | Valor p | |
| Testosterona, ng/ml | Sí | 35 | 5,25 | 1,8 | 0,16 |
| No | 35 | 4,69 | 1,5 | ||
| Aldosterona, pg/ml | Sí | 35 | 199,24 | 110,8 | 0,041 |
| No | 35 | 152,28 | 74,4 | ||
| Insulina, μU/ml | Sí | 35 | 11,7 | 6,5 | 0,004 |
| No | 35 | 7,9 | 3,8 | ||
| SHBG, nmol/l | Sí | 35 | 29,5 | 34,3 | 0,97 |
| No | 35 | 29,3 | 21,7 |
AAG: alopecia androgénica; DE: desviación estándar; SHBG: proteína transportadora de hormonas esteroideas.
Los resultados de este estudio confirman la relación de la AAG masculina con una mayor prevalencia de factores de riesgo cardiovascular incluidos en los criterios de síndrome metabólico y un incremento de la ateromatosis carotídea.
La asociación entre la AAG y la enfermedad cardiovascular fue sugerida inicialmente por Cotton et al1 en 1972. Desde entonces se han realizado numerosos estudios epidemiológicos para corroborar esta relación, con diferentes resultados. La mayoría de ellos se han centrado en el análisis de la enfermedad coronaria (infarto agudo de miocardio o mortalidad por causas cardíacas) y en pocos casos se ha estudiado la asociación con factores de riesgo cardiovascular, como criterios de síndrome metabólico o presencia de placa de ateroma carotídea.
Los 2 grupos estudiados fueron muy homogéneos en cuanto a la distribución de datos antropométricos, como el peso, la talla o el IMC; otros factores de confusión como el tabaquismo, el sedentarismo, los antecedentes personales o familiares de enfermedad cardíaca y el consumo de fármacos también se distribuyeron de forma similar en los 2 grupos.
Síndrome metabólicoAl comparar la frecuencia de síndrome metabólico en ambos grupos, encontramos diferencias importantes. Más de la mitad de los pacientes con alopecia cumplía 3 o más de los criterios de síndrome metabólico, y se consideraba como criterio imprescindible la presencia de obesidad abdominal siguiendo las últimas recomendaciones de la International Diabetes Federation. En el grupo control sólo se diagnosticó de síndrome metabólico al 14,3% de los sujetos.
La relación entre la enfermedad cardiovascular y el síndrome metabólico está bien documentada. Según trabajos recientes, los individuos que cumplen los criterios de la ATP-III tienen entre 2,59 y 3,5 más posibilidades de experimentar un episodio cardiovascular en los próximos 10 años7,8. Además, estos autores defienden que existe una mejor correlación entre los criterios de la ATP-III y la enfermedad cardiovascular que con otros criterios de síndrome metabólico que se han definido.
No se han publicado estudios que analicen la prevalencia de síndrome metabólico siguiendo los criterios de la ATP-III en sujetos con AAG. Sin embargo, la prevalencia de síndrome metabólico descrita para la población general varía desde el 11,7%, cifra similar a la de nuestro estudio, al 30% en la población brasileña, con un valor medio en algunos trabajos publicados en España del 20%9–12.
En nuestro estudio, la obesidad abdominal ha tenido un valor medio significativamente superior para los sujetos con alopecia; sin embargo, no existen diferencias en ambos grupos en relación con el peso ni con el IMC, lo que indica que en los sujetos con alopecia se produce una redistribución abdominal de la grasa, y se considera un factor importante de riesgo cardiovascular relacionado en muchos estudios con la resistencia a la insulina. En nuestro estudio, los sujetos con alopecia han presentado valores medios de insulina más elevados, lo que indica una resistencia periférica a la insulina y un intento compensador del páncreas por mantener sus acciones. De igual forma, hemos comprobado que los pacientes con síndrome metabólico tienen hiperinsulinemia (insulina superior a 10μU/ml), lo que confirma que la resistencia a la insulina es un elemento clave en la patogenia del síndrome metabólico.
Matilainen et al13 establecieron la asociación entre la AAG de inicio precoz y la resistencia a la insulina, pero el mecanismo mediante el que la resistencia a la insulina contribuye a la alopecia no está claro. Es posible que el exceso de insulina circulante provoque una vasoconstricción y un déficit nutricional en los folículos del cuero cabelludo, lo que favorecería el efecto de la dihidrotestosterona (DHT) en la miniaturización folicular. Klemp et al14 ya habían apuntado que la reducción del flujo sanguíneo en el cuero cabelludo podría estar relacionada con la AAG de inicio precoz. Además, se ha documentado la existencia de una insuficiencia microvascular en áreas de alopecia15.
Los valores medios de presión arterial sistólica han sido significativamente superiores en el grupo de pacientes con alopecia, sin encontrar diferencias en las cifras de presión arterial diastólica. Probablemente el tratamiento antihipertensivo ligeramente superior en los pacientes con alopecia haya reducido las diferencias de presión arterial diastólica entre ambos grupos.
Recientemente se ha publicado un artículo que analiza la relación entre la AAG y la hipertensión. El 82% de los pacientes con hipertensión (superior a 140/90mmHg) tenía alopecia, frente al 56% de los normotensos (p<0,001) y confirmaron que tal asociación era independiente de la edad16. Los autores proponen 2 explicaciones para esta asociación: la primera es que los andrógenos implicados en la patogenia de la AAG se unan a los receptores vasculares y favorezcan el aumento de la presión sanguínea; la segunda es que el hiperaldosteronismo, que subyace a la mayoría de los casos de hipertensión, participe directamente en el desarrollo de la alopecia, sobre la base de un estudio realizado con ratones transgénicos con sobreexpresión cutánea de receptores mineralocorticoideos que desarrollaban alopecia17. Sin embargo, en este estudio no determinaron los valores de aldosterona.
Las cifras de aldosterona en nuestros pacientes alopécicos fueron significativamente superiores al grupo control (199 frente a 152pg/ml; p<0,05), lo que apoya la hipótesis anterior. No encontramos, sin embargo, diferencias significativas en los valores de testosterona. En estos casos, la utilización de antagonistas de la aldosterona podría tener un doble efecto beneficioso: por un lado, el control de la presión arterial, y, por otro, la detención de la progresión de la alopecia. Los nuevos fármacos antagonistas selectivos de los receptores de aldosterona podrían resultar útiles para el tratamiento de la AAG masculina, y evitar los efectos adversos antiandrogénicos de la espironolactona18.
Hirsso et al19 también encuentran cifras tensionales más elevadas en pacientes con AAG en relación con el grupo control (el 65 frente al 45%), así como una mayor frecuencia de diabetes y de hiperinsulinemia. Sin embargo, este mismo autor, en un trabajo publicado en 20072, no halla diferencias estadísticamente significativas para los niveles de presión arterial sistólica o diastólica en pacientes menores de 35 años.
Los valores medios de cHDL, aunque algo menores en el caso de los pacientes con alopecia, resultaron bastante similares. Sus niveles plasmáticos están muy relacionados con el ejercicio físico; las tasas tan elevadas de sedentarismo que encontramos en ambos grupos justifican los bajos valores de cHDL y la ausencia de diferencias. Sin embargo, los valores medios de triglicéridos son más altos en los alopécicos si los comparamos con los del grupo control (164 frente a 123mg/dl; p<0,05). Matilainen et al20 obtienen resultados similares en su estudio cuando comparan la trigliceridemia en varones alopécicos revascularizados por enfermedad cardíaca con un grupo control. Sharrett et al21 estudiaron estos 2 parámetros (cHDL y triglicéridos) en la población general y afirman que la asociación con presencia de placa de ateroma no era muy importante, pero, sin embargo, se asociaban fuertemente con la enfermedad coronaria; así, mostraban que los valores elevados de triglicéridos y los niveles bajos de cHDL se relacionaban con la transición de ateroma a aterotrombosis y que, por tanto, el control de estos 2 factores de riesgo cardiovascular es fundamental en pacientes con enfermedad subclínica.
Los valores de glucemia resultaron estar significativamente más elevados en el grupo de alopécicos en relación con el grupo control (105 frente a 89mg/dl; p=0,04). El 19% de los sujetos con alopecia presentaba valores de glucemia basal alterada; sin embargo, en el grupo control todos los individuos tenían glucemias inferiores a 110mg/dl. Hirsso et al2 destacan una frecuencia de diabetes del 21% en los sujetos con AAG y de un 12% en el grupo control. La hiperglucemia en sujetos con valores de insulina más elevados se justifica por la resistencia periférica a la acción de la insulina.
Ateromatosis carotídea y estudio de flujosEl segundo aspecto importante analizado en este trabajo es la presencia de placa de ateroma carotídea, estudiada mediante ecografía Doppler. Se asume en muchos estudios que la patogenia es similar para la aterosclerosis coronaria y cardíaca y que, por tanto, la presencia de placa de ateroma carotídea predice también el daño coronario21. El 34% de los pacientes con AAG presentaba placas de ateroma y en 3 de ellos había alteraciones hemodinámicas con alteración del flujo carotídeo. Por el contrario, solamente el 8,6% de los pacientes del grupo control presentó placa de ateroma de forma unilateral. Además, el GIM carotídeo es superior en los pacientes con AAG.
La mayoría de los trabajos que versan sobre el tema no estudia la presencia de ateromatosis carotídea como factor predisponente de enfermedad cardiovascular, sino que analiza directamente los episodios cardiovasculares, generalmente del tipo infarto de miocardio, con un denominador común: solo analizar a los sujetos que han sobrevivido a la enfermedad coronaria, con lo que se pierden los datos de los pacientes que fallecen y no tienen en cuenta a los individuos asintomáticos con enfermedad coronaria.
Shahar et al22 publican un nuevo trabajo sobre calvicie e infarto de miocardio. A pesar de que establecen una OR de 1,43 (IC del 95%: 1,05–1,86) para el grupo de pacientes con alopecia moderada en la zona del vértex, concluyen que el patrón masculino de alopecia no es un factor de riesgo importante para el infarto de miocardio o la aterosclerosis asintomática. Realizan un análisis muy interesante de medición del GIM en los sujetos sin enfermedad cardiovascular y comparan los resultados según el grado de alopecia, pero no encuentran diferencias estadísticamente significativas en el GIM según el grado de alopecia, a pesar de estudiar a un número importante de pacientes. Sin embargo, no analizan si la presencia de placa de ateroma difiere en ambos grupos, y hay que tener en cuenta que para algunos autores ésta se correlaciona mejor con el infarto de miocardio que el GIM23. Sin embargo, Dogramaci et al24 encuentran una asociación entre la AAG grave y un mayor GIM carotídeo, pero tampoco analizan la prevalencia de placa de ateroma.
No se han publicado trabajos previos que analicen la prevalencia de placa de ateroma en pacientes con AAG. El estudio de Junyent et al25 analiza la frecuencia de placa de ateroma en la población general, en la que se observan cifras similares a las de nuestro grupo control para edades similares. Nuestro trabajo estudia la prevalencia de placa de ateroma y el GIM en pacientes con AAG; la placa de ateroma es un parámetro más fácil de medir que el GIM y muy útil para valorar el riesgo cardiovascular global de nuestros pacientes. Es una técnica no invasiva, fiable, reproducible y con bajo coste, y, por todo esto, es la técnica de elección para la detección de la aterosclerosis subclínica, lo que permite una estratificación más allá de los factores de riesgo comunes.
Parámetros de inflamación crónicaSe midieron, además, algunos reactantes de fase aguda en ambos grupos, como el DD, el fibrinógeno, la VSG y la PCR, con valores medios significativamente superiores para todos ellos salvo para la PCR en el grupo de pacientes con alopecia. Los pacientes con síndrome metabólico presentaron valores superiores de fibrinógeno y VSG (p<0,05). También fue estadísticamente significativa la asociación de la VSG y el DD con la presencia de placa de ateroma. Sin embargo, Hirsso et al2 describieron un incremento de la PCR ultrasensible en pacientes menores de 35 años con alopecia moderada o grave a medida que aumentaba el índice cintura-cadera.
Se ha comprobado que la inflamación crónica desempeña un importante papel en la presencia de resistencia a la insulina, la disfunción endotelial y la enfermedad cardiovascular26. Esta situación proinflamatoria que subyace a la AAG y que se manifiesta con la presencia de valores medios de reactantes de fase aguda más elevados, podría favorecer el incremento de citoquinas proinflamatorias encontradas en la pared arterial y en el folículo piloso. La microinflamación que se encuentra en el folículo piloso y que puede estar relacionada con la patogenia de la alopecia podría ser una manifestación local de una inflamación sistémica, que se relaciona con la mayor frecuencia de síndrome metabólico y de enfermedad cardiovascular en sujetos con alopecia2.
Estudio hormonalEn relación con el estudio hormonal realizado a nuestros pacientes, no encontramos diferencias significativas en los niveles de testosterona y SHBG en ninguno de los grupos, resultado esperable porque los sujetos con AAG no tienen niveles más elevados de testosterona, sino una mayor sensibilidad periférica a los andrógenos. La testosterona se transforma en DHT por la acción de la 5-alfa-reductasa, actúa a nivel del folículo piloso y provoca la miniaturización de éste.
Además, se ha descrito la presencia de la enzima 5-alfa-reductasa en la capa muscular de los vasos sanguíneos y el corazón27, de forma que la testosterona se convierte en DHT por la acción de esta enzima, y estimula la síntesis de la musculatura lisa de los vasos. Se podría explicar, por tanto, la relación existente entre la AAG y la presencia de placa de ateroma por una mayor sensibilidad de los andrógenos tanto en el cuero cabelludo como en la musculatura vascular, lo que favorece en un caso la miniaturización folicular y, en otro, la presencia de placa de ateroma.
Mecanismos patogénicos que explican el incremento del riesgo cardiovascular en pacientes con alopecia androgénica- 1.
La hiperinsulinemia producida por un incremento de la resistencia a su acción periférica se ha considerado para explicar la relación entre la AAG y la afectación cardiovascular. Los niveles elevados de insulina constituyen el eje central del síndrome metabólico, y favorecen la intolerancia hidrocarbonada y la obesidad abdominal de tipo central. Además, se ha demostrado que la insulina favorece la vasoconstricción y el déficit nutricional en los folículos del cuero cabelludo, e incrementa el efecto de la DHT en la miniaturización folicular. En nuestro estudio hemos hallado cifras de insulina más elevadas en los pacientes con síndrome metabólico, resultado claramente esperable; además, los valores de esta hormona fueron significativamente más altos en el grupo de sujetos con alopecia, lo que apoya esta teoría.
- 2.
Se ha demostrado que la sobreexpresión de receptores mineralocorticoideos en ratones transgénicos y su estimulación provoca alopecia. La asociación entre la hipertensión arterial y la presencia de AAG que se ha documentado en algunos estudios se podría explicar de esta forma. Se esgrime un hiperaldosteronismo como causa de la hipertensión esencial, de forma que la aldosterona estimularía estos receptores cutáneos, lo que favorecería la progresión de la alopecia. En nuestro estudio hemos encontrado niveles más elevados de aldosterona en los pacientes con AAG, y esta diferencia es estadísticamente significativa. Además, en nuestro estudio observamos que los valores de aldosterona son superiores exclusivamente en el grupo de pacientes hipertensos con alopecia, con valores de aldosterona inferiores en los sujetos hipertensos no alopécicos.
- 3.
La AAG se produce por una mayor sensibilidad periférica a los andrógenos, de forma que la testosterona libre se transforma por acción de la 5-alfa-reductasa en DHT, y favorece la miniaturización folicular. De la misma forma, se ha determinado la presencia de la enzima 5-alfarreductasa en los vasos sanguíneos y el corazón, junto con la existencia de receptores de DHT, implicados en la proliferación de la musculatura lisa de los vasos, fenómeno clave en la arteriosclerosis, junto con el depósito lipídico. Uno de los mecanismos para explicar el incremento de la prevalencia de la placa de ateroma encontrado en nuestros pacientes con AAG sería el incremento de la sensibilidad a los andrógenos tanto a nivel del cuero cabelludo, lo que favorece la miniaturización folicular, como a nivel vascular, lo que promueve el desarrollo de placas de ateroma.
- 4.
Se puede recurrir a la genética para explicar la relación alopecia-enfermedad cardiovascular, y subrayar el papel tan importante que tienen los antecedentes familiares en el desarrollo de la alopecia, de igual forma que la enfermedad cardiovascular tiene un importante componente hereditario. En nuestro estudio hemos encontrado una relación muy significativa entre la presencia de AAG y los antecedentes familiares de ésta. Los antecedentes familiares de enfermedad cardíaca han sido también superiores en el grupo de pacientes con alopecia (OR: 2,6; IC del 95%: 0,7–9,7).
- 5.
La presencia de parámetros de inflamación crónica, más elevados en pacientes con AAG, ha servido para explicar la relación con la enfermedad cardiovascular. Esta posible situación proinflamatoria que subyace a la AAG, y que se manifiesta con la presencia de valores medios de reactantes de fase aguda más elevados en sujetos alopécicos, podría favorecer el incremento de citoquinas proinflamatorias encontradas en la pared arterial y en el folículo piloso. Nosotros hemos encontrado valores más elevados de DD, VSG y fibrinógeno en los pacientes con AAG en relación con el grupo control, lo que apoya, por tanto, esta explicación.
El incremento del tamaño muestral permitiría analizar cómo se comportan estos factores de riesgo cardiovascular en función del grado de AAG según la escala de Ebling. Además, sería interesante estudiar estos mismos parámetros en mujeres con AAG y realizar un análisis comparativo con los varones. A pesar de que los estudios de casos y controles pueden incurrir en sesgos de selección, en el presente trabajo la distribución de todos los factores de confusión fue homogénea en ambos grupos.
En cualquier caso, se ha establecido una relación entre la AAG y los factores de riesgo cardiovascular incluidos en los criterios de síndrome metabólico y ateromatosis carotídea que puede explicarse por diferentes mecanismos; no son excluyentes, sino complementarios. Pensamos que la realización por parte del dermatólogo de un cribado cardiovascular en los pacientes que presentan AAG puede ser útil para detectar a aquellos individuos en riesgo e iniciar tratamiento preventivo antes del desarrollo de la enfermedad cardiovascular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A las Dras. Fernández Pugnaire y Burkhardt Pérez por su gran ayuda en el trabajo de campo.