El tratamiento de una paciente gestante es siempre complejo debido a la limitación del arsenal terapéutico disponible, por los posibles efectos teratógenos que el fármaco pueda producir. A esta complejidad general se une, en el caso de los fármacos de administración tópica, la falta de estudios, tanto de teratogenia como del grado de absorción sistémica de estos fármacos1. Por ello, es útil disponer de la información que se posee sobre la teratogenia de los fármacos más usualmente utilizados en dermatología.
Hemos realizado una selección de los fármacos que se utilizan con más frecuencia en el tratamiento de las enfermedades dermatológicas, clasificándolos por su actividad farmacológica. Se realizó una búsqueda de los estudios de teratogenia recogidos de todos ellos, evaluados en diferentes bases de datos, tanto informáticas: TERIS2, REPROTOX3 y SHEPARD'S4 (integradas en la base de datos de medicamentos MICROMEDEX) como en soporte papel1,4-7. Entre estas últimas destaca el ya clásico libro Drugs in pregnancy and lactation8. En el caso de no hallar información en ninguna de estas bases de datos se recurrió al Catálogo de Especialidades Farmacéuticas9.
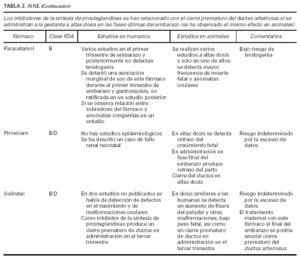
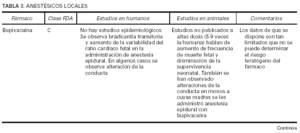
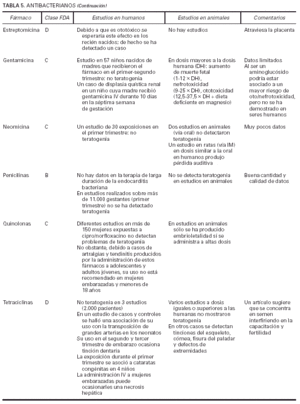
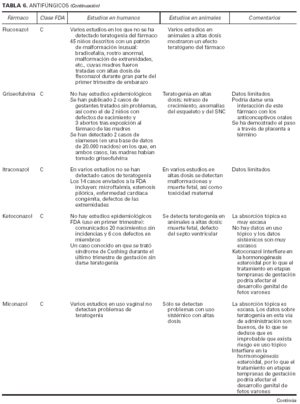
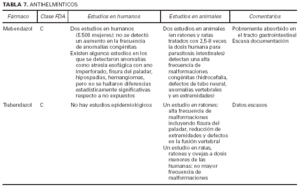
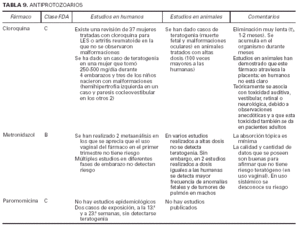
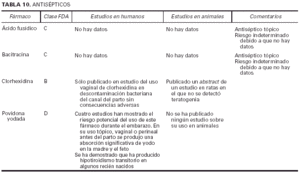
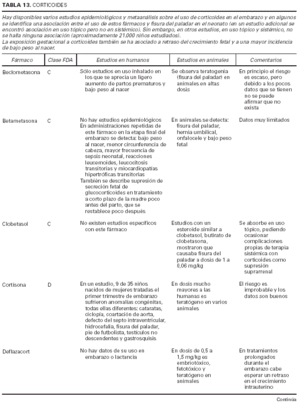
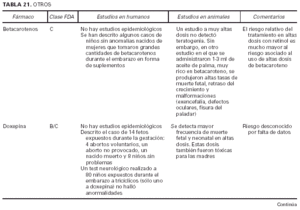
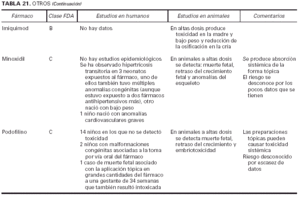
Toda la información se recopiló en tablas que contienen cuatro apartados:
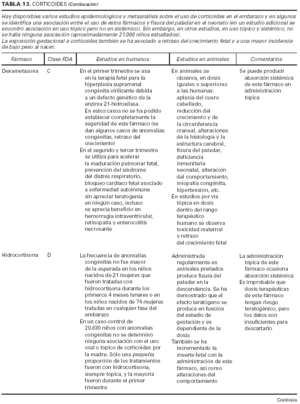
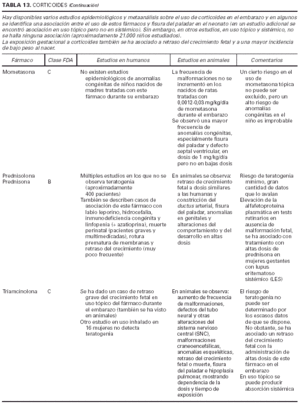
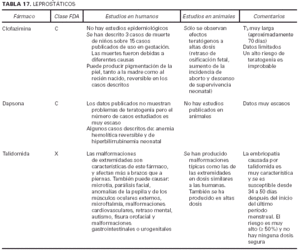
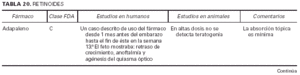
1. Clasificación de teratogenia de la Food and Drugs Administration (FDA)4,6 (tabla 1). En algunos casos, esta casilla se encuentra vacía por falta de asignación de este fármaco a una categoría de la FDA.
2. Estudios realizados en seres humanos (ensayos clínicos, estudios de casos y controles, estudios de cohortes, etc.), diferenciando, cuando estaba indicado, la etapa de gestación en la que se llevó a cabo el estudio, el número de sujetos estudiados, la vía de administración, los casos descritos de teratogenia y el perfil teratógeno.
3. Estudios realizados en animales, describiendo si la dosis utilizada fue mayor, menor o equivalente a la dosis humana, la vía de administración y el perfil de teratogenia hallado.
4. Información adicional: grado de absorción de los preparados tópicos, paso del fármaco a través de la placenta, características de los datos obtenidos (cantidad y calidad), etc.
La información sobre el grado de teratogenia de los fármacos es difícil de interpretar, en muchas ocasiones, debido principalmente al bajo número de sujetos estudiados, lo cual hace difícil poder establecer una relación causa-efecto de los casos observados. A ello hay que añadir que la información sobre teratogenia se centra en la administración sistémica de los fármacos, mientras que se han realizado muy pocos estudios y/o seguimientos de los posibles efectos teratógenos derivados de la aplicación tópica, incluso en aquellos fármacos en los que se ha demostrado un grado de absorción sistémica considerable. Por lo tanto, aún resulta más complicado encontrar información sobre aquellos fármacos cuyo uso es principalmente tópico, incluso en los datos aportados por el laboratorio farmacéutico fabricante. Todo ello se refleja en los medicamentos estudiados. Así, se han encontrado muy pocos estudios sobre la teratogenia en el uso tópico de los fármacos, ya sea en seres humanos o en animales, y en aquellos de administración exclusivamente tópica, la clasificación en la categoría «C» de la FDA obedece, en la mayoría de los casos, a la escasez de datos de teratogenia disponibles. Los resultados obtenidos se exponen en las tablas 2 a 21.