El adenoma sebáceo (AS) y el carcinoma sebáceo (CS) son unos tumores anexiales infrecuentes que muestran una diferenciación sebácea. El AS es una lesión benigna, mientras que el CS es una neoplasia maligna. Ambos pueden aparecer de forma aislada o en el contexto de un síndrome de Muir-Torre (SMT)1.
Un varón de 60 años consultó por la aparición progresiva en los últimos 8 años de unas tumoraciones faciales asintomáticas. El paciente había recibido un trasplante pulmonar 15 años antes, por el que estaba en tratamiento inmunosupresor con tacrolimus y glucocorticoides orales y, durante los últimos 3 años, también con everolimus. La introducción de este último se acompañó de una estabilización de las lesiones cutáneas. No refirió antecedentes personales ni familiares de neoplasia o de poliposis intestinal.
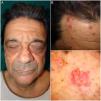
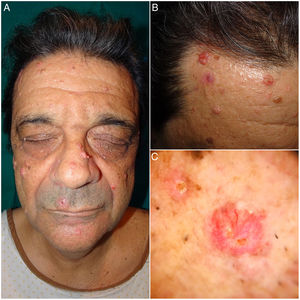
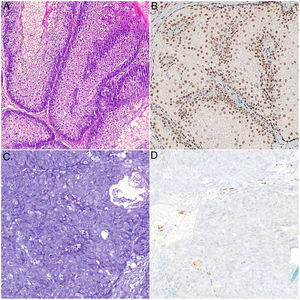
A la exploración física se observaban unas tumoraciones faciales umbilicadas múltiples, de color rosado, de 5 a 25mm de tamaño y de localización predominante en el dorso nasal, la frente y las mejillas. En la dermatoscopia se identificó la presencia de glóbulos amarillos pálidos sobre un fondo eritematoso, acompañados de unos vasos ramificados y tortuosos (fig. 1). En el estudio dermatopatológico se observó una lesión tumoral, bien circunscrita y formada por unos lóbulos sebáceos separados por unos tabiques de tejido conectivo. Cada lóbulo estaba constituido por unas células basaloides en la periferia, y unas células sebáceas maduras en el centro. Destacó una maduración más desordenada que la de las glándulas sebáceas normales, con escasas figuras mitóticas y ausencia de necrosis. Estos hallazgos fueron compatibles con el diagnóstico de AS (fig. 2A). La inmunohistoquímica para MLH1, MSH2, MSH6 y PMS2 descartó la existencia de inestabilidad de microsatélites, haciendo muy improbable el diagnóstico de un SMT asociado (fig. 2B).
A y B) Imágenes histológicas de AS. Se aprecian unos lóbulos sebáceos constituidos por unas células basaloides en la periferia y unas células sebáceas maduras en el centro separados por unos tabiques de tejido conectivo. Positividad nuclear intacta para MSH6: A) Hematoxilina-eosina, ×20; B) Inmunohistoquímica para MSH6, ×20. C y D) Imágenes histológicas de CS. Células indiferenciadas con unos núcleos grandes, nucléolos prominentes, abundantes figuras de mitosis y unas zonas de necrosis. Se observa pérdida de positividad nuclear para MSH6 en las células tumorales: C) Hematoxilina-eosina, ×20; D) Inmunohistoquímica para MSH6, ×20.
En sucesivas revisiones se extirparon varias lesiones con un objetivo diagnóstico y terapéutico. Todas estas lesiones fueron informadas como AS, salvo una lesión de 2 meses de evolución localizada en la zona maxilar, que fue diagnosticada de CS. El estudio dermatopatológico de esta última mostró una tumoración con un patrón lobular, ulcerada y constituida por unas células indiferenciadas con núcleos grandes, nucléolos prominentes y abundantes figuras de mitosis. La tumoración penetraba en profundidad y mostraba amplias zonas de necrosis (fig. 2C). Se realizó un estudio inmunohistoquímico para las proteínas reparadoras de errores de replicación del ADN que mostró una pérdida de la positividad nuclear en las células tumorales exclusivamente para MSH6 (fig. 2D). Se realizó una ampliación de márgenes del CS que fue negativa, así como una ecografía cervical y de parótidas con las que se descartó la afectación locorregional. Se practicó una colonoscopia como cribado de cáncer colorrectal donde el único hallazgo fue un pólipo hiperplásico aislado en la zona rectal. El paciente continúa realizando revisiones clínico-radiológicas semestrales.
Los pacientes trasplantados de órgano sólido en tratamiento inmunosupresor presentan un mayor riesgo de desarrollar tumores anexiales cutáneos, entre ellos los sebáceos2. Los inhibidores de la calcineurina (IC) como ciclosporina y tacrolimus promueven su desarrollo a través de la interacción con los receptores de factor de crecimiento transformante beta (TGF-β), la sobreexpresión de TGF-β1 y el factor de crecimiento vascular endotelial (VEGF-C), interviniendo en la diferenciación y el crecimiento de las glándulas sebáceas.
La aparición de neoplasias y proliferaciones con diferenciación sebácea en pacientes trasplantados sometidos a IC es muy infrecuente. Ha sido descrita tanto de forma esporádica como asociada a un SMT (tabla 1)3–10.
Casos descritos de neoplasias sebáceas en pacientes trasplantados tratados con IC
| Tipo de neoplasia o proliferación | Trasplante | Inhibidor de la calcineurina | Síndrome de Muir-Torre | |
|---|---|---|---|---|
| 3. Jung HY, Ann Dermatol. 2016 | Hiperplasia sebácea | Renal | Ciclosporina + tacrolimus | No |
| 4. Boschnakow A, Br J Dermatol. 2003 | Hiperplasia sebácea (×2 pacientes) | Renal (×2) | Ciclosporina (×2) | No (×2) |
| 5. Levandoski KA, Dermatol Online J. 2017 | Hiperplasia sebácea | Renal | Tacrolimus | No |
| 6. Seo BF, Ann Dermatol. 2014 | Carcinoma sebáceo | Hepático | Tacrolimus | No |
| 7. Kaminska ECN, J Cutan Pathol. 2013 | Neoplasia sebácea borderline | Renal | Tacrolimus | No |
| 8. Donati M, Exp Clin Transplant. 2017 | Adenomas sebáceos múltiples | Renal | Tacrolimus | Dudoso. Mutación en MSH6-eson 1 (c116G>A) |
| 9. Landis MN, J Am Acad Dermatol. 2011 | Adenomas sebáceos múltiples, sebaceomas, carcinomas sebáceos | Renal | Tacrolimus | Sí |
| 10. Levi Z, Am J Transplant. 2007 | Adenomas sebáceos múltiples, carcinomas sebáceos | Pulmonar | Tacrolimus | Sí |
| Nuestro caso | Adenomas sebáceos múltiples y carcinoma sebáceo | Pulmonar | Tacrolimus | No |
IC: inhibidores de la calcineurina.
En nuestro caso, la secuencia temporal sugiere que es probable que sea tacrolimus el fármaco responsable en la patogenia de las neoplasias sebáceas de nuestro paciente. El everolimus no parece estar relacionado con el desarrollo de estas neoplasias sebáceas dado que fue administrado una vez ya estaban presentes las lesiones, la estabilización de las mismas tras comenzar a tomarlo, la ausencia de casos asociados en la literatura y por su efecto anti-proliferativo tumoral a través de la vía mTOR. La pérdida de positividad nuclear para MSH6 en el CS es probablemente una consecuencia de una mutación somática esporádica de las células malignas, dada la ausencia de poliposis intestinal y la positividad nuclear intacta en la inmunohistoquímica de los adenomas sebáceos cutáneos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.