Las características de nuestro entorno sugieren que enfermedades como la queratosis actínica (QA) aumentarán su prevalencia y, en consecuencia, la demanda asistencial en los próximos años. Deben tenerse en cuenta una extensa lista de características clínicas en el abordaje terapéutico de la QA, hasta hace poco compuesto únicamente por técnicas ablativas y exclusivamente dirigidas a las lesiones, sin considerar el campo de cancerización. El incremento del arsenal terapéutico de los últimos años hace necesaria la homogenización de criterios que faciliten la elección de la mejor opción para cada paciente. La formulación de recomendaciones de consenso entre expertos a partir de la revisión de las evidencias científicas en cuanto a diagnóstico y tratamiento disponibles, permite aportar conocimiento dirigido a la mayor calidad en la atención de los pacientes, facilita una mayor homogeneidad en la toma de decisiones y promueve la sensibilización necesaria de todos los agentes sanitarios involucrados.
Current trends in our setting indicate that the prevalence of actinic keratosis and similar diseases will increase in coming years and impose a greater burden on health care resources. A long list of clinical features must be taken into account when approaching the treatment of actinic keratosis. Until recently, therapeutic approaches focused solely on ablative procedures and the treatment of individual lesions and did not take into account areas of field cancerization. Now that the therapeutic arsenal has grown, standardized criteria are needed to guide the optimal choice of treatment for each patient. The elaboration of evidence-based consensus recommendations for the diagnosis and treatment of actinic keratosis generates knowledge that will help clinicians to deliver the highest level of care possible, standardizing decision-making processes and enhancing awareness among all the health professionals involved in the care pathway.
Resulta difícil estimar la prevalencia de la queratosis actínica (QA) dada la ausencia de registros y los escasos estudios centrados en este objetivo. Los datos epidemiológicos disponibles muestran una elevada incidencia en poblaciones con fototipo cutáneo I-III y un incremento en todo el mundo en las últimas décadas1–6. En Europa se ha documentado una prevalencia del 15% en hombres y del 6% en mujeres en un estudio en el Reino Unido7. Estas cifras varían notablemente dependiendo del país y según la edad de la población estudiada, aumentando su prevalencia con la edad; en el mismo estudio del Reino Unido se citan prevalencias superiores al 34% cuando la población estudiada supera los 70 años7. Citando la conclusión de la propia guía europea8, la incidencia de QA va en aumento y, afectando a millones de pacientes en todo el mundo, se convierte en el carcinoma in situ más frecuente en el ser humano.
Aunque la guía europea8 repasa inicialmente las evidencias disponibles en cuanto a la etiopatogenia, histopatología y clínica de la QA, revisa el amplio espectro de opciones terapéuticas disponibles que deben dominar la toma de decisiones terapéuticas sin llegar a formular recomendaciones específicas al respecto. Con la elaboración de este trabajo se pretende alcanzar un mayor nivel de homogeneidad en la toma de decisiones para el manejo clínico y terapéutico de los pacientes con QA, destacando la importancia del diagnóstico y tratamiento precoz de esta lesión para evitar su progresión a carcinoma escamoso (CE) invasivo.
MetodologíaLa elaboración de este documento se fundamenta en la adaptación de la guía europea publicada durante el 20118 al contexto del ámbito asistencial español, a partir de un proceso estructurado y participativo de consenso de expertos elaboradores de las recomendaciones y autores de este trabajo.
Se formalizó un grupo de trabajo formado por 7 especialistas de referencia y un médico de atención primaria de diferentes centros españoles. La metodología de trabajo que se estableció partió de la traducción técnica de la guía europea8, a partir de la cual se realizó una síntesis de la misma focalizando la lectura crítica en los objetivos, que a juicio de los expertos se consideraron prioritarios para establecer las recomendaciones de contexto al ámbito asistencial de nuestro país. Estos aspectos se ampliaron a partir de una revisión de la literatura científica dirigida por expertos, posterior a la publicación de la guía europea. Tras la lectura detallada de los artículos se añadieron algunas evidencias y se establecieron unas recomendaciones preliminares relativas a la evaluación y tratamiento de la QA, así como sobre otros aspectos generales y conceptuales.
El primer borrador del documento se debatió y completó mediante metodología participativa y estructurada en una reunión presencial del grupo de expertos. Una vez el grupo de expertos validó el documento, cada recomendación fue clasificada con su nivel de evidencia (NE) y grado de recomendación (GR) atendiendo a las categorías del sistema SIGN9 (tabla 1) y del NICE10 (tabla 2) en el caso de las pruebas diagnósticas. Por último, el documento final de recomendaciones de consenso fue aprobado por todos los participantes.
Niveles de evidencia científica y grados de recomendación de SIGN
| Niveles de evidencia científica | |
| 1++ | Metaanálisis de alta calidad, revisiones sistemáticas de ensayos clínicos o ensayos clínicos de alta calidad con muy poco riesgo de sesgo |
| 1+ | Metaanálisis bien realizados, revisiones sistemáticas de ensayos clínicos o ensayos clínicos bien realizados con poco riesgo de sesgos |
| 1– | Metaanálisis, revisiones sistemáticas de ensayos clínicos o ensayos clínicos con alto riesgo de sesgos |
| 2++ | Revisiones sistemáticas de alta calidad de estudios de cohortes o de casos y controles. Estudios de cohortes o de casos y controles con riesgo muy bajo de sesgo y con alta probabilidad de establecer una relación causal |
| 2+ | Estudios de cohortes o de casos y controles bien realizados con bajo riesgo de sesgo y con una moderada probabilidad de establecer una relación causal |
| 2– | Estudios de cohortes o de casos y controles con alto riesgo de sesgo y riesgo significativo de que la relación no sea causal |
| 3 | Estudios no analíticos, como informes de casos y series de casos |
| 4 | Opinión de expertos |
| Grados de recomendación | |
| A | Al menos un metaanálisis, revisión sistemática o ensayo clínico clasificado como 1++ y directamente aplicable a la población diana de la guía; o un volumen de evidencia científica compuesto por estudios clasificados como 1+ y con gran consistencia entre ellos |
| B | Un volumen de evidencia científica compuesta por estudios clasificados como 2++, directamente aplicable a la población diana de la guía y que demuestran gran consistencia entre ellos; o evidencia científica extrapolada desde estudios clasificados como 1++ o 1+ |
| C | Un volumen de evidencia científica compuesta por estudios clasificados como 2+ directamente aplicables a la población diana de la guía y que demuestran gran consistencia entre ellos; o evidencia científica extrapolada desde estudios clasificados como 2++ |
| D | Evidencia científica de nivel 3 o 4; o evidencia científica extrapolada desde estudios clasificados como 2+ |
| Buena práctica clínica | |
| √ | Práctica recomendada, basada en la experiencia clínica y el consenso del grupo de expertos |
Fuente: Scottish Intercollegiate Guidelines Network9.
Niveles de evidencia científica y formulación de recomendaciones para preguntas sobre diagnóstico
| Niveles de evidencia científica | |
| Ia | Revisión sistemática con homogeneidad de estudios de nivel 1 |
| Ib | Estudios de nivel 1 |
| II | Estudios de nivel 2 |
| Revisión sistemática de estudios de nivel 2 | |
| III | Estudios de nivel 3 |
| Revisión sistemática de estudios de nivel 3 | |
| IV | Consenso, opiniones de expertos sin valoración crítica explícita |
| Estudios de nivel 1 | Cumplen: |
| Comparación enmascarada con una prueba de referencia («patrón oro») válida | |
| Espectro adecuado de pacientes | |
| Estudios de nivel 2 | Presentan solo uno de estos sesgos: |
| Población no representativa (la muestra no refleja la población donde se aplicará la prueba) | |
| Comparación con el patrón de referencia («patrón oro») inadecuado (la prueba que se evaluará forma parte del patrón oro o el resultado de la prueba influye en la realización del patrón oro) | |
| Comparación no enmascarada. | |
| Estudios casos-control. | |
| Estudios de nivel 3 | Presentan 2 o más de los criterios descritos en los estudios de nivel 2 |
| Recomendación | Evidencia |
| A | Ia o Ib |
| B | II |
| C | III |
| D | IV |
Fuente: National Institute for Clinical Excellence10.
El grupo de expertos alcanzó un acuerdo sobre la definición de QA: las QA son CE in situ con bajo riesgo de evolución a CE invasivo que se manifiestan como lesiones levemente eritematosas, rasposas a la palpación, que aparecen sobre áreas de piel con daño actínico crónico. Considerando el actual debate en la comunidad científica y la controversia respecto a las evidencias que avalan o no esta definición, se considera «definición a criterio de expertos», por lo que se categoriza como NE 4 y GR D.
EtiopatogeniaTal y como refiere la guía europea, la principal causa de la QA es la radiación no ionizante, principalmente la radiación ultravioleta (RUV), derivada de la exposición crónica al sol u otras fuentes de RUV. El estrés oxidativo provocado por la RUV-A (320-400nm) induce de forma indirecta mutaciones características del ADN, mientras que la RUV-B (290-320nm) provoca directamente la formación de dímeros de ciclobutano (timina) en el ADN y el ARN. Cuando fallan o se agotan los mecanismos reparadores estas alteraciones del ADN conllevan el inicio de mutaciones en los queratinocitos que conducen al desarrollo de QA11.
Otros factores capaces de inducir la aparición de QA son las repetidas exposiciones iatrogénicas a fuentes artificiales de RUV, rayos X y radioisótopos12,13. Además, la infección por el virus del papiloma humano (VPH) puede desempeñar un papel etiopatogénico como cocarcinógeno a través de la interacción de la proteína vírica E6 y E7 con la proteína-Bak de acción proapoptótica14–18.
Factores de riesgoSiendo el principal factor de riesgo la exposición crónica acumulada a la RUV, las variables que la comportan incluyen una edad avanzada, género masculino, actividad profesional al aire libre (agricultores, navegantes, etc.), actividad recreacional/deportiva al aire libre (tenis, golf, etc.), lugar de residencia (latitud y altitud: países cercanos al ecuador) y fuentes artificiales de RUV. Asimismo, existen también otros factores de riesgo como son la susceptibilidad individual a la RUV determinada por el fenotipo cutáneo (fototipo i y ii), la inmunosupresión iatrogénica crónica (por ejemplo, receptores de trasplante de órgano sólido), síndromes genéticos caracterizados por alteraciones en los mecanismos de reparación del ADN, inestabilidad cromosómica, fotosensibilidad y ciertos tóxicos o fármacos que alteran el ciclo celular entre los que además de la hidroxiurea o el arsénico es probable que se incluyan diversos agentes biológicos de interés en oncología19–21.
Campo de cancerizaciónEl campo de cancerización es un término creado para explicar el desarrollo de múltiples tumores primarios en un área de células genéticamente alteradas por un agente carcinógeno común22. En el caso de las QA correspondería al área de piel con daño actínico que puede estar rodeando a cada QA y que muestra las mismas alteraciones genéticas que la QA. En esta área podemos encontrar QA clínicamente visibles, QA subclínicas (diagnosticables solo microscópicamente) y focos de queratinocitos con alteraciones genéticas detectables solo por estudios moleculares22. La existencia del campo de cancerización tiene implicaciones terapéuticas importantes, como ya será comentado posteriormente.
Clasificación anatomopatológica y clínica de la queratosis actínicaLas QA se caracterizan microscópicamente por una proliferación intraepidérmica de queratinocitos atípicos con pérdida de polaridad, pleomorfismo, hipercromasia nuclear y mitosis; características indistinguibles de las de los queratinocitos de los CE invasivos, por lo que deben ser consideradas como carcinomas in situ23–27 (NE 4, GR D). Estas alteraciones representan el primer paso de un proceso continuo evolutivo, caracterizado por la proliferación de queratinocitos atípicos1, que puede acabar en un CE invasivo. Asimismo y adicionalmente a estas argumentaciones anatomopatológicas, existen evidencias indirectas que apuntan en este sentido, como por ejemplo, que el 80% de los CE invasivos presentan en los bordes queratosis actínicas y otras evidencias moleculares28. En función del grado de afectación intraepidérmica por la atipia queratinocítica se distinguen 3 grados histológicos para estas lesiones29: QA-I (limitada al tercio inferior de la epidermis), QA-II (afecta a los 2/3 inferiores de la epidermis), QA-III (afecta a la totalidad de la epidermis). Dependiendo de la intensidad o el predominio de algunos de los signos que caracterizan una QA se han diferenciado algunas variantes clínicas como las que se muestran en la tabla 3.
Variantes clínicas de la QA
| QA hipertrófica o hiperqueratósica |
| Pápula o placa con importante componente queratósico sobre una base inflamatoria que la hace fácilmente identificable. Cuando el componente queratósico es muy exuberante da lugar al llamado cuerno cutáneo |
| QA pigmentada |
| Mácula o pápula aplanada, hiperqueratósica hiperpigmentada o reticulada, sin eritema asociado. Obliga a distinguirla de un lentigo maligno, carcinoma basocelular pigmentado y queratosis seborreica reticulada. La dermatoscopia es útil para diferenciarla, aunque en ocasiones hay que realizar una biopsia |
| QA liquenoide |
| Es una variante clínicamente similar a la forma clásica de QA pero con un pronunciado eritema rodeando la base de la lesión que traduce la aparición de un infiltrado liquenoide subyacente a la QA |
| QA atrófica |
| Mácula eritematosa, ligeramente descamativa, mostrando en la histología una epidermis atrófica |
QA: queratosis actínica.
El diagnóstico de las QA es fundamentalmente clínico. Sin embargo, en algunas ocasiones requiere confirmación histopatológica para diferenciarlo de otras lesiones, o principalmente cuando existan dudas de su posible invasión dérmica y por tanto transformación en CE invasivo. Aunque no hay signos clínicos claros que nos indiquen que una QA ha progresado a CE invasivo, al menos inicialmente, esta posibilidad debe sospecharse cuando la lesión aparece inflamada o indurada, se ulcera, sangra, es mayor de 2cm, cuando experimenta un rápido crecimiento o no cura tras la aplicación de un tratamiento adecuado o cuando se produce una rápida recurrencia tras el tratamiento exitoso. Para diferenciarla de otras posibles lesiones cuando existan dudas en el diagnóstico clínico, y ante la sospecha de que se haya transformado en CE invasivo, la QA debe ser biopsiada (NE 4, GR D).
Algunas técnicas diagnósticas han aportado valor al diagnóstico diferencial de estas lesiones, como es el caso de la dermatoscopia. Esta técnica puede ser de utilidad para diferenciar la QA del carcinoma basocelular superficial, siendo también eficaz para diferenciar la QA pigmentada del lentigo maligno y del carcinoma basocelular pigmentado. Otra herramienta como la microscopia láser confocal de barrido ha mostrado una gran sensibilidad y especificidad en el diagnóstico, pero que aún hoy, al menos en España, es más utilizada en el campo de la investigación que en la aplicación clínica de la práctica diaria, ya que son pocos los centros hospitalarios que disponen de esta tecnología30. Otra técnica, en ocasiones utilizada, es el diagnóstico fotodinámico, cuya eficacia no ha sido del todo confirmada, pero que puede ayudar a delimitar el campo de cancerización; sin embargo, no está disponible en todos los centros y consume recursos31.
Evolución y pronósticoLas QA tienen 3 posibilidades evolutivas: regresión espontánea, persistencia como tal o progresión a CE invasivo, siendo impredecible qué camino tomarán lo aconsejable es tratarlas. Harvey et al. en 1997 señalaron una tasa de regresión espontánea de entre el 15 y el 55% de QA en un año3. El porcentaje de QA que evoluciona a CE invasivo ha sido motivo de diversos estudios con metodología distinta y resultados dispares. Sin embargo, no hay que olvidar que más del 80% de los CE invasivos de áreas expuestas emergen sobre o en contigüidad con QA28,32–34. Marks et al. realizaron un estudio prospectivo y longitudinal, que concluyó que el riesgo de progresión a CE invasivo es de 0,24% por año para cada lesión de QA35. No obstante, la mayoría de los pacientes tienen más de una lesión, lo que finalmente se traduce en un riesgo de progresión a CE invasivo en 10 años entre el 6,1 y el 10,2%36, cifra que se eleva al 40% en los pacientes inmunodeprimidos37–40, como ya apuntan las guías europeas. Es importante recordar que las QA son consideradas un marcador de daño actínico crónico e identifican a un grupo de pacientes con alto riesgo para el desarrollo de cáncer cutáneo no melanoma41(NE 4, GR D√).
Prevención y seguimientoLa prevención de la QA incluye medidas de prevención primaria y secundaria. Entre las medidas de prevención primaria la información y la educación en medidas de protección solar resultan fundamentales. Ello es especialmente importante en la población trasplantada, con muy alto riesgo para el desarrollo de QA y CE invasivos, y cuya prevención primaria debería iniciarse ya en el momento en que entran en lista de espera para un trasplante8,42,43. Entre las medidas de prevención secundaria la autoexploración previa a una consulta y la detección y el tratamiento precoz por parte del médico resultan de gran importancia para su curación, evitando así su posible progresión a CE invasivo. Actualmente se está evaluando la eficacia de productos que combinan protectores solares con enzimas reparadoras del ADN44.
En pacientes trasplantados se debe considerar con mayor énfasis el tratamiento preventivo, la vigilancia estrecha (cada 3 o 4 meses) y los controles periódicos más cercanos. En varios estudios, tanto sobre la población general como en el grupo de trasplantados, el uso de fotoprotección ha mostrado ser eficaz no solo al evitar la aparición de lesiones nuevas, sino incluso en la desaparición de lesiones ya existentes45–48.
Debido a las frecuentes recurrencias de la lesión, a la aparición de otras nuevas en el área de cancerización y a su papel de marcador de daño actínico crónico, y por tanto de riesgo para el desarrollo de cáncer cutáneo invasivo, el paciente con QA debe ser seguido con periodicidad a intervalos diferentes en función del número de lesiones, del perfil de paciente, factores de riesgo asociados y otras circunstancias individuales insistiendo en el diagnóstico/tratamiento precoz y en las medidas de fotoprotección27,49–52 (NE 4, GR D).
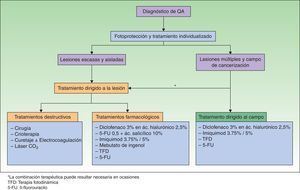
Algoritmo terapéutico consensuado por el grupo de expertosLos autores de este trabajo parecen estar de acuerdo en recomendar el tratamiento de todas las QA, dado que son consideradas carcinomas in situ con posibilidad de progresar a CE invasivo6,8,22 (NE 4 GR D). El algoritmo terapéutico desarrollado por Stockfleth et al.27 establece que tras el diagnóstico de QA se debe iniciar la fotoprotección y el tratamiento individualizado en función de las particularidades de cada paciente. Además, en el caso de las lesiones escasas y aisladas, el tratamiento de elección será el dirigido a la lesión, mientras que en el caso las lesiones múltiples o sospecha del campo de cancerización el tratamiento debe abordar el campo de cancerización, pudiendo combinarse con tratamiento dirigido a la lesión (fig. 1).
La existencia del campo de cancerización tiene implicaciones terapéuticas importantes, pues si solo tratamos la lesión o lesiones clínicamente visibles eliminamos las lesiones, pero el campo persiste y con el tiempo surgirán nuevos elementos49. Por el contrario, si tratamos el campo eliminamos no solo las lesiones evidentes, sino también las subclínicas y los clones de células destinadas a convertirse en QA, con lo que se previene el desarrollo de nuevas QA y de CE invasivo, se obtienen remisiones más prolongadas y aumenta el intervalo entre sesiones de tratamiento para las QA27. Por tanto, siempre que sea posible se debe tratar el campo de cancerización con el objetivo de evitar que lesiones subclínicas puedan progresar a lesiones clínicamente visibles y puedan acabar en un CE invasivo (NE 4, GR D√).
En la elección del tratamiento para cada paciente se deben barajar distintas variables y elegir el más adecuado individualmente. Es importante recordar que la combinación de tratamientos destructivos (en general dirigidos a tratar la lesión) y tópicos (útiles para tratar tanto la lesión como el campo de cancerización) puede ser recomendable en algunas circunstancias, como las de progresión a un carcinoma invasivo (NE 4, GR D√). La combinación de tratamientos puede ser adecuada ante la necesidad de eliminar primero la lesión a través de un procedimiento destructivo y a continuación tratar el campo de cancerización. La elección de la combinación de un tratamiento destructivo con otro farmacológico dependerá del perfil del paciente, de las características de la lesión, del acceso a las diferentes opciones terapéuticas y de las necesidades determinantes en el momento de aplicación. También puede ser positivo el tratamiento tópico combinado de terapia fotodinámica e imiquimod, ya que puede proporcionar una mejor respuesta clínica e histológica que la monoterapia con cada uno de ellos, así como mejorar la tolerancia50. Se desconoce por el momento la utilidad del tratamiento farmacológico tópico combinado, aunque habrá que tener presente las posibles interacciones farmacológicas entre los diferentes fármacos, hasta el momento no conocidas.
Opciones de tratamientoLa decisión de utilizar un tratamiento dirigido a la lesión o al campo de cancerización, así como la modalidad a utilizar dependerá de numerosos factores tal y como se muestra en la tabla 4.
Factores determinantes en la elección del tratamiento
| Relacionados con la enfermedad y el paciente8,27 |
| Número, localización y extensión de las lesiones |
| Edad, comorbilidades, inmunosupresión |
| Estado mental y cumplimiento |
| Accesibilidad, estética |
| Historia previa de cáncer cutáneo y tratamientos previos |
| Coste del tratamiento |
| Preferencias del paciente |
| Relacionados con el tratamiento27 |
| Disponibilidad, eficacia, seguridad, tolerabilidad y resultado a largo plazo |
| Relacionados con el médico |
| Experiencia con el procedimiento |
| Preferencias en el tratamiento |
Los tratamientos destructivos deben utilizarse para el tratamiento de las lesiones únicas o aisladas y ante la sospecha de progresión a un carcinoma invasivo (NE 4 GR D√).
La eficacia y seguridad de estos métodos en el tratamiento de las QA son de difícil evaluación al no existir, ser muy escasos y con un número de pacientes reducido los ensayos clínicos controlados publicados8.
Común a todos ellos es que no son útiles para tratar el campo de cancerización, requieren anestesia local (salvo la crioterapia) y pueden dejar cicatrices y/o alteraciones de la pigmentación51. En general, son fáciles de llevar a cabo, rápidos desde la perspectiva del médico y efectivos en el tratamiento de QA aisladas; sin embargo están poco estandarizados.
Escisión quirúrgicaLa extirpación de la QA no se utiliza de forma rutinaria y se elige solo cuando hay sospecha de CE invasivo o en el caso de lesiones recurrentes. Esta técnica permite el análisis anatomopatológico de la lesión para confirmar el diagnóstico. No está indicada para pacientes con lesiones múltiples51.
CrioterapiaEs el método más ampliamente usado a nivel mundial y particularmente en España, por su sencillez y rapidez en la realización, la aceptabilidad por parte del paciente y su bajo coste52. Sin embargo, su gran problema es la falta de un método de aplicación estandarizado (duración, intensidad, frecuencia, temperatura, etc.) y su alta tasa de recurrencias de hasta un 84,8% en un estudio reciente realizado con evaluación histopatológica53. Al tratarse de una técnica no específica la criocirugía destruye células atípicas, pero también normales mediante la disrupción y separación de la epidermis de la dermis8. La eficacia de la crioterapia con nitrógeno líquido ha sido demostrada en varios estudios, que apuntan a tasas de curación del 67 al 99%, siendo más alta cuanto mayor sea el tiempo de congelación54–56.
RaspadoEl raspado es una técnica que puede utilizarse sola o en combinación con la electrocoagulación. Permite el estudio anatomopatológico de la muestra, aunque a diferencia de la cirugía no confirma si existe invasión en los márgenes de resección. El raspado es particularmente útil para el tratamiento de una o escasas lesiones de QA, especialmente cuando son hiperqueratósicas como en el cuerno cutáneo, y generalmente se asocia a electrocoagulación de la base.
Tratamiento tópicoLos tratamientos tópicos son preferibles a los destructivos en pacientes con múltiples QA y en aquellos con evidente campo de cancerización, ya que permiten tratar la lesión y el campo26 (NE 4, GR D).
Los tratamientos tópicos de las QA ofrecen diversas ventajas sobre los tratamientos destructivos. Permiten tratar tanto la lesión como el campo de cancerización, y eliminar así no solo las QA evidentes sino también las subclínicas y los clones de células destinadas a convertirse en QA57. Por ello, tratando el campo de cancerización se obtienen remisiones prolongadas, aumenta el intervalo entre sesiones de tratamiento y se previene el desarrollo de CE invasivo27.
Es importante mencionar que el tratamiento dirigido al campo de cancerización utilizando preparados tópicos es compatible con el uso concomitante o secuencial de cualquiera de los métodos de tratamiento dirigidos a la lesión27. A continuación describimos los mecanismos de acción de los tratamientos tópicos cuyas particularidades se comentan en la tabla 5.
Principales características de los tratamientos tópicos
| Diclofenaco 3% en gel de ácido hialurónico 2,5% | |
| Aplicación | Se aplica localmente sobre la piel 2 veces al día |
| La cantidad necesaria depende del tamaño de la lesión y la duración habitual del tratamiento es de 60 a 90 días. La eficacia máxima se ha observado en tratamientos de una duración próxima al periodo superior de este margen | |
| Pueden transcurrir hasta 30 días desde el cese del tratamiento hasta la curación completa de las lesiones o hasta producirse el efecto terapéutico óptimo91 | |
| Tasas de respuesta | Tasa de respuesta en torno al 85% (TNLS≥75%) |
| A los 90 días de tratamiento con 0,5g 2 veces al día, remisión clínica completa en el 41-50% de los pacientes92,93 | |
| La eficacia de un ciclo único de 90 días de diclofenaco sódico al 3% gel persiste al cabo de un año en la mayoría de los pacientes92 | |
| Seguridad | Muy buena tolerancia con efectos adversos limitados a la piel, de intensidad leve o moderada, y consistentes en ligero eritema, prurito, sequedad y disestesia, siendo muy infrecuentes las reacciones fotoalérgicas y la dermatitis alérgica de contacto94,95 |
| Pacientes de alto riesgo | Se ha estudiado diclofenaco 3% en pacientes receptores de órganos con tasas de desaparición completa de las lesiones entre el 41-50%87,96, lo que demuestra que diclofenaco al 3% gel es un tratamiento eficiente y bien tolerado para la QA múltiple, previniendo además el desarrollo de CE invasivo en el área tratada en estos pacientes de alto riesgo87,96 |
| Imiquimod | |
| Aplicación | Existen diferentes pautas de tratamiento con imiquimod 5%, siendo las más utilizadas la aplicación una vez al día, 3 veces por semana/4 semanas y 2-3 veces por semana/16 semanas97 |
| Tasas de respuesta | Tasas de curación entre el 45 y el 84% en pauta de 2-3 veces por semana durante 12-16 semanas39,98 |
| Tasas de recurrencias del 10% al año y del 20% a los 2 años39,99 | |
| En administración de pauta corta (3 veces por semana/4 semanas/2 ciclos separados por 4 semanas) la curación completa se observó en 54 y 69% y tras 2 ciclos en 61 y 80%100–102 | |
| En un metaanálisis de 5 estudios (n=1.293) en pauta de 3 veces por semana durante 12-16 semanas la tasa de curación completa fue del 50 vs 5% con placebo80 | |
| Seguridad | Puede producir una dermatitis grave, de intensidad variable, no predecible, distinta para cada paciente y consistente en importante eritema, con erosiones, exudación y formación de costras, con dolor y prurito. Cuando la aplicación es muy extensa puede dar lugar a fiebre, síndrome gripal y cefalea97 |
| Debe considerarse la interrupción del tratamiento si se producen reacciones inflamatorias locales intensas o si se observa infección en el lugar de tratamiento | |
| Buenos resultados estéticos, manteniendo la calidad cutánea del paciente103 | |
| Pacientes de alto riesgo | Imiquimod 5% también ha sido evaluado en un estudio para el tratamiento de las QA de los receptores de trasplante de órgano sólido (hígado, riñón, corazón) con una tasa de curación histológica del 62,1% (n=29) vs 0% (n=14) con placebo86 |
| Terapia fotodinámica | |
| Aplicación | Con el objeto de optimizar el tratamiento es aconsejable retirar primero la queratina superficial con un ligero legrado. Luego se aplica el fotosensibilizante bajo oclusión durante 3h, antes de iluminar con luz roja de gran intensidad |
| En los numerosos estudios se han empleado distintos protocolos con diferentes fármacos, tiempos de incubación y fuentes de luz, y todavía están por determinar los niveles óptimos de irradiancia, longitud de onda y dosis en el tratamiento de la QA104,105 | |
| Las principales indicaciones de la TFD son en pacientes con múltiples QA confluentes y superficiales, y con QA localizadas en áreas de difícil cicatrización | |
| Tasas de respuesta | Tasas de respuesta en torno al 70-80% tras un ciclo de tratamiento, incrementándose al 90% tras un segundo ciclo49 |
| En un estudio reciente la eficacia para la TFD a los 12 meses de tratamiento fue de 47% para ALA y de 36% para MAL | |
| La tasa de recurrencias es del 19% al año de tratamiento106 | |
| Seguridad | El agente fotosensibilizante de la TFD no es selectivo, lo que reduce la efectividad del tratamiento y causa posibles reacciones de hipersensibilidad a la luz durante el día, la penetración limitada del agente fotosensibilizante (3-4mm) y el dolor local durante y después del tratamiento8,107,108. Además consume recursos, tiene un elevado coste y requiere de personal entrenado109 |
| Aproximadamente el 60% de los pacientes experimenta reacciones localizadas en el lugar del tratamiento, atribuibles a los efectos tóxicos de la TFD (fototoxicidad) o a la preparación de la lesión mediante raspado ates de aplicar el fotosensibilizante | |
| Los efectos secundarios más frecuentes son el dolor local durante el tratamiento y que puede prolongarse hasta el día siguiente, y cierto grado de eritema y edema en el lugar de irradiación. Sin embargo el resultado estético final es excelente105,109,110 | |
| 5-Fluorouracilo | |
| Aplicación | Se aplica 2 veces al día durante 2-4 semanas8 |
| Tasas de respuesta | Tasas de curación clínica que varían del 50 al 96%, con tasas de recurrencia alrededor del 55%88,90,111–114 |
| En un estudio reciente con tasas de curación clínica del 96% la curación histológica fue del 67%, mientras que al año la tasa de eliminación permanente de lesiones tratadas inicialmente (respuesta sostenida) fue del 54%, y del campo total de tratamiento fue del 33%88 | |
| Seguridad | Da lugar a una fuerte reacción inflamatoria con prurito y dolor, aparición de eritema y otros signos inflamatorios de variada intensidad8. La inflamación inducida puede ser importante, y a veces puede provocar que los pacientes modifiquen o interrumpan el tratamiento antes de que este haya sido completado90 |
| En algunas ocasiones se ha descrito fototoxicidad y dermatitis de contacto89. Los pacientes con cáncer con disminución de dihidropirimidina-deshidrogenasa están en mayor riesgo de toxicidad grave, incluyendo diarrea, estomatitis, mucositis, mielosupresión, neurotoxicidad y, en casos excepcionales, la muerte115 | |
5-FU: 5-fluorouracilo; ALA: ácido 5-deltaaminolevulínico; CE: carcinoma escamoso; MAL: metilaminolevulinato; QA: queratosis actínica; TFD: terapia fotodinámica; TNLS: total number lesion score.
Diclofenaco 3% en ácido hialurónico 2,5% es un fármaco antiinflamatorio no esteroideo que inhibe la ciclooxigenasa 2 (COX-2) y, por tanto, la cascada del ácido araquidónico y la producción de prostaglandinas. Como consecuencia tiene una actividad antiinflamatoria derivada de la disminución en la síntesis de la prostaglandina E2 (PGE2), suprimiendo la producción de linfocitos inmunorreguladores, la proliferación de células T y B y la actividad citotóxica de las células natural killer.
Además de la acción antiinflamatoria tiene una actividad antineoplásica por su efecto proapoptótico, por disminuir la expresión del factor de crecimiento endotelial vascular (VEGF) con la consecuente inhibición de la angiogénesis tumoral y por activar los receptores gamma peroxisomales (PPAR-gamma), lo que reduce la proliferación celular neoplásica8,58–63. El ácido hialurónico al 2,5% que acompaña al diclofenaco 3% ayuda a transportar el principio activo y lo mantiene en la epidermis, lo que facilita y permite su acción59. Diclofenaco 3%+ácido hialurónico 2,5% redujo los niveles de PGE2 en las líneas celulares del carcinoma de células escamosas sensibles a la apoptosis (SCL-II, SCC-12, SCC-13) mientras que PGE2 y COX-2 no eran detectables en células resistentes a la apoptosis (SCL-I)62.
Imiquimod 5%Imiquimod es un agonista del Toll-like receptor-7 (TLR-7) que pertenece a la categoría de fármacos modificadores de la respuesta inmune; además de presentar actividad antineoplásica y antivírica64 estimula la respuesta inmune innata y adquirida mediante la activación del interferón (INF) y del factor nuclear κB (NFκB) a través de TLR-7 en monocitos y células dendríticas.
Terapia fotodinámicaLa terapia fotodinámica (TFD) actúa mediante la destrucción selectiva de queratinocitos atípicos a través de la fotoactivación de un fotosensibilizador en presencia de oxígeno. Las células metabólicamente activas, como las células neoplásicas, acumulan más fotosensibilizadores que las células normales. El fotosensibilizador genera especies reactivas del oxígeno bajo iluminación con fuentes de luz artificial de determinada longitud de onda, lo que provoca efectos fotoquímicos y fototérmicos selectivos sobre el tejido irradiado. Como fotosensibilizantes se usan los precursores de protoporfirina ix, siendo los utilizados con más frecuencia el ácido 5-deltaaminolevulínico (ALA) y sus derivados, como el agente lipofílico metilaminolevulinato (MAL).
5-fluorouracilo 5%El 5-fluorouracilo (5-FU) es un antimetabolito quimioterápico que actúa mediante interferencia en la síntesis de ADN y ARN al inhibir la timidilatosintetasa, lo que bloquea la reacción de metilación del ácido desoxiuridílico a ácido timidílico. La ausencia de síntesis de ADN, particularmente en las células displásicas de crecimiento rápido, evita la proliferación celular y provoca la muerte celular8. El 5-FU para uso tópico no está actualmente comercializado en España.
Nuevas opciones terapéuticasÚltimamente han aparecido nuevas moléculas y nuevas formulaciones de productos ya existentes que han ampliado el arsenal terapéutico de las QA (tabla 6).
Principales características de nuevas opciones terapéuticas
| 5-FU al 0,5% y ácido salicílico al 10% | |
| Aplicación | Posología en adultos incluidos pacientes de edad avanzada |
| Se debería aplicar una vez al día hasta su desaparición total o durante un máximo de 12 semanas116 | |
| Tasas de respuesta | Un estudio piloto realizado con este preparado consiguió la eliminación completa del 77% de las QA tras 84 días de tratamiento117 |
| Seguridad | Irritación e inflamación en la zona de aplicación de intensidad leve o moderada116 |
| Imiquimod al 3,75% | |
| Aplicación | Ofrece varias ventajas en comparación con imiquimod al 5%, ya que se puede aplicar en zonas más extensas de la piel (>25cm), como todo el cuero cabelludo o la región facial |
| El patrón de aplicación es más sencillo y corto que para imiquimod al 5%, ya que se basa en una dosificación acelerada durante 6 semanas (2 veces al día×2 semanas, descanso 2 semanas y se repite una vez al día×2 semanas)8 | |
| Tasas de respuesta | Eliminación completa de todas las QA (incluidas las lesiones detectadas durante el tratamiento: «QA subclínica») en el 36% de los pacientes, respecto al 6% de las del grupo placebo66,67 |
| Se alcanzó una eliminación parcial (>75% de reducción del total de QA) en el 59% de los pacientes tratados con imiquimod al 3,75%, frente al 23% del placebo66,67 | |
| Mebutato de ingenol | |
| Aplicación | Su presentación es de un solo uso, debiéndose aplicar en un área máxima de 25cm2 (por ejemplo 5cm×5cm)69 |
| No debe aplicarse en heridas abiertas o piel dañada, cerca de los ojos, en el interior de la nariz, en el interior de las orejas o en los labios. Tampoco se recomienda su utilización en piel no restablecida tras un tratamiento previo69 | |
| Tasas de respuesta | La aplicación de mebutato de ingenol (0,015%) durante 3 días en QA de cara y cuero cabelludo obtuvo tasas de remisión completa y parcial (≥75%) a los 57 días del 42,2 y del 63,9% respectivamente118 |
| Las tasas de remisión completa y parcial para los pacientes con lesiones localizadas en el cuerpo y las extremidades tratados con mebutato de ingenol (0,05%) durante 2 días fueron de 34,1 y de 49,1%, respectivamente69 | |
| Tasas de recurrencia del 13,2% en QA localizadas en el cuerpo y las extremidades (mebutato de ingenol 0,05%) y del 12,8% en QA de la cara y el cuero cabelludo (mebutato de ingenol 0,015%) a los 12 meses69,119,120 | |
| Seguridad | Las reacciones adversas más frecuentes reportadas son reacciones locales en la piel, tales como eritema, descamación, costras, hinchazón, formación de vesículas, pústulas, erosiones y ulceración en el sitio de aplicación69 |
| La mayoría de los pacientes (>95%) experimentaron una o más respuestas locales tras su aplicación con una incidencia de reacciones cutáneas graves en la cara y el cuero cabelludo del 29% y del 17% en el tronco y las extremidades69 | |
| Resiquimod | |
| Tasas de respuesta | La tasa de respuesta completa tras un solo ciclo fue del 40,0, 74,2, 56,3 y 70,6% para las distintas concentraciones y de 77,1, 90,3, 78,1, 85,3% tras 2 ciclos de tratamiento (concentraciones 0,01, 0,03, 0,06 y 0,1% una vez/día/4 semanas respectivamente)121 |
| Tasa de curación tras 2 ciclos de tratamiento similar para las distintas concentraciones pero con mejor tolerancia para las concentraciones bajas121 | |
| Seguridad | Se presentaron efectos adversos graves locales y síntomas gripales en el 0-3-12-13% de los pacientes (concentraciones: 0,01, 0,03, 0,06 y 0,1% una vez/día/4 semanas respectivamente)121 |
5-FU: 5-fluorouracilo; CE: carcinoma escamoso; QA: queratosis actínica.
La nueva formulación tópica de 5-FU al 0,5% con ácido salicílico al 10%, recientemente aprobada y ya comercializada en algunos países europeos, comporta menos efectos secundarios que 5-FU al 5%. El ácido salicílico es un agente queratolítico que se utiliza desde hace mucho tiempo para diversas efermedades cutáneas que cursan con hiperqueratosis. En combinación con una dosis baja (0,5%) de 5-FU puede reducir la hiperqueratosis de la QA y favorecer la penetración del fármaco8.
Imiquimod al 3,75%Aunque actualmente no está comercializado en España, está indicado en el tratamiento tópico de las QA, no hiperqueratósicas ni hipertróficas, visibles o palpables, de la región facial o del cuero cabelludo alopécico en adultos inmunocompetentes, cuando otros tratamientos tópicos están contraindicados o son menos apropiados65. Ofrece varias ventajas en comparación con imiquimod al 5%. En primer lugar, se puede aplicar en zonas más extensas de la piel (>25cm2), como todo el cuero cabelludo o la región facial. En segundo lugar, a pesar de que cualitativamente la formulación de 3,75% produce el mismo tipo de efectos adversos que la de 5% (siendo las reacciones en el lugar de aplicación los más comunes), la incidencia de estos es menor (10,6%) que la notificada para pacientes tratados con imiquimod 5% (33%). Además, el número de pacientes que discontinúan el tratamiento a causa de efectos adversos es mucho menor en los pacientes tratados con imiquimod 3,75% que en los tratados con el 5%66,67.
Mebutato de ingenolEl mebutato de ingenol (ingenol-3-angelato, antes PEP005) es un éster diterpeno extraído y purificado de la planta Euphorbia peplus68 que ha sido recientemente aprobado por la European Medicines Agency (EMA) para el tratamiento de la QA no hiperqueratósica ni hipertrófica en adultos69. Aunque el mecanismo de acción no es del todo conocido, in vivo y en modelos in vitro se ha demostrado una doble función: 1) inducción local de muerte celular; y 2) promoción de una respuesta inflamatoria caracterizada por la infiltración de células inmunocompetentes69.
ResiquimodEl resiquimod es un agonista del Toll-like receptor 7 y 88. Tiene efectos inmunomoduladores semejantes a imiquimod, pero además de estimular las células dendríticas plasmocitoides también activa las mieloides induciendo mayor secreción de IL-12 y TNF70.
Otros tratamientosLos retinoides sistémicos orales, la dermoabrasión, los peelings químicos y el láser de CO2 son considerados tratamientos de segunda línea o coadyuvantes y su uso debe ser valorado en circunstancias especiales8,71,72 (NE 4, GR D√).
Es recomendable además de tratar tópicamente el campo de cancerización hacer quimioprofilaxis oral con retinoides, al menos en los pacientes con antecedentes de CE invasivo y que presenten múltiples QA73 (NE 4, GR D).
Pacientes receptores de un trasplante de órgano sólido y lesiones de alto riesgo de progresiónLa población de enfermos receptores de trasplante de órgano sólido requiere una inmunosupresión mantenida para evitar el rechazo del órgano trasplantado, incrementando el riesgo de infecciones y el desarrollo de lesiones pre-cancerosas y cancerosas, entre ellas las QA, que a menudo se presentan o manifiestan con una clínica atípica. El riesgo relativo de desarrollar QA en la población de trasplantados se multiplica por 250 en relación con la población inmunocompetente74. Suelen ser lesiones múltiples, con una incidencia acumulada del 35-40% a los 5 años, y con un mayor riesgo y más rápida evolución a CE invasivo que en la población inmunocompetente75–77.
En lesiones de alto riesgo de progresión a CE invasivo hay que considerar el tratamiento con técnicas que permitan el estudio anatomopatológico, aunque pueden combinarse con tratamientos tópicos para incrementar su efectividad78–83 (NE 4, GR D). Estas lesiones son aquellas localizadas en los labios, las orejas o la zona periocular, pues los CE invasivos de estas localizaciones tienen mayor poder metastatizante82,84. También hay que considerar esta posibilidad en las QA que aparecen en sujetos con antecedentes de CE invasivo y en las QA secundarias a radiaciones ionizantes, así como las que acontecen en pacientes infectados por el VIH y en receptores de trasplante de órgano sólido27. En esta última circunstancia se han comunicado buenos resultados con tratamientos tópicos que incluyen diclofenaco 3% e imiquimod 5%, por lo que una buena estrategia es combinar procedimientos destructivos que permitan el estudio anatomopatológico de la lesión con tratamientos farmacológicos78,85–87.
En pacientes receptores de trasplante de órgano sólido se recomiendan medidas preventivas para el desarrollo de queratosis actínicas (fotoprotección extrema), así como exploraciones periódicas destinadas a la detección y tratamiento precoz de estas lesiones cuando aparezcan, dada su más alta prevalencia y más rápida evolución a CE invasivo que en la población inmunocompetente42,75–77(NE 4, GR D).
En pacientes con QA recalcitrante o recurrente se recomienda cirugía con objeto de obtener material para examen anatomopatológico de cara a descartar un CE invasivo.
ConclusionesLas características socio-epidemiológicas, culturales y climatológicas de nuestro entorno sugieren que en los próximos años enfermedades como la QA aumentarán su prevalencia clínica, y en consecuencia la demanda asistencial. Aunque es verdad que cada vez existe una mayor cultura de fotoprotección, también es cierto que el aumento de la población envejecida y las condiciones de deterioro ambiental de la capa de ozono hacen más vulnerable la protección atmosférica respecto a la RUV y más susceptible el impacto de esta sobre las personas.
En España el tratamiento de las QA recae en general en el dermatólogo, quien en la mayoría de los casos trata al paciente con técnicas ablativas y dirigidas exclusivamente a las lesiones, sin considerar el tratamiento del campo de cancerización. Es evidente que en estos últimos años se ha incrementado el arsenal terapéutico para el tratamiento de las QA, a expensas fundamentalmente de la aparición de nuevas moléculas de aplicación tópica, muy útiles en el tratamiento del campo de cancerización. Por ello creemos necesario la existencia de unas recomendaciones de consenso entre expertos (tabla 7) que faciliten la elección de la mejor opción para cada caso. La elección de una u otra dependerá de las características de estas, así como de la tipología de la lesión, del campo de cancerización y de las preferencias del paciente; 5-FU se puede aplicar en múltiples lesiones en pauta de 2 veces al día durante 2-4 semanas y presenta una alta tasa de eliminación clínica inicial, no obstante la tasa de recidivas a los 12 meses también es alta88. Puede producir efectos adversos como dermatitis graves, fototoxicidad o dermatitis de contacto, que pueden comportar el abandono del tratamiento89. Su formulación al 0,5% en combinación con ácido salicílico al 10%, sin embargo, presenta mejor perfil de seguridad90. Imiquimod 5% presenta una menor tasa de recidivas que el 5-FU al 5% y una alta eliminación permanente en el campo tratado a los 12 meses. Además mantiene la calidad cutánea del paciente al final del tratamiento. Sin embargo, algunos pacientes se ven obligados a abandonar el tratamiento por la severidad de la dermatitis que desarrollan, aunque en general se puede considerar que presenta un aceptable perfil de tolerancia88. Su formulación al 3,75% permitirá su aplicación en zonas más extensas, como el cuero cabelludo o la cara, aunque está indicado solo en las queratosis actínicas no hiperqueratósicas, no hipertróficas, visibles o palpables y cuando otros tratamientos tópicos están contraindicados o son menos apropiados65. Diclofenaco 3% en gel de ácido hialurónico 2,5% se puede aplicar en zonas extensas, y el tratamiento debe ser de 60-90 días91. Por otra parte su perfil de tolerancia es excelente. Mebutato de ingenol, sin embargo, se administra tan solo durante 3 días, aunque hay que esperar 8 semanas antes de evaluar los resultados69. Debido a su reciente aprobación en España aún existe escasa experiencia en la práctica clínica diaria en nuestro país. Por su parte la TFD también es un excelente tratamiento, pero con los inconvenientes de su coste, escasa disponibilidad y necesidad de desplazamiento a unidades terapéuticas con la consiguiente pérdida de horas laborales.
Listado de recomendaciones
| Recomendación | Ref. | NE/GR | Publicación previa | |
| 1 | Las queratosis actínicas son CE in situ con bajo riesgo de evolución a CE invasivo que se manifiestan como lesiones levemente eritematosas, rasposas a la palpación, que aparecen sobre áreas de piel con daño actínico crónico | Stockfleth et al.8 | 4D | Stockfleth et al.8 |
| 2 | En pacientes receptores de trasplante de órgano sólido se recomienda medidas preventivas para el desarrollo de queratosis actínicas (fotoprotección extrema), así como exploraciones periódicas destinadas a la detección y tratamiento precoz de estas lesiones cuando aparezcan, dada su más alta prevalencia y más rápida evolución a CE invasivo que en la población inmunocompetente | Ulrich et al.42, Fuente et al.75, Ferrandiz et al. 76, Johnson et al.77 | 4D | Ulrich et al.42 |
| 3 | La QA debe biopsiarse cuando aparece inflamada o indurada, se ulcera, sangra, es mayor de 2cm, cuando experimenta un rápido crecimiento o no cura tras aplicación de un tratamiento adecuado o cuando se produce una rápida recurrencia tras tratamiento exitoso, fundamentalmente para descartar que se trate de un CE invasivo y para diferenciarla de otras posibles lesiones cuando existan dudas en el diagnóstico clínico | Stockfleth et al.8 | 4D | Stockfleth et al.8 |
| 4 | La QA debe considerarse un carcinoma in situ al mostrar una proliferación intraepidérmica de queratinocitos atípicos con las mismas alteraciones morfológicas de los queratinocitos del CE invasivo, consistentes en pleomorfismo e hipercromasia nuclear, mitosis y pérdida de polaridad | Ackerman23, Ackerman et al. 24, Guenthner et al.25, Jorizzo et al.26, Stockfleth et al.27 | 4D | Stockfleth et al.8 |
| 5 | Es recomendable tratar las QA dado que es un carcinoma in situ con posibilidad de progresar a CE invasivo | Massa et al.6, Stockfleth et al.8, Braakhuis et al.22 | 4D | Stockfleth et al.8 |
| 6 | Cuando sea posible se debe tratar el campo de cancerización con el objetivo de evitar que lesiones subclínicas puedan progresar a lesiones clínicamente visibles y puedan acabar en un CE invasivo | - | 4D√ | - |
| 7 | Los tratamientos destructivos deben utilizarse para el tratamiento de las lesiones únicas o ante la sospecha de un carcinoma invasivo | - | 4D√ | - |
| 8 | Los tratamientos tópicos son preferibles a los destructivos en pacientes con múltiples QA y en aquellos con evidente campo de cancerización, ya que permiten tratar la lesión y el campo | Jorizzo et al.26 | 4D | - |
| 9 | Los retinoides sistémicos orales, la dermoabrasión, los peelings químicos y el láser de CO2 son considerados tratamientos de segunda línea o coadyuvantes y su uso debe ser valorado en circunstancias especiales | Stockfleth et al.8, Moriarty et al.71, Yu et al.72 | 4D√ | - |
| 10 | En la elección del tratamiento para cada paciente se deben barajar distintas variables y elegir el más adecuado individualmente. Es importante recordar que la combinación de tratamientos destructivos y tópicos puede ser recomendable en algunas circunstancias | - | 4D√ | - |
| 11 | Es recomendable, además de tratar tópicamente el campo de cancerización, hacer quimioprofilaxis oral con retinoides, al menos en los pacientes con antecedentes de CE invasivo y que presenten múltiples QA | Carneiro et al.73 | 4D | - |
| 12 | En lesiones de alto riesgo de progresión a CE invasivo hay que considerar el tratamiento con técnicas que permitan el estudio anatomopatológico, aunque pueden combinarse con tratamientos tópicos para incrementar su efectividad | Del Rosso78, Ehrig et al.79, Hadley et al.80, Perrett et al.81, Rowe et al.82, Serra-Guillen et al.83 | 4D | - |
| 13 | Las medidas de prevención primaria y secundaria constituyen el mejor tratamiento de la QA y resultan imprescindibles en los sujetos de riesgo | Stockfleth et al.8, Ulrich et al.42, Ulrich et al.43, Berman et al.122, Schwartz et al.123 | 1A | - |
| 14 | Las QA son consideradas un marcador de daño actínico crónico e identifican a un grupo de pacientes con alto riesgo para el desarrollo de cáncer cutáneo no melanoma | Chen et al.41 | 4D√ | - |
| 15 | El paciente con QA debe ser seguido con periodicidad y se debe insistir en el diagnóstico/tratamiento precoz y en las medidas de fotoprotección | Stockfleth et al.27, Schmitt et al.124, Fenske et al.125, Strickland et al.126, Pandey et al.127 | 4D | - |
CE: carcinoma escamoso; QA: queratosis actínica.
Dado el incesante crecimiento en la incidencia y prevalencia del cáncer cutáneo, incluida la QA, y considerando que el médico de atención primaria es el primero en ver al enfermo, no cabe duda de que este desempeñará un papel importante en el diagnóstico y tratamiento de las QA. En ellos recae la responsabilidad no solo de reconocer las QA que son motivo de consulta por parte del paciente, sino también de buscarlas en aquellos pacientes que consultan por otros motivos y son portadores de evidentes lesiones, pero que no consultan por ellas al ser asintomáticas y desconocer su naturaleza. Su papel en la identificación de estos pacientes, en el tratamiento de las lesiones incipientes y en su derivación al dermatólogo ante lesiones con dudas diagnósticas, y aquellos que necesiten tratamientos ablativos o de campo de cancerización resultará clave para disminuir la creciente incidencia de este proceso y su posible evolución a CE invasivo.
La implementación de las recomendaciones desarrolladas partir de la revisión sistemática y sobre la base de la evidencia disponible permitirá no solo reducir la variabilidad en la práctica clínica interespecialista, sino también aumentar la eficacia en el uso de recursos sanitarios, así como optimizar en la medida de lo posible el rápido acceso del paciente al punto diagnóstico-terapéutico más apropiado. La revisión periódica y continua de las evidencias científicas en cuanto a diagnóstico y tratamiento disponibles aportan conocimiento dirigido a la mayor calidad en la atención de los pacientes, facilitan una mayor homogeneidad en la toma de decisiones y promueven la sensibilización necesaria de todos los agentes sanitarios involucrados.
Conflicto de interesesCarlos Ferrándiz en relación con la temática de QA ha recibido honorarios en concepto de conferenciante, participación en ensayos clínicos, asesorías o ayudas a la investigación por parte de Almirall, Leo-Pharma e Isdin. Eduardo Fonseca Capdevila ha participado en acciones de formación continuada, estudios clínicos y publicaciones financiadas por Abbott, Almirall, Celgene, FaesFarma, Janssen, MSD y Pfizer. Amaro García Diez ha sido asesor, ha dado charlas, ha colaborado en trabajos de investigación y ha recibido ayudas de Almirall, Isdin, Serono, Abbott, Abbie, Leo Pharma, Pfizer y MSD. Carlos Guillén Barona ha recibido honorarios en concepto de conferenciante, participación en ensayos clínicos, asesorías o ayudas a la investigación patrocinadas por parte de Almirall, Leo-Pharma, 3M, Meda y Galderma, todas relacionadas con el tema del cáncer cutáneo no melanoma. Isabel Belinchón Romero ha participado en proyectos de investigación, conferencias y cursos de formación patrocinados por Abbott, MSD, Pfizer, Janssen, Leo Pharma y Almirall. Pedro Redondo Bellón ha recibido honorarios por colaboración con Almirall, MSD, Galderma y Allergan. José Carlos Moreno Giménez ha recibido becas, ayudas, colaborado en trabajos de investigación, conferencias y publicaciones con MSD, Pfizer, Leo-Pharma, GSK, Galderma, Amirall, Abbot y Janssen. Rosa Senan ha recibido honorarios por asesorías con Almirall y por conferencias con GSK.
FinanciaciónLaboratorios Almirall S.A. ha promovido la elaboración de este documento sin interferir en las decisiones del grupo de expertos.