Las vacunas contra el SARS-CoV-2 son las primeras vacunas que han sido usadas en humanos contra coronavirus y su desarrollo se ha producido en un tiempo récord. En los análisis de seguridad de los ensayos clínicos previos a su aprobación y en la fase postautorización en la población, se han descrito efectos secundarios dermatológicos. La descripción y categorización de las manifestaciones cutáneas de la COVID-19 fueron importantes para el conocimiento de la enfermedad y de la misma forma pueden serlo las generadas por las vacunas. En este artículo hacemos un repaso a las características de los diferentes tipos de vacunas disponibles y en desarrollo, su modo de interacción con el sistema inmune, las consecuentes manifestaciones clínicas que pueden generar, con especial interés en los efectos secundarios dermatológicos hasta el momento descritos, y las actitudes terapéuticas recomendadas ante cada una de estas reacciones.
Vaccines against the severe acute respiratory coronavirus 2, which are the first to be used in humans against any coronavirus, were developed and produced in record time. Dermatologic adverse effects appeared during clinical trials and have also been described in the population since approval. Just as descriptions and categorization of skin manifestations of the coronavirus disease 2019 proved important for understanding the disease itself, characterizing the effects of vaccines may also further that goal. This paper reviews the properties of the different types of vaccines currently available and under development and describes how they interact with the immune system and the clinical signs they may cause. We focus on dermatologic adverse effects reported to date and recommendations for managing them.
Las lecciones aprendidas de otras epidemias (Ébola, SARS-CoV y MERS-CoV) y la coordinación internacional del conocimiento generado han facilitado la respuesta global a la pandemia COVID-19. La iniciativa internacional de investigación COVID-NMA, surgida del plan I+D de la OMS, ha facilitado la valoración conjunta de un número elevado de ensayos clínicos y de evidencias sobre la prevención, el tratamiento y las vacunas frente a la enfermedad. Esto ha posibilitado el avance del conocimiento, la toma de decisiones y la consecución de una vacuna, herramienta imprescindible para el control de la pandemia, en un tiempo récord1,2.
Aunque estaban en desarrollo, hasta el momento no se había utilizado ninguna vacuna eficaz en humanos contra coronavirus (CoV). Con SARS-CoV se alcanzó un desarrollo preclínico que se paralizó por la desaparición del virus como amenaza para la salud. Pero la similitud de la secuencia genómica de SARS-CoV-2 y SARS-CoV3, redujo el tiempo dedicado al diseño. Pronto empezaron los ensayos fase i/ii y, en base al análisis intermedio de sus resultados, se iniciaron, de manera acelerada y con ensayos en paralelo, los de fase ii. Antes de finalizar los estudios, ya empezaron a producirse varias vacunas candidatas. Todo ello ha posibilitado su disponibilidad para la inoculación a la población con una rapidez impensable1.
La tecnología novedosa empleada y la rapidez del proceso no implica que se hayan pasado por alto los controles necesarios de seguridad. Pero era esperable que, como estamos viendo, con el uso clínico vayan irrumpiendo efectos secundarios no encontrados o no categorizados suficientemente durante el periodo preclínico. Las manifestaciones cutáneas y su categorización fueron importantes para el entendimiento de la enfermedad4 de la misma forma que pueden ser las generadas por las vacunas5. En muchas de estas manifestaciones dermatológicas asociadas a la COVID-19 no se encontró el virus o su acción citopática directa y pueden estar relacionadas con la repuesta inmunitaria del huésped.
En los documentos de autorización de todas las vacunas disponibles se informa de la presencia de efectos secundarios dermatológicos y, tras su uso clínico, siguen apareciendo publicaciones de reacciones cutáneas variadas. Como dermatólogos, es importante conocer las características de los distintos tipos de vacunas, su interacción con el huésped y el rango de reacciones sistémicas y dermatológicas que podemos encontrar.
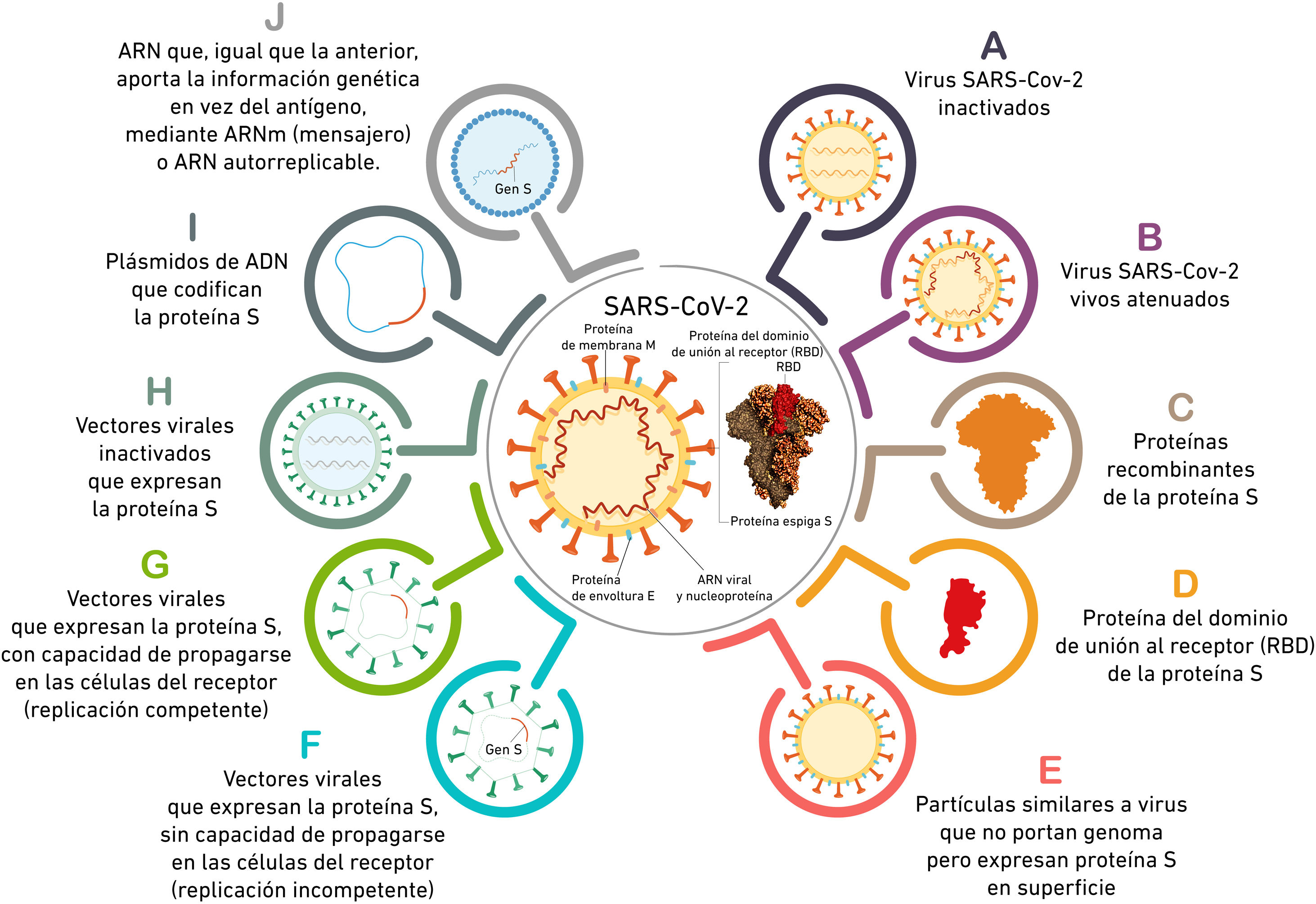
Las vacunas frente a SARS-CoV-2El SARS-CoV-2 se introduce en la célula huésped uniéndose a la enzima convertidora de angiotensina 2 (ACE2) a través de su proteína «spike» de superficie (S). La liberación del ARN conduce a la replicación, transcripción y síntesis del ARN viral y las proteínas estructurales resultantes (ARN viral, proteínas de la nucleocápside [N], de membrana [M], de envoltura [E] y S) forman el virión maduro, capaz de liberarse de la célula huésped para infectar a otras.
En el huésped, SARS-CoV-2 induce una respuesta inmune innata, con participación de IFN-I y otras citocinas proinflamatorias y una respuesta inmune adaptativa, en la que los linfocitos T CD4+ y CD8+ reaccionan contra las proteínas virales S, M y N, Nsp y ORF3a. En la mucosa de la vía respiratoria alta, el contacto con el virus induce la formación de IgA secretora. A nivel sistémico, la IgG específica contra las proteínas S y la proteína de su dominio de unión al receptor (RBD) es reclutada desde el suero hacia la vía respiratoria baja. Las respuestas de IgM e IgA sérica son menos intensas1,6.
Las vacunas entrenan al sistema inmunológico usando antígenos inofensivos del SARS-CoV-2 para estimular una respuesta inmunitaria sin causar enfermedad. Las de administración intramuscular inducen fundamentalmente una inmunidad humoral pero no son capaces de mejorar la respuesta local. Las administradas vía intranasal inducen una inmunidad local dependiente de IgA, potencialmente esterilizadora, pero inducen una inmunidad sistémica menos eficaz. Algunas vacunas utilizan adyuvantes para activar los receptores celulares e inducir una respuesta inmune innata local y en los ganglios linfáticos regionales, o para polarizar el tipo de respuesta inmune deseado. Mejoran la respuesta inmune, aunque también aumentan las reacciones a la vacuna6,7. Se formulan con adyuvantes tanto las de virus inactivado como las basadas en proteínas.
Cada vacuna introduce un tipo de antígeno, desencadena una respuesta inmune específica que, a su vez, genera la memoria inmunitaria que permite combatir al SARS-CoV-2 ante futuras exposiciones. Este antígeno es procesado por las células presentadoras de antígeno y presentado a las células T CD8+ y CD4+. Las citocinas Th1 también estimulan a las células T CD8+ y las citocinas Th2 inducen la producción de anticuerpos neutralizantes por parte de las células B.
Todas las vacunas inducen algún nivel de inflamación desencadenada por la activación de la inmunidad innata8. El desequilibrio de estas respuestas pueden originar reacciones inflamatorias6 que pueden manifestarse en la piel.
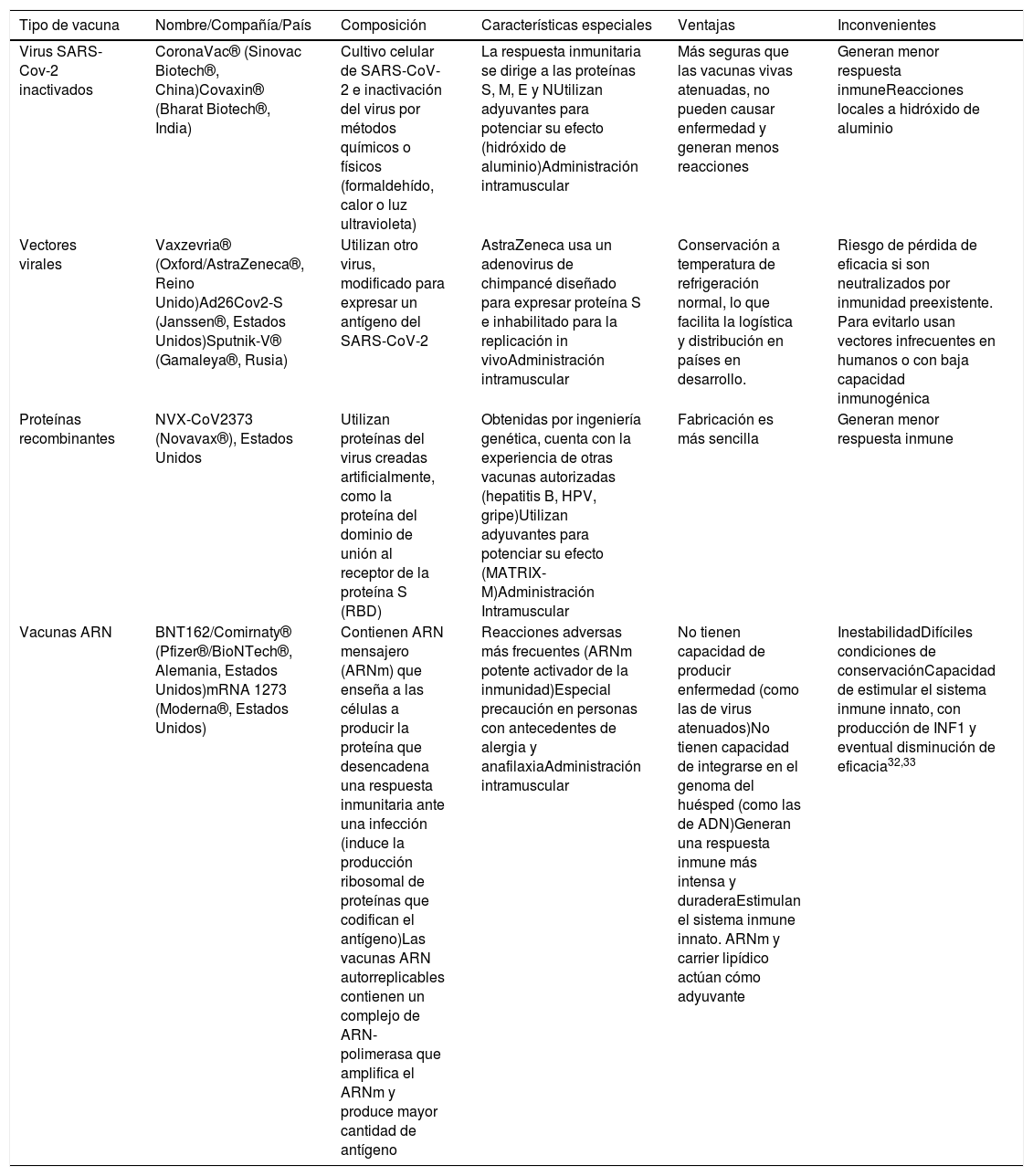
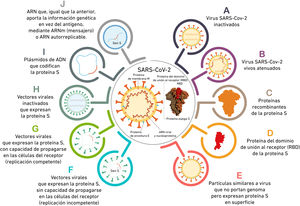
Los anticuerpos antiproteína S inhiben la unión SARS-CoV-2 - ACE-2 por lo que el desarrollo de vacunas se ha centrado en antígenos derivados de la proteína S. Las diferentes formas que usan las vacunas para introducir el antígeno se detallan en la figura 1. Y las diferentes características de las principales vacunas disponibles y en desarrollo se muestran en la tabla 1.
Características comparativas de los diferentes tipos de vacunas
| Tipo de vacuna | Nombre/Compañía/País | Composición | Características especiales | Ventajas | Inconvenientes |
|---|---|---|---|---|---|
| Virus SARS-Cov-2 inactivados | CoronaVac® (Sinovac Biotech®, China)Covaxin® (Bharat Biotech®, India) | Cultivo celular de SARS-CoV-2 e inactivación del virus por métodos químicos o físicos (formaldehído, calor o luz ultravioleta) | La respuesta inmunitaria se dirige a las proteínas S, M, E y NUtilizan adyuvantes para potenciar su efecto (hidróxido de aluminio)Administración intramuscular | Más seguras que las vacunas vivas atenuadas, no pueden causar enfermedad y generan menos reacciones | Generan menor respuesta inmuneReacciones locales a hidróxido de aluminio |
| Vectores virales | Vaxzevria® (Oxford/AstraZeneca®, Reino Unido)Ad26Cov2-S (Janssen®, Estados Unidos)Sputnik-V® (Gamaleya®, Rusia) | Utilizan otro virus, modificado para expresar un antígeno del SARS-CoV-2 | AstraZeneca usa un adenovirus de chimpancé diseñado para expresar proteína S e inhabilitado para la replicación in vivoAdministración intramuscular | Conservación a temperatura de refrigeración normal, lo que facilita la logística y distribución en países en desarrollo. | Riesgo de pérdida de eficacia si son neutralizados por inmunidad preexistente. Para evitarlo usan vectores infrecuentes en humanos o con baja capacidad inmunogénica |
| Proteínas recombinantes | NVX-CoV2373 (Novavax®), Estados Unidos | Utilizan proteínas del virus creadas artificialmente, como la proteína del dominio de unión al receptor de la proteína S (RBD) | Obtenidas por ingeniería genética, cuenta con la experiencia de otras vacunas autorizadas (hepatitis B, HPV, gripe)Utilizan adyuvantes para potenciar su efecto (MATRIX-M)Administración Intramuscular | Fabricación es más sencilla | Generan menor respuesta inmune |
| Vacunas ARN | BNT162/Comirnaty® (Pfizer®/BioNTech®, Alemania, Estados Unidos)mRNA 1273 (Moderna®, Estados Unidos) | Contienen ARN mensajero (ARNm) que enseña a las células a producir la proteína que desencadena una respuesta inmunitaria ante una infección (induce la producción ribosomal de proteínas que codifican el antígeno)Las vacunas ARN autorreplicables contienen un complejo de ARN-polimerasa que amplifica el ARNm y produce mayor cantidad de antígeno | Reacciones adversas más frecuentes (ARNm potente activador de la inmunidad)Especial precaución en personas con antecedentes de alergia y anafilaxiaAdministración intramuscular | No tienen capacidad de producir enfermedad (como las de virus atenuados)No tienen capacidad de integrarse en el genoma del huésped (como las de ADN)Generan una respuesta inmune más intensa y duraderaEstimulan el sistema inmune innato. ARNm y carrier lipídico actúan cómo adyuvante | InestabilidadDifíciles condiciones de conservaciónCapacidad de estimular el sistema inmune innato, con producción de INF1 y eventual disminución de eficacia32,33 |
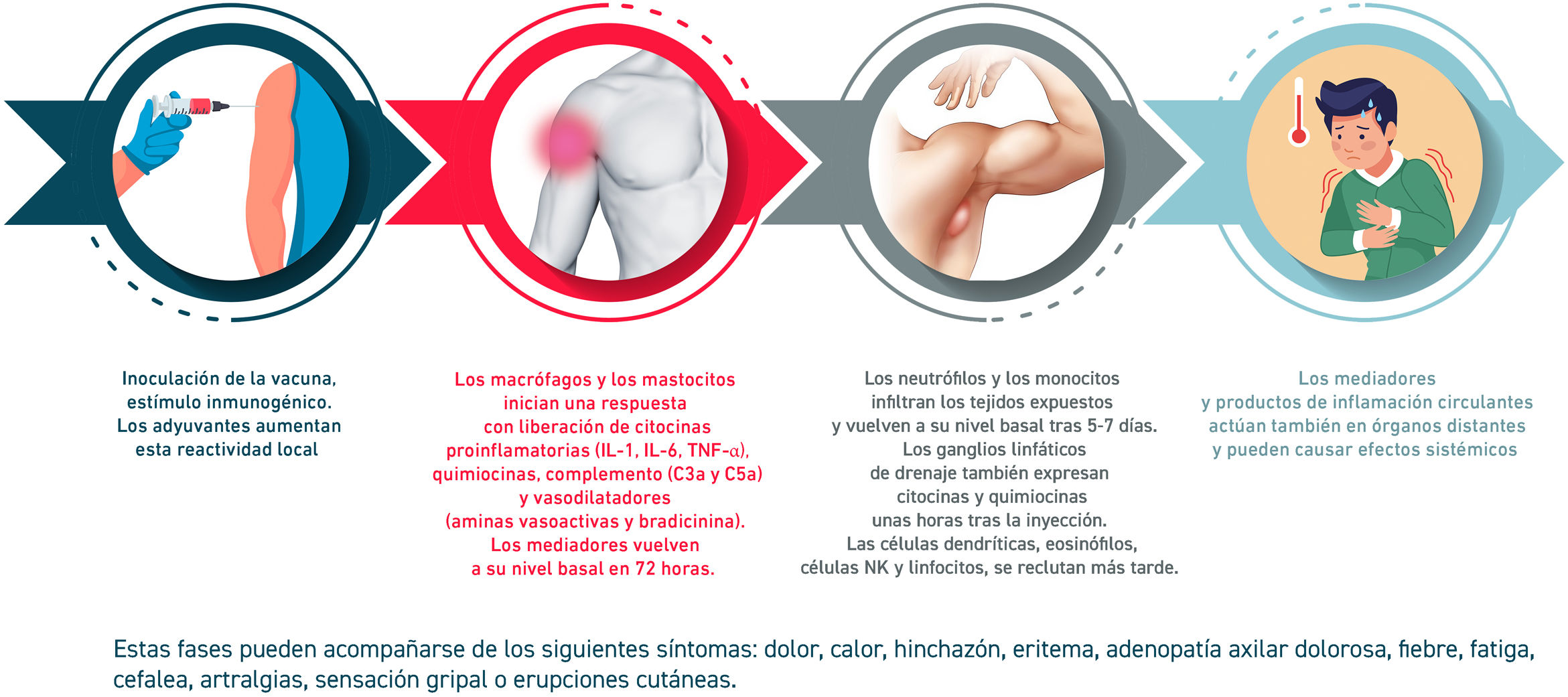
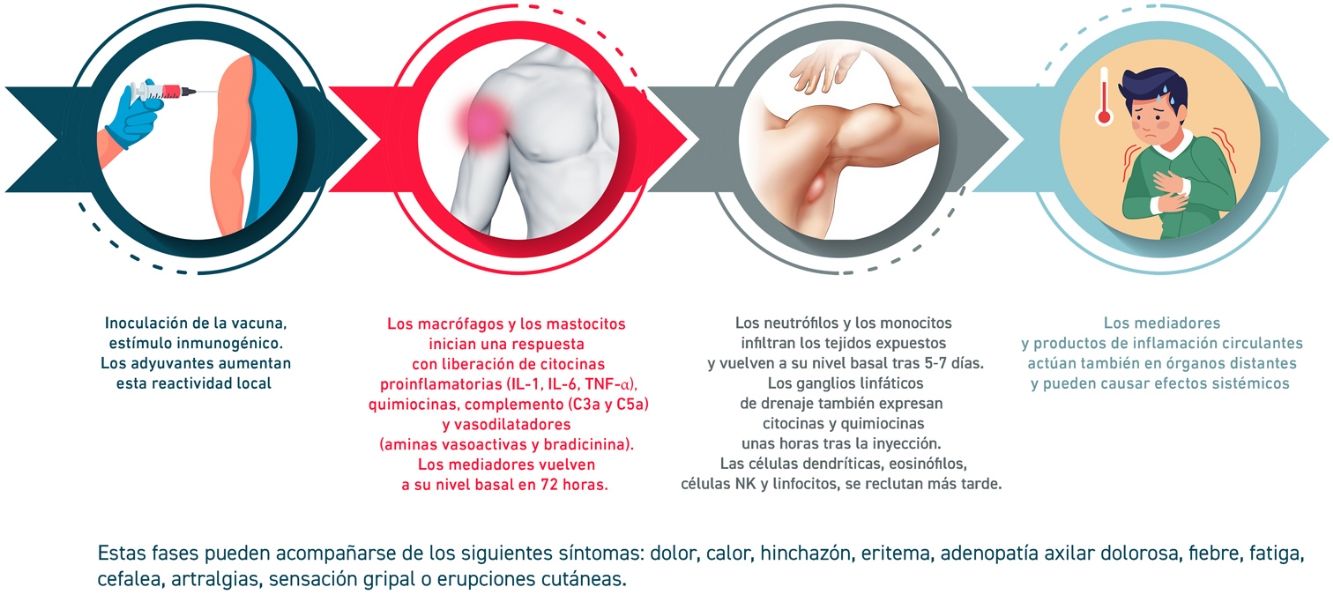
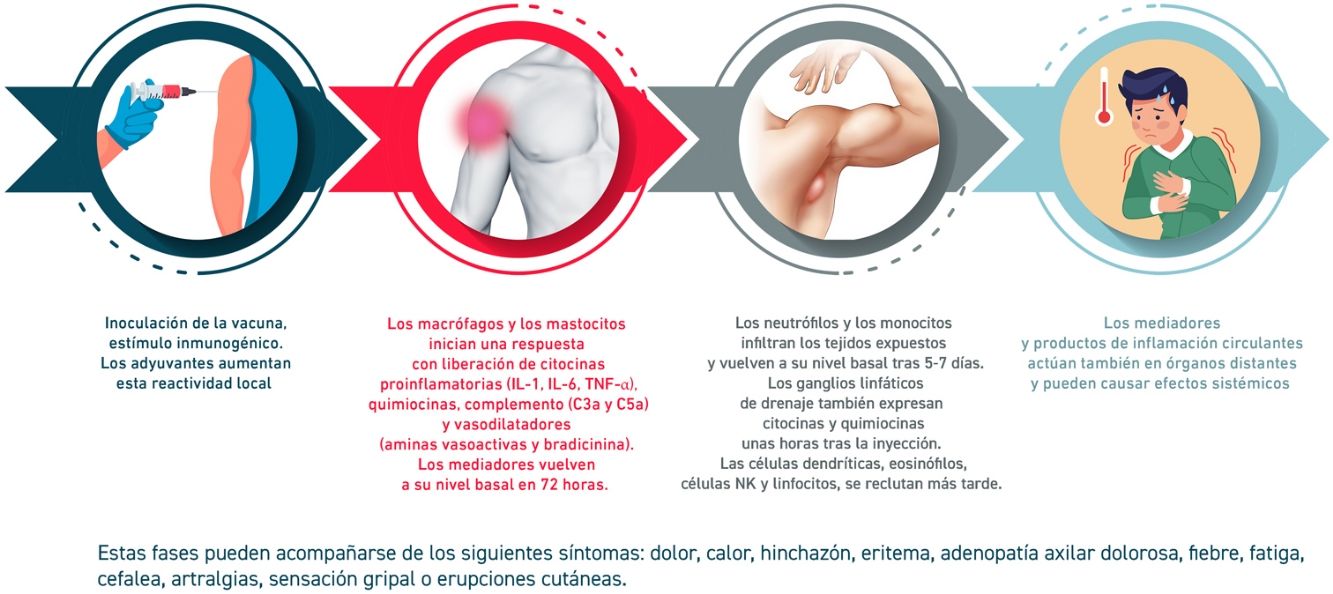
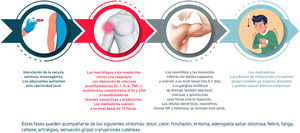
La reactogenicidad, o manifestación física de la respuesta inflamatoria, puede presentarse como una reacción local en el punto de inyección (dolor, calor, enrojecimiento, hinchazón, induración) y/o con la presencia de síntomas sistémicos (fiebre, mialgia, dolor de cabeza…). La sucesión de reacciones inducidas desde el contacto con la vacuna se detallan en la figura 2.
El perfil de tolerabilidad e inmunogenicidad de las vacunas varía según el tipo de antígeno y el adyuvante empleados. Las vacunas de ARN (potente activador de la inmunidad innata) inducen frecuentes reacciones adversas, aunque leves. Otros factores que modifican estos efectos son la edad (más reactogenicidad en jóvenes), un índice alto de masa corporal (quizá relacionado con una mala técnica de administración por inyección subcutánea), la inmunidad preexistente, la vía y punto de administración, la técnica de inyección, el sexo (mayor reactogenicidad en mujeres), algunos factores genéticos o raciales y la ansiedad.
Efectos secundarios de las vacunas COVID-19Los ensayos clínicos previos a la aprobación de las vacunas disponibles notificaron efectos secundarios, entre los que se encuentran reacciones cutáneas, en ocasiones poco detalladas, que se resumen en la tabla 29–12.
Efectos secundarios descritos en los ensayos clínicos
| Sistémicos |
| Muy frecuentes: cefalea, fatiga y artromialgias |
| Menos frecuentes: fiebre, adenopatías, náuseas/vómitos, diarrea y escalofríos |
| Con las vacunas de Moderna® y Pfizer® son más frecuentes tras la segunda dosis y con AstraZeneca®, tras la primera |
| Locales |
| Extremadamente frecuentes: dolor y sensibilidad en el sitio de inyección (84,2% de los participantes tras la primera dosis) |
| Menos frecuente: eritema y edema11 |
| La inflamación local mayor de 2,5cm se consideró efecto secundario y mayor a 10cm, se consideró grave |
| Reacciones locales retardadas (una semana o más tras la inyección) 0,8% de los participantes tras la primera dosis; 0,2% tras la segunda. (Moderna®) |
| Otros efectos secundarios cutáneos |
| Rosácea y celulitis (AstraZeneca®) |
| Urticaria (uno), rash máculo-papular (uno), reacciones de hipersensibilidad no anafilácticas (1,5% de vacunados) y edema en zonas de rellenos dérmicos (3) (Moderna®) |
| Reacciones de hipersensibilidad no anafiláctica en el 0,63% (Pfizer®) |
| Urticaria (5) y urticaria con angioedema (uno), 7 y 4 días tras recibir la vacuna (Janssen®) |
Los efectos secundarios cutáneos que han sido publicados poscomercialización son, en parte, los mismos a los descritos en los ensayos clínicos. Entre ellos se incluyen:
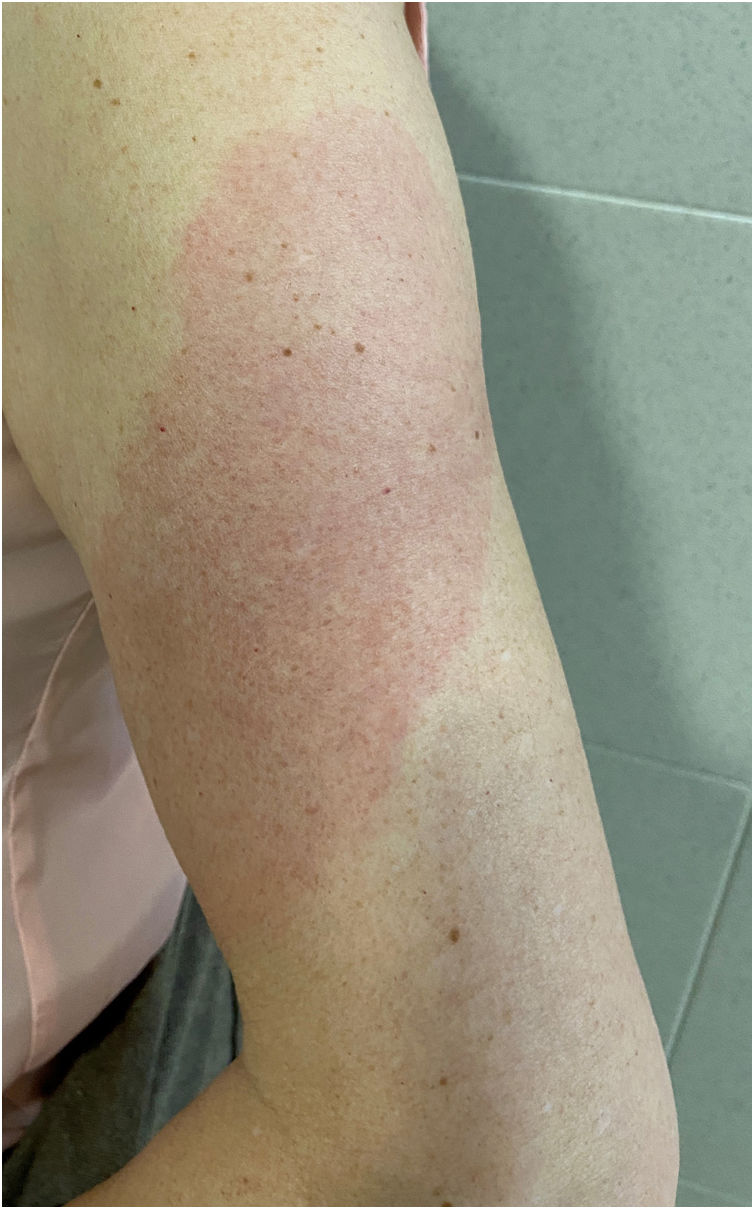
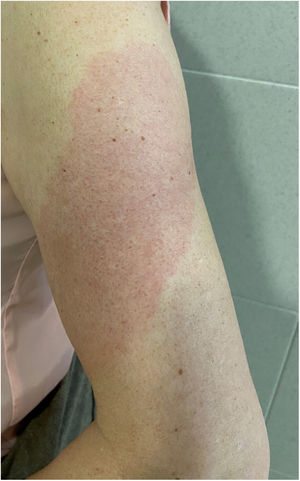
Brazo-COVID (COVID-Arm) (fig. 3)Es la reacción comunicada con más frecuencia. Se trata de la aparición de unas placas eritematosas y edematosas de distintos tamaños en la zona donde se recibió la vacuna. Estas erupciones se han descrito con otras vacunas, como la combinada antineumocócica13.
Los primeros casos publicados8 aparecieron 7 a 10 días después de la primera dosis de Moderna®, que se atribuyó inicialmente a una reacción de hipersensibilidad al polietilenglicol contenido en la vacuna. Sin embargo, en otra serie, la prueba intradérmica con polietilenglicol-polisorbato solo mostró una positividad en un paciente con una reacción que se presentó únicamente tras la segunda dosis. Esto no apoya como causa una reacción IgE mediada a estos compuestos14. Otro estudio apoya como causa una reacción de hipersensibilidad retardada o mediada por células T, en base al cuadro histopatológico, que mostraba la presencia de unos infiltrados linfocíticos perivasculares y perifoliculares superficiales con mastocitos y eosinófilos dispersos15,16. En un estudio retrospectivo se analizaron las reacciones cutáneas en un grupo de trabajadores sanitarios vacunados con Pfizer®. Un 2,1%, presentaron una reacción local retardada, tanto tras la primera dosis como tras la segunda. Como se describe en otras series, en la mitad de los casos la reacción se repitió tras la segunda dosis. Dos fueron biopsiados, encontrándose un infiltrado linfocitario perivascular superficial y profundo, con vasos dilatados, neutrófilos intraluminales e inmunohistoquímica negativa para la proteína SARS-CoV-2 «spike» 1A917.
Todos los casos comunicados se resolvieron con tratamiento conservador, como la aplicación local de frío, corticoides tópicos y/o mediante la toma de antihistamínicos. No se han comunicado reacciones adversas graves tras la segunda dosis, por lo que no se recomienda modificar la pauta.
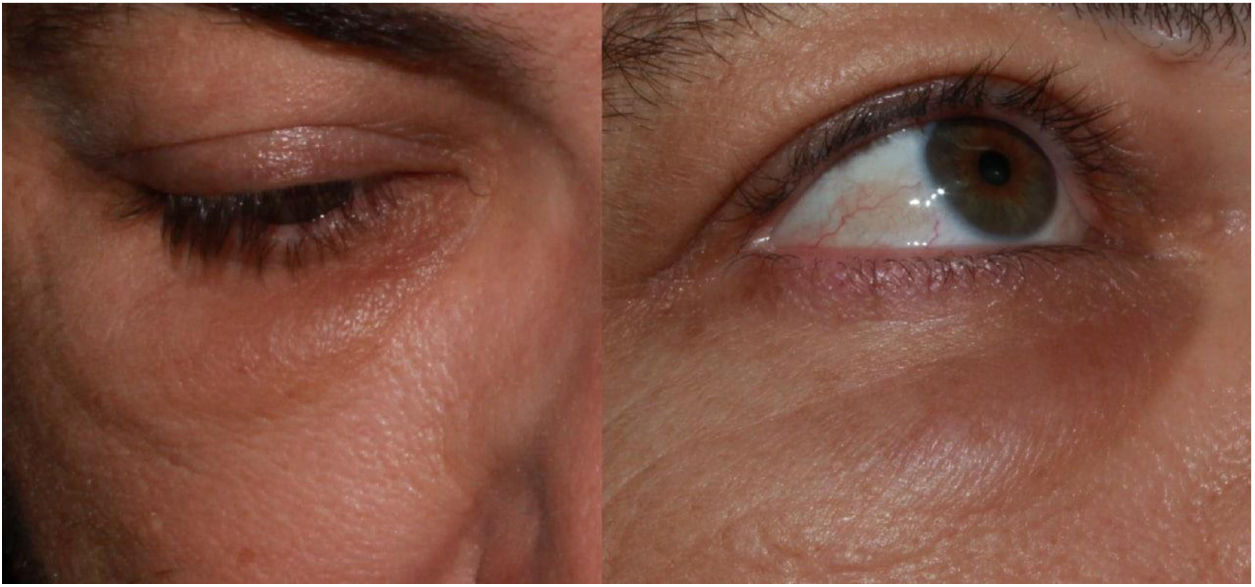
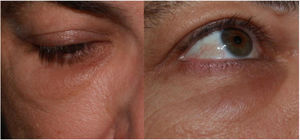
Reacciones inflamatorias en las áreas con rellenos dérmicos de ácido hialurónico (fig. 4)Es conocida la aparición de eritema, edema y nódulos en zonas que anteriormente habían sido sometidas a rellenos dérmicos tras procesos como infecciones virales o vacunas18 e, igualmente, se ha descrito coincidiendo con la infección por SARS-CoV-2 y algunos casos aislados tras la vacunación frente a la COVID-1919,20. Teniendo en cuenta el número de vacunas administradas globalmente y el número de personas portadoras de rellenos dérmicos, parece probable que su frecuencia sea muy baja21.
Como mecanismo fisiopatológico se postula una cascada de acontecimientos que comienza por una fagocitosis deficiente del ácido hialurónico, la formación de «biofilm» alrededor del material de relleno, la activación de células T y la formación de fibrosis y de granulomas. Estas alteraciones favorecen la presencia de células T Th1/CD8+ y las altas concentraciones de ACE2 en las células residentes. Esto ocasionaría una alteración de la regulación entre la producción de angiotensina ii proinflamatoria y angiotensina i antiinflamatoria. La unión de la proteína S inducida por la vacuna a ACE2 inclinaría la balanza hacia la inflamación. Esta hipótesis justificó, en 5 casos, el tratamiento de estas reacciones bloqueando la angiotensina ii con un IECA, obteniendo buenos resultados. Recomiendan lisinopril 5mg/día, doblar la dosis si en 72h no se obtiene mejoría y pretratar antes de la segunda dosis a los pacientes que tuvieron esta complicación en la primera.
Es importante tener en cuenta que, siendo muy pocos de momento, todos los casos comunicados han tenido buena evolución independientemente del tratamiento pautado, que ha sido muy diverso. Así, se han descrito casos que se trataron con antihistamínicos, antibióticos o corticoides sistémicos, corticoides y 5-fluorouracilo intralesional e inyecciones de hialuronidasa. Sin duda, es necesario un conocimiento más profundo y una experiencia más amplia, antes de obtener conclusiones.
Otras erupciones cutáneasIgual que sucedió con la COVID-19, se han descrito una gran variedad de manifestaciones cutáneas de aparición coincidente con la vacunación y sin otra causa aparente. Erupciones morbiliformes15, urticarianas17, máculo-papulares22, liquen plano23,24, eritema multiforme25 y reactivaciones de herpes zóster26. Estos datos los corrobora la publicación reciente de 414 reacciones tras la vacuna Moderna® y Pfizer® comunicadas por distintos profesionales de la salud, a través del registro de manifestaciones cutáneas del SARS-CoV-2 de la Academia Americana de Dermatología. No se encontraron reacciones graves y la mitad de los pacientes con reacciones tras la primera dosis no las presentan tras la segunda. Añaden reacciones diferentes, observadas tanto tras la primera como tras la segunda dosis, como eritromelalgia y perniosis27.
Otras manifestacionesSe han descrito adenopatías supraclaviculares autolimitadas, que se han relacionado con la inyección en un lugar inadecuado, más alto del recomendado (2-3 dedos bajo el acromion)28 y reacciones anafilácticas poco frecuentes y sin ningún desenlace fatal29 pero en un porcentaje mayor al de las vacunas habituales (4,2 frente a un caso por millón).
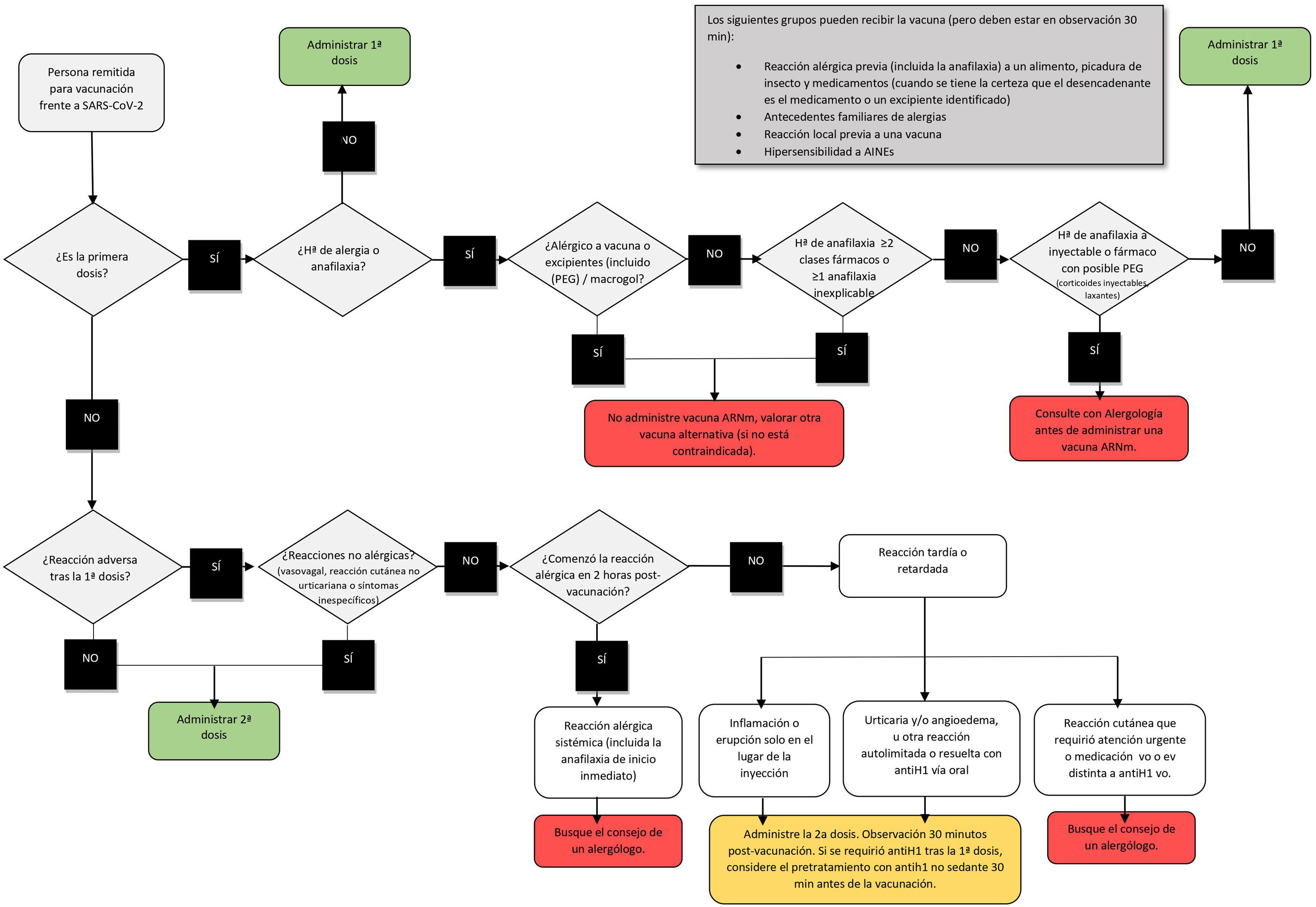
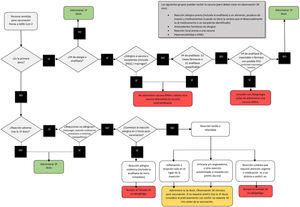
La CDC ha hecho recomendaciones para las vacunas de ARNm, sobre cuándo dar luz verde, actuar con precaución o evitar administrarlas, que se resumen en la figura 5. Aunque la mayoría de los pacientes que han tenido reacciones anafilácticas tienen antecedentes de alergia30, los pacientes atópicos, con urticaria y con eccema, si bien deben estar correctamente tratados en el momento de la vacuna, no deben retrasar la vacunación ni tienen un riesgo aumentado de reacciones alérgicas graves31.
Estudio vacunas COVID-pielDe la misma manera que sucedió con la emergencia de la COVID-19, la administración masiva a la población de una vacuna de nueva creación y tecnología está sacando a la luz una gran variedad de manifestaciones cutáneas. Como dermatólogos, tenemos la misión de estar pendientes, analizar, categorizar, valorar el significado y las consecuencias de cada una y comunicar nuestros hallazgos a las unidades de farmacovigilancia y a la comunidad científica.
Con este fin y con el apoyo de la Academia Española de Dermatología, muchos dermatólogos del país nos proponemos recoger el máximo número posible de efectos secundarios dermatológicos.
Por el momento, la mayoría de los más de 100 casos comunicados corresponden a mujeres y a la vacuna de Pfizer®. Se han comunicado un número equivalente tras la primera y tras la segunda dosis. Las manifestaciones más habituales están siendo el «brazo-covid», las erupciones urticariales y la reactivación de un herpes zóster. Información: vacunascovidpiel@gmail.com; https://aedv.es/reacciones-cutaneas-tras-la-administracion-de-vacunas-frente-a-sars-cov-2/
ConclusiónLas vacunas tienen un perfil de seguridad contrastado. Sin embargo, presentan reacciones sistémicas y locales que debemos conocer.
La categorización correcta de las reacciones cutáneas a las vacunas permitirá ofrecer una adecuada información a nuestros pacientes, evitar rechazos innecesarios a la vacunación, disminuir los efectos secundarios graves en los individuos predispuestos y ahondar en los mecanismos fisiopatológicos que subyacen a la reacción inmunitaria al SARS-CoV-2.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Academia Española de Dermatología por su apoyo, a Álvaro Frías Sánchez por la elaboración de los gráficos y a José Luis Martínez Amo por ceder la figura4.