La microscopía confocal (MC) es una técnica de imagen que permite la visualización en tiempo real de estructuras de la piel, con una resolución comparable a la histología convencional1. Es una técnica que se ha aplicado sobre múltiples patologías dermatológicas, fundamentalmente sobre patología tumoral como el carcinoma basocelular (CB) o espinocelular. Esta tecnología puede aplicarse directamente sobre la piel (in vivo), o sobre piezas que se hayan extirpado quirúrgicamente (ex vivo). En este último caso, el uso de fluoróforos ha conseguido mejorar la calidad de las imágenes obtenidas, en lo que se conoce como MC de fluorescencia (MCF).
Se han usado múltiples tinciones en MCF, como el azul de metileno o azul de toluidina; sin embargo, el naranja de acridina (NA) es el más usado2. El NA se une de forma específica al ADN y ARN de células vivas, actuando como un fluoróforo que se excita a una longitud de onda específica y emite fluorescencia. De esta forma, los núcleos celulares pueden ser resaltados, y se observan como estructuras brillantes blancas en los mosaicos de MCF3. Por su parte, las estructuras que carecen de núcleo, como los haces de colágeno que forman parte de la dermis, emitirían una fluorescencia muy débil o nula. De esta forma, el NA mejora hasta 100 veces el contraste de las imágenes4. Además, es importante señalar que el NA no degenera la muestra ni impide que sea posteriormente teñida con la clásica tinción de hematoxilina-eosina5.
Hasta el momento, en las imágenes publicadas en la literatura de MCF, la fluorescencia emitida por el NA era traducida por el microscopio a una imagen final en escala de grises o bicromática6. A pesar del excelente contraste entre estructuras y la gran correlación histopatológica que muestran estas imágenes, los mosaicos finales en escala de grises resultan complejos de interpretar para dermatólogos y patólogos no expertos en MC.
Recientemente nuestro grupo ha descrito una nueva técnica para la obtención de imágenes de MCF en escala de tres colores (MCF-3CS), mediante el uso conjunto del NA y bromuro de etidio (BE)7.
En esta técnica, las piezas extirpadas se introducen en nitrógeno líquido, lo que supone una congelación prácticamente instantánea. Posteriormente se secciona con el criostato en cortes rápidos de unos 20-30 μm de grosor. Tras ser seccionada la muestra se tiñe vertiendo sobre ella la mezcla de NA 0,1 mM y BE 0,25 mM, dejando actuar la solución durante un minuto. Tras este breve procesamiento la muestra se coloca en el microscopio confocal, modelo Nikon A1R+ (Nikon Corporation®, Japón), disponible comercialmente. Una vez situada en el microscopio la muestra es estimulada de forma simultánea por láser con dos longitudes de onda diferentes, 405 nm y 488 nm. El microscopio recoge la fluorescencia que emite la muestra tras ser estimulada, obteniéndose imágenes en escala de tres colores. Este proceso requiere unos 10-15 minutos hasta la obtención de los mosaicos a color finales.
Estas imágenes a color son resultado de la acción conjunta de los dos fluoróforos aplicados sobre la muestra. El BE es un fluoróforo que se une de forma específica al ADN de células que han perdido la integridad de su membrana8. El BE atraviesa las membranas nucleares dañadas tras el congelamiento, uniéndose con gran afinidad al ADN y tiñendo de esta forma los núcleos celulares. De esta forma, cuando la muestra es estimulada con láser a 405 nm, el BE emite fluorescencia roja, destacando con gran precisión dichos núcleos. Por su parte, la dermis y las estructuras anucleadas emiten fluorescencia verde que procede del NA tras ser estimulado a 488 nm. Por otro lado, la fluorescencia azul débil proviene de la fluorescencia intrínseca de los tejidos. Toda esta fluorescencia es recogida por el microscopio, y como resultado se obtienen las imágenes finales en escala de tres colores.
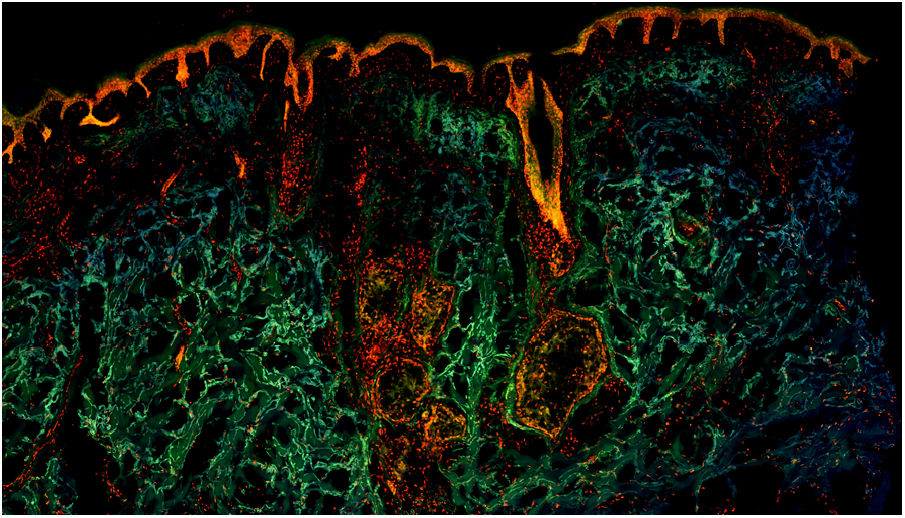
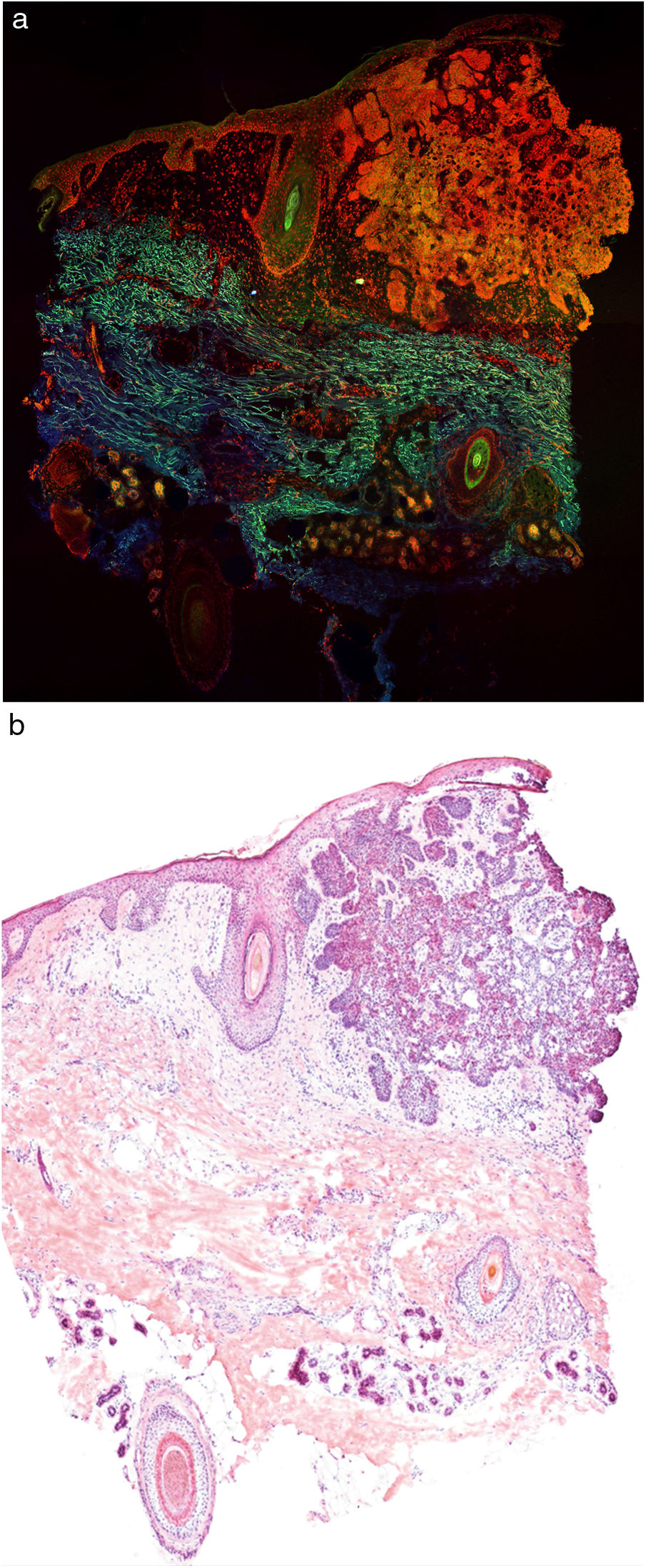
En la figura 1 se puede observar cómo se visualiza un fragmento de piel sana con esta técnica. Las estructuras nucleadas emiten fluorescencia roja, que contrasta significativamente con la fluorescencia verde, obteniéndose imágenes muy intuitivas y sencillas de interpretar, con una resolución muy alta. Esta alta resolución permite delimitar con gran precisión los límites de tumores cutáneos, como el CB que se muestra en la figura 2a. Nótese la total correlación con la tinción con hematoxilina-eosina clásica (figura 2b). Tras el procesamiento, y en relación a las imágenes de H-E, no observamos cambios significativos en la calidad de las imágenes.
La principal aplicabilidad de MC ex vivo en la actualidad es la relacionada con procesos quirúrgicos oncológicos, como la cirugía de Mohs. Es de esperar que en los próximos años se abaraten los dispositivos de MC haciéndolo una técnica más coste-efectiva y pudiendo incorporarse progresivamente a la práctica clínica habitual.
En conclusión, las imágenes de MCF a color son significativamente más sencillas de interpretar que las imágenes en escala de grises para dermatólogos y patólogos no expertos en MC. Además, gracias al procesamiento mediante congelamiento la muestra está completamente aplanada, lo que permite obtener imágenes de la muestra completa, sin perderse mosaicos por pliegues de la misma. Todo esto supone importantes ventajas con respecto a las imágenes previas obtenidas con MC. No obstante, son necesarios más estudios que validen esta nueva técnica.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.