Es conveniente ampliar el conocimiento del manejo de apremilast en práctica clínica. El estudio APPRECIATE (NCT02740218) pretende describir las características de pacientes con psoriasis tratados con apremilast, evaluar sus perspectivas y las de sus dermatólogos, y los resultados obtenidos en la práctica clínica española.
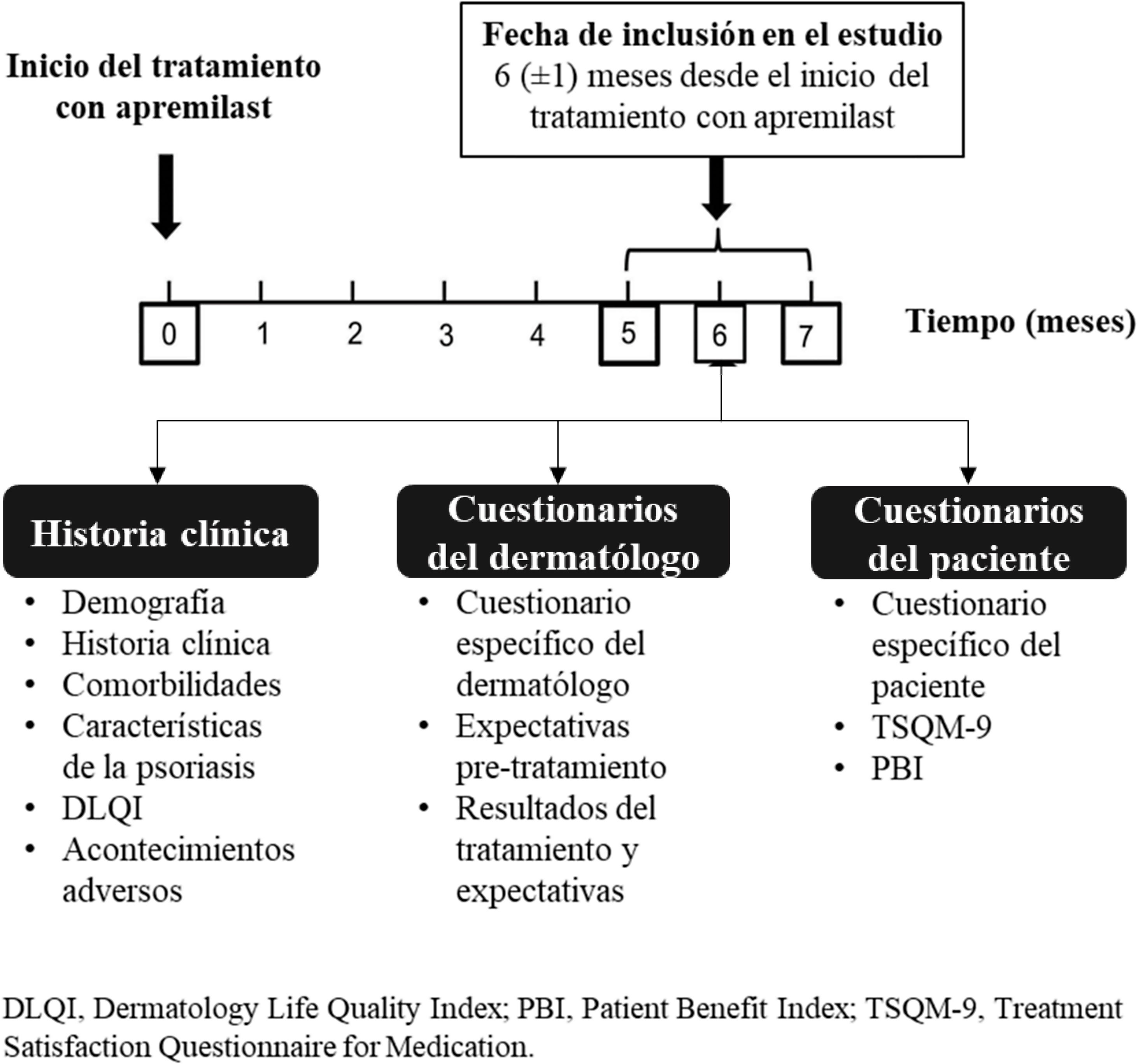
MétodosEstudio observacional, retrospectivo, transversal y multicéntrico en pacientes con psoriasis crónica en placas, a los que se visitó seis (± 1) meses después de iniciar apremilast. Los datos se obtuvieron de las historias clínicas y cuestionarios realizados por pacientes y dermatólogos.
ResultadosSe evaluaron 80 pacientes, al iniciar apremilast presentaban Psoriasis Area and Severity Index (PASI) medio (desviación estándar, DE) = 8,3 (5,3) y Dermatology Life Quality Index (DLQI) medio (DE) = 8,9 (6,6). A los seis meses, el 58,8% (n = 47) continuaba con apremilast (discontinuaciones: falta de eficacia [16,3%], seguridad/tolerabilidad [20,0%]). En pacientes que continuaban en tratamiento, el PASI75 fue alcanzado por el 36,7%; la puntuación DLQI media (IC 95%) fue 2,2 (0,7-3,6) y Patient Benefit Index medio (DE) 2,8 (0,8). El cumplimiento de las expectativas de los dermatólogos se correlacionó con los beneficios descritos por los pacientes (r = 0,636). El 56,3% reportó acontecimientos adversos (diarrea y náuseas los más frecuentes).
ConclusionesLos pacientes que recibieron apremilast durante seis meses en la práctica clínica en España reportaron una mejoría en su calidad de vida (DLQI medio se redujo más de seis puntos) y en la gravedad de la enfermedad (PASI75 alcanzado por más de un tercio de los pacientes), a pesar de presentar una afectación cutánea menor que aquellos pacientes incluidos en ensayos clínicos.
It is necessary to expand the knowledge in the use of apremilast in clinical practice. The APPRECIATE study (NCT02740218) aims to describe the characteristics of patients with psoriasis treated with apremilast, to evaluate their perspectives and those of dermatologists, as well as the outcomes obtained in clinical practice in Spain.
MethodsObservational, retrospective, cross-sectional, multicenter study of patients with chronic plaque psoriasis who could be contacted 6 (±1) months after apremilast initiation. The data were obtained from medical records and questionnaires from patients and physicians.
ResultsA total of 80 patients were evaluated; at apremilast onset, they showed mean (standard deviation, SD) Psoriasis Area and Severity Index (PASI) = 8.3 (5.3), mean (SD) Dermatology Life Quality Index (DLQI) = 8.9 (6.6). At six months, 58.8% (n=47) of patients continued apremilast treatment (discontinuations due to lack of efficacy [16.3%], safety/tolerability [20.0%]). In patients continuing treatment, PASI75 was achieved by 36.7% of patients; mean (95% CI) DLQI score was 2.2 (0.7-3.6) and mean (SD) Patient Benefit Index score was 2.8 (0.8). Compliance with physicians’ expectations was correlated with benefits reported by patients (r=0.636). Adverse events were reported by 56.3% of patients (the most common were diarrhoea and nausea).
ConclusionsPatients receiving apremilast for 6 months in Spanish clinical practice, reported substantial improvements in their quality of life (mean DLQI reduced by more than 6 points) and disease severity (PASI75 achieved by over one-third of patients), despite less skin involvement than patients who enrolled in clinical trials.
El uso de apremilast (inhibidor oral de la fosfodiesterasa 4) fue aprobado en Europa para tratar la psoriasis crónica en placas de moderada a grave y la artritis psoriásica en 20151. A partir de ensayos clínicos, apremilast demostró su eficacia y seguridad en pacientes con psoriasis de moderada a grave previamente tratados con terapias sistémicas (ESTEEM 1 y 2)2,3, sin terapia biológica previa (LIBERATE)4 y sin terapia biológica o sistémica previa (UNVEIL)5. Posteriormente, la efectividad mostrada en las series de práctica clínica, en perfiles de pacientes diferentes a los de los ensayos pivotales, parece ser superior. Por ello, se consideró conveniente ampliar el conocimiento sobre el uso y efectividad de apremilast en condiciones de práctica clínica, frente a los ensayos pivotales mencionados, y generar datos sobre la satisfacción obtenida por pacientes y dermatólogos tras el uso de apremilast.
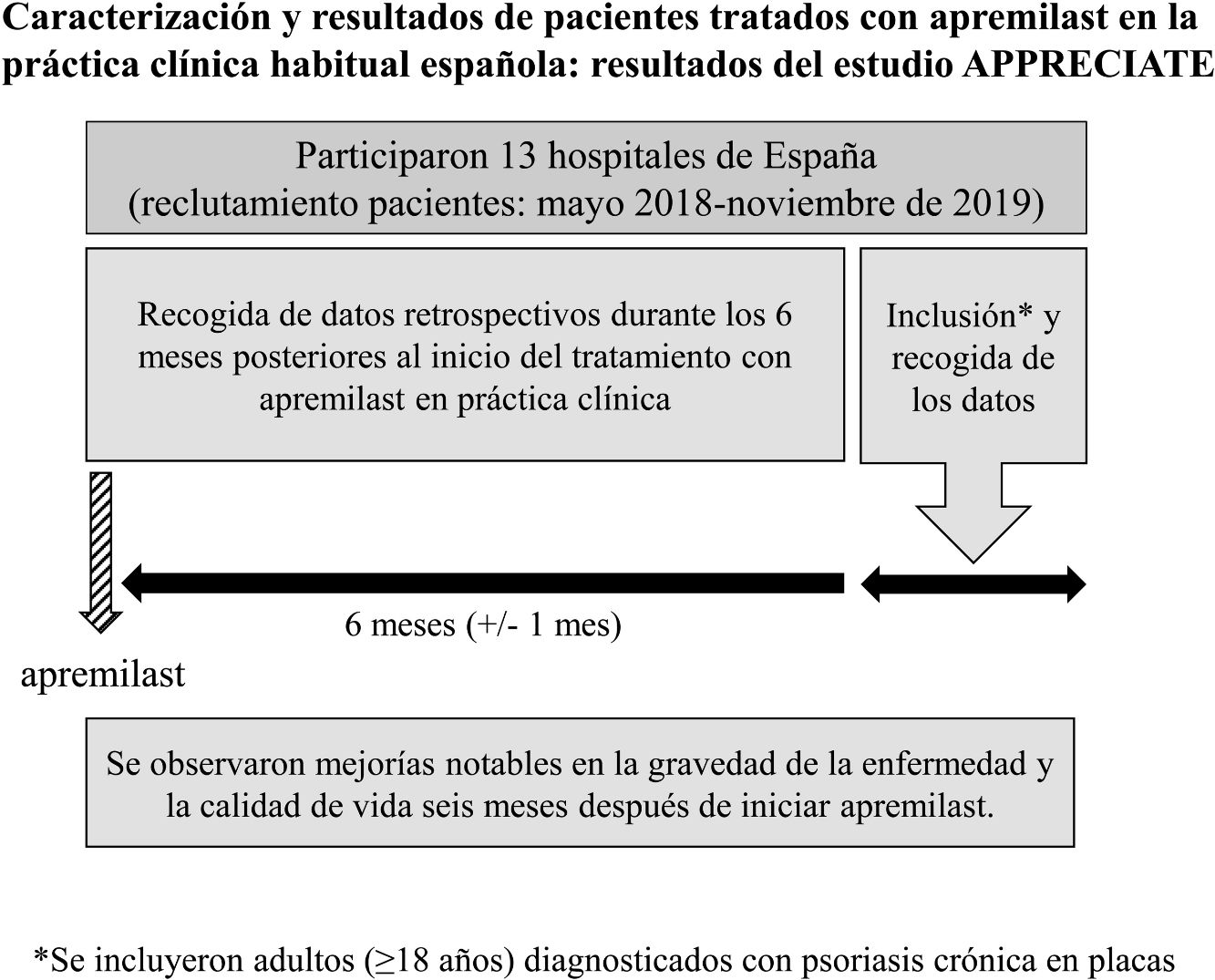
El estudio APPRECIATE (NCT02740218) tiene como objetivo describir las características de los pacientes con psoriasis tratados con apremilast en la práctica clínica habitual y evaluar las perspectivas de los pacientes y dermatólogos cuando se inicia el tratamiento, junto con los resultados y beneficios clínicos obtenidos. Los resultados de Alemania, Austria, Irlanda, Reino Unido, Suecia y Suiza fueron publicados recientemente6. En el presente trabajo se presentan los resultados de España.
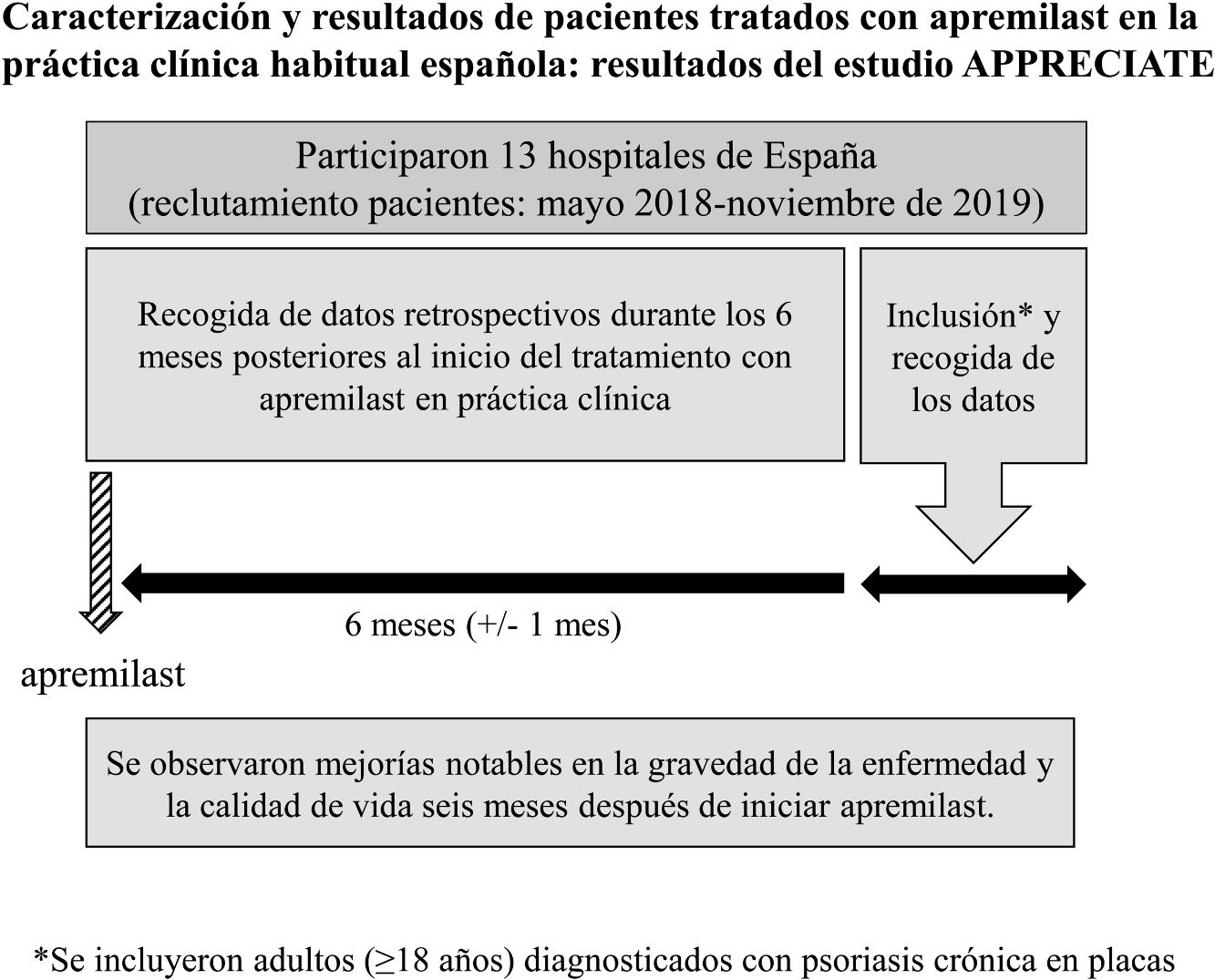
MétodosDiseño del estudioAPPRECIATE es un estudio observacional, retrospectivo, transversal e internacional, que recoge los resultados con apremilast seis meses después de iniciar tratamiento en la práctica clínica habitual (fig. 1). El presente análisis incluyó los datos recopilados en 13 hospitales de España, donde el reclutamiento de pacientes se inició en mayo de 2018 y finalizó en noviembre de 2019.
PoblaciónLos pacientes elegibles eran adultos (≥ 18 años) diagnosticados con psoriasis crónica en placas que habían iniciado tratamiento con apremilast 6 ± 1 meses antes de la inclusión en el estudio. Se invitó a participar a todos los pacientes que cumplían dichos criterios de forma consecutiva, independientemente de que hubieran suspendido apremilast en el momento de su evaluación. La inclusión en el estudio no interfirió en ningún caso con la práctica habitual de cada dermatólogo. El único criterio de exclusión fue la participación de los pacientes en algún ensayo clínico. El estudio se realizó de acuerdo con la Declaración de Helsinki y fue aprobado por los comités éticos de los centros participantes. Todos los participantes firmaron el consentimiento informado antes de la recopilación de datos.
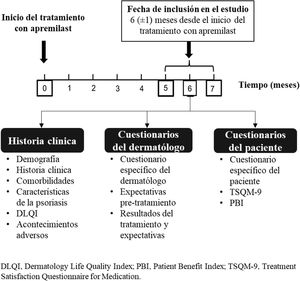
Recopilación de datosEl estudio se basa en una única visita presencial a los 6 ± 1 meses del inicio de apremilast, en la que se recogieron los datos de las historias clínicas y de los cuestionarios completados por dermatólogos y pacientes.
De las historias clínicas se recogieron los datos demográficos, historial médico, comorbilidades, gravedad de la enfermedad (Psoriasis Area and Severity Index [PASI] y Body Surface Area [BSA])7, manifestaciones clínicas (prurito, fatiga, uñas, cuero cabelludo, palmoplantar, psoriasis inversa genital y no genital, pustulosis palmoplantar y artritis psoriásica), estado del tratamiento con apremilast (fecha y motivos de discontinuación si aplica), tratamientos previos para la psoriasis, calidad de vida (CdV, Dermatology Life Quality Index [DLQI])8 y acontecimientos adversos (AAs).
Los dermatólogos cumplimentaron tres cuestionarios de satisfacción específicos del estudio que recogían información sobre los motivos del uso de apremilast (1), los efectos del tratamiento sobre los síntomas, la tolerabilidad del tratamiento, la efectividad de apremilast sobre las manifestaciones específicas de la psoriasis (2), el cumplimiento de las expectativas y el éxito general (3).
Los pacientes completaron tres cuestionarios: Patient Benefit Index (PBI)9, Treatment Satisfaction Questionnaire for Medication (TSQM-9)10 y el cuestionario específico del estudio. Dicho cuestionario recopiló datos demográficos, socioeconómicos, factores de estilo de vida y expectativas y experiencia con apremilast.
La tabla 1 resume las principales herramientas de evaluación.
Principales herramientas de evaluación utilizadas
| Índice o cuestionario | Objetivo | Puntuación |
|---|---|---|
| Body Surface Area (BSA)* | Medir la superficie corporal afectada por las lesiones de psoriasis. | Leve: < 3% de la superficie; Moderada: 3-10%; Grave: > 10%. |
| Psoriasis Area and Severity Index (PASI)* | Valorar severidad de cada lesión (en base a eritema, infiltración y descamación) y el área que afecta (cabeza, tronco, extremidades superiores e inferiores). | Leve: 0-5; Moderada: 5-10; Grave: > 10. |
| Physician's Global Assessment (PGA)* | Valorar la intensidad de las lesiones. | Blanqueada: 0; Casi blanqueada: 1; Leve: 2; Leve a moderada: 3; Moderada: 4; Moderada a grave: 5; Grave: 6. |
| Dermatology Life Quality Index (DLQI)‡ | Valorar el efecto de la enfermedad en la calidad de vida. | Sin efecto: 0-1; Efecto mínimo: 2-5; Efecto moderado: 6-10; Muy grande: 11-20; Extremadamente grande: 21-30. |
| Patient Benefit Index (PBI)† | Valorar el beneficio que aporta el tratamiento desde la perspectiva del paciente en base a un cuestionario sobre las necesidades terapéuticas del paciente y otro sobre el beneficio alcanzado por el tratamiento. | Sin beneficio: 0; Beneficio mínimo: 1; Beneficio máximo: 4. |
| Treatment Satisfaction Questionnaire for Medication (TSQM-9)§ | Valorar la satisfacción con el tratamiento en términos de efectividad, conveniencia y satisfacción global. | De 0-100, donde 100 representa la máxima satisfacción. |
Se analizaron los datos demográficos de los pacientes, las características de la enfermedad, los resultados del tratamiento y los AAs mediante estadística descriptiva. Se calcularon los intervalos de confianza (IC) del 95%. Los valores ausentes no fueron imputados. Los resultados se estratificaron según el estado de la terapia con apremilast: en curso vs. discontinuado. Se calcularon las correlaciones entre las medidas de resultado. Los análisis estadísticos fueron realizados mediante el programa SAS versión 9.4.
ResultadosCaracterísticas de la poblaciónEn España se invitó a 86 pacientes a participar en el estudio APPRECIATE, de los cuales 82 fueron incluidos en el estudio. Finalmente, 80 pacientes formaron parte de la población de seguridad y del conjunto de análisis completo (FAS); dos pacientes (2,4%) fueron excluidos por no haber sido diagnosticados de psoriasis.
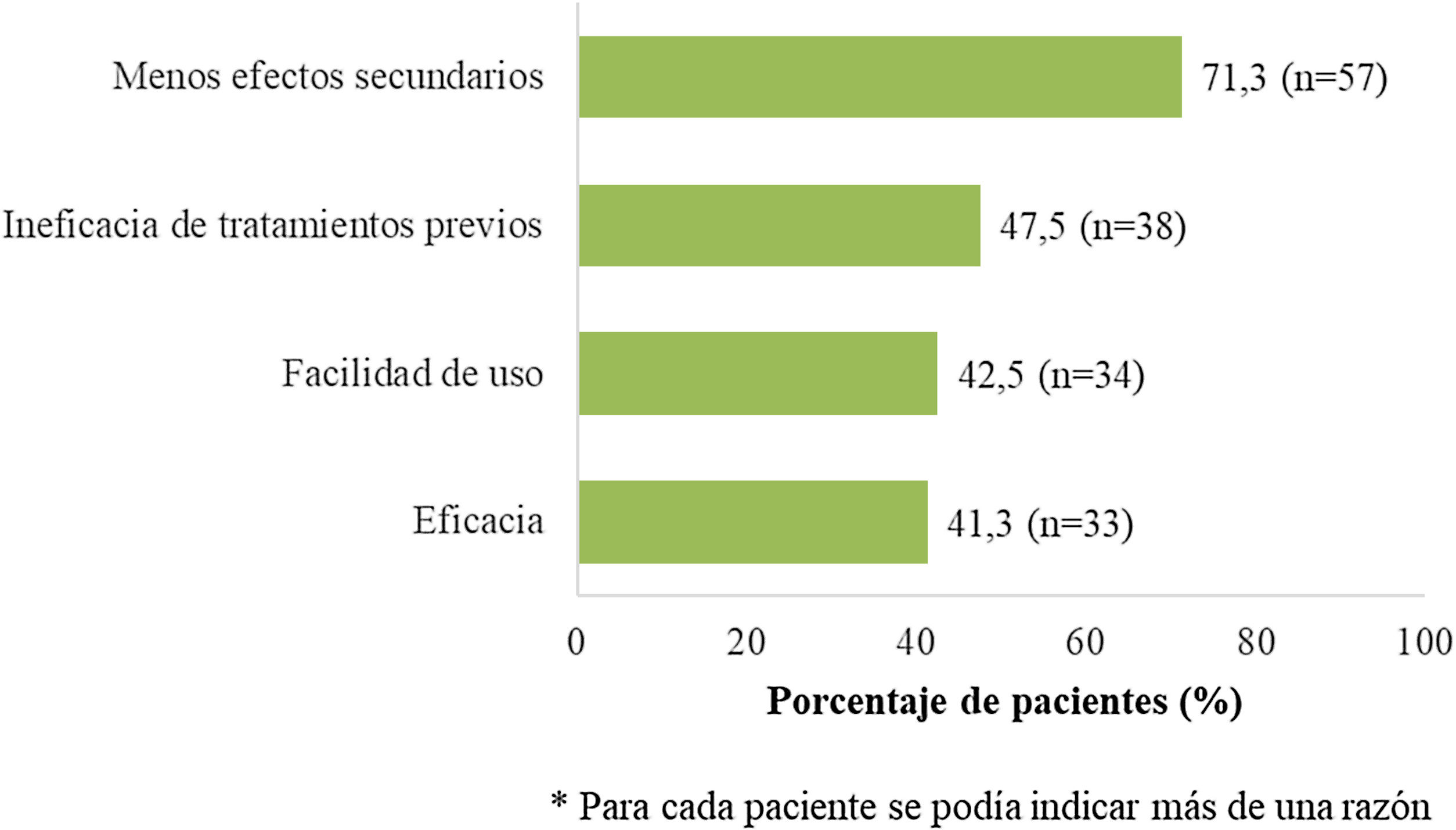
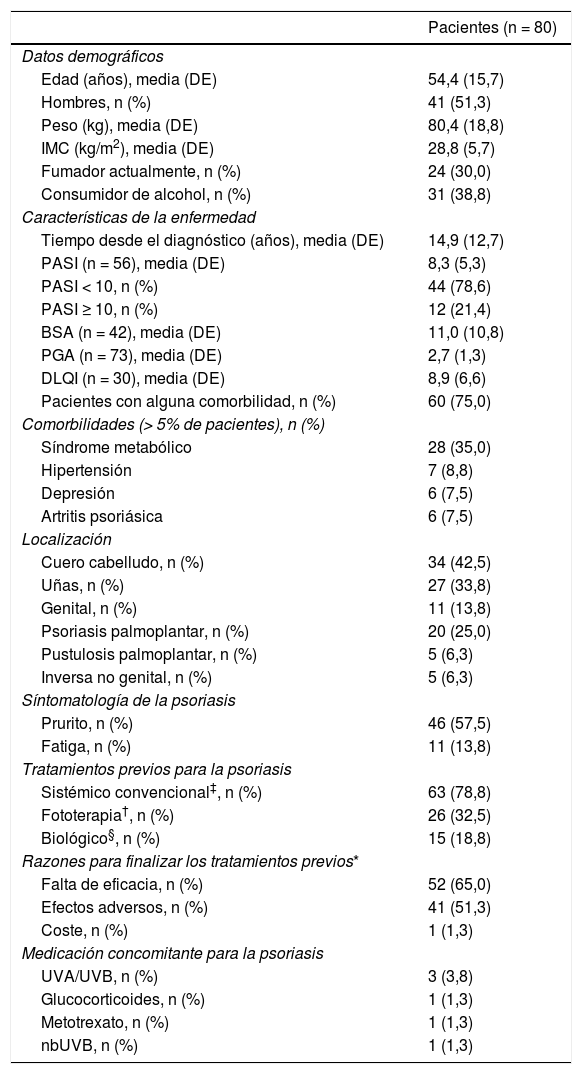
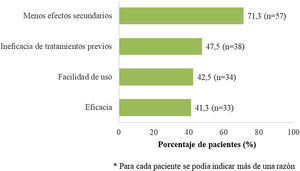
En el momento de iniciar apremilast, los pacientes presentaban una puntuación media basal para PASI y BSA (desviación estándar, DE) de 8,3 (5,3) y 11,0 (10,8), respectivamente. Asimismo, al inicio de apremilast, la mayoría de los pacientes (78,6%) presentó una puntuación PASI < 10 (intensidad leve-moderada) y la puntuación DLQI media (DE) fue 8,9 (6,6), mostrando un efecto moderado sobre la CdV (tabla 2). La principal sintomatología fue el prurito (57,5%) y la localización más frecuente fue el cuero cabelludo, seguido de las uñas (42,5% y 33,8%, respectivamente). El 75,0% (n = 60) de los pacientes presentaban comorbilidades asociadas (tabla 2). Al inicio del tratamiento con apremilast, el 16,3% (n = 13) y el 11,3% (n = 9) de los pacientes recibían medicación para la ansiedad y la depresión, respectivamente. La mayoría de los pacientes (n = 70; 87,5%) había recibido al menos un tratamiento sistémico previo para la psoriasis (26 [32,5%] pacientes una terapia, 25 [31,3%] pacientes dos terapias y 19 [23,8%] pacientes más de dos terapias previas) y seis (7,5%) mantenían algún otro tratamiento sistémico concomitante (tabla 2). La figura 2 muestra las principales razones para considerar el tratamiento con apremilast.
Datos demográficos y características de la enfermedad al inicio de apremilast
| Pacientes (n = 80) | |
|---|---|
| Datos demográficos | |
| Edad (años), media (DE) | 54,4 (15,7) |
| Hombres, n (%) | 41 (51,3) |
| Peso (kg), media (DE) | 80,4 (18,8) |
| IMC (kg/m2), media (DE) | 28,8 (5,7) |
| Fumador actualmente, n (%) | 24 (30,0) |
| Consumidor de alcohol, n (%) | 31 (38,8) |
| Características de la enfermedad | |
| Tiempo desde el diagnóstico (años), media (DE) | 14,9 (12,7) |
| PASI (n = 56), media (DE) | 8,3 (5,3) |
| PASI < 10, n (%) | 44 (78,6) |
| PASI ≥ 10, n (%) | 12 (21,4) |
| BSA (n = 42), media (DE) | 11,0 (10,8) |
| PGA (n = 73), media (DE) | 2,7 (1,3) |
| DLQI (n = 30), media (DE) | 8,9 (6,6) |
| Pacientes con alguna comorbilidad, n (%) | 60 (75,0) |
| Comorbilidades (> 5% de pacientes), n (%) | |
| Síndrome metabólico | 28 (35,0) |
| Hipertensión | 7 (8,8) |
| Depresión | 6 (7,5) |
| Artritis psoriásica | 6 (7,5) |
| Localización | |
| Cuero cabelludo, n (%) | 34 (42,5) |
| Uñas, n (%) | 27 (33,8) |
| Genital, n (%) | 11 (13,8) |
| Psoriasis palmoplantar, n (%) | 20 (25,0) |
| Pustulosis palmoplantar, n (%) | 5 (6,3) |
| Inversa no genital, n (%) | 5 (6,3) |
| Síntomatología de la psoriasis | |
| Prurito, n (%) | 46 (57,5) |
| Fatiga, n (%) | 11 (13,8) |
| Tratamientos previos para la psoriasis | |
| Sistémico convencional‡, n (%) | 63 (78,8) |
| Fototerapia†, n (%) | 26 (32,5) |
| Biológico§, n (%) | 15 (18,8) |
| Razones para finalizar los tratamientos previos* | |
| Falta de eficacia, n (%) | 52 (65,0) |
| Efectos adversos, n (%) | 41 (51,3) |
| Coste, n (%) | 1 (1,3) |
| Medicación concomitante para la psoriasis | |
| UVA/UVB, n (%) | 3 (3,8) |
| Glucocorticoides, n (%) | 1 (1,3) |
| Metotrexato, n (%) | 1 (1,3) |
| nbUVB, n (%) | 1 (1,3) |
Tratamiento sistémico convencional incluyó metotrexato (n = 38; 47,5%), acitretina (n = 25; 31,3%), retinoides (n = 16; 20,0%), ciclosporina (n = 14; 17,5%), alitretinoína (n = 2; 2,5%), ácido fumárico (n = 2; 2,5%), sulfasalazina (n = 1; 1,3%).
El 58,8% (n = 47) de los pacientes evaluados continuaban en tratamiento con apremilast después de seis meses. Los pacientes que suspendieron el fármaco lo utilizaron durante una media (DE) de 103,5 (64,3) días. Los principales motivos de discontinuación fueron la falta de eficacia (n = 13/80; 16,3%) y motivos de seguridad/tolerabilidad (n = 16/80; 20,0%).
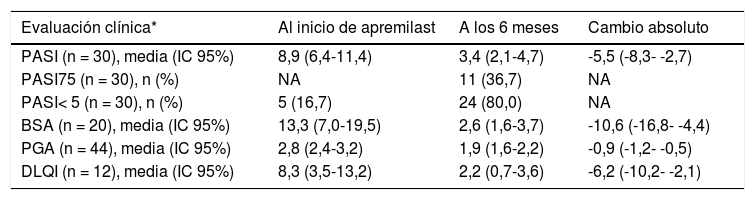
En los pacientes que continuaban con apremilast a los seis meses en los que se disponía de las diferentes puntuaciones al inicio y al seguimiento, la media de la puntuación PASI al seguimiento (n = 30/47; 63,8%) fue de 3,4 (IC 95%: 2,1-4,7), lo que supone una mejoría del 54,8% (tabla 3). El objetivo PASI75 fue alcanzado por el 36,7% (n = 11/30) de los pacientes, y el 80,0% (n = 24/30) alcanzó PASI< 5 (tabla 3). De los pacientes que al inicio del tratamiento presentaban PASI< 10 (n = 23) el 26,1% (n = 6/23; IC 95%: 10,2-48,4%) alcanzó PASI75 y el 78,3% (n = 18/23) PASI< 5; entre los pacientes con PASI≥ 10 al inicio (n = 7), se alcanzó PASI75 en cinco pacientes y PASI< 5 en seis pacientes. La media (IC 95%) de la puntuación DLQI al seguimiento (n = 12/47; 25,5%) fue de 2,2 (0,7-3,6), lo que supone una mejoría media de 6,2 puntos (tabla 3). Los siete pacientes con DLQI ≥ 4 al inicio del tratamiento alcanzaron una mejoría ≥ 4 puntos a los seis meses.
Evolución de las evaluaciones clínicas
| Evaluación clínica* | Al inicio de apremilast | A los 6 meses | Cambio absoluto |
|---|---|---|---|
| PASI (n = 30), media (IC 95%) | 8,9 (6,4-11,4) | 3,4 (2,1-4,7) | -5,5 (-8,3- -2,7) |
| PASI75 (n = 30), n (%) | NA | 11 (36,7) | NA |
| PASI< 5 (n = 30), n (%) | 5 (16,7) | 24 (80,0) | NA |
| BSA (n = 20), media (IC 95%) | 13,3 (7,0-19,5) | 2,6 (1,6-3,7) | -10,6 (-16,8- -4,4) |
| PGA (n = 44), media (IC 95%) | 2,8 (2,4-3,2) | 1,9 (1,6-2,2) | -0,9 (-1,2- -0,5) |
| DLQI (n = 12), media (IC 95%) | 8,3 (3,5-13,2) | 2,2 (0,7-3,6) | -6,2 (-10,2- -2,1) |
Datos de pacientes que a los seis meses continuaban en tratamiento con apremilast en los que se tenía el dato al inicio y al seguimiento.
BSA: Body Surface Area; DLQI: Dermatology Life Quality Index; IC, intervalo de confianza; NA: no aplica; PASI: Psoriasis Area and Severity Index; PGA: Physician's Global Assessment.
Según la evaluación por los dermatólogos, el 73,8% (n = 59) de los pacientes presentaron mejoría en las valoraciones de aclaramiento general de la psoriasis, el 61,3% (n = 49) bienestar general y el 56,3% (n = 45) en el objetivo de alcanzar una vida diaria normal. Entre los pacientes que al inicio mostraban síntomas y manifestaciones específicas de la psoriasis, los dermatólogos confirmaron una mejoría del prurito en el 80,4% (37/46), 67,6% (23/34) de las manifestaciones en cuero cabelludo, 63,0% (17/27) en la afectación ungueal y 55,0% (11/20) en las lesiones palmoplantares. Los dermatólogos indicaron que los resultados obtenidos fueron superiores a sus expectativas en la mitad de los pacientes tratados (50,0%; n = 40).
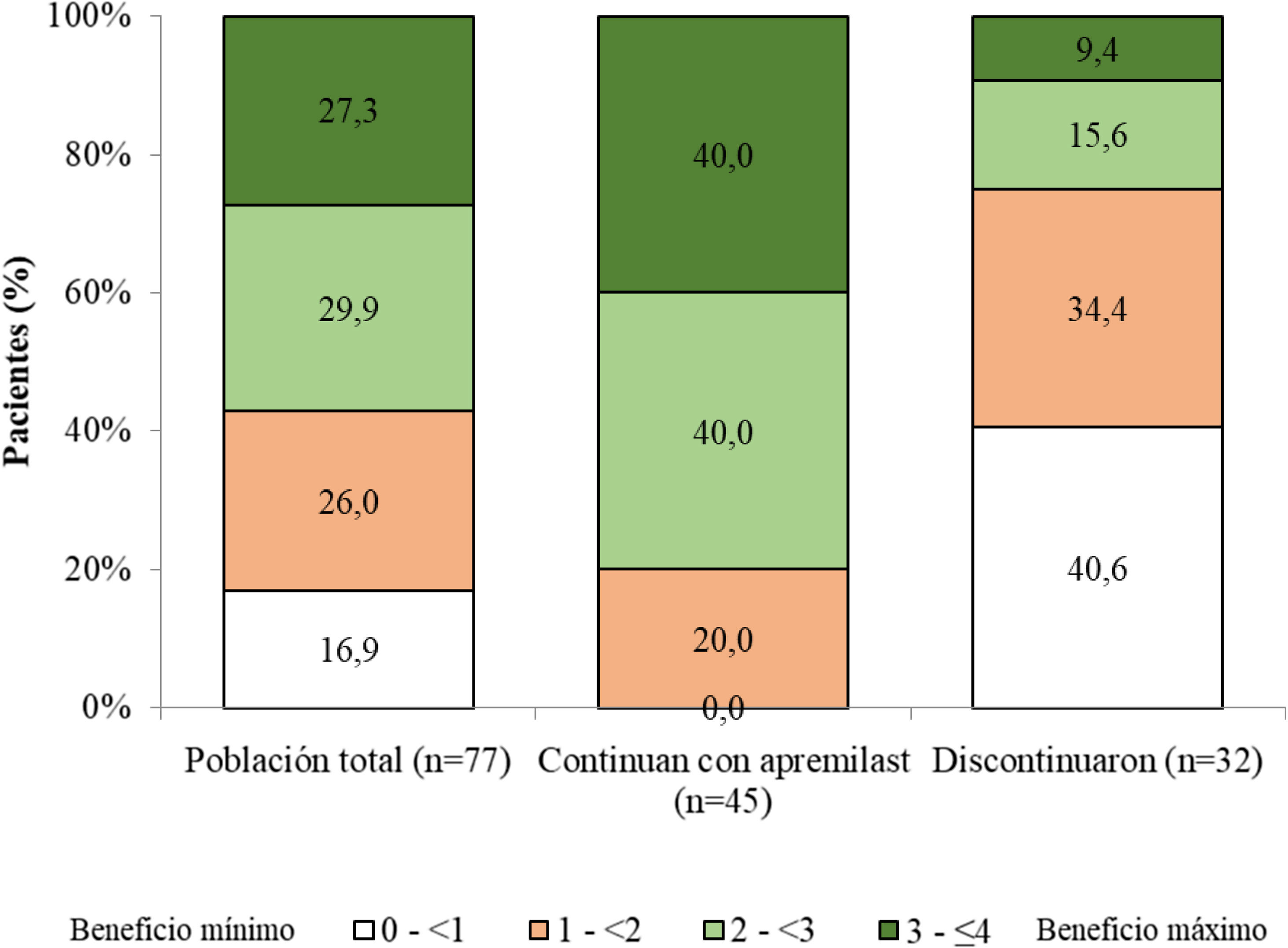
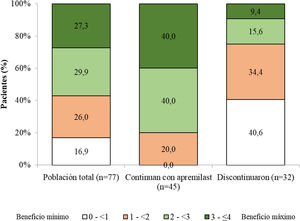
Satisfacción del paciente con apremilastLa puntuación PBI media (DE) para la población total fue 2,2 (1,2) y el 83,2% (n = 64) de los pacientes alcanzó PBI ≥ 1 (beneficio clínicamente significativo) (fig. 3). En los pacientes que se mantenían con apremilast, la media (DE) de la puntuación PBI fue 2,8 (0,8) y el 100,0% (n = 45) alcanzó PBI ≥ 1 (fig. 3).
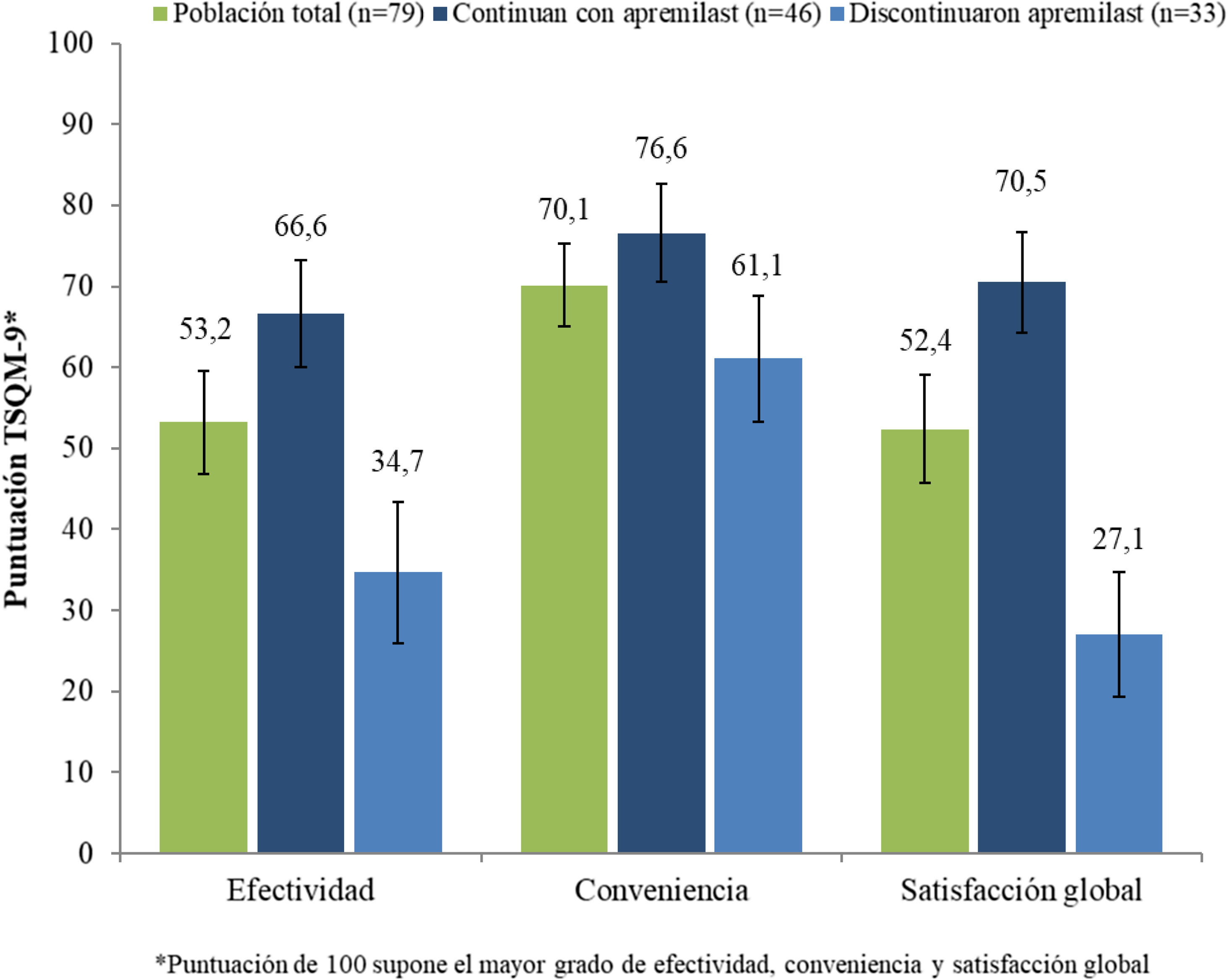
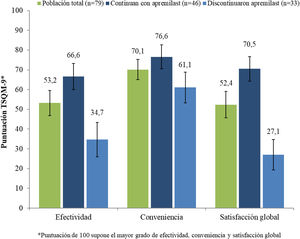
En los pacientes que continuaban con apremilast, la puntuación media global (DE) de satisfacción con el tratamiento (cuestionario TSQM-9) fue 66,6 (22,9), 76,6 (21,0) y 70,5 (21,5) para las subescalas de efectividad, conveniencia y satisfacción global, respectivamente (fig. 4). En este mismo grupo de pacientes, se observó una reducción de los síntomas de psoriasis durante el primer mes de tratamiento en el 48,9% (n = 23), y el 59,6% (n = 28) consideró que apremilast le permitía llevar una vida cotidiana normal.
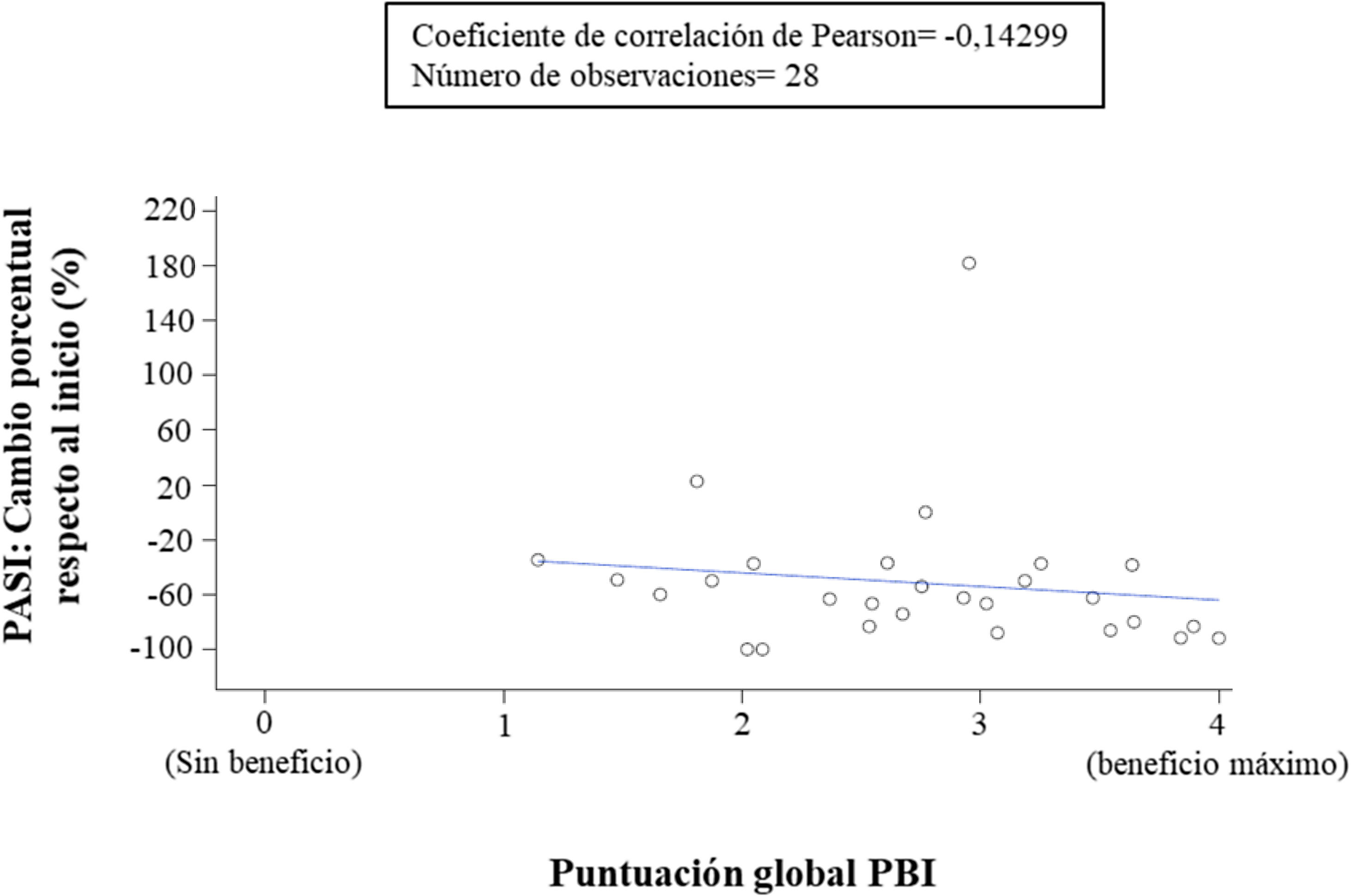
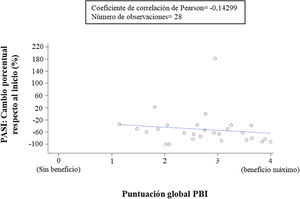
Correlación de las evaluaciones clínicas, expectativas y beneficios reportados por dermatólogos y pacientesLa correlación entre el cambio porcentual respecto al valor basal del PASI y el beneficio del tratamiento (puntuación del PBI global) reportado por los pacientes mostró una correlación negativa muy baja (coeficiente de correlación = -0,14299), lo que significa que no había mucha correlación, es decir, que la respuesta cutánea no fue suficiente para explicar el beneficio del paciente con el tratamiento (fig. 5). Por el contrario, la evaluación de los dermatólogos sobre el éxito general de apremilast y la percepción de los pacientes sobre el beneficio del tratamiento (puntuación del PBI global) mostró una correlación positiva alta (coeficiente de correlación= 0,63629). Los casos en los que los dermatólogos indicaron que sus expectativas se alcanzaron o superaron coincidieron con la percepción de los pacientes de un alto beneficio (PBI ≥ 3), y viceversa.
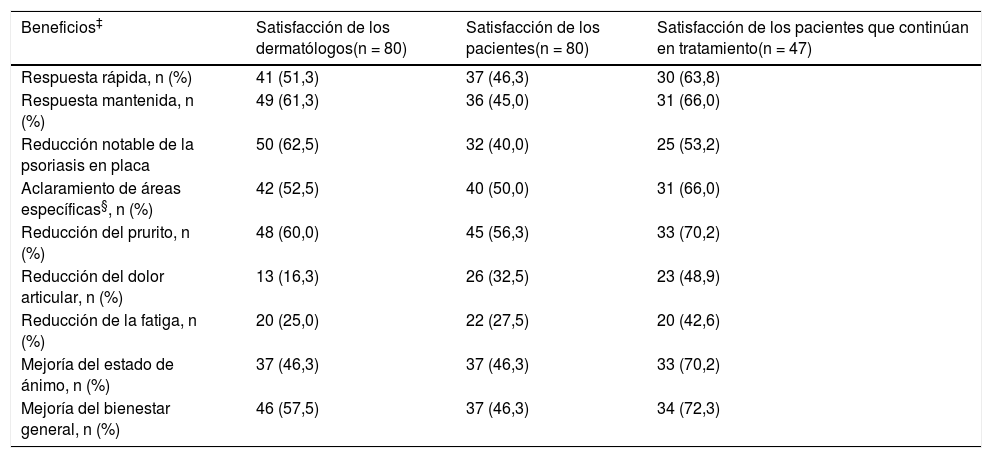
En la tabla 4 se muestran los niveles de satisfacción de dermatólogos y pacientes respecto al efecto del tratamiento con apremilast sobre los síntomas. Concretamente, la satisfacción de los pacientes que continuaban en tratamiento con apremilast fue del 63,8% en la respuesta rápida, 66,0% en la respuesta mantenida, 70,2% en la reducción del prurito, 70,2% en la mejoría del estado de ánimo y 72,3% en la sensación de bienestar general.
Niveles de satisfacción de dermatólogos y pacientes respecto al efecto del tratamiento sobre los síntomas (datos de los cuestionarios específicos)
| Beneficios‡ | Satisfacción de los dermatólogos(n = 80) | Satisfacción de los pacientes(n = 80) | Satisfacción de los pacientes que continúan en tratamiento(n = 47) |
|---|---|---|---|
| Respuesta rápida, n (%) | 41 (51,3) | 37 (46,3) | 30 (63,8) |
| Respuesta mantenida, n (%) | 49 (61,3) | 36 (45,0) | 31 (66,0) |
| Reducción notable de la psoriasis en placa | 50 (62,5) | 32 (40,0) | 25 (53,2) |
| Aclaramiento de áreas específicas§, n (%) | 42 (52,5) | 40 (50,0) | 31 (66,0) |
| Reducción del prurito, n (%) | 48 (60,0) | 45 (56,3) | 33 (70,2) |
| Reducción del dolor articular, n (%) | 13 (16,3) | 26 (32,5) | 23 (48,9) |
| Reducción de la fatiga, n (%) | 20 (25,0) | 22 (27,5) | 20 (42,6) |
| Mejoría del estado de ánimo, n (%) | 37 (46,3) | 37 (46,3) | 33 (70,2) |
| Mejoría del bienestar general, n (%) | 46 (57,5) | 37 (46,3) | 34 (72,3) |
Se muestra recuento y porcentaje para la respuesta «de acuerdo» o «totalmente de acuerdo» a la pregunta para el dermatólogo «¿De qué manera cree que apremilast ha ayudado en el tratamiento de la psoriasis de este paciente?» y a la pregunta para el paciente «¿De qué manera cree que apremilast ha ayudado en el tratamiento de su psoriasis?»
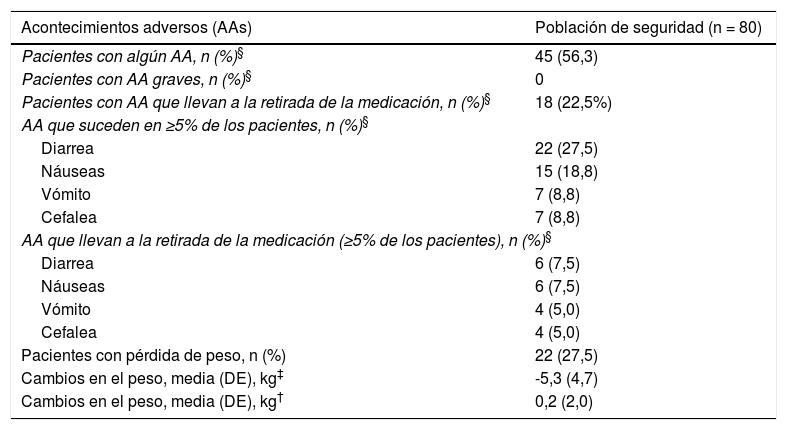
Se registraron un total de 80 AAs en 45 pacientes (56,3%). En la gran mayoría de estos casos (n = 44 [55,0%]), dichos AAs se relacionaron con el tratamiento, y en 18 pacientes (22,5%) condujeron a la retirada de apremilast. Los AAs reportados con mayor frecuencia fueron diarrea (27,5%) y náuseas (18,8%) (tabla 5). Tres pacientes sufrieron insomnio (uno de estos casos, en tratamiento previo por ansiedad). No se registraron AA graves.
Seguridad con apremilast
| Acontecimientos adversos (AAs) | Población de seguridad (n = 80) |
|---|---|
| Pacientes con algún AA, n (%)§ | 45 (56,3) |
| Pacientes con AA graves, n (%)§ | 0 |
| Pacientes con AA que llevan a la retirada de la medicación, n (%)§ | 18 (22,5%) |
| AA que suceden en ≥5% de los pacientes, n (%)§ | |
| Diarrea | 22 (27,5) |
| Náuseas | 15 (18,8) |
| Vómito | 7 (8,8) |
| Cefalea | 7 (8,8) |
| AA que llevan a la retirada de la medicación (≥5% de los pacientes), n (%)§ | |
| Diarrea | 6 (7,5) |
| Náuseas | 6 (7,5) |
| Vómito | 4 (5,0) |
| Cefalea | 4 (5,0) |
| Pacientes con pérdida de peso, n (%) | 22 (27,5) |
| Cambios en el peso, media (DE), kg‡ | -5,3 (4,7) |
| Cambios en el peso, media (DE), kg† | 0,2 (2,0) |
El estudio observacional APPRECIATE demuestra que los pacientes tratados con apremilast en condiciones de práctica habitual en España, presentaban características diferentes a las observadas en los ensayos clínicos2,3,5: afectación cutánea más moderada (puntuación PASI media = 8,3 con puntuaciones < 10 en el 78,6% de los pacientes) junto a impacto sustancial en la CdV (puntuación DLQI media = 8,9). Publicaciones previas (incluida la de la población europea del estudio APPRECIATE) ya habían confirmado esta tendencia a tratar pacientes menos graves, a pesar de que asocian un elevado impacto en la CdV2,3,5,6,11–16. Esta observación sugiere que apremilast puede satisfacer una necesidad de tratamiento en pacientes con una afección cutánea más moderada.
Aunque los índices PASI y DLQI son herramientas usadas comúnmente para evaluar la gravedad de la enfermedad y la eficacia del tratamiento, en el presente estudio su uso sólo pudo ser recogido, al inicio del tratamiento y al seguimiento, en el 37,5 y 15,0% de los pacientes, respectivamente. Estos datos sugieren que estas escalas no se usan de manera consistente en la práctica diaria, por lo que parece necesario mejorar la evaluación de las necesidades de los pacientes y la efectividad del tratamiento más allá de las medidas tradicionales. En este sentido, el presente análisis muestra una baja correlación negativa entre el porcentaje de cambio en PASI a los seis meses de tratamiento y el beneficio global del tratamiento reportado por los pacientes (PBI), lo que sugiere que la mejoría de las lesiones visibles no fue suficiente para explicar el beneficio del paciente. Además, los pacientes también reportaron su satisfacción con la respuesta rápida y mantenida a apremilast, así como con la reducción del prurito, la mejoría del estado de ánimo y la sensación de bienestar general. Dermatólogos y pacientes reportaron una satisfacción similar con apremilast. Además, la evaluación de los dermatólogos sobre el éxito general de apremilast en el logro de las expectativas y la percepción de los pacientes sobre el beneficio obtenido mostraron una correlación positiva alta.
Por otra parte, el grupo de pacientes que mantuvieron tratamiento con apremilast durante seis meses mostraron mejoría en PASI (reducción de 5,5 puntos), BSA (reducción del 10,6% de la superficie corporal), DLQI (reducción de 6,2 puntos), PBI (todos los pacientes alcanzaron PBI ≥ 1, valor considerado como beneficio clínicamente significativo)9 y TSQM-9 (satisfacción global = 70,5 puntos). Los valores alcanzados para PASI (3,4), BSA (2,6) y DLQI (2,2) fueron consistentes con los observados en el estudio del Grupo Español de Psoriasis (GPs) (3,6; 3,1 [semana 12]/2,5 [semana 52]; 5,2 [semana 12]/2,3 [semana 52], respectivamente)16 y en el análisis intermedio del estudio APPROPRIATE (2,6; 3,7 y 53% valores de 0-1, respectivamente)17. En el estudio APPRECIATE multinacional, los valores alcanzados (PASI = 4,6; BSA = 10,9; DLQI = 5,7) fueron ligeramente más elevados, pero se debe considerar que los valores de partida eran también mayores (PASI = 12,5; BSA = 25,4; DLQI = 13,4)6. La persistencia a los seis meses fue del 58,8% en este estudio frente al 72,3% observado en el estudio APPRECIATE multinacional.
El perfil de seguridad de apremilast confirmó el ya observado en los ensayos clínicos2,3,5. Al igual que en otros estudios de práctica clínica, la proporción de AAs fue menor que la de los ensayos (47-59 vs. 67-79%, respectivamente) pero, por el contrario la proporción de pacientes que discontinuaron apremilast debido a AAs fue mayor (16-23 vs. 6,6-7,3%)2,3,5,16,18,19. Pese a que la ficha técnica de apremilast advierte sobre su uso cauteloso en pacientes con depresión1, el 11,3% de los pacientes tratados en este estudio estaban recibiendo tratamiento antidepresivo cuando iniciaron apremilast; ninguno de estos pacientes presentó AA relacionados con trastornos psiquiátricos. Por otra parte, en este estudio no se han reportado infecciones en vías respiratorias superiores, AA reportado con una frecuencia del 8,4% y principalmente de intensidad leve en la ficha técnica1.
En este estudio se incluyeron todos los pacientes consecutivos que pudieron ser contactados seis meses (± 1 mes) después del inicio del tratamiento (pudiendo pacientes haber completado o no los seis meses de tratamiento con apremilast) con la finalidad de minimizar el sesgo en la selección de los pacientes. No obstante, este estudio presenta algunas limitaciones inherentes a su diseño retrospectivo, su corto periodo de seguimiento y las condiciones de práctica clínica, así como la inexistencia de un grupo control o la disponibilidad de datos en algunos pacientes. El hecho que haya un porcentaje bajo de pacientes con valores PASI y DLQI disponibles puede haber influenciado en los análisis realizados. Se reconoce un potencial sesgo positivo de selección porque los pacientes con experiencia positiva con apremilast pudieron ser más propensos a aceptar participar en el estudio. Finalmente, como los cuestionarios fueron rellenados retrospectivamente, no podemos descartar el sesgo de memoria, aunque la duración del estudio (seis meses) fue especialmente escogida para minimizar este riesgo.
ConclusionesEl estudio APPRECIATE muestra que los pacientes que iniciaron apremilast en la práctica clínica en España presentaban una afectación cutánea menor que aquellos reclutados en ensayos clínicos. Aun así, se confirma un impacto inesperadamente elevado en la CdV de estos pacientes. Esto sugiere que, a la hora de evaluar la importancia real de la enfermedad, deben considerarse y medirse otros factores, además del grado de afectación de la piel.
Los resultados del estudio muestran que a los seis meses del inicio de apremilast, se observaron mejorías en las evaluaciones globales de la gravedad de la enfermedad (PASI75 36,7%), en la CdV (DLQI medio se redujo más de 6 puntos) y en la satisfacción de los pacientes que continuaban en tratamiento con apremilast (63,8% en la respuesta rápida, 66,0% en la respuesta mantenida, 70,2% en la reducción del prurito, 70,2% en la mejoría del estado de ánimo y 72,3% en la sensación de bienestar general).
Finalmente, los resultados de este estudio resaltan la necesidad de definir la gravedad de la psoriasis de una manera más completa, incorporando medidas centradas en el paciente a la medición de las escalas tradicionales.
FinanciaciónEste estudio ha sido financiado por Celgene. Amgen adquirió los derechos de Otezla® (apremilast) en todo el mundo el 21 de noviembre de 2019.
Los investigadores cualificados pueden solicitar datos de estudios clínicos de Amgen. Los detalles completos están disponibles en http://www.amgen.com/datasharing
Conflicto de interesesPedro Herranz: investigador/asesor/conferenciante de AbbVie, Almirall, Amgen, Janssen, LEO Pharma, Lilly, Novartis, Pfizer, Sandoz, Sanofi y UCB Pharma.
Lidia Trasobares: investigadora y/o conferenciante de AbbVie, Almirall, Amgen, Celgene, Janssen, LEO Pharma, Meda y Novartis.
Almudena Mateu: no declaran conflictos de interés.
Esperanza Martínez: no declaran conflictos de interés.
Ricardo Ruiz Villaverde conferenciante y/o asesor de AbbVie, Amgen, Celgene, LEO Pharma, Lilly, MSD, Novartis y UCB Pharma.
Ofelia Baniandrés: asesora y/o conferenciante de AbbVie, Celgene, LEO Pharma, Lilly MSD, Novartis, Janssen y Pfizer.
Javier Mataix Díaz: no declara ningún conflicto de intereses.
Natalia Jiménez Gómez: no declaran conflictos de interés.
Marta Serra: conferenciante de AbbVie, Almirall, Celgene, Janssen, LEO Pharma y Lilly.
Diana Patricia Ruiz Genao asesora y/o conferenciante honoraria de AbbVie, Amgen, Janssen, LEO Pharma, Lilly, Novartis y Pfizer.
Noelia Rivera: no declaran conflictos de interés.
Jesús Tercedor Sánchez: no declaran conflictos de interés.
Carmen García: anterior empleada de Amgen.
Myriam Cordey: empleados de Amgen (Europe) GmbH.
Enrique Herrera Acosta: no declaran conflictos de interés.
Los autores quieren agradecer a todos los investigadores, coordinadores y al personal de los centros participantes, así como a los pacientes por su participación en este estudio. El soporte en la redacción médica fue proporcionado por Irene Mansilla, MSc, de TFS S.L.