En los últimos años se están haciendo notables esfuerzos para entender la relación existente entre la psoriasis y la esteatosis hepática metabólica (EHmet). No solo se presenta este trastorno en pacientes psoriásicos con una mayor prevalencia, sino que además se acompaña de una mayor gravedad. Con este precedente, se evidencia la necesidad de establecer un protocolo de abordaje precoz de la enfermedad hepática en los pacientes con psoriasis. Asimismo, es de especial relevancia la evaluación de riesgo y beneficio en referencia al uso de tratamientos con potencial hepatotóxico. En el presente manuscrito se exponen las recomendaciones de un panel de expertos en dermatología y hepatología para el cribado, diagnóstico, monitorización y criterios de derivación en pacientes con psoriasis, en caso de sospecha de esteatosis hepática metabólica.
Recent years have seen concerted efforts to understand the relation between psoriasis and metabolic-associated fatty liver disease (MAFLD). Not only is MALFD diagnosed more often in patients with psoriasis, but its clinical course is also more aggressive. A common approach is therefore needed to enable early detection of liver disease coincident with psoriasis. Especially important is an analysis of risks and benefits of potentially hepatotoxic treatments. This consensus paper presents the recommendations of a group of experts in dermatology and hepatology regarding screening for MALFD as well as criteria for monitoring patients and referring them to hepatologists when liver disease is suspected.
Aproximadamente 125 millones de personas sufren psoriasis a nivel mundial (1-3%), más de un millón en España (2,69%)1,2. Es una enfermedad inflamatoria sistémica, con efectos sinérgicos con otras enfermedades inflamatorias inmunomediadas (IMIDs)2,3. Por este motivo, reconocer el impacto de las comorbilidades asociadas es esencial para un manejo integral2.
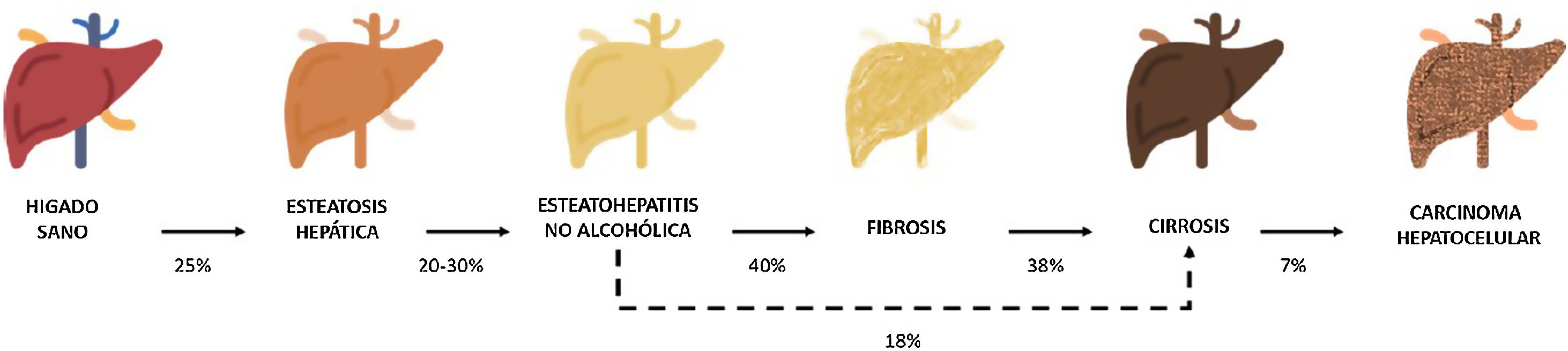
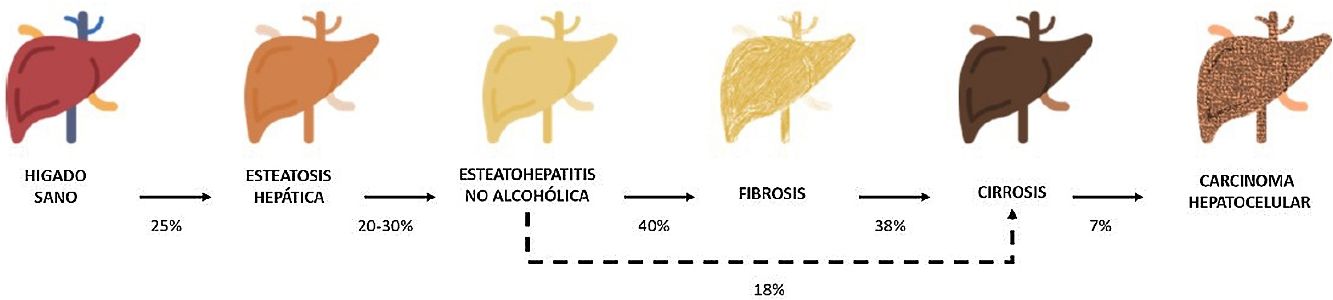
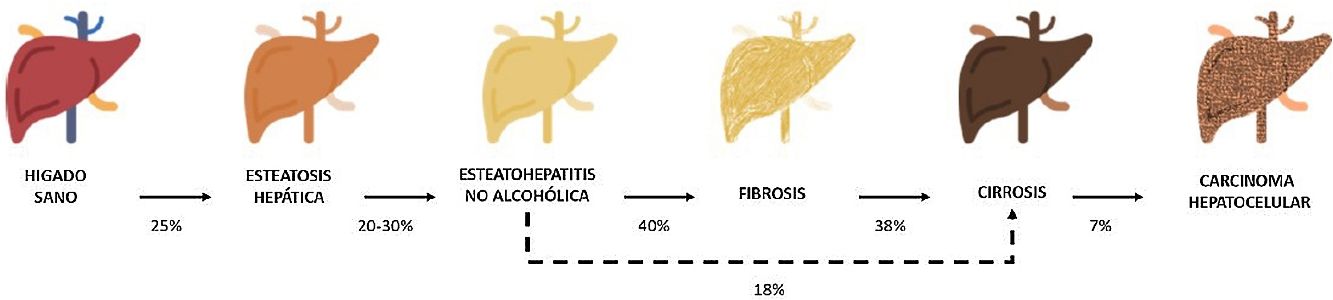
Entre estas comorbilidades se encuentra la hasta ahora denominada enfermedad hepática grasa no alcohólica; que en esta revisión denominaremos esteatosis hepática metabólica (EHmet), siguiendo el consenso promovido por la Asociación Española para el Estudio del Hígado (AEEH)4. La EHmet engloba un espectro de lesiones hepáticas, desde la acumulación de grasa en el hígado considerada un trastorno metabólico con escaso potencial evolutivo, hasta la forma inflamatoria o esteatohepatitis, con riesgo de evolucionar a cirrosis y sus complicaciones. En la mayoría de los casos, es asintomática y se asocia con el síndrome metabólico (SM)5. De hecho, se reconoce como la manifestación hepática del SM y puede aparecer antes que otras manifestaciones6,7. El SM se define como un conjunto de anomalías metabólicas, entre las que las hepáticas se consideran fundamentales6,7. La EHmet presenta un amplio espectro clínico (fig. 1), de naturaleza dinámica, con periodos de progresión, regresión y estabilidad8,9. La genética y los cambios en el estilo de vida explican parcialmente esta variabilidad. Otros factores causantes de variabilidad de la enfermedad y su respuesta al tratamiento son la edad, la raza, el consumo de alcohol, el sexo y la microbiota5.
Progresión de la EHmet. Desde la esteatosis hepática (estable, con escaso riesgo de progresión, caracterizada por la acumulación de grasa intracelular en el hepatocito), pasando por la evolución a esteatohepatitis no alcohólica (EHNA) (cuando la infiltración de grasa va acompañada de cambios inflamatorios y daño celular), y el desarrollo de fibrosis hepática (depósito de colágeno en forma de septos fibrosos que provocan una alteración arquitectural y disfunción progresiva del hepatocito). La fibrosis predispone al desarrollo de cirrosis (septos fibróticos y nódulos de regeneración) y carcinoma hepatocelular (CHC) y/o fallo hepático6,8,10,12–14.
La prevalencia de la EHmet aumenta progresiva y paralelamente a la prevalencia del SM, la obesidad y la diabetes mellitus tipo 2 (DM2)8,10. Se estima que la EHmet afecta a 25% de la población, llegando a 55,5% en pacientes con DM2. Aunque se desconoce el porcentaje de pacientes con EHmet que desarrollan esteatohepatitis no alcohólica (EHNA), se sabe que supera 10%. La EHNA se diagnostica mediante biopsia en 29,9% de los pacientes con EHmet, pero recientemente esta tasa parece haber aumentado hasta 59,1%5.
La EHNA progresa a fibrosis en 40,76% de los pacientes8. En España, se estima que la prevalencia de la EHmet es de 25,8%, y el grado de fibrosis significativa, estimada mediante combinación secuencial de elastometría de transición (ET) y biopsia hepática, es de 2,8%10.
El pronóstico del paciente con EHmet viene condicionado por la evolución hacia EHNA, fibrosis y sus comorbilidades; la morbimortalidad hepática aumenta fundamentalmente a partir del estadio de fibrosis avanzada10,11. Por ello la EHmet es un importante problema de salud y una causa importante de trasplante hepático9,12.
Existen numerosas evidencias de la relación entre psoriasis y EHmet15. En general, la prevalencia de EHmet aumenta en pacientes con psoriasis más grave16,17. Phan et al. demostraron una prevalencia de EHmet duplicada en pacientes con psoriasis, comparados con no psoriásicos, confirmando datos publicados anteriormente15,18. En España, 42,3% de los pacientes con psoriasis presentan EHmet19. Además, la gravedad de la psoriasis se correlaciona directamente con la de la enfermedad hepática20. En concordancia, un estudio transversal ha detectado que la fibrosis avanzada es más prevalente en pacientes con psoriasis que en controles sanos, siendo la psoriasis un predictor significativo de fibrosis hepática avanzada independientemente de otros factores como edad, sexo, índice de masa corporal, hipertensión y diabetes21. De hecho, la psoriasis es un factor de riesgo independiente de EHmet22,23. Asimismo, la hipertensión, la hiperglicemia y la obesidad son los principales factores de riesgo de EHmet en pacientes con psoriasis y la asociación entre psoriasis y EHmet es independiente de factores de confusión, lo que confirma una fisiopatología común que implica vías inflamatorias y predisposición genética15. Ambas tienen como etiología común una inflamación crónica de baja intensidad, que implica adipocinas involucradas en el balance energético y citocinas inflamatorias: interleucina- 17 (IL-17), factor de necrosis tumoral-α (TNF-α) o interleucina-6 (IL-6)3,24,25.
Estos precedentes permiten sugerir un abordaje precoz de los pacientes con psoriasis realizando un cribado de la EHmet26. La AEEH ha publicado recientemente un consenso sobre detección y derivación de enfermedades hepáticas prevalentes ocultas. Dos conclusiones operativas del consenso fueron: 1) Hacer valoración y seguimiento de una posible enfermedad hepática crónica en pacientes con enfermedades dermatológicas inmunomediadas; y 2) la prevalencia de hepatopatía crónica aumenta en estas patologías, tanto por mecanismos inmunológicos como inflamatorios, o por hepatotoxicidad26.
Para incentivar el manejo multidisciplinar, y con el objetivo de actualizar las recomendaciones de cribado, diagnóstico, monitorización y criterios de derivación ante la sospecha de EHmet en pacientes con psoriasis, un panel de expertos ha elaborado este documento, basándose en la evidencia científica disponible y en su experiencia en práctica clínica real.
MetodologíaPara elaborar este documento siete dermatólogos y cinco hepatólogos, especializados en el manejo de la psoriasis y la EHmet, constituyeron un grupo de trabajo. La metodología utilizada se basó en el denominado «método formal»27,28. Se empezó evaluando la evidencia científica disponible y cumplimentando varios cuestionarios diseñados ad hoc para identificar puntos clave sobre identificación, cribado, diagnóstico y manejo de la psoriasis y el riesgo de enfermedad hepática. Posteriormente, se analizaron los aspectos clínicos de definición y manejo del paciente de riesgo en tres reuniones. En la última reunión, se desarrolló un algoritmo de manejo del paciente de riesgo y unas recomendaciones de diagnóstico y monitorización basadas en las principales guías de práctica clínica (GPC) y en la experiencia en práctica clínica real del grupo de expertos.
Identificación de los pacientes con psoriasis y riesgo de enfermedad hepáticaEl panel recomienda cribar los pacientes diagnosticados de psoriasis siguiendo las GPC nacionales29,30, independientemente del tratamiento y el tiempo desde el diagnóstico, siempre que presenten al menos una de las condiciones contempladas como criterios acompañantes del hallazgo de esteatosis en el diagnóstico de la EHmet31, es decir, sobrepeso u obesidad, DM2, y/o evidencias de alteraciones metabólicas, las cuales pueden resumirse así:
- •
Circunferencia de la cintura ≥ 102 cm en hombres y ≥ 88 cm en mujeres.
- •
Presión arterial ≥ 130/85 mmHg o tratamiento farmacológico específico.
- •
Triglicéridos plasmáticos ≥ 150 mg/dL (≥ 1,70 mmol/L) o tratamiento farmacológico específico.
- •
Colesterol de HDL en plasma < 40 mg/dL (< 1,0 mmol/L) para hombres y < 50 mg/dL (< 1,3 mmol/L) para mujeres, o tratamiento farmacológico específico.
- •
Prediabetes (niveles de glucosa en ayunas: 100 a 125 mg/dL [5,6 a 6,9 mmol/L], o dos horas tras sobrecarga oral: 140 a 199 mg/dL [7,8 a 11,0 mmol/L] o HbA1c: 5,7 a 6,4% [39 a 47 mmol/mol]).
- •
HOMA-IR (modelo homeostático para evaluar la resistencia a la insulina) ≥ 2,5.
- •
Nivel de proteína C reactiva de alta sensibilidad en plasma > 2 mg/L.
Ante un paciente con psoriasis y al menos un factor de riesgo de SM, se debe valorar el riesgo o presencia de enfermedad hepática. Al ser una enfermedad silenciosa, las GPC nacionales e internacionales aconsejan la identificación precoz del riesgo de estadios progresivos de EHmet, desde la esteatosis a estadios avanzados como la fibrosis, utilizando métodos no invasivos como el FIB-410,30,31. Se descarta usar valores aislados de transaminasas como método único para el diagnóstico precoz de la EHmet, ya que pueden ser normales incluso con fibrosis avanzada32.
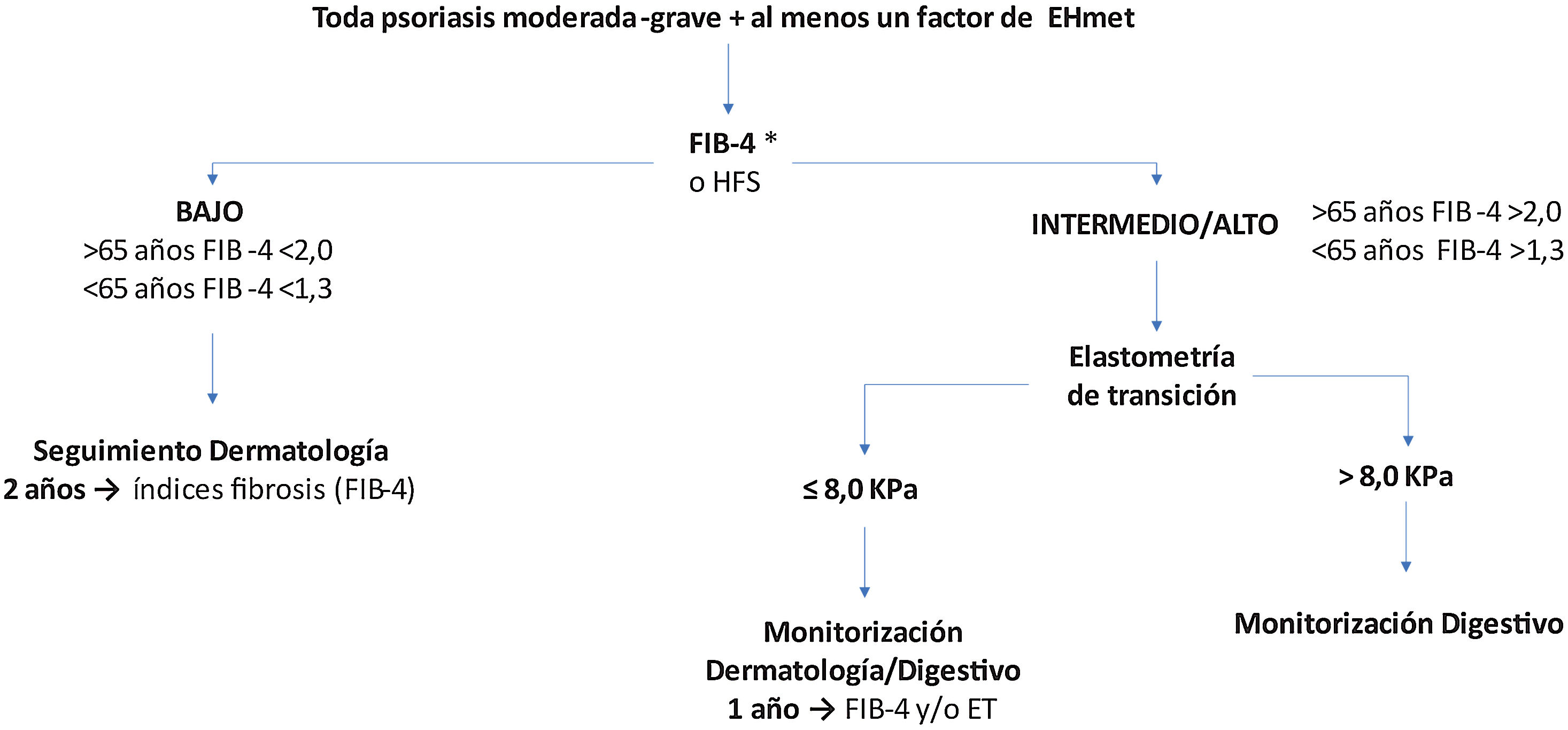
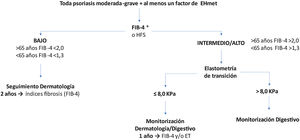
Recomendaciones de cribado de la EHmetTras identificar un paciente de riesgo, se inicia la primera etapa del algoritmo de cribado y seguimiento recomendado (fig. 2).
Algoritmo de cribado del paciente de riesgo de EHmet. Se debe tener en cuenta que en función de la realidad asistencial de cada hospital y la disponibilidad de elastometría de transición (ET), la ET se puede solicitar desde el Servicio de Dermatología o se debe derivar el paciente al Servicio de Aparato Digestivo.
*Se aconseja realizar ET para evaluar el riesgo de fibrosis a pacientes con FIB-4 bajo y con tratamiento hepatotóxico.
No existe un consenso sobre estrategias de diagnóstico y puntos de corte de herramientas no invasivas (tabla 1) empleadas en lugar de la biopsia hepática (prueba de referencia33, pero con complicaciones)10,22,31. Las GPC recomiendan combinar índices serológicos y la ET, que reduce aproximadamente en 50-60% la necesidad de biopsia y ofrece un diagnóstico preciso34, empleando índices serológicos de fibrosis como primera herramienta de cribado y, en caso de riesgo elevado, la ET.
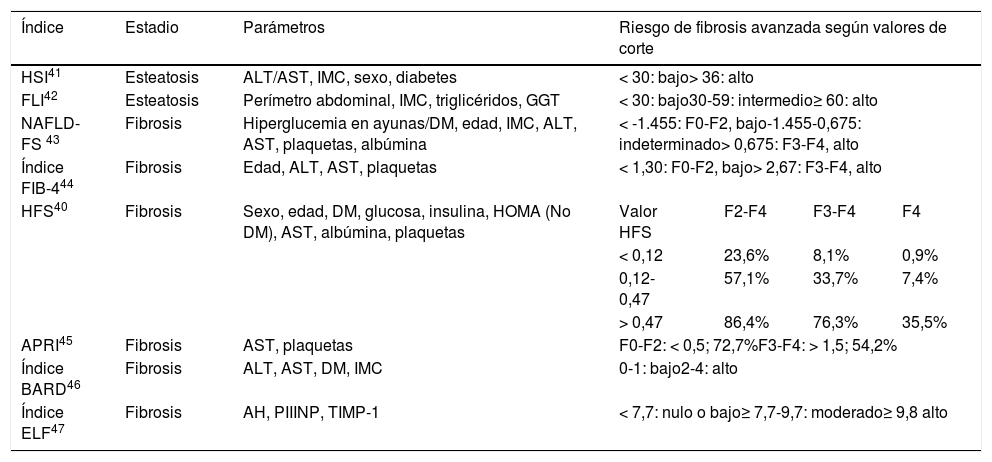
Índices para el diagnóstico no invasivo de la EHmet
| Índice | Estadio | Parámetros | Riesgo de fibrosis avanzada según valores de corte | |||
|---|---|---|---|---|---|---|
| HSI41 | Esteatosis | ALT/AST, IMC, sexo, diabetes | < 30: bajo> 36: alto | |||
| FLI42 | Esteatosis | Perímetro abdominal, IMC, triglicéridos, GGT | < 30: bajo30-59: intermedio≥ 60: alto | |||
| NAFLD-FS 43 | Fibrosis | Hiperglucemia en ayunas/DM, edad, IMC, ALT, AST, plaquetas, albúmina | < -1.455: F0-F2, bajo-1.455-0,675: indeterminado> 0,675: F3-F4, alto | |||
| Índice FIB-444 | Fibrosis | Edad, ALT, AST, plaquetas | < 1,30: F0-F2, bajo> 2,67: F3-F4, alto | |||
| HFS40 | Fibrosis | Sexo, edad, DM, glucosa, insulina, HOMA (No DM), AST, albúmina, plaquetas | Valor HFS | F2-F4 | F3-F4 | F4 |
| < 0,12 | 23,6% | 8,1% | 0,9% | |||
| 0,12-0,47 | 57,1% | 33,7% | 7,4% | |||
| > 0,47 | 86,4% | 76,3% | 35,5% | |||
| APRI45 | Fibrosis | AST, plaquetas | F0-F2: < 0,5; 72,7%F3-F4: > 1,5; 54,2% | |||
| Índice BARD46 | Fibrosis | ALT, AST, DM, IMC | 0-1: bajo2-4: alto | |||
| Índice ELF47 | Fibrosis | AH, PIIINP, TIMP-1 | < 7,7: nulo o bajo≥ 7,7-9,7: moderado≥ 9,8 alto | |||
AH: ácido hialurónico; ALT: alanina aminotransferasa; APRI: AST to platelet ratio index; AST: aspartato aminotransferasa; DM: diabetes mellitus; ELF: enhanced liver fibrosis; FLI: fatty liver index; GGT: gamma-glutamil transferasa; HFS: Hepamet fibrosis score; HSI: hepatic steatosis index; IMC: índice de masa corporal; NAFLD-FS: non-alcoholic fatty liver disease fibrosis score; PIIINP: péptido amino-terminal del procolágeno III; TIMP-1: inhibidor tisular de la metaloproteinasa 1 de la matriz.
La tabla 1 enumera diversas herramientas no invasivas de cribado de la fibrosis hepática. Se consideró que el marcador serológico fibrosis-4 (FIB-4) es la herramienta más adecuada para iniciar el cribado en dermatología, ya que se ha validado externamente para el cribado de fibrosis en hígado graso de pacientes con psoriasis, es de fácil petición y manejo y está recomendado por las GPC10,22,31. El FIB-4 utiliza el recuento plaquetario, la edad y los valores de aspartato aminotransferasa (AST) y alanina aminotransferasa (ALT); ofrece un alto valor predictivo negativo (VPN) para el diagnóstico de fibrosis avanzada (F3-F4), permitiendo evitar la biopsia hepática35,36. Valores del FIB-4 inferiores a 1,30 excluyen la fibrosis avanzada con un VPN de 85%; valores superiores a 2,67 indican fibrosis avanzada con un VPP de 79%37. No obstante, hay que tener en cuenta el riesgo de falso positivo asociado al VPP, la probabilidad relativamente elevada (1/3) de obtener valores intermedios (1,30-2,67) y el efecto de la edad en la exactitud del pronóstico (se propone un valor umbral de FIB-4 = 2 en mayores de 65 años)38.
No debe olvidarse que la precisión del FIB-4 depende de la edad: no es aplicable en menores de 35 años y requiere valores de corte más ajustados para incrementar su especificidad en mayores de 6539. El Hepamet Fibrosis Score (HFS) es un panel serológico más específico (con valores predictivos mayores que el FIB-4) y preciso, con menor incertidumbre diagnóstica y la única limitación de incluir el índice HOMA, que no suele obtenerse de rutina40.
Cuando el índice utilizado sugiera riesgo bajo, se recomienda seguimiento bianual por dermatología con reevaluación del índice de riesgo31. Con riesgo medio/alto, se recomienda la ET31,38,48. Esta técnica ha demostrado ser efectiva para monitorizar periódicamente la gravedad de la enfermedad y diagnostica con elevada precisión los estadios avanzados de fibrosis (F3-F4) en correlación con las características clínicas del paciente49,50 y sin añadir riesgos, al ser una prueba inocua. No obstante, se debe tener en cuenta que, independientemente de la ET, un FIB-4 elevado indica riesgo aumentado; por lo tanto, la decisión dependerá de la accesibilidad y utilidad de la ET (cómo influirá el resultado). Asimismo, se recomienda derivar para ET a pacientes con FIB-4 intermedio, por su elevada incertidumbre.
Wong et al. demostraron que el valor de ET = 7,9 kPa presenta la mayor precisión (sensibilidad 91%, especificidad 75% y VPP 97%) para el diagnóstico de fibrosis avanzada y cirrosis en pacientes con EHmet51. Por ello, el punto de corte recomendado en pacientes de riesgo elevado es 8 kPa. Con FIB-4 elevado y ET ≤ 8 kPa, se reevaluará anualmente el FIB-4 y/o se solicitará una nueva ET según disponibilidad.
Si se confirma una ET >8 kPa, con riesgo de fibrosis avanzada (F3-F4), el paciente se derivará al Servicio de Aparato Digestivo, en donde se considerará el manejo más adecuado (fig. 2). Si la ET no estuviera disponible, los pacientes con FIB-4 elevado deben derivarse a un especialista de digestivo.
Tratamientos actuales para la psoriasis e impacto sobre la EHmetLas recomendaciones del panel de expertos se centran en pautas generales a considerar en supuestos clínicos frecuentes adaptables, según criterio del especialista.
Las recomendaciones de dieta y ejercicio de las GPC son el pilar del tratamiento de la EHmet31. Reducciones de peso ≥ 10% pueden resolver la EHNA y reducir la fibrosis al menos un estadio. Pérdidas de peso menores (5-10%) pueden mejorar algunos componentes de la EHmet. La dieta mediterránea, aun sin pérdida de peso, reduce el contenido graso del hígado52.
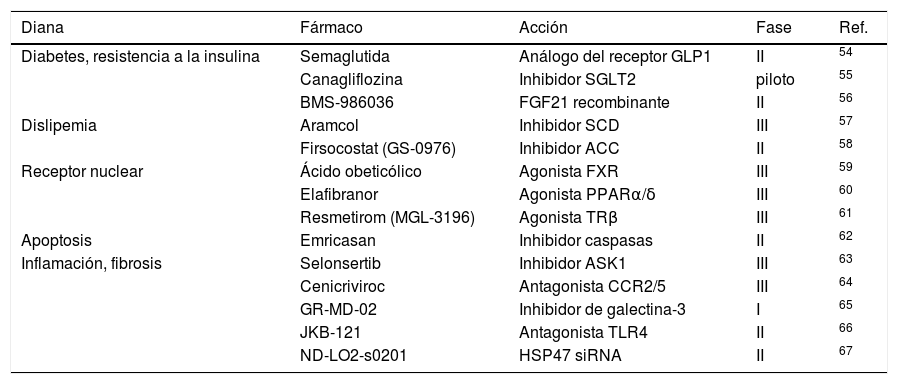
Actualmente se están desarrollando fármacos para el tratamiento de la EHmet. En la tabla 2 se enumeran algunos ensayos clínicos de su eficacia y seguridad.
Ensayos clínicos de tratamientos para la EHmet (adaptado de53)
| Diana | Fármaco | Acción | Fase | Ref. |
|---|---|---|---|---|
| Diabetes, resistencia a la insulina | Semaglutida | Análogo del receptor GLP1 | II | 54 |
| Canagliflozina | Inhibidor SGLT2 | piloto | 55 | |
| BMS-986036 | FGF21 recombinante | II | 56 | |
| Dislipemia | Aramcol | Inhibidor SCD | III | 57 |
| Firsocostat (GS-0976) | Inhibidor ACC | II | 58 | |
| Receptor nuclear | Ácido obeticólico | Agonista FXR | III | 59 |
| Elafibranor | Agonista PPARα/δ | III | 60 | |
| Resmetirom (MGL-3196) | Agonista TRβ | III | 61 | |
| Apoptosis | Emricasan | Inhibidor caspasas | II | 62 |
| Inflamación, fibrosis | Selonsertib | Inhibidor ASK1 | III | 63 |
| Cenicriviroc | Antagonista CCR2/5 | III | 64 | |
| GR-MD-02 | Inhibidor de galectina-3 | I | 65 | |
| JKB-121 | Antagonista TLR4 | II | 66 | |
| ND-LO2-s0201 | HSP47 siRNA | II | 67 |
ACC: acetil-coenzima A carboxilasa; ASK1: cinasa reguladora de la señal de apoptosis 1; CCR2/5: correceptor de quimiocinas 2/5; FGF21: factor de crecimiento de fibroblastos 21; FXR: receptor X farnesoide; GLP1: péptido similar al glucagón 1; HSP47 siRNA: ácido ribonucleico pequeño de interferencia de la proteína de choque térmico 47; PPARα/δ: receptores activados por proliferadores peroxisomales α/δ; SCD: estearoil-coenzima A desaturasa; SGLT2: cotransportador de sodio-glucosa tipo 2; TLR4: receptor tipo toll 4; TRβ: receptor β de hormona tiroidea.
En pacientes con ET 6-8 kPa, independientemente del FIB-4, sin enfermedad hepática grave, se deben valorar los factores de SM, evaluando el grado de enfermedad metabólica para estimar el riesgo de progresión hacia fibrosis avanzada o cirrosis7. Así, se determinará la monitorización y pruebas complementarias a realizar con respecto a las recomendaciones en estos perfiles (seguimiento anual y repetición de FIB-4).
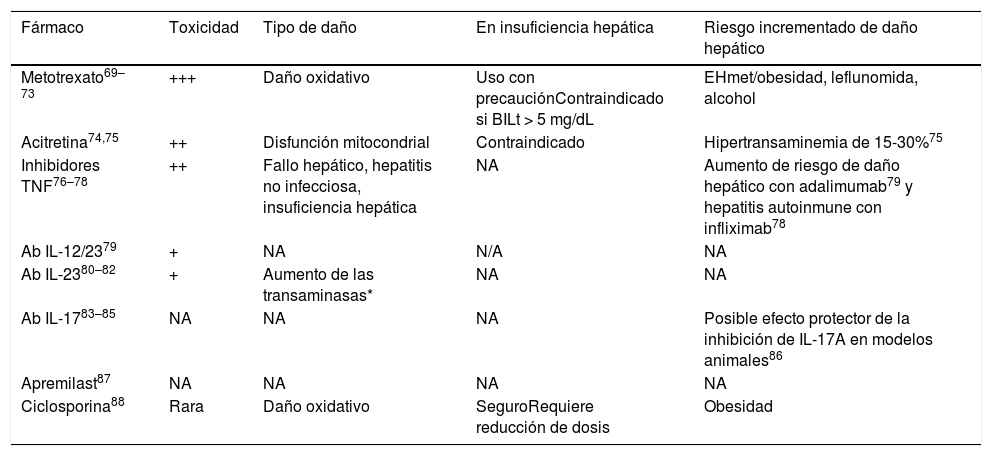
Los pacientes con psoriasis y hepatopatía tienen riesgo aumentado de hepatotoxicidad inducida por fármacos (tabla 3)68. Metotrexato (MTX) es el fármaco sistémico convencional más utilizado en psoriasis moderada-grave debido a su coste-efectividad y larga trayectoria clínica, pero es hepatotóxico y puede favorecer la fibrosis69–71.
Fármacos empleados en el tratamiento de la psoriasis y su impacto hepático (adaptada de25,69–88)
| Fármaco | Toxicidad | Tipo de daño | En insuficiencia hepática | Riesgo incrementado de daño hepático |
|---|---|---|---|---|
| Metotrexato69–73 | +++ | Daño oxidativo | Uso con precauciónContraindicado si BILt > 5 mg/dL | EHmet/obesidad, leflunomida, alcohol |
| Acitretina74,75 | ++ | Disfunción mitocondrial | Contraindicado | Hipertransaminemia de 15-30%75 |
| Inhibidores TNF76–78 | ++ | Fallo hepático, hepatitis no infecciosa, insuficiencia hepática | NA | Aumento de riesgo de daño hepático con adalimumab79 y hepatitis autoinmune con infliximab78 |
| Ab IL-12/2379 | + | NA | N/A | NA |
| Ab IL-2380–82 | + | Aumento de las transaminasas* | NA | NA |
| Ab IL-1783–85 | NA | NA | NA | Posible efecto protector de la inhibición de IL-17A en modelos animales86 |
| Apremilast87 | NA | NA | NA | NA |
| Ciclosporina88 | Rara | Daño oxidativo | SeguroRequiere reducción de dosis | Obesidad |
NA: no aplicable (no existen estudios al respecto); BILt: bilirrubina total.
El grupo de inhibidores de TNF incluye etanercept, adalimumab e infliximab. El grupo de anti-IL17A incluye brodalumab, ixekizumab y secukinumab. El grupo de anti-IL23 incluye tildrakizumab, guselkumab, risankizumab.
Un reciente estudio español en pacientes con psoriasis moderada-grave tratados con MTX demostró correlación entre la duración del tratamiento y el riesgo de fibrosis hepática: la proporción de pacientes con riesgo de fibrosis avanzada (FIB-4 > 1,3) aumentó desde 18,2%, con MTX administrado durante 16-24 semanas, hasta 27,3% y 32,3%, cuando el tratamiento duró 52-104 semanas y > 104 semanas, respectivamente72. Shetty et al. recomiendan adaptar la intensidad y frecuencia de monitorización dependiendo de los factores de riesgo individuales, y enfatizan el mayor riesgo de daño hepático por MTX en pacientes con EHNA o EHNA-fibrosis71.
Se recomienda monitorizar el daño hepático de pacientes con psoriasis tratados con esteatógenos68. Una reciente GPC considera que la amiodarona, el metotrexato, el tamoxifeno y los agentes quimioterapéuticos 5-fluoracilo e irinotecán son factores de riesgo de EHmet y se deben mantener o retirar en función de sus beneficios potenciales frente al riesgo de progresión de la enfermedad hepática (recomendación de grado B basada en la extrapolación de estudios de nivel 1 de evidencia)89.
Se aconseja realizar ET a pacientes con FIB-4 bajo y tratamiento hepatotóxico70,89,90. Ante pacientes con psoriasis moderada-grave, tratamiento hepatotóxico y ET ≤ 8 kPa (procedente del brazo FIB-4 alto o reevaluado con FIB-4 bajo debido al tratamiento), se valorará continuar el tratamiento con fármacos hepatotóxicos según el balance riesgo-beneficio individualizado, teniendo en cuenta las recomendaciones del hepatólogo. Se desaconsejan los fármacos hepatotóxicos en pacientes con FIB-4 alto y/o ET > 8 kPa, debido al riesgo de fibrosis avanzada (F3-F4) (tabla 4).
Definición de la psoriasis «moderada a grave» candidata a terapia sistémica propuesta por el Grupo de Psoriasis (GPS) de la Academia Española de Dermatología y Venereología (AEDV)29
| Escalas de gravedad de la psoriasis | BSA* 10% o PASI** > 10 o DLQI*** > 10 |
| Localización | Áreas expuestas (región facial y dorso de manos), palmas, plantas, genitales, cuero cabelludo, uñas y placas recalcitrantes, con impacto funcional o psicológico para el paciente |
| Fracaso de terapias previas | No controlable con tratamiento tópico o fototerapia |
La determinación de la superficie corporal afectada, body surface area (BSA), es una de las escalas de medida más empleadas en la evaluación de la gravedad de la psoriasis91. El índice BSA se calcula a partir de la media aritmética de la superficie de la piel afectada ponderada según el área total que ocupa cada parte del cuerpo evaluada: la cabeza representa 10%, las extremidades superiores 20%, el tronco 30% y las extremidades inferiores 40% de la superficie corporal total92.
El Psoriasis Area Severity Index (PASI) es la escala de medida más utilizada para la valoración de la gravedad de la psoriasis y la toma de decisión para la indicación de tratamiento. Este índice combina la valoración de cada lesión de psoriasis del 0 al 4 (0 = ninguno, 1 = leve, 2 = moderado, 3 = marcado, 4 = muy marcado) con base en tres parámetros: eritema, infiltración y descamación, en cuatro partes del cuerpo: cabeza, tronco, extremidades superiores y extremidades inferiores92,93.
El Dermatology Life Quality Index (DLQI) se compone de 10 preguntas con cuatro respuestas (0 = nada, 1 = un poco, 2 = mucho, 3 = muchísimo) y se calcula sumando la puntuación de cada pregunta. A mayor puntuación, mayor es el deterioro de la calidad de vida94.
La definición consensuada entre dermatólogos y hepatólogos de criterios sencillos basados en la evidencia para identificar, diagnosticar y monitorizar individuos de riesgo resulta fundamental para el manejo eficiente de la EHmet. Las recomendaciones generales deberán adaptarse a las peculiaridades, necesidades y posibilidades organizativas y asistenciales de los distintos centros y profesionales.
Debe considerarse la interacción entre los tratamientos de la psoriasis y la EHmet, teniendo en cuenta tanto la prevalencia de la patología hepática como el impacto potencial y diverso de los fármacos. Es necesario ponderar el balance entre riesgo y beneficio del uso continuado de tratamientos con potencial hepatotóxico en pacientes con riesgo de fibrosis hepática, realizando una evaluación y seguimiento individualizados.
De todos los tratamientos investigados, el riesgo de desarrollar y/o empeorar la EHmet solo aumenta con el MTX. La fototerapia y algunos tratamientos convencionales de nueva generación no han demostrado hepatotoxicidad en pacientes con esteatosis hepática. Por su parte, aunque la mayoría de las terapias biológicas presenta un balance riesgo-beneficio favorable en pacientes con esteatosis hepática y grados variables de fibrosis, su potencial hepatotóxico es diverso (tabla 3).
ConclusionesAnte la prevalencia de la EHmet en pacientes con psoriasis y la interrelación entre ambas patologías recomendamos el despistaje de enfermedad hepática en pacientes con psoriasis y algún componente de EHmet, independientemente del grado de alteración de la bioquímica hepática. El despistaje será sistemático, como parte del proceso asistencial de la psoriasis en las consultas o unidades asistenciales de dermatología. La estrategia recomendada de mayor valor es la aplicación combinada del índice serológico FIB-4 y la ET y la derivación del paciente a hepatología cuando se detecte riesgo significativo de fibrosis avanzada.
FinanciaciónLas reuniones del panel de expertos fueron financiadas por Novartis Farmacéutica S.A.
Conflictos de interesesNovartis ha facilitado la celebración de las reuniones para los integrantes del grupo, pero ninguno de sus empleados ha participado en el desarrollo y elaboración del material científico, las discusiones o el texto escrito.
Antonio Olveira ha participado como investigador, ponente o consultor en proyectos patrocinados por: Abbvie, Alexion, BMS, Janssen, MSD, Gilead, Novartis.
Isabel Belinchón ha sido consultora y/u oradora y/o participó en ensayos clínicos patrocinados por compañías que fabrican medicamentos utilizados para el tratamiento de la psoriasis, incluyendo Janssen Pharmaceuticals Inc., Almirall SA, Lilly, Abbvie, Novartis, Celgene, Biogen, Amgen, LEO Pharma, Pfizer-Wyeth, MSD y UCB.
Pedro Herranz ha participado como investigador, ponente o consultor en proyectos patrocinados por: Abbvie, Almirall, Amgen, Celgene, LEO Pharma, Lilly, Novartis, Pfizer, Sandoz, Sanofi, UCB.
Javier Crespo ha participado como investigador, ponente o consultor en proyectos patrocinados por: Abbvie, Alexion, BMS, Amgen, Celgene, Gilead, Janssen, MSD.
Eva Vilarrasa ha percibido honorarios de consultoría/orador de y/o participó en ensayos clínicos patrocinados por Abbvie, Almirall, Amgen, Bayer, Boehringer Ingelheim, Celgene, Gebro, Isdin, Janssen, LEO Pharma, Lilly, Merck-Serono, MSD, Novartis, Pfizer, Roche, Sandoz, Sanofi y UCB.
Salvador Benlloch Pérez ha participado como investigador, ponente, o consultor en proyectos y ensayos clínicos patrocinados por Novartis, Novo Nordisk, Gilead.
Jorge Alonso Suárez Pérez ha participado como miembro de «steering committee» y/o invitado como ponente por Novartis, LEO Pharma, Abbvie, Lilly, Janssen, UCB, Amgen y Almirall.
José Manuel Carrascosa ha participado como IP/SI y/o asesor o miembro del comité directivo y/o ponente invitado de Novartis, LEO Pharma, Abbvie, Lilly, Janssen, UCB, Sandoz, Mylan, Amgen, Almirall, Bristol-Myers-Squibb y Boehringer Ingelheim.
Javier Ampuero declara no tener conflictos de interés.
Francisco Guimerá declara no tener conflictos de interés.
El Grupo de Trabajo para el Abordaje Común de la Psoriasis y la EHmet (GACPE) está constituido por siete dermatólogos y cinco hepatólogos, especializados en el manejo de la psoriasis y la EHmet:
Jorge Alonso Suárez-Pérez. Departamento de Dermatología, Hospital Universitario Virgen de la Victoria, Málaga, España.
Susana Armesto Alonso. Departamento de Dermatología, Hospital Universitario Marqués de Valdecilla, Santander, España.
Isabel Belinchón Romero. Departamento de Dermatología, Hospital General Universitario de Alicante, Instituto de Investigación Sanitaria y Biomédica (ISABIAL), Universidad Miguel Hernández de Elche, Alicante, España.
José Manuel Carrascosa Carrillo. Departamento de Dermatología. Hospital Universitario Germans Trias i Pujol. Universitat Autònoma de Barcelona. IGTP Badalona, España.
Francisco Guimerá Martín-Neda. Servicio de Dermatología y Patología, Hospital Universitario de Canarias, La Laguna, España.
Pedro Herranz Pinto. Departamento de Dermatología, Hospital Universitario La Paz, Madrid, España.
Eva Vilarrasa Rull. Departamento de Dermatología, Hospital Santa Creu i Sant Pau, Universitat Autònoma de Barcelona, Barcelona, España.
Javier Ampuero Herrojo. Departamento de Enfermedades Digestivas, Hospital Universitario Virgen del Rocío. Laboratorio 213, Instituto de Biomedicina de Sevilla (IBIS). Departamento de Medicina, Universidad de Sevilla. Centro Biomédico en Red de Enfermedades Hepáticas y Digestivas (CIBERehd). Sevilla, España.
Salvador Benlloch Pérez. Servicio de Enfermedades Digestivas, Hospital Arnau de Vilanova. Valencia. Centro Biomédico en Red de Enfermedades Hepáticas y Digestivas (CIBERehd). Valencia, España.
Javier Crespo García. Servicio de Gastroenterología y Hepatología. Hospital Universitario Marqués de Valdecilla. IDIVAL. Escuela de Medicina. Universidad de Cantabria. Santander, España.
Antonio Olveira Martín. Servicio de Aparato Digestivo, Hospital Universitario La Paz, Madrid, España.