El xantogranuloma necrobiótico (Xn) con paraproteinemia es una histiocitosis no-X poco frecuente, descrita por primera vez por Kossard y Winkelmann en 1980, aunque previamente había recibido otros nombres, como reticulohistiocitosis multicéntrica atípica con paraproteinemia, xantoma diseminado atípico o necrobiosis lipoídica diabeticorum atípica 1. No tiene predilección por sexos y la edad media de comienzo son los 53 años. Clínicamente se caracteriza por la presencia de múltiples placas o nódulos indurados, de color amarillento-anaranjado, bien delimitados, de superficie atrófica y con telangiectasias, que tienden a la ulceración. La localización más frecuente es la periorbitaria (85 % de los casos) 2 y con menor frecuencia las lesiones asientan en tronco y extremidades. Uno de los hechos más característicos de este proceso es su asociación a múltiples alteraciones de laboratorio y enfermedades hematológicas. El 80 % de los pacientes con Xn presentan una gammapatía monoclonal IgG, siendo más frecuente el tipo kappa que el lambda 3, y aproximadamente un 10 % de los enfermos con Xn y paraproteinemia pueden desarrollar a lo largo de los años mieloma, amiloidosis y macroglobulinemia 1,4. El Xn se asocia con frecuencia a alteraciones de laboratorio, entre las que destacan aumento de velocidad de sedimentación globular (VSG), leucopenia, neutropenia, disminución de CH50, C4, y C1-esterasa inhibidor, anemia con frecuencia normocrómica-normocítica, trombocitopenia, hipergammaglobulinemia, crioglobulinemia, anticuerpos antinucleares (ANA) positivos y factor reumatoide positivo. Habitualmente los niveles de glucosa son normales y los lípidos sanguíneos pueden estar normales, elevados o disminuidos 3,5. La enfermedad habitualmente sigue un curso crónico y progresivo. Existen múltiples regímenes de tratamiento, pero ninguno es curativo. Debemos considerar este proceso como una enfermedad sistémica y realizar el seguimiento de los pacientes a largo plazo para detectar el desarrollo de malignidad asociada.
CASO CLINICO
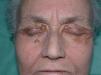
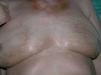
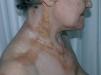
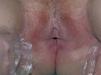
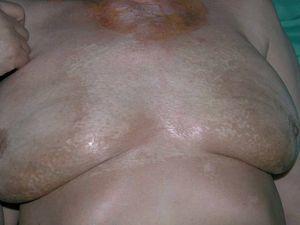
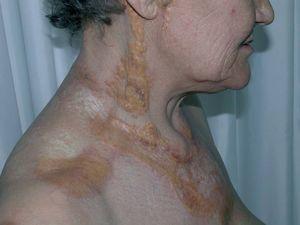
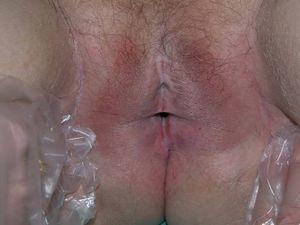
Mujer de 58 años seguida en nuestra consulta por lesiones de liquen escleroatrófico en piel y genitales de larga evolución. Recibió para esta patología tratamiento con clovetasol y tacrólimus tópico, con moderada respuesta. Entre los antecedentes personales destacan: gammapatía monoclonal de significado incierto IgG lambda, diagnosticada hace 8 años y estable, cirrosis biliar primaria, enfermedad tiroidea autoinmune eutiroidea, hiperlipoproteinemia tipo II-A, gastritis crónica autoinmune con anemia perniciosa secundaria, pancitopenia periférica crónica moderada, osteoartrosis, colelitiasis y patología pulmonar intersticial difusa bilateral con hipertensión arterial pulmonar. Recibía tratamiento con prednisona 15 mg al día, ácido fólico, hierro, losartán, hidroclorotiazida, simvastatina y aclofenaco. En los 6 últimos años aparecieron progresivamente grandes placas de aspecto xantomatoso, amarillento-anaranjadas, bien delimitadas, infiltradas, de superficie atrófica con telangiectasias, localizadas en regiones periorbitarias (fig. 1), laterales de cuello, escote, áreas supraclaviculares (fig. 2), cara posterior de cuello y antebrazos. Las lesiones progresivamente aumentaron en extensión, con induración y ulceración de las mismas. La paciente refería prurito, quemazón y dolor en las lesiones periorbitarias. Así mismo, en la exploración observamos, salpicando tronco y nalgas, numerosas lesiones lenticulares, blanco-nacaradas, atróficas y brillantes, que correspondían a lesiones de liquen escleroatrófico (LEA) (fig. 3). Los genitales externos presentaban eritema, atrofia y esclerosis con formación de sinequias (fig. 4). En las pruebas complementarias destacaba: hemoglobina 10,6 g/dl; hematocrito 33 %; leucocitos 1.500/ul; neutrófilos 13 %; plaquetas 87 mil/mc; fibrinógeno 533; VSG 133 mm; crioglogulinas negativas; lípidos séricos, glucosa y niveles de complemento normales; en el proteinograma se observó una banda monoclonal IgG lambda; IgG: 1930 mg/dl; Ig M 325 mg/dl; IgE total 32 UK/l; Ac-antimicrosomales + 1/1600; Ac-antitiroglobulina + 1/2560; Ac-anti células parietales gástricas + 1/160; Ac-anti factor intrínseco en suero + 1,62; ANA positivos 1/160; antígenos nucleares extraíbles (ENA) negativos; ac-anti scl-70 negativo; serología de Borrelia negativa; proteína de Bence Jones en orina negativa. Se realizó biopsia de médula ósea que demostró discrasia plasmocelular. La exploración oftalmológica reveló un síndrome seco, sin otras enfermedades inflamatorias oculares asociadas. La resonancia magnética nuclear (RMN) de órbitas descartó patología infraorbitaria. La serie ósea fue normal. La radiografía de tórax, electrocardiograma y ecocardiograma fueron normales. Se realizaron tres biopsias de las placas xantomatosas de cuello y escote, y el estudio histológico mostró una epidermis normal y en dermis e hipodermis extensas áreas de necrosis y un denso infiltrado inflamatorio compuesto por linfocitos, histiocitos, células gigantes multinucleadas tipo Touton, así como histiocitos xantomizados y cristales de colesterol (figs. 5A, 5B, 5C y 5D). El examen inmunohistoquímico indicó que las células que componían el infiltrado eran CD15 y CD4 positivas y CD1a y S-100 negativas. La biopsia de las lesiones liquenoides de tórax y genitales mostró una epidermis atrófica con desestructuración de la unión dermo-epidérmica y vacuolización de los queratinocitos basales, edema y esclerosis en dermis, así como infiltrado linfocitario en banda con predominio del fenotipo T. Se instauró tratamiento con prednisona oral 30 mg al día y corticoides tópicos de moderada y alta potencia durante varias semanas, obteniendo nula respuesta en las lesiones xantomatosas. Los tratamientos sistémicos con agentes alquilantes fueron desaconsejados por los hematólogos, debido a la neutropenia que presentaba la paciente. La evolución de las lesiones xantomatosas ha seguido un curso progresivo, con aparición de nuevas placas y ulceración de las ya existentes, permaneciendo la paraproteinemia estable y sin tratamiento desde su diagnóstico.
Fig. 1.--Placas xantomatosas periorbitarias.
Fig. 2.--Grandes placas xantomatosas en cuello, escote y zonas
Fig. 3.--Lesiones de liquen escleroatrófico en tórax.
Fig. 4.--Lesiones de liquen escleroatrófico en genitales.
Fig. 5.--Histología de lesiones xantomatosas en cuello. (A) Epidermis normal. En dermis e hipodermis denso infiltrado inflamatorio con áreas de necrosis. (B) Áreas de necrosis e infiltrado inflamatorio compuesto por linfocitos, histiocitos y células gigantes de tipo Touton.
DISCUSION
Las series más largas de la literatura del Xn corresponden a Mehregan y Winkelmann, con 32 casos 3, y previamente a Finan y Winkelmann con 22 5. Nuestra paciente presenta lesiones cutáneas clínica e histológicamente típicas de Xn y asocia una paraproteinemia IgG lambda y múltiples alteraciones de laboratorio típicas de la enfermedad, como anemia, leucopenia, neutropenia, trombocitopenia, aumento de VSG y ANA positivos. El Xn se ha asociado con diversas patologías, algunas de las cuales aparecen en nuestra paciente, como enfermedad pulmonar intersticial, enfermedad tiroidea autoinmune o cirrosis biliar primaria. También se ha asociado con hepatomegalia, esplenomegalia, artritis o artralgias, neuropatía, hipertensión arterial, enfermedad pulmonar obstructiva crónica (EPOC), síndrome neoplásico, linfomas, esclerodermia sistémica, asma, edema de Quincke y morfea 5-9. Las lesiones óseas y la proteinuria de Bence-Jones son raras, y el mieloma múltiple, cuando ocurre, es poco agresivo 3,7. El examen de la médula ósea muestra con frecuencia una proliferación de células plasmáticas y raramente un verdadero mieloma 3,5. Aunque los síntomas sistémicos no son frecuentes, el Xn puede afectar órganos internos, entre los que se encuentran el pulmón, miocardio, faringe, músculo esquelético, riñones, ovarios e intestino, entre otros. Muchos de estos hallazgos se han encontrado en estudios post mortem 3. Esta afectación hace que algunos autores recomienden la evaluación cardiológica y pulmonar de los enfermos con la realización de electrocardiograma y ecocardiograma rutinario 2,3,10. En nuestra enferma no hemos encontrado evidencia de enfermedad extracutánea. Para el diagnóstico de Xn se recomienda realizar hasta tres biopsias en diferentes localizaciones 3. Nuestro caso presenta los hallazgos histopatológicos típicos, que se caracterizan por un infiltrado granulomatoso que afecta a la totalidad de la dermis y tejido subcutáneo, donde se observan linfocitos, focos de células plasmáticas, células espumosas y células gigantes de Touton 5,11,12. Las áreas de necrobiosis están separadas netamente del granuloma circundante, y en ellas podemos observar cristales de colesterol (aproximadamente en un tercio de las biopsias) y cerca de éstos células gigantes multinucleadas atípicas, voluminosas y con angulaciones no habituales. Pueden observarse nódulos linfoides (en más de la mitad de las biopsias) 5 en la dermis o tejido adiposo subcutáneo, y en este último una paniculitis de células de Touton (única en esta entidad) 11. No existen datos de vasculitis 3,5,11. El examen inmunohistoquímico indica que las células que componen el infiltrado son CD15 y CD4 positivas y CD1a y S-100 negativas 3,11,12. Se ha descrito una variante histológica con escasa cantidad de lípidos y células gigantes, pudiendo contribuir a una demora en el diagnóstico. También se ha descrito la elimininación de cristales de colesterol transepitelial, observada en la necrobiosis lipoídica, demostrando la superposición histológica entre ambos procesos 13.
Parece claro que en la etiología y patogenia del Xn y LEA deben de estar implicadas alteraciones a nivel del sistema inmunológico, sin embargo la causa última que los produce permanece desconocida. En el Xn el depósito en la piel de complejos formados por inmunoglobulinas y lípidos, con la posterior reacción de células gigantes a cuerpo extraño, se ha sugerido como un probable mecanismo causante de la enfermedad 14. La isquemia y el daño vascular podrían contribuir a la necrobiosis 15. Se ha sugerido también como causa del Xn la activación de los monocitos y posterior acumulación intracelular de lípidos 16. Según otros autores, la paraproteinemia sería el fenómeno primario y secundariamente se produciría una proliferación de macrófagos con receptores para la porción Fc de la IgG 2. El trauma puede desempeñar un papel en la patogenia, pues se ha descrito la aparición de lesiones en zonas de cicatrices antiguas o en zonas adyacentes a los pinchazos de corticoides para el tratamiento de la enfermedad 9. Anecdóticamente se ha descrito en un paciente mejoría de las lesiones cutáneas tras el tratamiento con antibióticos sistémicos, lo que puede implicar la participación de un agente infeccioso en la patogenia o ser sólo un hallazgo coincidente con la posible resolución espontánea de la enfermedad, por lo que se precisan más estudios para valorar esta respuesta 2. El LEA es una enfermedad inflamatoria crónica de etiología desconocida, que también se ha asociado con malignidad. Estudios recientes han identificado el LEA como una dermatosis crónica inflamatoria mediada por autoanticuerpos contra la proteína-1 de la matriz extracelular (ECM1), que están presentes en más del 80 % de los pacientes afectados 17. El estrés oxidativo también se ha implicado en la patogénesis del LEA, contribuyendo a la esclerosis, autoinmunidad y carcinogénesis 18. Otro estudio sugiere que esta enfermedad podría resultar de un daño epidérmico de origen desconocido, responsable de una progresiva disminución de la glucoproteína transmembrana CD44 de los queratinocitos, lo que conllevaría cambios dérmicos con acumulación de hialuronato, y se observó que los retinoides tópicos incrementaban esta expresión, por tanto la monoterapia con estos fármacos podría ser una opción terapéutica 19.
El diagnóstico diferencial del Xn puede ser difícil, particularmente en lesiones precoces, e incluye procesos necrobióticos y fundamentalmente la necrobiosis lipoídica 3,6,11,12. En la necrobiosis lipoídica diabeticorum los nódulos linfoides no están descritos, los cristales de colesterol son raros y hay amplias zonas de depósitos de lípidos (focales o ausentes en el Xn). El infiltrado granulomatoso en el Xn es más celular, con más células gigantes atípicas y prominentes. Gibson y Reizner revisaron 331 casos de necrobiosis lipoídica y encontraron que los tres casos que mostraban en la histología cristales de colesterol se asociaron con una diabetes mellitus más severa 20. Otros diagnósticos diferenciales incluyen el granuloma anular subcutáneo, xantoma diseminado, xantelasmas, xantogranulomatosis orbitaria o enfermedad de Erdheim-Chester, xantoma plano normolipémico, reticulohistiocitosis multicéntrica y granulomas por cuerpo extraño. Cuando los nódulos linfoides son prominentes y se asocian a paniculitis, debemos diferenciarlos de la paniculitis lúpica. Con menos frecuencia se puede confundir con otros procesos granulomatosos, como sarcoidosis, granulomas de origen infeccioso o la granulomatosis linfomatoide. El sarcoma epitelioide, que se manifiesta como un proceso granulomatoso con necrosis en el cual puede ser difícil de diferenciar una población tumoral maligna, puede llevarnos a la confusión, sobre todo en los casos descritos de Xn solitario 21.
Existen múltiples regímenes de tratamiento, pero ninguno es curativo, y en ocasiones no consiguen respuestas o éstas son parciales 3,5. El tratamieto sistémico, en particular con quimioterapia a bajas dosis, fue beneficioso en muchos casos de enfermedad cutánea y hematológica. Clorambucil a bajas dosis (2-4 mg/día), asociado o no a esteroides, consigue buena respuesta en algunos pacientes 2,3. Se han utilizado otros agentes alquilantes, generalmente a bajas dosis, porque muchos pacientes asocian leucopenia, como el melfalán, metotrexate, hidroxicloroquina, azatioprina, ciclofosfamida o mostaza nitrogenada. La administración de glucocorticoides a altas dosis, corticoides intralesionales y corticoides tópicos ha producido respuestas variables 22. El interferón alfa-2a subcutáneo se ha demostrado efectivo en el tratamiento de la paraproteinemia y de las lesiones cutáneas. Permite disminuir la dosis de esteroides y puede emplearse en pacientes resistentes o con efectos secundarios severos a otros tratamientos 23,24. La extirpación quirúrgica de las lesiones se ha asociado con recurrencias (42 %) y aumento de actividad de la enfermedad, por lo que debe evitarse 2,5. En casos seleccionados de afectación cutánea localizada el tratamiento paliativo con láser de C02 25 puede ser beneficioso. Los pacientes con afectación ocular localizada pueden beneficiarse de la radioterapia a bajas dosis 26.
El Xn con paraproteinemia sigue una evolución crónica y progresiva, con la aparición de nuevas lesiones y ulceración de las ya existentes. Su pronóstico depende fundamentalmente de la patología asociada. Más de la mitad de los pacientes de la serie de Mehregan y Winkelmann murieron de procesos malignos asociados, y el administrar o no tratamiento generalmente no produce variaciones en los parámetros de laboratorio 3. La paraproteinemia tiende a permanecer estable y paralela a la actividad de la enfermedad cutánea, sin embargo esto no siempre ocurre 27. Se han descrito casos de resolución espontánea, como vemos en otras histiocitosis no X 5.
El Xn con paraproteinemia es una entidad que tiene que ser reconocida clínica e histológicamente, y debe ser separada de otros síndromes de xantomas planos generalizados y granulomas necrobióticos. El reconocimiento de este cuadro es importante, ya que las patologías asociadas requieren un seguimiento estrecho de los pacientes, aunque se han descrito xantogranulomas necrobióticos solitarios sin asociación con malignidad ni paraproteinemia 21. Consideramos el Xn como un marcador de enfermedad sistémica, en el cual encontramos anormalidades en las proteínas séricas en la mayoría de los casos, y donde el período de tiempo entre la aparición de las lesiones cutáneas y el desarrollo de enfermedad hematológica puede ser muy variable, por lo que los pacientes necesitan un seguimiento de por vida. No hemos encontrado descrita en la literatura la asociación entre Xn con paraproteinemia y liquen escleroatrófico, por lo que se necesitan más conocimientos sobre la patogenia de estas dos enfermedades que nos puedan indicar si esta asociación es o no fortuita.
Correspondencia:
Yolanda Juárez Casado.
Complejo Hospitalario Xeral-Calde de Lugo.
San Roque, 25, 3.º D. 27002 Lugo. España.
yojuarezca@yahoo.es
Recibido el 28 de febrero de 2006.
Aceptado el 28 de junio de 2006.