La absorción de productos tópicos a través de la epidermis está limitada por la función de barrera cutánea. Existen distintas técnicas, tales como el microneedling, la dermoabrasión, la radiofrecuencia o los láseres, que se han empleado para aumentar la absorción de estas sustancias en una estrategia conocida como vehiculización transdérmica de fármacos. Entre estas técnicas destaca la vehiculización de fármacos asistida por láseres (VFAL), especialmente láseres fraccionales ablativos (CO2/Er:YAG), por su capacidad de generar canales de microablación. En la VFAL se deben ajustar los parámetros en función del tipo de paciente, la dermatosis, la localización y el fármaco empleado. Se ha estudiado la VFAL en el uso de corticoides, fotosensibilizantes o inmunoterapia tópica (imiquimod o 5-fluorouracilo), entre otros, y en múltiples indicaciones: cicatrices, cáncer cutáneo no melanoma, fotodaño, etc. La VFAL es una técnica prometedora que permite aumentar la absorción de moléculas tópicas consiguiendo, además, el efecto sinérgico del láser.
Absorption of topical products through the epidermis is limited by the skin's barrier function. Numerous techniques and agents such as microneedling, dermabrasion, radiofrequency, and lasers have been used to increase penetration within an approach known as transdermal drug delivery. One of these techniques is laser-assisted drug delivery (LADD), which often uses ablative fractional lasers (CO2 or erbium:YAG lasers) because of their capacity to produce microscopic ablated channels. The parameters in LADD need to be adjusted to the patient, the skin condition and its location, and the drug. LADD has been used with various topical products, such as corticosteroids, photosensitizers, and immunotherapy agents (imiquimod or 5-fluorouracil) to treat numerous conditions, including scars, nonmelanoma skin cancer, and photodamage. LADD is a promising technique that enhances the absorption of topical molecules while adding the synergic effect of the laser.
Como dermatólogos, una de nuestras prácticas más habituales es la de prescribir tratamientos tópicos para inducir un efecto local sobre las dermatosis. Sin embargo, la permeabilidad cutánea de estos tratamientos contrasta con la función principal de la piel como barrera frente al medio externo. El estrato córneo, por su composición y localización como capa más externa, es el principal protagonista en esta función de defensa1.
La tasa de permeabilidad de moléculas tópicas a través de la epidermis intacta se ha calculado en torno al 1-5%2. Existen hasta 3 vías de permeabilidad a través de la epidermis: 1) intercelular, mediante la cual se absorben las sustancias más lipofílicas, a través de los desmosomas de los espacios intercelulares; 2) transcelular, a través de los poros acuosos de los queratinocitos y 3) transanexial, que tiene lugar a través de los espacios de los folículos pilosos principalmente y, en menor medida, de los acrosiringios3.
Además, debemos tener en cuenta las propiedades intrínsecas de cada molécula que influyen directamente en su absorción. Según la ley de Fick de la difusión, el flujo de absorción vendrá determinado por las diferencias en la concentración de la molécula entre el exterior y la dermis, pero también por la solubilidad y el coeficiente de difusión de estas. Las moléculas más cargadas o de mayor peso molecular difundirán de forma más lenta que las de menor tamaño y neutras. Las moléculas lipofílicas o hidrofóbicas encuentran su camino a través de la epidermis de forma más rápida4.
Para facilitar la absorción de fármacos tópicos se han empleado diversos métodos físicos en lo que se conoce como la vehiculización transdérmica de fármacos. Entre estos métodos destacan los láseres, cuyo uso ha dado lugar al desarrollo exponencial de la técnica conocida como vehiculización de fármacos asistida por láser (VFAL) o laser-assisted drug delivery en inglés1.
Vehiculización transdérmica de fármacosEl concepto de vehiculización transdérmica de fármacos implica el transporte asistido de moléculas a través de la epidermis utilizando diversos métodos físicos. Se trata de una vía prometedora para la introducción de fármacos en el organismo, ya que permite aumentar la absorción conseguida respecto a la vía tópica. Además, la administración oral de fármacos muchas veces conlleva problemas de biodisponibilidad real debido al efecto del primer paso y puede estar limitada por el mayor riesgo de efectos secundarios. Existen estudios de vehiculización transdérmica de fármacos con raspado, dermoabrasión, microneedling, ondas de presión, efecto vacío, radiofrecuencia o láseres. Con estas modalidades se ha intentado vehiculizar un gran número de fármacos y moléculas, tales como la triamcinolona, el ácido metil-aminolevulinato (MAL), el 5-fluorouracilo o el metotrexato5–11.
Existen pocos estudios que comparen la eficacia de las distintas técnicas disponibles. En un estudio bien diseñado se comparó la eficacia de la terapia fotodinámica (TFD) tras la aplicación de MAL asistida por distintos métodos físicos, tales como el láser fraccional ablativo (LFA), el láser fraccional no ablativo (LFNA), el curetaje, la dermoabrasión y el microneedling, frente a la aplicación de MAL tópico12. Los hallazgos de este estudio concluyeron que no existían diferencias en la formación de protoporfirina ix tras la aplicación de MAL aislado o conjuntamente con LFNA. Sin embargo, el resto de las técnicas sí demostraron superioridad respecto a la formación de protoporfirina ix, siendo la más eficaz de todas el LFA. Estos resultados han sido corroborados al menos parcialmente por estudios posteriores, por lo que hasta la fecha se considera el LFA como la técnica más eficaz para la vehiculización de fármacos13,14.
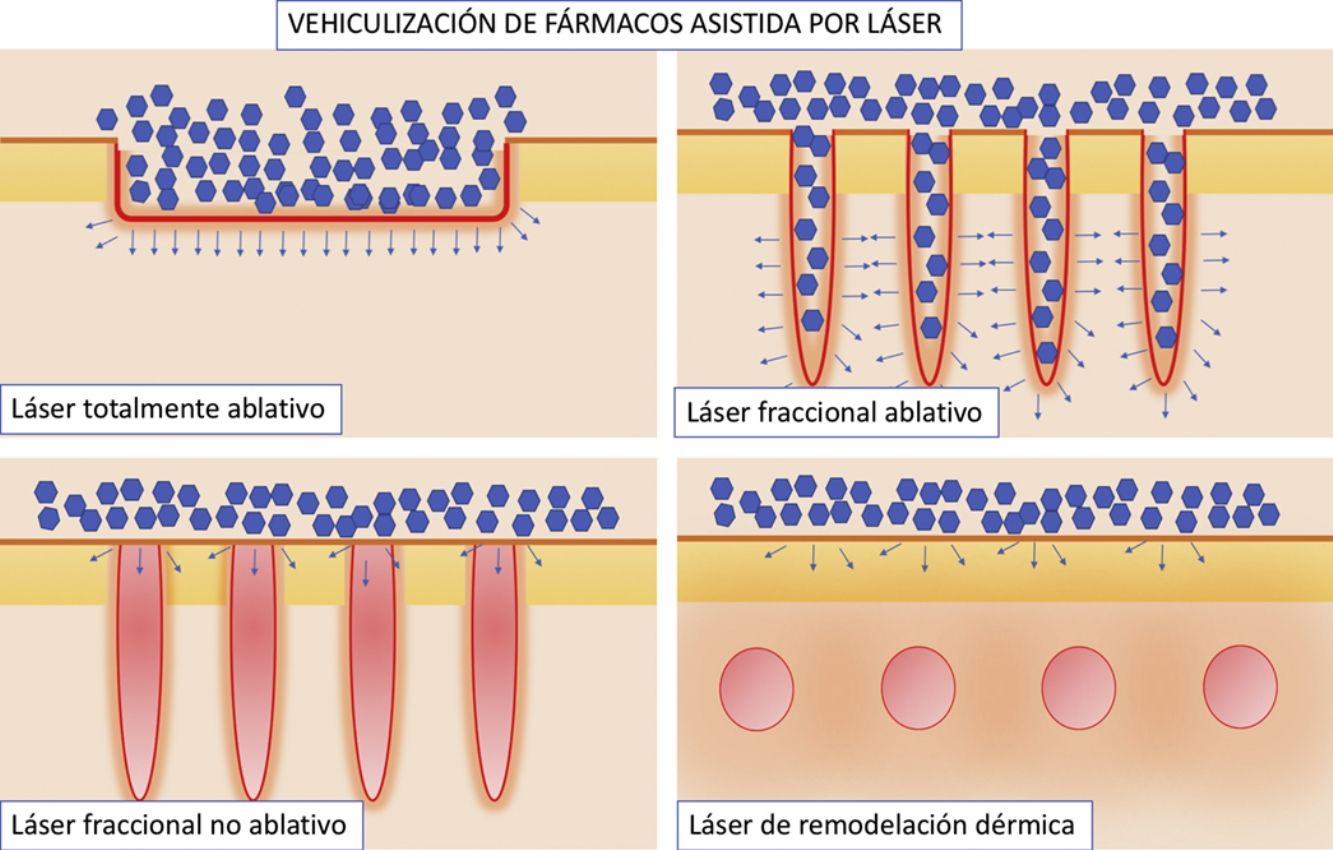
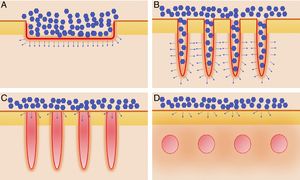
Vehiculización de fármacos asistida por láser: consideraciones generalesConsideraciones del láserSe han empleado distintos tipos de láser en el contexto de la VFAL. Cada tipo de láser lleva aparejada una mayor o menor eficacia, pero, además, tenemos que conocer su perfil de seguridad. A efectos prácticos podemos dividir los láseres empleados en la VFAL hasta en 4 subgrupos: 1) láseres totalmente ablativos, tales como el de CO2 (10.600nm) o el Er:YAG (2.940nm): tienen como cromóforo principal el agua y producen un calentamiento y vaporización total del tejido; 2) LFA: son los mismos láseres del subgrupo previo, pero usados de forma fraccionada producen lo que denominamos columnas de daño térmico, que son zonas de tratamiento microscópico (ZTM); 3) LFNA: de forma análoga a los anteriores, existen láseres tales como el de fibra de erbio de 1.550nm, entre otros, que producen igualmente ZTM, pero en cuyas columnas solo se produce calentamiento del tejido sin llegar a la ablación dermoepidérmica, y 4) láseres de remodelación dérmica no ablativa: en este grupo se incluye el resto de los láseres con cromóforos distintos al agua pero que se han usado para intentar inducir una mayor absorción de moléculas. Entre estos se encuentran los láseres vasculares, como el láser de colorante pulsado de 585/595nm o el Nd:YAG de 1.064nm15. Por sus características, los LFA son los que más se han estudiado en el contexto de la VFAL, seguidos por los LFNA (fig. 1).
Distintos tipos de láseres empleados en la vehiculización de fármacos asistida por láser. A) Láseres totalmente ablativos: CO2 (10.600nm) y Er:YAG (2.940nm) principalmente; realizan una ablación total, no fraccionada, de la epidermis, permitiendo a las moléculas alcanzar la dermis. B) Láseres fraccionales ablativos: los mismos tipos que en A, en su versión fraccionada; generan canales de microablación que utilizan los fármacos para penetrar hasta la dermis. C) Láseres fraccionales no ablativos: por ejemplo, Er:Glass 1.550nm, entre otros; generan columnas de microcoagulación sin llegar a producir ablación de la epidermis. D) Remodelación dérmica no ablativa: se agrupan en este subtipo todos aquellos láseres con cromóforos distintos al agua, que producen un depósito de energía en la zona en la que se encuentre su cromóforo, generalmente en la dermis, como por ejemplo los láseres vasculares como el colorante pulsado 585/595nm o el Nd:YAG 1.064nm.
Si bien los riesgos de producir efectos adversos tales como eritema, vesiculación, costras o incluso cicatrización son menores con los láseres fraccionales respecto a los ablativos convencionales, estos efectos pueden aparecer sobre todo al usar fluencias y densidades elevadas16–18. Al usar los LFA para la VFAL los parámetros deben estar optimizados para conseguir los mejores resultados con el menor riesgo.
Se describe la densidad en los láseres fraccionales como la cantidad de tejido cubierta por las ZTM del láser. La densidad total depende tanto del número de canales como del tamaño del haz del láser. En estudios iniciales con MAL, y posteriormente confirmados con otras sustancias (diclofenaco, tretinoína), se ha demostrado que las concentraciones dérmicas de producto aumentan al incrementar la densidad hasta un máximo del 5%, en el que las concentraciones dérmicas se estancan19–22. De esta forma, densidades mayores del 5% de tratamiento con LFA no conllevarían claros beneficios y sí producirían un mayor riesgo de efectos adversos.
Otro de los parámetros más relevantes es la profundidad del propio canal, que depende directamente de la fluencia utilizada con el láser. Como regla general, deberíamos usar fluencias más elevadas para profundizar a capas más profundas de la dermis si queremos tratar dermatosis tales como las alopecias o las cicatrices. Las capas más superficiales de la dermis serían las apropiadas para el tratamiento del fotodaño, del melasma o de las cicatrices superficiales. Para situaciones como el melasma, el vitíligo o el cáncer cutáneo no melanoma superficial, podría ser suficiente una ablación casi limitada a la epidermis23.
En los LFA, además de la profundidad total de la ablación, la zona de coagulación (ZC) que rodea estos canales influye en la absorción del fármaco. Esta ZC varía en su área en torno a 50-150mm, dependiendo de la fluencia sobre todo de la longitud de onda del láser, siendo mayor en el caso de los LFA de CO2 (10.600nm) frente a Er:YAG (2.940nm)24,25. La mayor afinidad por el agua del Er:YAG genera una ablación más «pura», sin casi desprender calor alrededor de las ZTM, mientras que en el caso de CO2 se genera una ZC más amplia por tener una menor afinidad por el agua. Se ha demostrado que la presencia de estas ZC supone una absorción aún mayor de las moléculas vehiculizadas a través de los canales. Esto puede explicar, además, la superioridad del LFA frente a las modalidades que no implican la generación de ningún calor rodeando los canales como el caso del microneedling12. Sin embargo, no debemos olvidar que la presencia de estas ZC no refleja sino una transmisión del calor a la dermis circundante, lo que puede llevar asociadas reacciones locales no deseadas26.
Consideraciones del fármaco y la técnica de aplicaciónDebido a que las moléculas lipofílicas tienen una mayor capacidad intrínseca para atravesar la epidermis intacta, el efecto mayor de la VFAL se observa con las sustancias hidrofílicas4. Otros factores relevantes que influyen en la absorción son el vehículo utilizado, el tipo de preparación y la presencia de aditivos o excipientes. Las formulaciones líquidas o en gel pasarán con mayor afinidad por los canales realizados por el LFA que las preparaciones más oleosas en cremas o pomadas27. Esta situación se debe tener en cuenta tanto por la mayor eficacia como por el mayor riesgo de efectos adversos al utilizar estas preparaciones4.
Existe, además, una disparidad entre las moléculas hidrofóbicas e hidrofílicas y su relación con la penetración a través de los canales del láser. En el caso de las sustancias hidrofílicas, tales como el 5-fluorouracilo o el metotrexato, se han detectado absorciones mayores en relación directa con la fluencia del LFA y, por tanto, la profundidad de los canales. Sin embargo, este hallazgo no ha sido corroborado en estudios con moléculas hidrofóbicas tales como el imiquimod o la lidocaína8,9,23,28.
Respecto a la idoneidad o no de introducir fármacos pensados para su aplicación tópica directamente en la dermis, existen ciertas consideraciones a tener en cuenta. Lo primero que debemos preguntarnos es si las moléculas y excipientes que pretendemos introducir directamente en la dermis están preparadas para su aplicación subcutánea. Existen ya casos de hipersensibilidad local a la aplicación de vitamina C en serum asistida mediante microneedling, dando lugar a la formación de granulomas demostrados histológicamente o incluso a reacciones sistémicas de hipersensibilidad29. En condiciones ideales utilizaríamos únicamente productos con una esterilidad clara, si bien lo cierto es que no todos los fármacos tópicos están disponibles en esta forma. La propia utilización del LFA conlleva cierto riesgo de infección bacteriana por la exposición directa de la dermis, y este riesgo es aún mayor cuando introducimos moléculas como 5-fluorouracilo, corticoides o MAL14,17,30,31. Se debe insistir especialmente en la asepsia de los procedimientos durante la VFAL.
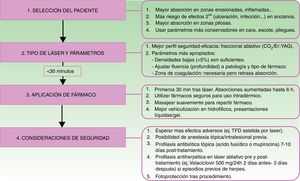
Otro factor determinante en la VFAL es el intervalo entre la realización del láser y la aplicación del producto sobre la piel. Se debe tener en cuenta que los microcanales realizados se cerrarán con el paso del tiempo por diversos detritus, incluyendo fibrina, mediadores de inflamación, queratinocitos, etc.32–34. Según un estudio, la aplicación tópica tras las primeras 6h del impacto del láser conlleva un aumento en la absorción de este, que es máxima en los primeros 30min. Sin embargo, aplicaciones pasadas 24h no mostraron ningún incremento en la absorción35. En la figura 2 se detallan los pasos correctos para la VFAL y las consideraciones en cada uno de ellos.
Consideraciones del pacienteTal y como sucede con las terapias tópicas, la absorción de fármacos mediante VFAL depende de muchas características intrínsecas al paciente, a la dermatosis tratada o a la localización de esta. De esta forma, la absorción será más potente en los casos de piel inflamada o erosionada. Igualmente, las pieles más hidratadas tienen más afinidad por la absorción de sustancias oleosas. Además, debemos valorar la edad del paciente, ya que los mayores tendrán más tendencia a la atrofia, las erosiones y las ulceraciones, y un mayor riesgo de infecciones y tiempos de recuperación prolongados36. Por ello, lo ideal será valorar correctamente el tipo de piel del paciente, ya que en los fototipos bajos, incluso en edades tempranas se puede presentar la piel con una cierta atrofia por la elastosis solar. En estos casos se deberá reducir la fluencia del láser, y en aquellos dispositivos de LFA tipo CO2 que lo permitan, utilizar unos pulsos con un menor depósito de calor para evitar las cicatrizaciones patológicas. Respecto a la localización, la vía transanexial de absorción predomina en las zonas pilosas por los canales foliculares, por lo que se debe ser más cauto con los parámetros al emplear la VFAL.
Fármacos vehiculizados por láserA efectos prácticos nos centraremos aquí en 2 de las grandes aplicaciones de la VFAL: la vehiculización de corticoides para cicatrices hipertróficas y queloideas y la TFD asistida por láser6,37–40. Además de estas 2 indicaciones, se han vehiculizado numerosos fármacos en muchas otras indicaciones en Dermatología7–9,17,23,28,41–50. Los datos de estos estudios se presentan en la tabla 1.
Distintos medicamentos empleados mediante vehiculización de fármacos asistida por láser
| Fármaco | Principales indicaciones estudiadas | Diseño de estudios principales | Resultados |
|---|---|---|---|
| Ácido amino-levulínico y 5-MAL: TFD asistida por láser 48–57 | 1. Queratosis actínicas48 2. Carcinomas basocelulares nodulares finos (<2mm)56 3. Carcinomas espinocelulares superficiales57 | 1. Una sesión de Er:YAG fraccionado (550μm; 22% densidad)+TFD con 5-MAL convencional vs. una sesión de TFD con 5-MAL convencional 2. Una sesión de Er:YAG fraccionado (550μm; 22% densidad)+TFD con 5-MAL vs. 2 sesiones de TFD convencional 3. Dos sesiones de Er:YAG fraccionado (550μm; 22% densidad)+TFD con 5-MAL vs. 2 sesiones de TFD convencional | 1. Respuesta del 91% en TFD asistida por láser respecto a 65,6% en TFD convencional a los 3 meses 2. Respuesta total del 84% en TFD asistida por láser respecto al 50% en TFD convencional a los 3 meses 3. Respuesta total del 84,3% en TFD asistida por láser respecto al 52% en TFD convencional a los 3 meses |
| ATC35,58,59 | Cicatrices hipertróficas y queloideas | Er:YAG fraccionado (primer pase 150-200μm sin coagulación, segundo pase 300-400μm con coagulación; 22% densidad)+ATC al 10% intralesional vs. Er:YAG fraccionado+corticoterapia tópica (desoximetasona 0,25%). Cuatro sesiones con intervalos de 6 semanas35 | Mejoría en ambos casos, sin diferencias significativas respecto a corticoterapia intralesional o tópica posláser, pero mucha mejor tolerancia del tratamiento tópico vehiculizado y mayor preferencia del paciente |
| Metotrexato9 | Estudios de absorción en modelo animal (murino) | Aplicación de metotrexato tópico tras láser Er:YAG 2.940nm continuo vs. electroporación | Mejor resultado en absorción con VFAL (3-80 veces mayor que tópico aislado dependiendo de fluencias) vs. electroporación (2 veces mayor que tópico aislado) |
| Imiquimod22 | Estudios de absorción en modelo animal (murino) con distintos láseres | Aplicación de imiquimod acuoso al 0,4% tras láser Er:YAG 2.940nm fraccionado | Concentraciones intradérmicas similares con la preparación acuosa al 0,4% en VFAL a las conseguidas con imiquimod al 5% en crema tópico |
| Ingenol mebutato43 | Enfermedad de Bowen | Ingenol mebutato 0,015% durante 3 días en cara y 0,05% durante 2 días en cuerpo; precedido o no por láser CO2 fraccional el primer día de tratamiento 100mJ; 100spot/cm2 | Respuestas completas en el 88,9% de los pacientes tratados mediante VFAL frente al 12,5% de los tratados con ingenol mebutato sin láser |
| 5-fluorouracilo7,11 | 1. Estudios de absorción en modelo animal (murino) con distintos láseres 2. Carcinoma basocelular superficial y enfermedad de Bowen en tronco y extremidades de<2cm | 1. Láser Qs ruby 694nm vs. Er:YAG 2.940nm continuo vs. CO2 continuo 2. Treinta pacientes tratados con CO2 fraccionado (0,12mm spot; 10mJ por pulso; densidad de 5%) seguido de 5-fluorouracilo al 5% en oclusión durante 7 días | 1. Mejores tasas de absorción con Er:YAG continuo llegando a ×156 2. Curación del 87% de los Bowen y 71% de los basocelulares histológicamente confirmada |
| Timolol41 | Hemangiomas infantiles profundos | Timolol 0,5% en solución oftálmica aplicado 4-5 veces al día con sesiones de CO2 fraccional ablativo (0,12mm spot; 25-30mJ por pulso; densidad 5%) semanales | Respuestas buenas/excelentes en más del 80% de los pacientes con una media de 14 semanas de tratamiento |
| Pimecrolimus, tretinoína y bimatoprost49 | Cicatrices hipopigmentadas | Bimatoprost 0,03%+tretinoína 0,05%+pimecrolimus 1% tópicos 2 veces al día durante 3 meses. Combinado con VFAL del láser fraccional no ablativo de 1.550nm(20-70mJ; 20-32% densidad), 4,5 sesiones de media con intervalos de 4-8 semanas | Repigmentación parcial>50% en el 86% de los casos |
| Ácido poli-L-láctico48 | Cicatrices atróficas | Sculptra® (Valeant Aesthetics, Quebec, Canadá) reconstituido con suero salino, lidocaína y epinefrina en combinación con láser CO2 fraccional (120μm spot size, 375-500μm profundidad, densidad 10%) | Mejoría de más del 30% en la mayoría de los casos. Menos formación de pápulas retardadas que con tratamiento intralesional |
| Finasterida50 | Alopecia androgenética masculina | Combinación de finasterida 0,05% y factores de crecimiento con láser Er:Glass fraccional no ablativo (1.550nm, 8 pases, 7mJ, 3-9% densidad) | En 4 pacientes encuentran mejoría en seguimiento fotográfico |
| Vitaminas46 | Recuperación tras tratamiento de rejuvenecimiento con láser ablativo fraccional | Fórmula con vitamina C, E y ferúlico aplicado tras láser CO2 fraccional y diariamente durante reepitelización. Estudio controlado aleatorizado | Mejoría en recuperación con menos efectos adversos. Molecularmente aumento de bFGF respecto a grupo placebo |
| Anestésicos28,42,43 | Estudios de absorción y preexposición a inyecciones subcutáneas | Lidocaína al 4% tópica combinada en VFAL con láser Er:YAG ablativo fraccionado | Niveles séricos de lidocaína y sus metabolitos aumentados en VFAL frente a vía tópica. Puntuaciones de dolor inferiores en grupo tratado con lidocaína en VFAL previa a inyección con aguja subcutánea |
ATC: acetónido de triamcinolona; bFGF: factor básico de crecimiento de fibroblastos; TFD: terapia fotodinámica; VFAL: vehiculización de fármacos asistida por láser; 5-MAL: 5-metil-aminolevulinato.
Existen estudios que avalan la mayor absorción de ácido amino-levulínico y 5-metil-aminolevulinato asistida por los distintos tipos de láseres o incluso trabajos que utilizan láseres como el de colorante pulsado como fuentes de luz. En este análisis nos interesan los trabajos que utilizan los láseres para vehiculizar los fotosensibilizantes hacia la dermis y conseguir así una mayor eficacia con la TFD. Se ha estudiado de esta forma la utilidad de la VFAL en el contexto de la TFD tanto para el tratamiento de las queratosis actínicas como de los carcinomas basocelulares y espinocelulares superficiales, consiguiendo unas tasas de eficacia mayores, pero también más efectos adversos (costras, prurito, dolor, eritema, etc.)51–60. Haedersdal et al. demostraron unas tasas de absorción de MAL 13,8 veces mayores con Er:YAG continuo y de hasta 7,3 veces con su versión fraccionada. Existen además estudios en modelos animales con CO2, con resultados similares56.
Cicatrices hipertróficas: acetónido de triamcinolonaEl acetónido de triamcinolona (ATC) es uno de los corticoides más utilizados por vía subcutánea o intralesionalmente en múltiples enfermedades cutáneas, por su liberación mantenida en el tiempo. Los efectos secundarios más relevantes incluyen la presencia de atrofia, equimosis, telangiectasias, infecciones o incluso ulceraciones en la zona de inyección30. Su aplicación mediante VFAL ha sido principalmente explorada en el contexto del tratamiento de las cicatrices patológicas (hipertróficas y queloideas) y de las secuelas de quemaduras. Existen varios estudios al respecto, entre los que destaca uno llevado a cabo por Waibel et al. en cicatrices hipertróficas y que causan una restricción funcional. La pauta empleada por estos autores consiste en ATC mediante VFAL con láser CO2 fraccionado, realizando entre 3-5 tratamientos cada 2-3 meses, con mejorías no solo en la textura y el grosor, sino también en la discromía y la funcionalidad de estas cicatrices6. Existen muchos otros estudios con unos resultados similares37,38,61,62. Especialmente interesante es uno en el que comparan la eficacia y la tolerabilidad en el tratamiento de cicatrices hipertróficas con Er:YAG fraccionado seguido de inyecciones de corticoides intralesionales (ATC al 10%) o corticoterapia tópica (desoximetasona al 0,25% ocluida), realizando 4 sesiones cada 6 semanas. Los resultados demuestran una discreta superioridad en cuanto a la eficacia, aunque no estadísticamente significativa, para el corticoide tópico, y, sobre todo, unas puntuaciones mucho más bajas en las escalas de dolor y de preferencia del paciente frente a la vía intralesional.
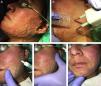
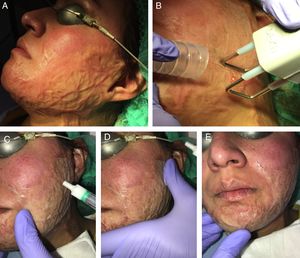
En nuestra experiencia, la asociación del láser CO2 con ATC al 10%, aplicado en los 15min posteriores al láser con un masaje suave, consigue muy buenos resultados tanto en las cicatrices hipertróficas y queloideas como en las secuelas de quemaduras (fig. 3). Además, es mejor tolerado por el paciente con la simple aplicación de anestésicos tópicos antes del láser frente a la combinación del impacto del láser con las inyecciones del ATC posteriormente. En el caso de las cicatrices eritematosas, muy vascularizadas, se puede combinar esta técnica con un abordaje vascular previo que se puede realizar con láser de colorante pulsado o luz pulsada intensa, entre otros. En líneas generales, utilizamos con este fin el láser de colorante pulsado de 595nm con pulsos de 0,5-6ms y fluencias de 5-7J/cm2, seguido inmediatamente después por el LFA.
Ejemplo de la vehiculización de acetónido de triamcinolona asistida por un láser fraccional ablativo de CO2 en una paciente con una secuela de una quemadura facial. A) Antes de la realización del tratamiento. B) Pase de láser CO2 con un escáner fraccional sobre toda la superficie de la quemadura facial; se emplea un extractor de humos asociado al tratamiento. C) Aplicación del acetónido de triamcinolona al 10% en solución inyectable: se aplica tópicamente sobre la zona tratada con láser. D) Extensión del corticoide por toda la superficie de la quemadura. E) Masaje suave para conseguir una mejor penetración del producto.
La técnica de VFAL se ha empleado para conseguir introducir en el organismo fármacos y moléculas con múltiples y variados fines, además de los ya repasados en el ámbito de la Dermatología. Existen estudios que han demostrado tanto en animales como en humanos la eficacia de láseres puramente ablativos y fraccionados para introducir en el organismo moléculas de RNA pequeño de interferencia (siRNA) y anticuerpos23,63. Respecto a los siRNA, se trata de moléculas con capacidad de inhibir la traducción de distintos genes, con utilidad en múltiples enfermedades. Si bien los únicos estudios de VFAL con siRNA hasta la fecha son con modelo murino, lo cierto es que cabe la posibilidad en el futuro de explorar esta vía en enfermedad dermatológica utilizando siRNA, como el 21 en psoriasis, por mencionar un ejemplo.
Incluso se ha comprobado la eficacia del VFAL para generar una respuesta inmune eficaz al utilizar vacunas tópicas22,64,65. Más avanzados aún son los estudios piloto llevados a cabo con células madre hematopoyéticas aplicadas tópicamente en combinación con láser ablativo en modelo murino, abriendo una puerta a una posible aplicación de la VFAL como alternativa para el trasplante de progenitores hematopoyéticos66.
ConclusionesMediante la VFAL tenemos la posibilidad de conseguir mejores resultados con los tratamientos tópicos facilitando la absorción y consiguiendo un efecto sinérgico entre el tratamiento médico (fármacos) y el físico (láseres). Existen aún controversias en cuanto a su seguridad y la técnica más apropiada, cuestiones que se irán resolviendo sin duda en los próximos años.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.