El término vasculitis define el daño e inflamación de las paredes vasculares, con independencia del calibre del vaso afectado. Clasificar las vasculitis con afectación cutánea constituye un reto aún no superado, como consecuencia, probablemente, de la falta de conocimiento sobre su etiopatogenia. En la microscopía deben encontrarse datos de afectación de la pared vascular, diferenciándose unos cuadros de otros por el calibre del vaso afectado, el tipo celular predominante en el infiltrado inflamatorio o la presencia de hallazgos característicos, como los granulomas extravasculares. En la clínica existe una correlación entre los hallazgos cutáneos (máculas, pápulas, nódulos, livedo reticular…) y el calibre del vaso afectado. El pronóstico de las vasculitis con afectación cutánea viene determinado por la presencia o no de compromiso extracutáneo, de forma que las vasculitis sistémicas muestran especial predilección por órganos como el riñón o el pulmón. No obstante, tras la introducción de los fármacos inmunosupresores la supervivencia de estos pacientes ha experimentado un cambio ostensible. En este artículo se revisan de forma práctica los aspectos relacionados con la fisiopatología, histopatología, tratamiento y diagnóstico diferencial de los principales cuadros vasculíticos con afectación cutánea.
Vasculitis is a term that refers to damage and inflammation of the walls of blood vessels of any size. The classification of types of cutaneous vasculitis continues to be a challenge, probably because of our lack of understanding of the etiology and pathogenesis of this condition. Changes in the vessel wall will be visible on microscopy and will enable the different clinical forms to be distinguished according to the caliber of affected vessels, the type of cell that predominates in the inflammatory infiltrate, or the presence of such key findings as extravascular granulomas. Skin manifestations (macules, papules, nodules, livedo reticularis, etc) correlate with the size of the vessel affected. The prognosis in cases of vasculitis with skin involvement will be determined by the presence or absence of extracutaneous disease. Systemic vasculitis shows a predilection for certain organs, such as the kidney or lung. The introduction of immunosuppressant drug treatments has led to evident improvement in survival rates for patients with vasculitis. This review covers practical aspects of the pathophysiology, histopathology, treatment, and differential diagnosis of the main clinical presentations of vasculitis with cutaneous involvement.
El término vasculitis se refiere a la inflamación y necrosis de los vasos sanguíneos, independientemente del tipo de vaso (arterias, venas o ambos), etiología del proceso u órgano afecto. El cuadro puede ser idiopático o secundario a infecciones, fármacos, neoplasias o enfermedades inflamatorias sistémicas.
La afectación cutánea en los distintos tipos de vasculitis es muy frecuente. Puede verse como única manifestación de la enfermedad o en el contexto de cuadros con compromiso sistémico, sin existir marcadores histológicos, analíticos o clínicos que garanticen una correcta delimitación entre las vasculitis limitadas a la piel y las vasculitis sistémicas.
ClasificaciónEl desarrollo de una clasificación unificada y aceptada por todos los profesionales implicados en el manejo y diagnóstico de los distintos tipos de vasculitis continúa siendo un objetivo difícil de alcanzar1,2.
En 1950 Zeek et al. diseñaron la primera clasificación diagnóstica basándose en el calibre del vaso afectado3, sirviendo como punto de partida para el resto de clasificaciones posteriores4.
En el año 1990 el Colegio Americano de Reumatología publicó una clasificación en función de diversos criterios clínicos e histopatológicos, acuñando el término «vasculitis por hipersensibilidad» como denominación para las vasculitis cutáneas de pequeño vaso5. Por su parte, la Conferencia para el Consenso de Chapel Hill decidió, en 1994, abandonar los criterios clínicos y unificar la nomenclatura en relación con las características histopatológicas, agrupando las distintas entidades en función del calibre del vaso afectado6. Sin embargo, ninguno de estos sistemas ha conseguido superar limitaciones tales como el solapamiento de las características clínicas correspondientes a cada uno de los cuadros, o los mecanismos inmunopatológicos implicados y su correlación pronóstica7. En un intento por eliminarlas Carlson et al. proponen un esquema de trabajo dirigido a clasificar las vasculitis cutáneas incluyendo criterios histopatológicos, clínicos, hallazgos de laboratorio y su relación con distintas etiologías6 (tabla 1). Por desgracia, a pesar de estos esfuerzos, actualmente no contamos con un sistema de clasificación universalmente aceptado8.
Clasificación de las vasculitis
| 1. Vasos de pequeño calibre |
| 1.1. Vasculitis neutrofílicas (mediadas por inmunocomplejos) |
| A) Vasculitis leucocitoclástica cutánea o vasculitis por hipersensibilidad |
| B) Púrpura de Schönlein-Henoch |
| C) Urticaria vasculitis |
| D) Eritema elevatum diutinum |
| E) Edema agudo hemorrágico del lactante |
| 1.2. Vasculitis eosinofílicas |
| A) Síndrome hipereosinofílico |
| B) Asociadas a enfermedad del tejido conectivo |
| 1.3. Vasculitis linfocitarias |
| A) Pitiriasis liquenoide y varioliforme aguda |
| B) Perniosis |
| 2. Vasos de pequeño-mediano calibre |
| 2.1. Vasculitis neutrofílicas |
| 2.1.1. Mediadas por inmunocomplejos: |
| A) Vasculitis crioglobulinémica |
| B) Vasculitis asociada a enfermedad del tejido conectivo |
| C) Forma hipocomplementémica de la urticaria vasculitis |
| D) Vasculitis séptica |
| 2.1.2. Mediadas por ANCA: |
| A) Poliangeítis microscópica |
| B) Granulomatosis de Wegener |
| C) Púrpura de Churg-Strauss |
| D) Vasculitis ANCA-positiva inducida por fármacos |
| 2.2. Vasculitis linfocitarias: |
| A) Enfermedad de Degos |
| B) Infecciones víricas y por rickettsias |
| C) Vasculitis asociadas a enfermedad del tejido conectivo |
| 3. Vasos de mediano-gran calibre |
| 3.1. Vasculitis neutrofílicas |
| A) Poliarteritis nudosa (forma clásica y cutánea) |
| B) Vasculitis nodular o eritema indurado de Bazin |
| 3.2. Vasculitis granulomatosas |
| A) Arteritis de células gigantes |
| B) Arteritis de Takayasu |
| 3.3. Vasculitis linfocitarias |
| Enfermedad de Kawasaki |
Adaptada de Carlson JA et al.8.
Existen numerosos factores relacionados con el desarrollo de los distintos tipos de vasculitis. Uno de ellos es el depósito de inmunocomplejos circulantes en las paredes vasculares, mecanismo implicado en las vasculitis por hipersensibilidad. Fármacos, sustancias químicas o agentes infecciosos como virus o bacterias actuarían como potenciales antígenos. Al interaccionar con el sistema del complemento, el depósito de inmunocomplejos estimularía la producción de factores quimiotácticos, aminas vasoactivas (histamina) y citoquinas proinflamatorias (IL-1, TNF-α), que inducirían la expresión de moléculas de adhesión en las células endoteliales (ICAM-1, VCAM-1, P- y E-Selectina). Este fenómeno reclutaría neutrófilos, que posteriormente degranularían su contenido a través de su unión con la fracción Fc de los anticuerpos depositados, liberando especies reactivas de oxígeno, colagenasa y elastasa, que desencadenarían la necrosis fibrinoide de las paredes vasculares9.
Otros factores relacionados con el desarrollo de las vasculitis son los anticuerpos anti-citoplasma de neutrófilos (ANCA). Se trata de anticuerpos dirigidos fundamentalmente contra dos antígenos proteicos citoplasmáticos, la proteinasa 3 (PR3) y la mieloperoxidasa (MPO), que mediante inmunofluorescencia indirecta (IFI) adoptan un patrón de fluorescencia perinuclear (p-ANCA), citoplasmático (c-ANCA) o atípico, que incluye características pertenecientes a los anteriores (X-ANCA o a-ANCA). Aunque la mayor parte de los c-ANCA reconocen a la PR3 y los p-ANCA a la MPO, existe un porcentaje de p-ANCA dirigido contra otros componentes de los gránulos citoplasmáticos primarios, como la elastasa o la catepsina, o de los gránulos secundarios, como la lactoferrina10. Estos anticuerpos activan y estimulan la degranulación de los polimorfonucleares, promoviendo la generación de especies reactivas de oxígeno y su adhesión a las células endoteliales. Su positividad debe interpretarse con cautela, dado que los ANCA pueden asociarse a enfermedades infecciosas (malaria, virus de la inmunodeficiencia humana [VIH]), gastrointestinales (enfermedad inflamatoria intestinal, hepatitis autoinmune, cirrosis biliar primaria), conectivopatías (lupus eritematoso sistémico, artritis reumatoide) y, ocasionalmente, encontrarse en individuos sanos11.
Otros factores que podrían relacionarse con la fisiopatología de las vasculitis sistémicas son los anticuerpos antiendoteliales, implicados en el desarrollo de otras enfermedades autoinmunes del tejido conectivo, a través de una acción directa e indirecta sobre el endotelio vascular12. Además, se han descrito distintos polimorfismos genéticos que traducirían un mayor o menor riesgo para desarrollarlas, como en el caso del CD18 y la poliangeítis microscópica o el síndrome de Churg-Srauss13 y la asociación de los alelos HLA A2, A11 y B35 con la púrpura de Schönlein-Henoch14.
Características clínicasLas manifestaciones cutáneas de los distintos tipos de vasculitis comprenden diferentes lesiones elementales, cuya morfología dependerá del calibre del vaso afectado, de la localización anatómica y del estadio evolutivo de las mismas.
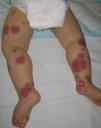
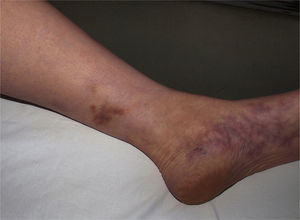
Las lesiones elementales más frecuentes son las máculas o pápulas purpúricas («púrpura palpable») (fig. 1), secundarias a la afectación de vasos dérmicos de pequeño calibre. Además, pueden existir ampollas de contenido hemorrágico, pústulas, placas de aspecto urticarial o anular o nódulos de profundidad variable que pueden llegar a ulcerarse. Estos nódulos pueden asociarse a livedo reticular, y traducen un daño en los vasos de la dermis profunda e hipodermis. Todas estas manifestaciones son más frecuentes en los miembros inferiores, debido probablemente a causas hemodinámicas. La presencia de lesiones en forma de nódulos, livedo reticular, úlceras o la localización por encima de la raíz de los miembros inferiores debe hacernos sospechar que se trata de una vasculitis con afectación sistémica. Independientemente del proceso subyacente o desencadenante, cualquier cuadro de vasculitis con afectación cutánea puede acompañarse de fiebre, astenia y/o artromialgias15.
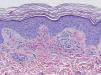
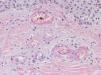
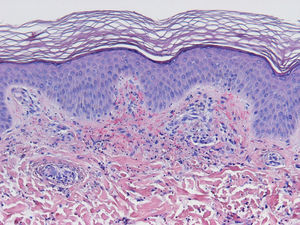
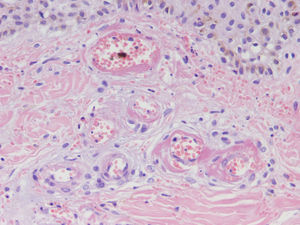
HistopatologíaDado que el término vasculitis corresponde a un concepto puramente histopatológico, la biopsia cutánea resulta fundamental en el abordaje del paciente con sospecha de vasculitis (tabla 2). Para la realización de la biopsia se recomienda escoger lesiones no ulceradas con una evolución inferior a las 48 horas. El tipo de vaso afectado (pequeño, mediano, grande) y la naturaleza del infiltrado inflamatorio (neutrofílico, linfocitario, granulomatoso) son los principales aspectos que se deben considerar desde el punto de vista anatomopatológico. Los neutrófilos se encuentran en la mayor parte de los cuadros relacionados con infecciones, tóxicos, fármacos, alimentos, conectivopatías autoinmunes, crioglobulinas tipo II y III o mediados por IgA. Estos neutrófilos sufren degeneración o leucocitoclasia (fig. 2), dando lugar al llamado polvo nuclear. Por su parte, los linfocitos y los monocitos pueden constituir el tipo celular predominante en algunas vasculitis, aunque ello dependerá del momento en el que se haya tomado la biopsia cutánea, puesto que estas células pueden reemplazar a los leucocitos polimorfonucleares en los cuadros evolucionados. Además, debe valorarse la presencia de hallazgos característicos de algunas formas de vasculitis, como la existencia de granulomas extravasculares. Como consecuencia del edema y del infiltrado inflamatorio en la pared vascular se produce un engrosamiento parietal progresivo, observándose, a veces de forma muy discreta, la necrosis fibrinoide de estas paredes vasculares (fig. 3). Por su parte, las células endoteliales suelen edematizarse, hallándose ocasionalmente trombos intravasculares o extravasación de hematíes en la dermis (tabla 2). En ocasiones puede existir un importante edema subepidérmico, responsable de las lesiones vesiculoampollares. El estudio por inmunofluorescencia directa aporta información adicional en la evaluación de las vasculitis. Debe realizarse sobre piel lesional, objetivándose depósitos de IgM, fibrinógeno y C3 en las lesiones recientes, IgG en las lesiones que presentan un desarrollo completo y fibrinógeno acompañado de C3 en las lesiones antiguas. La presencia de depósitos de IgA puede ser más evidente en pacientes con riesgo de compromiso renal16.
Criterios histopatológicos para el diagnóstico de vasculitis
| Definición histológica: proceso inflamatorio que afecta a la pared de un vaso |
| Se requieren dos criterios: |
| 1. Infiltrado inflamatorio dentro de la pared del vaso |
| 2. Daño en forma de depósitos de fibrina y/ o necrosis endotelial |
| Criterios histopatológicos de vasculitis |
| Mayores: |
| Neutrófilos y cariorrexis (polvo nuclear) |
| Necrosis y depósitos de fibrina |
| Menores: |
| Edematización de las células endoteliales |
| Hemorragia |
| Trombosis |
| Necrosis |
| Vesículas epidérmicas |
| Histiocitos |
| Eosinófilos |
| Aneurismas |
| Calcinosis |
A continuación se describen algunas de las vasculitis con expresión cutánea que conforman entidades propias, resumiendo brevemente sus principales características clínicas e histopatológicas:
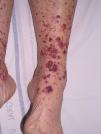
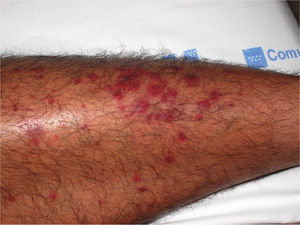
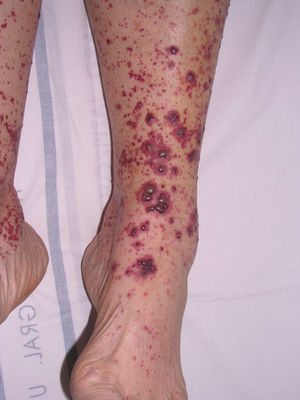
Vasculitis como entidades propiasVasculitis leucocitoclástica de los vasos cutáneos de pequeño calibreSe trata del tipo de vasculitis más frecuente en la práctica dermatológica. También se ha denominado vasculitis por hipersensibilidad o venulitis necrotizante cutánea. Clínicamente se manifiesta en forma de lesiones purpúricas que, en ocasiones, se acompañan de pápulas eritematosas, vesículas, ampollas, pústulas o placas de morfología anular, que se localizan en los miembros inferiores o en las zonas declives (fig. 4). De forma inconstante, el cuadro clínico puede verse precedido o asociar síntomas extracutáneos como artralgias, astenia, fiebre o anorexia. Aunque la mayor parte de los casos se manifiestan solo en la piel, se debe tener presente que estas lesiones cutáneas pueden presentarse en otras vasculitis con afectación sistémica. Los hallazgos histopatológicos reflejan una afectación de las vénulas poscapilares dérmicas, con infiltración de sus paredes por polimorfonucleares, acompañados intra y extravascularmente de eosinófilos17.
Las causas relacionadas con el desarrollo de vasculitis cutáneas de pequeño vaso se muestran en la tabla 318,88 . Hasta en un 50% de los pacientes no se consigue dilucidar un origen concreto. En algunos de estos cuadros puede identificarse la presencia de ANCA, concretamente del tipo anti-MPO o p-ANCA, normalmente relacionados con la ingesta de fármacos como la hidralazina o el propiltiouracilo19.
Etiología de las vasculitis leucocitoclásticas cutáneas de pequeño vaso
| Asociada a agentes precipitantes | ||
| – | Infecciosos | |
| + | Bacterianos: | |
| =Estreptococo | ||
| =Estafilococo | ||
| =Meningococo | ||
| =Gonococo | ||
| =Pseudomona | ||
| =Treponema palidum | ||
| =Mycobacterium leprae | ||
| =Mycobacterium tuberculosis (?) | ||
| + | Víricos: | |
| =Hepatitis B | ||
| =Influenza | ||
| =Citomegalovirus | ||
| + | Parasitarios: | |
| =Plasmodium | ||
| – | Medicamentos | |
| + | Penicilinas | |
| + | Tetraciclinas | |
| + | Sulfamidas | |
| + | Eritromicina | |
| + | Griseofulvina | |
| + | Antiinflamatorios (ácido acetil salicílico, fenacetina) | |
| + | Tiacidas | |
| + | Diuréticos del asa | |
| + | Propiltiouracilo | |
| + | Penicilamina | |
| + | Fenotiacinas | |
| + | Quinidina | |
| – | Sustancias químicas | |
| + | Insecticidas | |
| + | Herbicidas | |
| + | Derivados del petróleo | |
| Asociada a desórdenes crónicos persistentes | ||
| – | Enfermedades autoinmunes del tejido conectivo | |
| + | Lupus eritematoso sistémico | |
| + | Artritis reumatoide | |
| + | Síndrome de Sjögren | |
| – | Enfermedades inflamatorias intestinales | |
| + | Colitis ulcerosa | |
| + | Enfermedad de Crohn | |
| – | Crioglobulinemia mixta | |
| – | Púrpura hipergammaglobulinémica de Waldenström | |
| Asociada a neoplasias | ||
| – | Neoplasias hematológicas | |
| – | Neoplasias sólidas | |
| Idiopáticas o de etiología incierta | ||
Fuente: Carlson JA et al.88.
Cualquier afección vírica, bacteriana, parasitaria o fúngica puede causar una vasculitis cutánea. En su patogenia probablemente intervienen una combinación de varios mecanismos fisiopatológicos: la formación de inmunocomplejos (virus de la hepatitis B, C, inmunodeficiencia humana), el daño endotelial directo (citomegalovirus), la activación directa del sistema del complemento (Candida spp.) o la formación de autoanticuerpos20. Por su parte, las vasculitis paraneoplásicas, relacionadas fundamentalmente con las neoplasias hematológicas, pueden producirse por la invasión directa de la pared vascular, la formación de inmunocomplejos o la estimulación directa de la inmunidad celular por antígenos tumorales21.En distintas enfermedades de carácter inflamatorio y con origen autoinmune, como el lupus eritematoso sistémico22,23, la artritis reumatoide24, el síndrome de Sjögren25 o la enfermedad inflamatoria intestinal26, pueden producirse cuadros de vasculitis cutáneas.
Finalmente, existe un grupo de vasculitis cutáneas con relación al contacto con sustancias químicas (insecticidas, derivados del petróleo o fármacos de aplicación tópica27), vegetales o animales, así como asociadas a la ingesta de ciertos alimentos o sus aditivos28.
Púrpura de Schönlein-HenochTambién denominada púrpura anafilactoide o reumática, constituye el subtipo de vasculitis más frecuente en la infancia, con un pico de máxima incidencia a los 7 años. Afecta por igual a ambos sexos, pero en los adultos existe un ligero predominio masculino. Aunque en una proporción variable de los casos se produce tras una infección estreptocócica de las vías respiratorias superiores, en su etiopatogenia también se ha implicado a otras bacterias (Staphylococcus aureus, Campylobacter jejuni, Mycoplasma pneumoniae29), virus (virus de la hepatitis A, B, adenovirus, virus coxsackie, parvovirus B1930), parásitos (Toxocara canis31), fármacos, vacunas o, incluso, picaduras de insectos32. La IgA parece desempeñar un papel fundamental en la patogenia de esta entidad, tal y como demuestra la presencia de inmunocomplejos formados por esta inmunoglobulina en las paredes de los vasos dérmicos y en el mesangio glomerular. En concreto, parece que existe una alteración en la glucosilación de la IgA1 que determinaría su afinidad para formar inmunocomplejos y depositarse en estas áreas33.
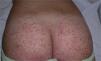
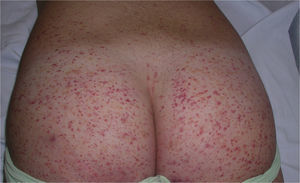
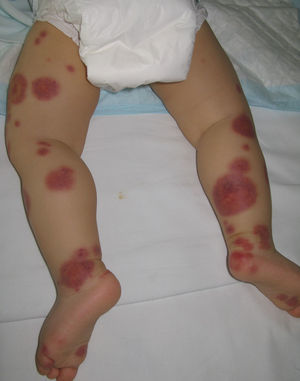
En la clínica se caracteriza por la presencia de manifestaciones cutáneas, gastrointestinales, articulares y renales. Al inicio, las lesiones cutáneas aparecen como máculas o pápulas de aspecto urticarial, que en su evolución se transforman en pápulas inflamatorias y purpúricas. Otras presentaciones cutáneas menos frecuentes incluyen en su espectro vesículas, ampollas y áreas de necrosis focal. Suelen distribuirse de forma simétrica en ambos miembros inferiores, incluyendo los glúteos (fig. 5), aunque pueden extenderse más allá del tronco alcanzado los miembros superiores. Hasta en el 75% de los pacientes existe compromiso gastrointestinal o musculoesquelético, que se manifiesta en forma de náuseas, vómitos, dolor abdominal, sangrado gastrointenstinal o artritis de grandes articulaciones como los tobillos y las rodillas34,35. No es infrecuente encontrar edema de los miembros inferiores. La afectación renal se presenta hasta en el 50% de los casos, la cual se expresa como hematuria, macro o microscópica, proteinuria, síndrome nefrótico o nefrítico. El 1-3% de los pacientes evoluciona hasta la insuficiencia renal terminal. Adicionalmente, algunos pacientes pueden asociar orquitis, intususcepción, pancreatitis, uveítis, alteraciones neurológicas o hemorragia pulmonar36.
Los hallazgos histopatológicos con tinciones convencionales demuestran la existencia de una vasculitis leucocitoclástica de los vasos de pequeño calibre de la dermis. Si la biopsia cutánea es reciente (menos de 48 horas), pueden apreciarse depósitos de IgA, fundamentalmente del subtipo IgA1, en las paredes vasculares.
Desde el punto de vista analítico no existen datos característicos o patognomónicos de la enfermedad, encontrándose habitualmente elevados los reactantes de fase aguda. De forma variable, en el 25-50% los casos existe un aumento policlonal de la IgA circulante.
El diagnóstico se basa en la correlación de los hallazgos clínicos e histopatológicos, mereciendo especial consideración los datos aportados por el estudio de inmunofluorescencia directa. No obstante, debe tenerse siempre en cuenta que el diagnóstico de púrpura de Schönlein-Henoch no es sinónimo de vasculitis IgA mediada.
Urticaria vasculitisSe caracteriza por la presencia de lesiones habonosas que persisten más allá de 24 horas. Inicialmente recibió el nombre de vasculitis urticariforme de Mac Duffie37 o vasculitis hipocomplementémica, aunque más tarde se describieron casos sin disminución de los niveles circulantes del complemento38. Las formas hipocomplementémicas se han relacionado en su etiopatogenia con la presencia de anticuerpos anti-C1q, hallazgo por el que algunos autores consideran que podrían incluirse dentro del espectro del lupus eritematoso sistémico39,40. Asimismo, su inicio se ha relacionado con otras conectivopatías (síndrome de Sjögren41), infecciones (hepatitis B, mononucleosis infecciosa), fármacos42, paraproteinemia IgM o IgA, enfermedad del suero o ciertas neoplasias43. Clínicamente se manifiesta con habones que, de forma característica, pueden contener focos purpúricos a lo largo de su evolución. Con frecuencia estas lesiones habonosas se acompañan de angioedema. Cuando existe hipocomplementemia el cuadro puede asociar sintomatología sistémica con afectación articular, ocular, pulmonar o digestiva. Clásicamente se asume que su estudio histopatológico resultaría compatible con el de una vasculitis leucocitoclástica de los vasos de pequeño calibre dérmicos, acompañada de un importante edema en la dermis superior. Sin embargo, algunos estudios señalan que existiría un predominio de neutrófilos en las lesiones pertenecientes a las formas hipocomplementémicas, mientras que en el resto se observaría una vasculitis de tipo linfocítico, acompañada de un número variable de eosinófilos44.
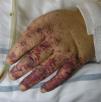
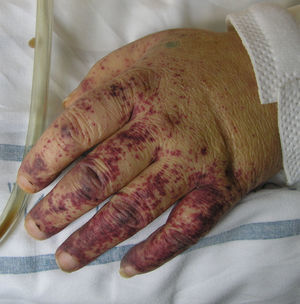
Eritema elevatum diutinumIncluido en el grupo de las dermatosis neutrofílicas, se caracteriza por la presencia de lesiones simétricas en el dorso de las manos o en las superficies extensoras de los miembros45. El depósito de inmunocomplejos circulantes actuaría como uno de los principales factores patogénicos implicados en su génesis46. Se han descrito casos en relación con infecciones (estreptococo beta-hemolítico del grupo A, VIH, VHB), enfermedades autoinmunes (lupus eritematoso sistémico, enfermedad inflamatoria intestinal, artritis reumatoide, policondritis recidivante), hemopatías (síndrome mielodisplásico, síndromes mieloproliferativos, mieloma múltiple, tricoleucemia) y algunas neoplasias sólidas47. En la clínica puede manifestarse como pápulas, placas o nódulos de coloración violácea, eritematosa o amarillenta. La afectación extracutánea resulta excepcional, aunque algunos pacientes refieren artralgias en las articulaciones subyacentes a las lesiones cutáneas. Los hallazgos histopatológicos variarán en función del momento en que se realice la biopsia. En las lesiones recientes existirá una vasculitis leucocitoclástica de los vasos dérmicos de pequeño calibre, acompañada de un número variable de neutrófilos con disposición perivascular. A medida que estas lesiones evolucionan, los neutrófilos ocuparán de forma difusa todo el espesor de la dermis, junto a los que podrán identificarse linfocitos, histiocitos y eosinófilos. Al igual que el granuloma facial, se considera una forma de vasculitis leucocitoclástica fibrosante crónica, por lo que en lesiones antiguas será posible encontrar un grado variable de fibrosis perivascular y dérmica48. La llamada colesterolosis extracelular, término anteriormente utilizado para designar al depósito de colesterol en los espacios extracelulares y en los histiocitos de las lesiones muy evolucionadas49, raramente se ve en la actualidad, como consecuencia de la introducción de la dapsona en el tratamiento de este cuadro.
Edema agudo hemorrágico del lactanteSinónimo de enfermedad de Finkelstein o síndrome de Seidlmayer, representa una entidad de curso benigno restringida a la edad pediátrica. Habitualmente se desarrolla en el transcurso o tras la resolución de una infección respiratoria o urinaria, tras administrar ciertas vacunas o en el contexto del tratamiento con algunos fármacos. Al igual que en otras vasculitis inmunomediadas, es probable que se formen inmunocomplejos en respuesta a un estímulo antigénico infeccioso o farmacológico50. El cuadro se caracteriza por la aparición abrupta de placas numulares o en escarapela de tonalidad eritematopurpúrica, de aspecto contusiforme, localizadas en la región facial o en áreas distales de los miembros (fig. 6). Las lesiones pueden transformarse en áreas vesiculoampollosas o necróticas. Casi nunca existe afectación extracutánea. Es infrecuente encontrarlo en edades superiores a los 2 años. En el estudio histopatológico se observa una vasculitis leucocitoclástica de pequeño vaso, asociada a edema en la dermis. Hasta en un tercio de los casos puede objetivarse el depósito de IgA en las paredes vasculares, motivo por el que algunos autores consideran que podría tratarse de un subtipo de púrpura de Schönlein-Henoch51. Se trata de una entidad benigna que habitualmente no requiere tratamiento, aunque en su abordaje inicial resulta fundamental descartar procesos como el eritema exudativo multiforme, la enfermedad de Kawasaki, la meningococemia, el síndrome de Sweet o, incluso, el maltrato infantil.
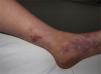
Vasculitis crioglobulinémicaSe denomina así a la vasculitis de pequeño y mediano vaso causada por el depósito en las paredes vasculares de inmunocomplejos circulantes, formados por crioglobulinas52. Estas son inmunoglobulinas que precipitan a temperatura menor de 37°C y solubilizan de nuevo al recuperar una temperatura superior a esta. En función de la composición inmunoquímica de las crioglobulinas se distinguen dos tipos de crioglobulinemias: la forma monoclonal y la forma mixta. La primera se asocia a la presencia de un componente monoclonal IgG o IgM sin actividad factor reumatoide, conocidas como crioglobulinas tipo I. En la mayor parte de los pacientes existe un trastorno hematológico subyacente (mieloma múltiple, macroglobulinemia de Waldenström o leucemia linfática crónica), manifestándose en la piel como lesiones purpúricas, cianosis acral, úlceras o livedo reticular. En la microscopía se identifican trombos eosinofílicos, compuestos por un material PAS positivo, que puede o no acompañarse de un infiltrado inflamatorio linfocítico perivascular. En la variante mixta pueden encontrarse crioglobulinas formadas por un componente IgG policlonal y otro monoclonal IgM con actividad factor reumatoide (crioglobulinas tipo II) o varios constituyentes policlonales, IgG policlonal e IgM policlonal con actividad factor reumatoide (crioglobulinas tipo III)53. Las formas mixtas se asocian con gran frecuencia a la infección por el virus de la hepatitis C, enfermedades autoinmunes, como el síndrome de Sjögren, o procesos linfoproliferativos. Sin embargo, en un porcentaje de pacientes no despreciable no es posible identificar un agente causal, denominándose entonces «crioglobulinemia mixta esencial». El cuadro clínico se caracteriza por la presencia de lesiones purpúricas de predominio acral (fig. 7), que pueden asociarse a úlceras o áreas necróticas. La mayor parte de los pacientes refiere empeoramiento clínico con la exposición al frío. En el examen anatomopatológico se observa la existencia de una vasculitis leucocitoclástica de los vasos dérmicos e hipodérmicos de pequeño y mediano calibre. La presencia de trombos hialinos intravasculares representa un hallazgo infrecuente, que suele objetivarse junto a las áreas ulceradas. El estudio por inmunofluorescencia directa pone de manifiesto la existencia de depósitos de inmunoglobulinas y C3 en las paredes vasculares. Otros órganos y tejidos frecuentemente afectados son el riñón (glomerulonefritis membranoproliferativa), el sistema nervioso periférico, las articulaciones y, en menor medida, el pulmón54.
Desde el punto de vista analítico la determinación sérica de las crioglobulinas circulantes puede resultar falsamente negativa, debido a la influencia de la temperatura ambiental en su solubilidad y a su posible descenso durante el período intercrítico. Debe tenerse en cuenta que la presencia de crioglobulinas circulantes no se asocia de manera constante al desarrollo de la clínica, reservándose la denominación «síndrome crioglobulinémico» para aquellos sujetos que se encuentren sintomáticos. Un alto porcentaje de pacientes presenta concentraciones plasmáticas elevadas de factor reumatoide y un descenso en los niveles de la fracción C4 del complemento55.
El pronóstico de estos pacientes depende fundamentalmente de la extensión de la afectación renal, la presencia de un trastorno neoplásico acompañante o la progresión —especialmente en las formas mixtas relacionadas con la infección por el VHC— a un proceso linfoproliferativo56.
Vasculitis sépticasSe trata de un subgrupo de vasculitis agudas asociadas a un estado de septicemia. En los casos de meningococemia aguda se observan lesiones purpúricas, de contornos irregulares, que muestran un infiltrado inflamatorio neutrofílico perivascular e intersticial, acompañado de imágenes focales de leucocitoclastia, necrosis fibrinoide y oclusión de las luces vasculares57. La tinción de Gram pone de manifiesto la existencia de abundantes diplococos gramnegativos en las células endoteliales y leucocitos polimorfonucleares. Los hemocultivos confirman el diagnóstico, aunque el abordaje antibiótico debe ser precoz. Las formas de meningococemia y gonococemia crónicas se caracterizan por la tríada clínica de fiebre intermitente, artralgias y lesiones cutáneas vesiculopustulosas o purpúricas. La histopatología difiere sutilmente de la encontrada en las formas clásicas de vasculitis por hipersensibilidad: afectación de las arteriolas, predominio de los neutrófilos y formación de pústulas subepidérmicas e intraepidérmicas. Con la tinción de Gram no se visualizan organismos, aunque sí se han detectado en ciertos casos mediante técnicas moleculares58. Los hemocultivos son positivos en la fase febril. El tratamiento con corticoides sistémicos puede complicar gravemente el cuadro59.
Granulomatosis de WegenerEntidad infrecuente caracterizada por el compromiso de las vías respiratorias superiores, inferiores y el glomérulo renal, secundario a la presencia de una vasculitis sistémica acompañada de focos inflamatorios granulomatosos y necróticos. Afecta a un amplio rango de edades, aunque suele iniciarse entre los 40 y los 50 años. Su patogénesis no se conoce con exactitud, pero la presencia de una respuesta inmune amplificada ante un estímulo antigénico concreto podría representar uno de los mecanismos implicados. Uno de los estímulos propuestos para desencadenar esta ruptura en la tolerancia inmunológica sería la infección por Staphylococcus aureus. En su génesis no solo se hallan involucrados los c-ANCA, sino que cada vez con más frecuencia se reconoce el rol desempeñado por los linfocitos T60. Inicialmente los pacientes suelen presentar sintomatología relacionada con el tracto respiratorio superior (rinitis, sinusitis, ulceraciones del tabique nasal) o referir clínica respiratoria inespecífica como disnea o tos seca persistente. No obstante, hasta el 10% de los pacientes puede comenzar con hemoptisis o hemorragias alveolares. La afectación renal es frecuente y puede constituir uno de los determinantes de peor pronóstico en caso de desarrollarse cambios irreversibles glomerulares. Los hallazgos cutáneos son inconstantes, encontrándose como forma de presentación en menos del 10% de los pacientes. La lesión cutánea habitual es la púrpura localizada en los miembros inferiores, aunque las lesiones papulonodulares con centro necrótico y distribución simétrica en el tronco y los miembros presentan una mayor especificidad. Las ulceraciones mucocutáneas constituyen el segundo hallazgo exploratorio más frecuente, encontrándose de forma característica en la mucosa oral una gingivitis hiperplásica o «en fresa»61. En los análisis destaca la elevación del recuento leucocitario, de los valores de la proteína C activada y de la velocidad de sedimentación globular. En aproximadamente el 80% de los pacientes existen c-ANCA, con especificidad para el antígeno PR-3, existiendo controversia sobre el valor de sus títulos como predictor del riesgo de recidivas postratamiento62,63. El estudio histopatológico se caracteriza por la presencia de una tríada constituida por la existencia de áreas necróticas, vasculitis e inflamación granulomatosa. En las biopsias de piel lesional lo más frecuente es encontrar una vasculitis neutrofílica de pequeño o mediano vaso. En una escasa proporción de casos existe un infiltrado inflamatorio granulomatoso compuesto por macrófagos, neutrófilos y células gigantes multinucleadas que rodean áreas necróticas. En algunos estudios la presencia de vasculitis cutánea se correlaciona con una mayor actividad de la enfermedad y con su progresión hacia la afectación renal64. El curso evolutivo de la enfermedad está marcado por la existencia de recidivas, que se producen hasta en la mitad de los pacientes.
Poliangeítis microscópicaInicialmente considerada como un subtipo de panarteritis nodosa, en la actualidad se describe como una entidad independiente. Se trata de una vasculitis que afecta a vasos de pequeño y mediano calibre con afectación sistémica. Los principales órganos comprometidos son el riñón (79-90%) y el pulmón (25-50%), en forma de glomerulonefritis rápidamente progresiva y hemorragias pulmonares65,66. El cuadro suele verse precedido por un período prodrómico en el que predominan las mialgias, las artralgias, la fiebre y la pérdida de peso. En ocasiones, pueden evidenciarse signos sugestivos de neuropatía periférica o síntomas gastrointestinales. Desde el punto de vista cutáneo las lesiones son indistinguibles de las que se presentan en las vasculitis leucocitoclásticas cutáneas de pequeño vaso. Hasta en el 70% de los pacientes existen p-ANCA. En la histopatología, en las muestras procedentes de las lesiones cutáneas purpúricas, se demuestra la existencia de una vasculitis leucocitoclástica de pequeño vaso, en ausencia de depósitos inmunes en el estudio por inmunofluorescencia directa67. En su etiopatogenia se han implicado distintos agentes víricos (VHB, VHC) aunque, al igual que en otros tipos de vasculitis, el mecanismo de producción de la enfermedad no se conoce con exactitud.
Síndrome de Churg-StraussTambién conocido como granulomatosis alérgica, representa un tipo de vasculitis sistémica caracterizada por la asociación de asma persistente grave y eosinofilia en sangre periférica. Independientemente del sexo, predomina en edades comprendidas entre los 30 y los 50 años. Los síntomas respiratorios abarcan un espectro que se extiende desde la rinitis alérgica, la poliposis nasal o la pansinusitis, hasta la presencia de asma corticodependiente desde su inicio en la edad adulta. Habitualmente existe una escasa respuesta a los tratamientos convencionales antiasmáticos. Como factores desencadenantes se identifican ciertas vacunas, procesos de desensibilización o la discontinuación brusca del tratamiento corticoideo. Sin embargo, el papel desempeñado por los fármacos antagonistas de los receptores de los leucotrienos o los anticuerpos monoclonales anti-IgE, como el omalizumab, continúa suscitando opiniones diversas68,69. Desde el punto de vista clínico, en la evolución de esta entidad pueden distinguirse varias etapas. En la primera se desarrollan los síntomas respiratorios y la eosinofilia periférica. A continuación, sobreviene la afectación pulmonar, cardíaca, neurológica, gastrointestinal o musculoesquelética. El compromiso cutáneo puede producirse desde el inicio del cuadro o en su evolución posterior en aproximadamente el 50% de los pacientes. La existencia de máculas o pápulas purpúricas, localizadas en los miembros inferiores, constituye la forma de presentación más frecuente. Los nódulos con superficie cutánea indemne (o ulcerada en su evolución), distribuidos por el cuero cabelludo y las áreas distales de los miembros, representan otro de los hallazgos que con más frecuencia se observan en estos pacientes. Sin embargo, también se han descrito casos en los que predomina la livedo racemosa, las lesiones urticariales o las vesiculopústulas70. El estudio anatomopatológico puede mostrar, aunque con frecuencia no de forma simultánea, tres datos característicos: vasculitis leucocitoclástica de los vasos de pequeño y mediano calibre, eosinofilia tisular y un infiltrado inflamatorio granulomatoso extravascular formado por un importante número de eosinófilos y sus productos de degradación («granulomas rojos»). En la analítica sanguínea se observa intensa eosinofilia que se acompaña de un aumento en la IgE durante los brotes. Hasta en la mitad de los pacientes es posible objetivar la existencia de p-ANCA, mientras que los c-ANCA solo resultarán positivos en el 10-20% de los pacientes. Según un estudio llevado a cabo por Sable-Fourtassou R et al., la presencia de ANCA se correlaciona con una mayor probabilidad para encontrar datos de vasculitis en el estudio histopatológico71.
Clásicamente, la vasculitis de Churg-Strauss se describía como una entidad de mal pronóstico, con una supervivencia global inferior a un año, siendo la principal causa de muerte el fallo cardíaco. Actualmente, gracias a la instauración precoz de tratamiento corticoideo e inmunosupresor, pueden alcanzarse remisiones prolongadas en gran parte de los casos72.
Poliarteritis nudosaSe trata de una vasculitis que afecta a las arterias de pequeño y mediano calibre, implicando habitualmente compromiso multiorgánico. Existe una mayor incidencia durante las edades comprendidas entre los 40 y los 60 años, relacionándose con la infección por el virus de la hepatitis B73, C, VIH, parvovirus B1974 o vacunaciones. La semiología clínica varía en función del órgano o tejido afecto, demostrando un especial tropismo por el sistema nervioso periférico (polineutritis), el aparato digestivo (hemorragias digestivas) o la vasculatura renal (hipertensión arterial e infartos renales). En la piel pueden encontrarse nódulos con superficie purpúrica y tendencia a la ulceración, así como livedo reticular o lesiones necróticas, que pueden suponer el inicio de la enfermedad (fig. 8). Las lesiones cutáneas muestran una histopatología variable, como consecuencia del daño segmentario de la pared vascular. Normalmente se afectan los vasos de pequeño calibre de la dermis y las arteriolas situadas en el tejido celular subcutáneo. En los estadios iniciales predomina el infiltrado inflamatorio neutrofílico, que suele extenderse al tejido celular subcutáneo, confiriendo un aspecto microscópico de paniculitis lobulillar. Posteriormente estas células son reemplazadas por un número variable de linfocitos. La obliteración progresiva de las luces vasculares suele implicar la aparición de microaneurismas. Desde el punto de vista analítico, destaca la presencia de un síndrome inflamatorio con velocidad de sedimentación globular elevada y eosinofilia ocasional. Los ANCA se detectan en una baja proporción de pacientes (10-20%) y normalmente presentan un patrón perinuclear.
Existe una forma localizada de poliarteritis nudosa que afecta de forma predominante a la piel. Es la llamada poliarteritis nudosa cutánea. Tiene un carácter crónico y recidivante, y el cuadro se caracteriza por la presencia de lesiones nodulares y livedo racemosa, similares a los hallazgos descritos en la forma clásica, de predominio en el tercio distal de los miembros inferiores. Los brotes pueden acompañarse de mialgias, astenia, edemas o fiebre, afectando incluso de forma extensa al resto de los miembros.
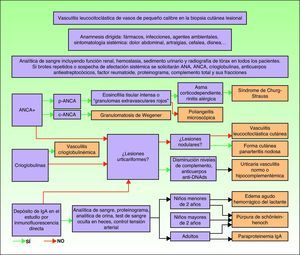
DiagnósticoUna vez confirmado su diagnóstico mediante los hallazgos de la biopsia cutánea, debe valorarse la extensión de la enfermedad. El primer paso es realizar una correcta anamnesis y exploración física completa, prestando especial atención a las articulaciones, al aparato respiratorio, al digestivo, al sistema nervioso y al corazón. Para ello debe realizarse una analítica sanguínea, un sedimento urinario, un electrocardiograma y una radiografía de tórax. La orientación etiológica dependerá tanto de la correlación semiológica como de los hallazgos de laboratorio sugestivos o específicos de algunas entidades. Por tanto, en los casos recurrentes o en los que sugieran la existencia de afectación sistémica, el estudio se ampliará solicitando la determinación en sangre de anticuerpos antinucleares, ANCA, factor reumatoide, crioglobulinas, complemento total y sus fracciones, anticuerpos antiestreptocócicos e inmunoelectroforesis de las proteínas. En casos seleccionados puede ser necesaria la realización de investigaciones dirigidas a determinar el compromiso de un órgano o tejido concreto (por ejemplo biopsia renal, neural, aspirado de médula ósea o arteriografías selectivas)75–77 (fig. 9).
Diagnóstico diferencialDentro de las posibles causas productoras de púrpura cutáneo-mucosa debe valorarse la existencia de procesos no vasculíticos. La fragilidad capilar puede observarse en una amplia proporción de pacientes ancianos, corticodependientes, en la avitaminosis C78 o en la amiloidosis sistémica primaria79. Las dermatosis purpúricas pigmentadas son entidades de curso benigno, de etiología habitualmente desconocida (púrpura de Schamberg, liquen aureus, púrpura eczematide-like, púrpura anular telangiectásica o enfermedad de Majocchi) o asociadas a insuficiencia venosa crónica (dermatitis ocre de Favre y Chaix, dermatitis purpúrica y liquenoide de Gougerot-Blum)80. Asimismo, en el diagnóstico diferencial de las vasculitis debe considerarse la existencia de púrpura con un origen primariamente trombótico. Es el caso del síndrome antifosfolipídico, la coagulación intravascular diseminada o el déficit de proteínas C y S. Sin embargo, en pacientes sometidos a intervenciones endovasculares, politraumatizados o portadores de cardiopatías embolígenas debe sospecharse la existencia de un proceso embolígeno subyacente81,82. Otros cuadros que por diversos mecanismos conducen a la obliteración de las luces vasculares simulando vasculitis son la calcifilaxia, la enfermedad por émbolos de colesterol, la hiperoxaluria o la hiperhomocisteinemia, entre otros.
TratamientoEn primer lugar, si existen factores predisponentes o precipitantes conocidos el tratamiento debe dirigirse a la eliminación de las posibles causas subyacentes.
Como tratamiento sintomático de las lesiones cutáneas se recomienda reposo absoluto con elevación de los miembros inferiores, antiinflamatorios no esteroideos —siempre que estos no sean los responsables del cuadro— o antihistamínicos. Se han obtenido también buenos resultados con la colchicina83 a la dosis de 0,5mg/ 8h y/ o dapsona84 a la dosis de 50-200mg/ 24h.
En las formas cutáneas graves, en las que se documenten extensas áreas necróticas o ulceradas, resulta necesario el uso de glucocorticoides sistémicos, como la prednisona a dosis de 0,5-1mg/ kg/ día, reduciendo progresivamente la dosis en un intervalo de 4-6 semanas. Si el paciente experimenta recidivas clínicas durante este descenso de dosis pueden prescribirse agentes inmunosupresores ahorradores de glucocorticoides como la azatioprina (50-100mg/ día) o el metotrexato (10-25mg/ semana)85.
Si existe compromiso sistémico el tratamiento inicial debe incluir el uso de glucocorticoides a dosis altas y/ o ciclofosfamida, en pulsos intravenosos o por vía oral, hasta alcanzar la remisión del cuadro. La posología se individualizará en función del cuadro, la situación renal y las contraindicaciones específicas de cada paciente86. Tras alcanzar la remisión, pueden instaurarse pautas de mantenimiento con azatioprina, micofenolato de mofetilo o metotrexato. El uso de inmunoglobulinas intravenosas o la plasmaféresis resulta útil en casos seleccionados. Fármacos como el infliximab o el rituximab han mostrado resultados prometedores en el tratamiento de las vasculitis sistémicas refractarias al tratamiento convencional87.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.