Introducción
Los fármacos biológicos han supuesto un importante avance en el tratamiento de diversos procesos cutáneos como la psoriasis.
En los últimos años numerosos fármacos de este tipo han ido apareciendo en la farmacopea dermatológica. Los medicamentos biológicos se definen como proteínas derivadas de seres vivos (ya sean animales, microorganismos o humanos) que se emplean en la prevención, tratamiento o curación de diferentes enfermedades.
En el campo de la Dermatología, la psoriasis es la única entidad para la que varios de estos fármacos están autorizados. Este grupo de medicamentos actúa en diferentes pasos inmunológicos y disponen de un buen perfil de eficacia y seguridad. En la psoriasis se emplean dos grupos diferentes de fármacos biológicos; por un lado los antagonistas del factor de crecimiento tumoral (TNF) y por otro lado los inhibidores de los linfocitos T o de las células presentadoras de antígenos. Sin embargo, y a pesar de no tener una indicación oficial, estos fármacos se han utilizado en numerosas dermatosis en función de su mecanismo fisiopatológico, habiéndose publicado diferentes revisiones de estos usos con anterioridad1-7. El creciente empleo de estos fármacos en la actualidad aumenta el número de posibles indicaciones de numerosas dermatosis que revisamos a continuación.
Infliximab
Infliximab es un anticuerpo monoclonal quimérico IgG1, cuya fracción constante es de origen humano, mientras que las fracciones variables son de origen murino.
Se une y bloquea tanto a la fracción soluble como a la unida a membrana del TNFα y es capaz de activar la lisis de las células que expresan TNFα transmembrana por mecanismos de citotoxicidad dependientes de complemento y de anticuerpos8,9.
Los usos actualmente aceptados por la Emea son: enfermedad de Crohn, colitis ulcerosa, artritis reumatoide, espondilitis anquilosante, artritis psoriásica y psoriasis cutánea moderada-severa en adultos en los que otros fármacos sistémicos como ciclosporina, metotrexato (MTX) o PUVA están contraindicados o han sido ineficaces10 (tabla 1).
Posología
Para la mayoría de las enfermedades en las que se ha utilizado se han administrado dosis de 3 o 5 mg/kg en las semanas 0, 2 y 6 y posteriormente cada 8 semanas1.
Efectos secundarios
Es un fármaco bien tolerado, la mayoría de los efectos secundarios descritos corresponden a reacciones adversas postransfusionales, que ocurren en aproximadamente el 10 % de los pacientes y que no suelen ser graves11,12.
Dado que parte de la molécula de infliximab es de origen murino, se ha descrito el desarrollo de anticuerpos neutralizantes, cuya incidencia varía según los estudios entre un 15 %-50 %13-16. Cuando aparecen se asocian a un mayor riesgo de efectos adversos y a un aumento en la dosis necesaria para el control de la enfermedad13,16.
La dosis de infliximab no guarda relación con el desarrollo de anticuerpos, aunque sí que se ha descrito una asociación entre bajos niveles en plasma de infliximab y la presencia de anticuerpos16,18.
El uso de fármacos inmunosupresores asociados, como ciclosporina o MTX, ha demostrado reducir la tasa de anticuerpos neutralizantes de infliximab18-20.
Respecto al perfil de seguridad del infliximab, al igual que del resto de los fármacos anti-TNF, se ha descrito una mayor tasa de tuberculosis entre los pacientes tratados con estos fármacos, que además puede presentarse como enfermedad diseminada o atípica21. Esto se debe al importante papel del TNF en la formación del granuloma como mecanismo de respuesta ante la tuberculosis22.
Además se han descrito casos de desarrollo de linfomas23 y de enfermedades desmielinizantes24-27 durante el tratamiento con fármacos anti-TNF.
Infliximab en dermatosis no psoriasis
Sarcoidosis
Los estudios in vitro e in vivo han demostrado la importancia del TNFα en la formación de granulomas22,28-30, pudiéndose comprobar un incremento de los niveles de TNFα en el líquido alveolar de los pacientes con sarcoidosis31,32, siendo además sus niveles predictores de una enfermedad más grave y resistente al tratamiento33.
Se han descrito múltiples series de casos evaluando la eficacia y seguridad de este fármaco en el tratamiento de la sarcoidosis sistémica. La mayoría de los casos publicados en el tratamiento de la sarcoidosis muestran que se trata de un fármaco que mejora los síntomas, con un perfil de eficacia y seguridad superponible al de otras patologías, concluyendo que es un fármaco eficaz y seguro34-43.
Sin embargo, no existen grandes series ni estudios controlados con placebo, por lo que este fármaco debe utilizarse todavía con cautela en los casos de sarcoidosis, especialmente ante la posibilidad de desarrollar una tuberculosis, cuyo diagnóstico puede suponer un reto si se presenta en un paciente con sarcoidosis37,44.
Respecto a la mejoría de los síntomas cutáneos de la sarcoidosis los primeros casos se publicaron a partir del año 2001, y desde entonces se han descrito varios pacientes cuya clínica cutánea mejoró tras el tratamiento con este fármaco45-55. Recientemente se ha publicado una serie de 12 pacientes con sarcoidosis refractaria a múltiples tratamientos, 5 de ellos con afectación cutánea extensa. Después del tratamiento con infliximab a dosis de 3 mg/kg en las semanas 2, 4, 6, 10 y 14 se produjo una clara mejoría de los síntomas cutáneos y sistémicos, pudiéndose en la mayoría suspender o reducir la corticoterapia. Sin embargo, una vez que el tratamiento se suspende, las lesiones reaparecen, siendo necesarios otros ciclos de medicación56.
Otra serie de 10 pacientes, 6 de ellos cuya principal manifestación era la afectación cutánea, fueron tratados con infliximab a dosis de 5 mg/kg en las semanas 0, 2 y 6 y cada 8 semanas. La mejoría de los síntomas cutáneos en todos ellos fue rápida e importante, además de apreciarse una evolución favorable de la sintomatología sistémica. El fármaco fue bien tolerado, excepto en un paciente que desarrolló una reacción de hipersensibilidad, que se asume que fue debida al desarrollo de anticuerpos frente a infliximab, y que fue el único en el que el tratamiento no se asoció a tratamiento inmunosupresor57.
Necrobiosis lipoídica
La inhibición de la formación del granuloma por fármacos que antagonizan la acción del TNFα puede tener un efecto beneficioso.
Sólo hemos encontrado un caso descrito en la literatura en el que se haya tratado esta enfermedad con infliximab. El caso corresponde a un paciente con una placa ulcerada de necrobiosis lipoídica, refractaria a múltiples tratamientos, que tras el tratamiento con dos dosis de infliximab (5 mg/kg) experimentó una gran mejoría tras las infusiones del fármaco, respuesta que se mantuvo a pesar de tener que suspenderse el tratamiento debido al diagnóstico de una tuberculosis miliar58.
Granuloma anular
El granuloma anular es otra enfermedad granulomatosa, de etiología desconocida y con un curso clínico impredecible. En ocasiones puede ser refractaria a los tratamientos clásicos y constituir un reto terapéutico. Existe un caso de una paciente con un granuloma anular diseminado, de 4 años de evolución, refractario a varios tratamientos (corticoides tópicos, retinoides tópicos, PUVA asociada a dapsona y clofazima), realizando tratamiento con corticoides sistémicos no se consideró oportuno debido a una diabetes mal controlada y que tras tratamiento con infliximab a dosis de 5 mg/kg en las semanas 0, 2 y 6 y cada 4 semanas durante 4 meses, alcanzó la remisión completa de las lesiones en la sexta semana, apreciándose mejoría desde la segunda, y manteniéndose asintomática un año después de suspender el tratamiento59.
Hidradenitis supurativa y acné
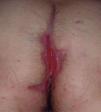
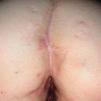
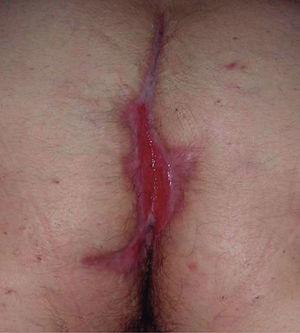
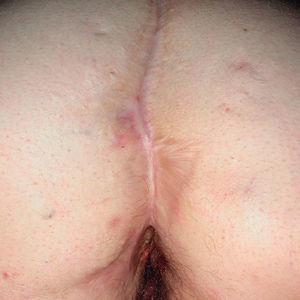
Existen algunas series de casos y casos aislados de tratamiento de la hidradenitis supurativa (HS) con infliximab con resultados muy dispares, desde la curación total hasta la falta de respuesta. Además los resultados son difíciles de interpretar, ya que en muchos de los casos descritos la HS se asocia con enfermedad inflamatoria intestinal (EII), por lo que no podemos saber si el efecto beneficioso en estos casos podría deberse a la mejoría de la inflamación crónica intestinal (figs. 1 y 2).
Figura 1. Hidradenitis; situación basal.
Figura 2. Hidradenitis tras 5 infusiones de infliximab intravenoso; lesiones cicatriciales.
La serie más extensa y la más reciente corresponde a un estudio retrospectivo de 7 pacientes con HS tratados con infliximab, obteniéndose una respuesta inicial en 5 de ellos tras tres infusiones (5 mg/kg). Sólo en dos de ellos la respuesta se mantuvo tras la terapia de inducción, teniéndose que suspender el tratamiento en uno de estos dos pacientes debido a la aparición de un efecto secundario y en el otro debido a falta de respuesta tras 8 infusiones. Los pobres resultados de esta serie pueden ser debidos a que estos pacientes presentaban una HS crónica y muy avanzada, y a que ninguno de ellos presentaba una enfermedad intestinal asociada cuya mejoría pudiera explicar en parte la respuesta de la HS. Además tres de estos pacientes presentaron un efecto secundario grave relacionado con infliximab60.
Usmani N et al61 publican una serie de 4 pacientes con HS refractaria a múltiples tratamientos que son tratados con infliximab obteniéndose mejoría en dos de ellos (presentando uno de ellos una enfermedad de Crohn asociada) y falta de respuesta en los otros dos. En ambos casos el tratamiento se tuvo que suspender debido a efectos secundarios relacionados con el fármaco (reacción lúpica y reacción de hipersensibilidad tras la infusión).
La serie que obtiene unos resultados más prometedores corresponde a un estudio retrospectivo de 5 pacientes con HS refractaria, que tras el tratamiento con infliximab (5 mg/kg) en una única infusión en el caso de dos de los pacientes, y tras dos infusiones en el caso de los tres pacientes restantes, se obtuvo en todos ellos una respuesta positiva entre moderada-excelente, sin asociar ninguno de ellos una EII62.
Thielen et al63 publican un caso de HS tratada con infliximab en el que se obtiene una importante, rápida y duradera mejoría en un paciente con una enfermedad muy desfigurante y sin EII asociada. El paciente fue tratado con infliximab a dosis de 5 mg/kg, con un total de 13 infusiones, asociado a MTX, alcanzando la remisión total de la enfermedad.
Además de estas series existe un total de 6 casos publicados de HS tratadas con infliximab64-69, obteniéndose en todos ellos una remisión completa y estando todos ellos asociados a una enfermedad intestinal inflamatoria crónica, enfermedad de Crohn64-66,69 o colitis ulcerosa67.
Sólo existe un caso descrito de tratamiento de acné conglobata con infliximab. Se trata de un paciente con artritis reumatoide y acné noduloquístico, que había respondido parcialmente a isotrenitoína oral. Debido al desarrollo de hipertrigliceridemia e hipercolesterolemia se decide tratamiento con infliximab a dosis de 3 mg/kg, pudiéndose apreciar clara mejoría, manteniéndose estable durante el tiempo de seguimiento (6 meses con infusiones cada 8 semanas) y permitiendo suspender progresivamente la isotrenitoína70.
Síndrome de SAPHO
Se trata de un síndrome que asocia sinovitis, acné, pustulosis, hiperostosis y osteítis, de etiología desconocida.
Olivieri en el año 2002 describió los dos primeros casos de síndrome de SAPHO tratados con infliximab71. Ambos pacientes obtuvieron una buena respuesta tanto de los síntomas como de los parámetros analíticos tras las tres primeras dosis del fármaco, presentando una recaída tras la suspensión de éste y finalmente una respuesta completa y mantenida durante un periodo de seguimiento de 18 meses tras una cuarta infusión, sin presentar ninguno de los dos pacientes efectos secundarios.
Posteriormente se han descrito un total de 6 pacientes72-74 en los que el tratamiento con este fármaco resultó eficaz, con un tiempo de seguimiento entre 10 y 21 meses, presentando dos de ellos una recaída de la enfermedad tras la suspensión del fármaco74. Uno de estos pacientes que respondió al tratamiento con infliximab se trataba un niño de 10 años de edad, con una efermedad de larga evolución y resistente al tratamiento, en el que las opciones terapéuticas eran limitadas debido a su edad72.
Pioderma gangrenoso
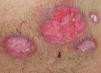
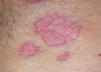
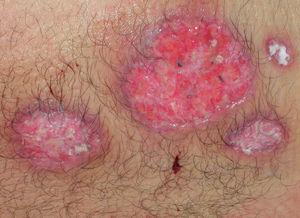
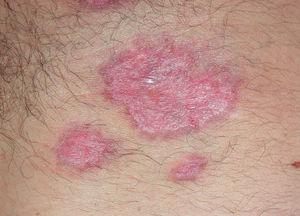
El pioderma gangrenoso (PG) es una dermatosis neutrofílica que se asocia a EII en un 1-5 % de los casos75 y cuya primera línea de tratamiento la constituyen los corticoides sistémicos y otros fármacos inmunosupresores (figs. 3 y 4).
Figura 3. Pioderma gangrenoso en un paciente con colitis ulcerosa.
Figura 4. Pioderma gangrenoso tras 6 semanas de iniciar el tratamiento con infliximab intravenoso; puede apreciarse que las lesiones han cicatrizado.
El tratamiento de la EII con fármacos anti-TNFα ha supuesto un gran avance y ha abierto nuevas opciones terapéuticas en el caso de las manifestaciones extracutáneas, como el PG.
La serie más extensa de pacientes con PG tratados con infliximab se trata de un estudio retrospectivo realizado sobre 13 pacientes que asociaban EII. De total de pacientes estudiados tres alcanzaron una respuesta completa tras la terapia de inducción (tres infusiones) y se mantuvieron asintomáticos durante el tiempo de seguimiento, sin requerir más tratamiento. Los otros 10 pacientes respondieron a la terapia de inducción, pero requirieron infusiones periódicas del fármaco cada 4-12 semanas. Todos los pacientes que estaban en tratamiento con corticoesteroides pudieron prescindir de los mismos76.
Otro estudio que también obtiene buenos resultados se llevó a cabo en 8 pacientes con PG y enfermedad de Crohn tratados con infliximab; respondiendo todos ellos tras uno a 4 meses de tratamiento con el fármaco. Tres de los pacientes alcanzaron una curación total de las lesiones, sin requerir más tratamiento, otros tres alcanzaron una respuesta completa, pero requirieron dosis de mantenimiento y dos de ellos sólo alcanzaron respuestas parciales77.
Rispo A78 publica un trabajo en 15 pacientes con enfermedad de Crohn tratados con infliximab (5 mg/kg) en el que estudia la respuesta de las manifestaciones extraintestinales de la enfermedad. A la décima semana todos los pacientes mostraron mejoría de la clínica extradigestiva. Cuatro de los 15 pacientes presentaban síntomas cutáneos y sólo uno PG, respondiendo este último de forma rápida y alcanzando la curación78.
Kaufman et al79 llevaron a cabo un trabajo prospectivo para el estudio de la afectación extracutánea de los pacientes con EII tratados con una única dosis de infliximab 5 mg/kg. De los 23 pacientes 4 asociaban PG y en todos ellos se produjo una importante y rápida respuesta tras la infusión (con curación completa en uno de ellos).
Aparte de estas series, se han publicado 38 pacientes con PG tratados con infliximab, la mayoría de ellos en pequeñas series de casos o casos individuales80-99, obteniendo una mejoría tras el tratamiento.
Además se han descrito casos en los que el tratamiento con infliximab fue satisfactorio en formas complicadas o peculiares de PG, como formas ulceradas e infectadas100, asociadas al síndrome de PAPA101 o PG vegetante86.
Se ha descrito un caso de PG idiopático y sistémico, con infiltrados neutrofílicos en psoas y en bazo, refractario a múltiples tratamientos y que respondió a infliximab (5 mg/kg) de forma espectacular, pero que tras la cuarta infusión (a las 16 semanas de la primera) el paciente desarrolla una reacción anafilactoide y se hace refractario, por lo que se inicia tratamiento con etanercept (75 mg/semana) sin éxito, hasta alcanzar la resolución del cuadro tras tratamiento con adalimumab (40 mg cada dos semanas)102.
Infliximab ha demostrado ser un fármaco eficaz y seguro para el tratamiento del PG, tanto de las formas asociadas a EII como de las que no lo están, y actualmente constituye una de las primeras líneas en el tratamiento del PG, especialmente en los casos asociados a EII.
Síndrome de Sweet
Hasta la actualidad sólo se han descrito 5 casos de Síndrome de Sweet (SS) tratados con infliximab, respondiendo adecuadamente 4 de los 5 y sólo de forma temporal e inicial uno de ellos.
Se han descrito dos casos de Sweet asociados a eritema nudoso tratados con infliximab, en los que se obtuvo una buena respuesta a las dosis y pautas habituales utilizadas con este fármaco103,104.
También se han descrito dos pacientes con síndrome de Sweet asociado a enfermedad de Crohn, y uno de ellos asociado además a enfermedad de Sjögren, que respondieron a infliximab con resolución total de las lesiones105.
A pesar de estos buenos resultados también se ha descrito un caso en el que el resultado fue más decepcionante. En esta ocasión se trataba de un paciente con una policondritis de larga evolución que posteriormente desarrolló un SS mientras estaba siendo tratado con glucocorticodes, y que tras tratamiento con infliximab (3 mg/kg) a pesar de una buena respuesta inicial, presentó una recurrencia a los pocos días, y tras la segunda infusión el paciente desarrolló una septicemia y murió106.
Pustulosis subcorneal
Se han descrito únicamente dos casos de esta enfermedad tratados con infliximab. El primero se trata de una mujer con una enfermedad refractaria a múltiples tratamientos (glucocorticoides, AZA, retinoides, fototerapia, colchicina y sulfadiacina) y que no toleró la dapsona. Esta paciente pudo ser controlada tras la introducción de infliximab con una rápida mejoría, requiriendo sólo dos infusiones de 5 mg/kg y manteniéndose controlada con acitretino durante un periodo de seguimiento de 6 meses107. El segundo caso es el de una mujer de 54 años de edad con una enfermedad de 8 años de evolución, refractaria a múltiples tratamientos y que respondió de forma rápida al tratamiento con infliximab (5 mg/kg), permitiendo reducir las dosis de metilprednisolona y de acitretino, pero que tras 12 semanas de tratamiento (tres dosis) se hizo refractaria al mismo108.
Enfermedades ampollosas
Se han descrito hasta el momento dos casos de pénfigo vulgar recalcitrantes y refractarios a múltiples tratamientos inmunosupesores, que respondieron de forma rápida al tratamiento con infliximab. Los pacientes alcanzaron en ambos casos una respuesta duradera (4 meses y 104 semanas)109,110.
Sólo existe un caso descrito de penfigoide ampolloso de mucosas refractario a múltiples tratamientos inmunosupresores y muy agresivo, en el que tras tratamiento con infliximab a las dosis y pautas habituales se alcanzó la remisión de la enfermedad de la mucosa oral y faríngea y estabilizó la afectación ocular que ya había ocasionado la pérdida de un ojo111.
Lupus eritematoso
El papel proinflamatorio del TNFα como citocina temprana involucrada en diferentes enfermedades del tejido conectivo, capaz de activar la cascada del complemento, ha sido demostrado en diferentes estudios. Por este motivo, su inhibición podría tener un efecto beneficioso en el tratamiento de este tipo de enfermedades112-114.
Sin embargo, es un tema sobre el que aún persiste controversia, y es que se han descrito algunos casos de lupus inducido por fármacos anti-TNFα115-131, y lo que es más frecuente, desarrollo de autoanticuerpos en pacientes tratados con infliximab por patologías como artritis reumatoide o enfermedad de Crohn132-138. En la mayor parte de los casos el desarrollo de autoanticuerpos no tiene relevancia clínica, y esto parece ser debido a que durante el tratamiento con infliximab los anticuerpos producidos son predominantemente anti-ds DNA de clase IgM, mientras que los que los que parecen ser responsables de la enfermedad son los de clase IgG139.
Respecto a cómo se modifican los niveles de autoanticuerpos en los propios pacientes con lupus eritematoso sistémico (LES) tratados con infliximab recientemente se ha publicado un estudio sobre 7 pacientes con LES en los que tras tres dosis de infliximab se comprobó un aumento de los niveles plasmáticos de anticuerpos anti-ds DNA (5 de los 7), anti histona (4 de los 7), anti-cromatina (6 de los 7) y de IgM anti cardiolipina (4 de los 7). Este incremento de los niveles plasmáticos de autoanticuerpos se produjo simultáneamente con la mejoría clínica, y volviendo los niveles de autoanticuerpos a los niveles basales a las pocas semanas. Los autores del estudio postulan que el incremento de los autoanticuerpos observado se debe a una liberación de antígenos de células que han sufrido apoptosis tras el bloqueo TNFα140.
Existen otros casos descritos de respuesta clínica y analítica de pacientes con LES tratados con infliximab141-143.
Aringer publica el estudio que engloba el mayor número de pacientes con LES tratados con infliximab (4 dosis de 300 mg), en los que se puede observar una rápida e importante mejoría de los síntomas sistémicos y de los parámetros analíticos, respuesta que se mantiene al menos 8 semanas después y que coincide con un incremento de los niveles de autoanticuerpos144.
Esclerodermia
Diferentes evidencias científicas apuntan a un papel patogénico del TNFα en la esclerodermia145-151. Sin embargo, existen muy pocos casos de esclerodermias sistémicas o localizadas tratadas con infliximab, correspondiendo además varios de ellos a descripciones de casos en los que a pesar de ser un fármaco eficaz tuvo que suspenderse debido a efectos secundarios (trombocitopenia asociada al desarrollo de IgM anticardiolipina152, pancitopenia seguida de infección fúngica153, lupus like con autoanticuerpos e hipocomplementemia)154 e incluso, paradójicamente, existe un caso en el que se desarrolló una reacción esclerodermia-like tras el uso de infliximab en un paciente con artritis reumatoide (AR), en el que se encontraron anticuerpos HACA155.
Magro et al describe una serie de pacientes en los que se desarrolló conectivopatía asociada a infección por citomegalovirus (CMV), uno de ellos (mujer de 66 años) presentó una esclerodermia generalizada que recibió tratamiento con infliximab durante un año, experimentando una importante mejoría156.
Recientemente se ha publicado un serie de 4 pacientes con fibrosis pulmonar debida a conectivopatía (tres con AR y uno con esclerosis sistémica), en los que después del tratamiento con infliximab a dosis 3 mg/kg en las semanas 0, 2 y 6 y cada 8 semanas, durante al menos 12 meses, se estabilizó la enfermedad pulmonar siendo el fármaco bien tolerado157. Se ha descrito un caso de una esclerosis sistémica con fibrosis e hipertensión pulmonar, que tras 6 meses de tratamiento con infliximab presentó una importante mejoría clínica y una disminución de la presión en la arteria pulmonar, con mejoría de las pruebas de función pulmonar158.
Dada la escasa experiencia es difícil obtener conclusiones sobre la eficacia de infliximab en esta patología y sobre el hipotético mayor riesgo de efectos secundarios asociado al tratamiento en estos pacientes.
Dermatomiositis
También en el caso de la dermatomiositis (DM) el TNFα parece desempeñar un importante papel159-163, y al igual que en las otras conectivopatías son escasos los casos publicados de dermatomiositis tratados con infliximab.
El primer caso descrito corresponde a Roddy E en el año 2002, que describe el caso de una mujer de 48 años de edad con DM refractaria a múltiples tratamientos y que después de recibir la tercera infusión de infliximab (5 mg/kg) presentó un cuadro séptico, por lo que se suspendió el fármaco, y 4 meses después se diagnosticó un linfoma no Hodgkin164. La posible relación entre el linfoma y el tratamiento con infliximab es dudosa, puesto que la paciente había sido tratada con fármacos inmunosupresores y además el linfoma podría ser la causa primaria de la DM. Este caso ilustra la complejidad de tratamiento de esta enfermedad, que puede tener un origen paraneoplásico con un fármaco que ha sido asociado con el desarrollo de procesos malignos.
Existen algunos casos (4 pacientes en total) con mejoría tras el uso de este fármaco165-167. Además se han descrito dos casos de respuestas espectaculares tras el uso de infliximab en pacientes con DM grave refractaria a tratamiento. Uno de ellos corresponde a una mujer de 19 años, que tras iniciarse ventilación mecánica debido a hipoventilación refractaria a múltiples terapias, es tratada con tres dosis de infliximab 8 mg/kg (junto a bolos de metil prednisolona intravenosa 1 g/día y MTX) y que a los 8 días del tratamiento recupera la respiración espontánea y tras la cuarta infusión queda asintomática168. El otro caso es el de otra mujer de 58 años que presentaba una DM grave (tetraparesia y necesidad de sonda nasogástrica), que no había respondido a múltiples tratamientos (bolos de metil-prednisolona, bolos de ciclofosfamida, bolos de inmunoglobulina, ciclosporina y MTX) y que respondió al tratamiento con infliximab (asociado a MTX, ciclosporina y prednisona), quedando asintomática (un año de seguimiento)169.
Se ha publicado un estudio retrospectivo realizado sobre 8 pacientes diagnosticados de DM o polimiositis (PM), tratados con anti-TNF, dos de ellos siguieron tratamiento con infliximab, obteniéndose una respuesta parcial sólo en uno de ellos y siendo ineficaz en el otro, mientras que de los otros 6 pacientes, tratados con etanercept, se obuvo una respuesta positiva en 5 de ellos170. El escaso número de pacientes que formaban la muestra no permite realizar comparaciones entre ambos fármacos.
Enfermedad de Sjögren
La molécula TNFα desempeña un papel principal en la enfermedad de Sjögren, y de hecho se ha demostrado un aumento de sus niveles en glándulas salivales de pacientes con esta enfermedad171.
Sin embargo, a pesar de que esta molécula parece estar implicada en la enfermedad, no se obtuvieron diferencias en un estudio prospectivo y randomizado llevado a cabo en un total de 103 pacientes con la enfermedad entre el grupo tratado con infliximab y el grupo placebo (no hubo diferencias en los síntomas de fatiga, artralgias o sequedad de mucosas)172.
Enfermedad de Behçet
Existe una experiencia bastante amplia con el uso de fármacos anti-TNFα en el tratamiento de diferentes manifestaciones de la enfermedad de Behçet, por lo que podemos asumir que esta citocina está implicada en la patogénesis de la enfermedad y que su bloqueo puede ser beneficioso.
Se han publicado varios casos de pacientes tratados con infliximab para el control de diferentes manifestaciones (oculares, neurológicas, etc.) y que también mejoraron en la sintomatología mucocutánea173-183.
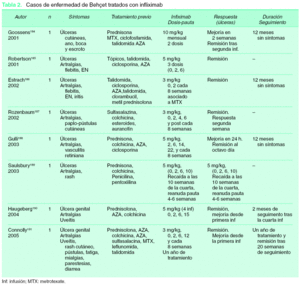
Hasta la actualidad se han descrito al menos 8 pacientes184-191 tratados con infliximab, en los que la principal afectación eran las úlceras orogenitales, de larga evolución, con importante repercusión para el paciente y que se habían mostrado refractarias a los tratamientos inmunosupresores clásicos (tabla 2). Las dosis utilizadas fueron en la mayoría de ellos las empleadas para otras enfermedades (3 o 5 mg/kg). En todos los casos se alcanzó la curación total de las úlceras, y en la mayor parte de ellos la respuesta al tratamiento fue rápida (dentro de las primeras 6 semanas tras la primera infusión), apreciándose en uno de los casos al tercer día de la primera infusión189. La mayoría de los pacientes mantuvieron una respuesta durante varias semanas después de la última infusión, tres de ellos se mantuvieron asintomáticos tras un año de seguimiento184,186,188 y otro 20 meses189. Sólo se ha descrito un caso de recaída tras la suspensión del tratamiento (a la décima semana de la última infusión), respondiendo rápidamente al reanudarse189.
En ninguno de los casos refieren un efecto secundario relacionado con el tratamiento y tan sólo en uno de los pacientes tuvo que modificarse la pauta debido a una infección leve190.
En todos los casos los síntomas extracutáneos también respondieron satisfactoriamente al tratamiento.
En la enfermedad de Behçet el tratamiento con infliximab ha conseguido resultados excelentes en la mayoría de los pacientes descritos, sin embargo se han descrito dos casos en los que la respuesta no fue satisfactoria. Se trataba de dos pacientes con afectación extracutánea de la enfermedad (ileítis-colitis y alteraciones musculoesqueléticas en uno y alteraciones oculares en el otro), con úlceras orogenitales y brotes recurrentes de eritema nudoso, afectando a las piernas en ambos casos. Los dos pacientes iniciaron tratamiento con infliximab a la dosis y pauta habituales (5 mg/kg) y a pesar de una mejoría rápida de las úlceras y de las alteraciones extracutáneas (excepto la diarrea por ileítis-colitis del primer paciente) ambos pacientes desarrollaron un brote inteso de lesiones de eritema nudoso en piernas (más escleritis en el segundo caso), por lo que se suspendió el tratamiento192.
Por último existe un caso publicado de enfermedad de Behçet en el que no se obtuvo respuesta tras tres meses de tratamiento con etanercept (25 g dos veces por semana), y sin embargo sí se obtuvo una rápida respuesta tras tratamiento con infliximab (3 mg/kg) asociado a MTX (7,5 mg semanales). Los autores apuntan la posibilidad de que en la enfermedad de Behçet, al igual que en la enfermedad de Crohn con la que comparte similitudes, estos dos tratamientos, a pesar de bloquear una misma molécula inflamatoria, tengan una eficacia diferente, en parte explicable por la capacidad de bloquear el TNFα unido a membrana que posee infliximab y no etanercept186.
Enfermedad de injerto contra huésped
El TNFα es una molécula que ejerce un papel principal en la enfermedad injerto contra huésped. Diferentes estudios en modelos animales han demostrado que el TNFα es una molécula implicada tanto en la enfermedad aguda como en la crónica, y que su bloqueo mediante la modificación genética de ratones donantes de trasplante de médula mediante anticuerpos anti-TNF reduce el desarrollo de la enfermedad193-197.
Además parece que tiene un importante rol tanto en el desarrollo de la enfermedad de injerto contra huésped como en la actividad injerto contra leucemia, por lo que los animales que reciben un trasplante libre de TNFα desarrollan en menor medida enfermedad de injerto contra huésped (EICH), pero alcanzan una supervivencia global menor, ya que mueren por el tumor193,194. En este sentido el tratamiento de la enfermedad de injerto contra huésped con mediadores que bloquean la vía TNFα, en un principio eficaces con esta finalidad, podrían disminuir el resultado global del trasplante. Recientemente se ha demostrado que ratones que habían recibido un trasplante de médula de ratones con incapacidad para formar la fracción del TNFα unida a membrana, pero sí la soluble, desarrollaban con una menor frecuencia EICH, sin que se viera afectada la capacidad de injerto contra tumor, por lo que según este estudio la fracción responsable de la EICH sería la unida a membrana, mientras que la soluble sería la implicada en la actividad contra tumor198. Este punto es importante ya que, de confirmarse estas mismas observaciones en humanos, podría existir una diferencia importante en la indicación de fármacos anti-TNF, estando en un principio más indicado el etanercept al no unirse a la fracción unida a la membrana.
En humanos se ha podido demostrar que los niveles elevados de TNFα se relacionan con una mayor frecuencia de aparición de EICH tanto aguda199,200 como crónica201-203.
Enfermedad de injerto contra huésped aguda
La EICH aguda se desarrolla en tres fases diferentes. El TNFα está implicado tanto en la primera fase, en la que se libera desde los tejidos dañados por el acondicionamiento, como en la tercera fase en la que es liberado por las células T efectoras del donante, previamente activadas por las células presentadoras de antígeno del receptor y que provocan la muerte celular por un mecanismo de citotoxicidad en el que interviene el TNFα204.
La EICH es una situación grave, en la que la primera línea de tratamiento son altas dosis de esteroides sistémicos, seguido de una terapia de mantenimiento con tacrolimus o ciclosporina, suponiendo un difícil reto terapéutico si este tratamiento no controla la enfermedad205. Los fármacos biológicos anti-TNFα han demostrado ser eficaces en algunos casos y se sitúan en primera línea de tratamiento en los casos refractarios. Algunos autores han encontrado una mayor eficacia del infliximab en los casos de EICH gastrointestinal206,207, postulando que el TNFα es la principal citocina en la enfermedad digestiva, mientas que en la EICH cutánea y hepática otras citocinas desempeñan también un importante papel207,208.
Existen algunas series publicadas de tratamiento de EICH aguda con infliximab. La mayoría de ellas se componen de pacientes que después de un trasplante de médula desarrollan una enfermedad aguda y severa refractaria a los tratamientos clásicos (inmunosupresores y corticoides). En estas series el tratamiento consiste en 4 infusiones de 10 mg/kg de infliximab por semana.
La serie más extensa es la de Couriel D, compuesta por 37 pacientes con EICH tratados con infliximab de los cuales el 28 % presentaban una enfermedad refractaria a corticoterapia. En esta serie el número de respuestas globales era del 75 % en los pacientes con clínica cutánea, 81 % en los que presentaban afectación del tracto gastrointestinal alto, 91 % en los enfemos con afectación del colon y 35 % en los que padecían enfermedad hepática. De los 37 pacientes 22 fallecieron, siendo 13 muertes atribuibles a progresión de EICH206.
Se han publicado dos estudios, ambos con un diseño retrospectivo, que han obtenido unas respuestas de esta enfermedad en pacientes refractarios a corticoterapia muy prometedoras. El primero de ellos es una serie de 21 pacientes (14 % grado I, 67 % grado II y 19 % grado III/IV) tratados con infliximab en solitario, en el que se alcanzó una respuesta global de 70 % para la enfermedad cutánea (67 % de respuesta total), 75 % de repuesta global para la afectación intestinal (65 % de respuestas totales) y 25 % de respuesta global (25 % de respuestas totales) para la enfermedad hepática. La supervivencia global fue del 38 % en los pacientes, sin embargo todos ellos desarrollaron posteriormente EICH crónica205. El segundo estudio refleja unos resultados similares en una serie de 32 pacientes diagnosticados de EICH grados II-IV. El 59 % de los pacientes tratados con infliximab responden adecuadamente (19 % respuestas completas y 40 % respuesta parcial)208.
Otras series publicadas de EICH aguda o refractaria tratadas con infliximab, engloban un total de 12 pacientes de los cuales, a pesar de que 8 de ellos mejoran tras el tratamiento, 10 mueren durante el periodo de seguimiento209-211. Sólo existen dos casos de tratamiento de EICH aguda con infliximab (ambos asociados a adalizumab) con buena respuesta212.
Se ha publicado un estudio que compara la eficacia de infliximab frente al tratamiento clásico en pacientes que previamente no han sido tratados. Se trata de un estudio en fase III en el que se randomizaron 58 pacientes en dos grupos de tratamiento, infliximab más metilprednisolona frente a metilprednisolona como único tratamiento. Tras completar el estudio los autores no encuentran diferencias estadísticamente significativas (63 % de respuestas en el grupo tratado con metilprednisolona frente a 66 % de respuestas del grupo tratado también con infliximab) entre los dos brazos de tratamiento213.
Enfermedad injerto contra huésped crónica
En el estudio de Couriel206 se describen 22 pacientes con EICH crónica que fueron tratados con infliximab asociado a prednisona o a otro fármaco inmunosupresor. La tasa de respuestas fue del 92 % para la afectación gastrointestinal y de 57 % para la cutánea. Once pacientes murieron, 7 de ellos debido a progresión de la enfermedad.
Infliximab es un fármaco bien tolerado en la mayor parte de los casos. Respecto a si se puede asociar a un riesgo mayor de infecciones, es difícil llegar a una conclusión ya que los pacientes con EICH refractaria son sujetos inmunodeprimidos, y es difícil determinar en qué medida colabora el infliximab. Algunos autores han publicado un aumento del riesgo de infecciones fúngicas asociadas al tratamiento de EICH con infliximab214.
Estos estudios parecen indicar que el tratamiento con infliximab puede ser una buena alternativa terapéutica para aquellos pacientes que no han respondido a los tratamientos previos. El infliximab es capaz de mejorar la sintomatología de la enfermedad, aunque sin conseguir un control completo en la mayoría de los pacientes, mientras que no parece ser un fármaco mejor que los tratamientos clásicos en el caso de pacientes previamente no tratados.
Respecto a la posible pérdida de eficacia del transplante al asociarse infliximab, no existen estudios en humanos que puedan resolver este importante aspecto que sí se ha podido comprobar en animales tras el bloqueo de la fracción unida a la membrana del TNFα.
Pitiriasis rubra pilaris
Se han descrito 4 pacientes con pitiriasis rubra pilaris tratados con infliximab. Wennie publica en 2005 dos casos de esta enfermedad, con afectación generalizada, que se ini-
ciaron en la edad adulta y refractarios a varios intentos terapéuticos (ciclosporina asociada a acitretino en uno de ellos y acitretino de forma aislada en el otro). Ambos fueron tratados con infliximab a las dosis y pauta habituales, alcanzando una importante mejoría que se pudo apreciar a las dos semanas de la primera dosis en ambos casos. Tras este tratamiento los pacientes se mantuvieron con acitretino en monoterapia y a una dosis menor de la que estaban recibiendo anteriormente215.
Posteriormente Manoharan describe una mujer con una pitiriasis rubra pilaris que después de ser tratada con múltiples fármacos orales y tópicos respondió de forma rápida (a las dos semanas de la primera infusión) e importante, quedando prácticamente asintomática y manteniéndose únicamente con emolientes216.
En contraposición a estos casos se ha descrito uno de pitiriasis rubra pilaris que no mejoró con el tratamiento combinado de infliximab (5 mg/kg 4 infusiones) y acitretino217.
Necrolisis epidérmica tóxica
El TNFα parece ser una molécula importante en la patogenia de la necrolisis epidermica tóxica (NET), aunque su papel exacto no está aclarado por completo. Diferentes estudios han comprobado que el suero de las ampollas de los pacientes con NET contenía una concentración mayor de TNFα que el suero del de las ampollas de los pacientes con quemaduras térmicas.
El primer caso de NET tratado satisfactoriamente con infliximab en una dosis única de 5 mg/kg está publicado en el año 2002 por Fisher218. Desde entonces se han descrito 5 casos más219-221, todos ellos con una respuesta satisfactoria. La publicación más reciente refiere tres casos de toxicodermia con características compatibles con una pustulosis exantemática y una NET, que no habían respondido a la corticoterapia ni a la suspensión del fármaco causante del cuadro, y que con una dosis única de infliximab sufrieron una rápida e importante mejoría221.
Vasculitis
El uso de infliximab para tratamiento de las vasculitis sistémicas es un aspecto que requiere futuras investigaciones, ya que la mayoría de los casos descritos corresponden a casos únicos o a series muy limitadas de pacientes, y además los pocos estudios prospectivos realizados muestran resultados dispares. Así, mientras que algunos estudios muestran un efecto beneficioso de este tratamiento en pacientes con vasculitis sistémicas222 y refractarias a múltiples tratamientos, otros muestran malos resultados con una alta tasa de efectos secundarios223.
Enfermedad de Wegener
La mayor experiencia en el uso de infliximab para el tratamiento de las vasculitis se tiene con la enfermedad de Wegener, en la que el mecanismo de acción de este fármaco es similar al de otras enfermedades granulomatosas ya comentadas previamente. El papel de esta citocina en esta enfermedad necrotizante se ha comprobado mediante un estudio en el que se evaluó la disfunción endotelial en pacientes con CANCAS-vasculitis. Con este estudio se pudo observar que el flujo sanguíneo del antebrazo ante un estímulo (acetilcolina) era menor que en individuos no enfermos, y que mejoraba cuando estos pacientes eran tratados con infliximab224.
Se han realizado tres ensayos clínicos prospectivos, con 7, 32 y 6 pacientes respectivamente222,225,226 en los que infliximab a dosis de 3-5 mg/kg con intervalos de 2-8 semanas resultó eficaz para el tratamiento de vasculitis con C-ANCAS, refractarias a los tratamientos inmunosupresores habituales. En el ensayo que contó con un mayor número de pacientes222, se obtuvo una tasa de respuesta global del 88 %, con un 20 % de recaídas entre los pacientes que inicialmente respondieron, mostrando que es un tratamiento eficaz en esta enfermedad. Sin embargo, dos pacientes del estudio murieron y 7 sufrieron una infección severa, remarcando el riesgo de efectos secundarios en pacientes que siguen este tratamiento y se encuentran inmunosuprimidos debido a los diversos tratamientos que han seguido o están siguiendo. También se han descrito casos con esta enfermedad que desarrollaron infecciones severas227, lo que puede indicar un especial riesgo en esta vasculitis.
Además se han descrito varios casos aislados con diferentes afectaciones, enfermedad severa del sistema nervioso central228,229, afectación ocular230,231, fallo renal232 que respondieron al tratamiento con infliximab y tres casos de enfermedad pediátrica en los que también se obtuvo una buena respuesta233.
Sin embargo, aparte de todos estos casos en los que el tratamiento con infliximab obtuvo una repuesta satisfactoria, también existen otros en los que dicho tratamiento no consiguió controlar la enfermedad223,224.
El infliximab, al igual que ocurre en la enfermedad de Crohn, parece ser más eficaz para controlar la enfermedad de Wegener que la molécula de etanercept, en la que los resultados no han sido tan notables235,236.
En resumen, infliximab es un tratamiento que puede ser eficaz en aquellos pacientes con enfermedad de Wegener que no ha sido controlada con otras terapias, ofreciendo una alternativa al tratamiento convencional de esta enfermedad.
Arteritis de células gigantes
Se han descrito algunos casos de respuesta rápida al tratamiento con inflximab237,238. Sin embargo, en un estudio prospectivo sobre 44 pacientes con esta enfermedad, respondedores a corticoterapia, no se pudo demostrar diferencias entre los que sólo estaban siendo tratados con corticoides y los que además de este tratamiento estaban recibiendo infusiones periódicas de infliximab (no hubo reducción de dosis de corticoides en este grupo de pacientes)239. Aunque el número de pacientes que formaban el estudio era pequeño no parece que este tratamiento sea beneficioso en pacientes que responden adecuadamente a corticoides.
Panarteritis nodosa
El infliximab se ha empleado en dos casos de panarteritis nodosa (PAN) en la infancia resistente a tratamiento inmunosupresor y muy agresiva, con unos resultados excelentes, permitiendo reducir los tratamientos previos durante un periodo de seguimiento de varios años240,241.
Existen casos de PAN refractarias en el adulto con una buena respuesta al tratamiento con infliximab242,243.
Granulomatosis de Churg-Strauss
Se han descrito dos casos de esta enfermedad con afectación del sistema nervioso central refractarios a tratamiento con corticoides y ciclofosfamida, en los que se obtuvo mejoría del cuadro tras la introducción de infliximab244. Sin embargo, también se ha publicado el caso de un paciente en el que la enfermedad no mejoró tras el tratamiento, y además tuvo que suspenderse debido a la aparición de una reacción lupus-like223.
Vasculitis leucocitoclástica
Los casos referidos en la literatura de vasculitis leucocitoclástica tratados con infliximab refieren buenas respuestas en todos ellos245,246,225.
Algunos casos de vasculitis asociadas a artritis reumatoide refieren una buena respuesta247-249, aunque no pudo ser mantenida posteriormente en uno de ellos248.
Arteritis de Takayasu
Se han publicado diversos casos de enfermedad de Takayasu refractarios al tratamiento convencional de la enfermedad en los que el tratamiento con infliximab resultó eficaz y permitió mantener a los pacientes con dosis bajas de corticoides250-252.
Además de los casos descritos se ha llevado a cabo un estudio prospectivo sobre 15 pacientes con enfermedad grave y refractaria, en los que se estudió el efecto a largo plazo de la asociación a su tratamiento previo un fármaco anti-TNFα (7 pacientes tratados con etanercept y 8 con infliximab)253. De los 15 pacientes todos menos uno respondieron (10 respuestas totales) y en 10 de ellos la respuesta fue mantenida, permitiendo suspender la corticoterapia. Este estudio coloca a los fármacos anti-TNFα como una línea muy importante de tratamiento, sin poder concluir diferencias entre los dos fármacos del estudio debido a que contaba con una muestra escasa.
Enfermedad de Still del adulto
El efecto del tratamiento con infliximab sobre la enfermedad de Still es contradictorio. Además sólo existen tres pacientes descritos en la literatura tratados con este fármaco.
En un caso de esta enfermedad tratado con infliximab no se obtuvo mejoría, y además el paciente sufrió un brote intenso de la enfermedad a pesar del fármaco, y a los 6 meses murió debido a un infarto de miocardio cuya relación con el tratamiento está pendiente de establecerse223.
Bonilla Hernán et al publican dos casos con esta enfermedad que respondieron al tratamiento con infliximab a las dosis y pautas habituales, y que obtuvieron una mejoría tanto clínica como de los parámetros analíticos de actividad de la enfermedad254.
Schönlein Henoch
Sólo hemos encontrado un caso en la literatura de esta enfermedad tratado con infliximab, en el que no se obtuvo mejoría y además tuvo que suspenderse el tratamiento debido a efectos secundarios223.
Enfermedad de Kawasaki
Se han descrito diferentes casos de esta enfermedad que después del fracaso de la terapia convencional (inmunoglobulina intravenosa, aspirina y metilprednisolona) fueron tratados con infliximab, obteniéndose una rápida respuesta y consiguiéndose la remisión de la enfermedad255-258.
En un estudio retrospectivo sobre 17 pacientes con enfermedad refractaria (resistentes a inmunoglobulina IV asociada o no corticoides) que recibieron tratamiento con infliximab 5-10 mg/kg y entre una y dos infusiones, según la gravedad de la enfermedad, se obtuvo una rápida respuesta (en 24 horas) de la clínica y los parámetros analíticos en 13 de los 17 pacientes, sin que se produjeran reacciones adversas al fármaco259.
Fiebre mediterránea familiar
Existen cuatro casos descritos en la literatura de tratamiento de fiebre mediterránea familiar con la molécula de infliximab260-263, todos ellos respondieron al tratamiento a pesar de ser pacientes que no habían respondido a los tratamientos habituales y dos de los casos presentaban alteración de la función renal debida a amilodosis, que también mejoró desués del tratamiento (disminución de la proteinuria)261,263.
Adalimumab
Es la molécula anti-TNF más recientemente desarrollada con un perfil de eficacia más parecida a infliximab que a etanercept.
Se trata de un anticuerpo monoclonal de clase Ig-1, totalmente humano, por lo que se supone que es menos inmunogénico que los anticuerpos anti-TNFα de origen murino o quimérico264. Sin embargo, su utilización provoca la formación de anticuerpos anti-humanos (HAHA), cuya etiología es aún incierta265,266.
Al igual que el infliximab se une tanto a la fracción soluble como unida del TNFα, y fija el complemento produciendo la lisis de las células que expresan dicha molécula267.
Se trata de un fármaco de administración subcutánea o intravenosa y la dosis y pauta a la que habitualmente se administra es de 40 mg cada dos semanas.
Tiene un perfil de seguridad bueno, siendo las reacciones locales a la inyección los efectos secundarios más frecuentemente descritos267.
Actualmente está aprobado para el tratamiento de la AR, artritis psoriásica y espondilitis anquilosante268 (tabla 3).
Usos en no psoriasis
Pioderma gangrenoso
Sólo se han descrito dos casos de PG tratado con adalimumab. Uno de ellos se trata de una mujer con una enfermedad inflamatoria intestinal de dos años de evolución, que a pesar de estar en tratamiento con azatioprina e infliximab desarrolló una úlcera en la pierna que respondió a tratamiento con 80 mg de adalimumab cada dos semanas, mientras que con tratamientos inmunosupresores habituales no se había obtenido respuesta269. El otro caso es el de una paciente de 47 años, sin enfermedad intestinal asociada, con una úlcera refractaria al tratamiento convencional tópico y sistémico, y que después del tratamiento con adalimumab a dosis de 20 mg/semana durante dos semanas y posteriormente a dosis de 40 mg/semana alcanzó remisión completa de la lesión en 5,5 meses de tratamiento, con mejoría desde el segundo mes y siendo adalimumab el único tratamiento sistémico270.
Además existe un caso publicado de PG con infiltrados neutrofílicos sistémicos (colecciones en bazo y psoas) y respuesta inicial al tratamiento con infliximab que se resolvió posteriormente con adalimumab a las dosis habituales102.
Enfermedad de Beçhet
Existe una serie de 6 pacientes con enfermedad de Beçhet previamente tratados con infliximab que respondieron adecuadamente, permitiendo suspender el tratamiento con este fármaco. Posteriormente sufrieron una recaída intensa que se trató con adalimumab a las dosis habituales, obteniéndose una rápida respuesta en todos los pacientes. Tres de ellos desarrollaron una reacción liquenoide271.
Además se ha publicado una serie de tres casos con uveítis por esta enfermedad, que tras conseguir la remisión y control de la enfermedad con infliximab se decide cambiarlo por adalimumab 40 mg/2 semanas, debido a la mayor comodidad para su administración272. Los tres pacientes continuaron en remisión tras cambiar el fármaco.
Hidradenitis supurativa
En la revisión de la literatura hemos encontrado dos casos de HS tratadas con adalimumab. El primero de ellos era una mujer con una enfermedad de larga evolución, muy desfigurante, que había sido tratada sin éxito con múltiples tratamientos (incluyendo cirugía). Al iniciar el tratamiento con adalimumab (40 mg/2 semanas) se obtiene una importante mejoría desde la primera inyección y una respuesta casi total (sin signos de inflamación, desaparición de los trayectos fistulosos y del dolor) al mes de tratamiento273.
Recientemente se ha descrito otro caso de HS que además presentaba artritis y acné noduloquístico, en el que se consigue una clara mejoría de la clínica con adalimumab (a dosis de mantenimiento de 40 mg semanales)274.
Vasculitis
Thirion et al275 publican un caso de una paciente con una úlcera cutánea debida a vasculitis leucocitoclástica, refractaria al tratamiento convencional, y que respondió a tratamiento con adalimumab, consiguiéndose su cierre completo, aunque a los pocos meses recurrió.
Se han publicado distintos casos sueltos de diferentes vasculitis (arteritis de la temporal276 y enfermedad de Takayasu277) refractarias a los tratamientos convencionales que repondieron a adalimumab.
Sarcoidosis
El primer caso de sarcoidosis cutánea tratada con adalimumab fue descrito por Phlilips MA278. Se trataba de una mujer con una sarcoidosis cutánea que presentaba una úlcera refractaria al tratamiento con prednisona, hidroxicloroquina y MTX, de meses de evolución y que con adalimumab (40 mg semanal) presentó una importante mejoría, consiguiéndose el cierre de la úlcera después de 9 semanas de tratamiento.
Posteriormente se ha descrito otro caso de sarcoidosis cutánea extensa, refractaria a múltiples tratamientos a la que se añadió adalimumab a su tratamiento anterior (hidroxicloroquina y pentoxifilina). Después de 5 semanas de tratamiento se mantuvo controlada la enfermedad durante un periodo de seguimiento de 10 semanas279.
Además se ha descrito un caso de sarcoidosis pulmonar que también obtuvo mejoría con el tratamiento con adalimumab280.
Otros
Adalimumab se ha utilizado para el tratamiento de tricoepiteliomatosis múltiple familiar asociado a aspirina. En esta enfermedad el defecto genético reside en una molécula que inhibe la síntesis de TNFα. Con estos dos fármacos se estaría actuando en la vía del TNF a dos niveles, TNFα-ligando y NF-κb, compensando así el defecto en la inhibición de la síntesis de esta molécula. Se trata de una mujer que había recibido múltiples sesiones de láser resurfacing, y que ante la escasa mejoría se inicia la administración de adalimumab (inicialmente 40 mg/2 semanas y posteriormente semanalmente) asociado a 325 mg/12 horas de aspirina. Después de 8 meses de tratamiento se obtuvo una importante mejoría (menor tamaño de los tumores y menor engrosamiento de la piel)281.
Adalimumab se ha empleado también para el tratamiento de la reticulohistiocitosis multicéntrica, obteniéndose respuesta tanto de los síntomas cutáneos como de los articulares a las 8 semanas de tratamiento282.
También se ha utilizado para el tratamiento de la dermatosis pustulosa subcorneal (pénfigo IgA) en una mujer joven en la que tras tratamiento con adalimumab a dosis de 40 mg/2 semanas asociado a micofenolato mofetil (al que no había respondido en monoterapia) obtuvo una respuesta casi total durante un periodo de seguimiento de 5 meses283.
Conclusión
Infliximab y adalimumab son dos moléculas cuyas propiedades terapéuticas residen en su capacidad de bloquear la molécula proinflamatoria TNFα. Ambas actúan de forma similar, por lo que es de esperar que con adalimumab, molécula con la que se tiene una menor experiencia, se consigan unos beneficios similares a los obtenidos con infliximab, pero con un perfil de efectos secundarios menor, al ser una molécula sin secuencias de origen no humano.
Con ambos fármacos, al igual que con otros tratamientos biológicos de reciente desarrollo, se han abierto numerosas puertas de tratamiento para enfermedades dermatológicas distintas de la psoriasis, que en muchos casos son de difícil tratamiento, constituyendo una esperanza para pacientes que prácticamente habían agotado sus opciones terapéuticas. Pero no sólo ofrecen una alternativa eficaz cuando otros tratamientos convencionales no lo son, sino que además parecen tener un perfil de seguridad mejor que el de los tratamientos inmunosupresores convencionales, al menos a corto plazo.
A pesar de esto no debemos dejarnos confundir por la novedad y los aspectos atractivos que estos fármacos nos ofrecen, ya que para la mayoría de las dermatosis no psoriasis que se han utilizado sólo contamos con la experiencia de casos individuales o de pequeñas series, y en algunas de ellas, como en las vasculitis sistémicas o en algunas conectivopatías, se ha descrito un importante número de efectos secundarios. Por otro lado, no debemos perder de vista el alto coste que suponen.
Esta es la primera parte de una revisión de los nuevos fármacos de origen biológico que en los últimos años se están incorporando al arsenal terapéutico del dermatólogo, y que también en pocos años probablemente constituyan un tratamiento de primera línea en dermatosis distintas de la psoriasis.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Correspondencia:
Blanca Díaz Ley.
Servicio de Dermatología.
Hospital Universitario de La Princesa.
Diego de León, 62.
28006 Madrid. España.
blancadiazley@hotmail.com
Aceptado el 5 de junio de 2007.