La infección por el virus de la hepatitis C (VHC) es una enfermedad frecuente con una incidencia del 3% en la población, pudiéndose manifestar en forma de hepatitis aguda o más frecuentemente de hepatitis crónica asintomática, que en el transcurso de los años puede evolucionar a formas más graves como la cirrosis hepática y el hepatocarcinoma. El tratamiento de la hepatitis crónica C se ha basado hasta estos años en el uso combinado de interferón pegilado alfa 2a o 2b junto con ribavirina, obteniendo una respuesta virológica persistente inferior al 50% en los casos infectados por el genotipo 1, lo que ha hecho necesario el desarrollo de nuevos tratamientos como telaprevir (Incivo®), un fármaco novedoso, cuya principal limitación de dosis es la toxicidad cutánea. Presentamos el caso de una paciente tratada con telaprevir, con la intención de poner en conocimiento de los dermatólogos la existencia de este nuevo fármaco.
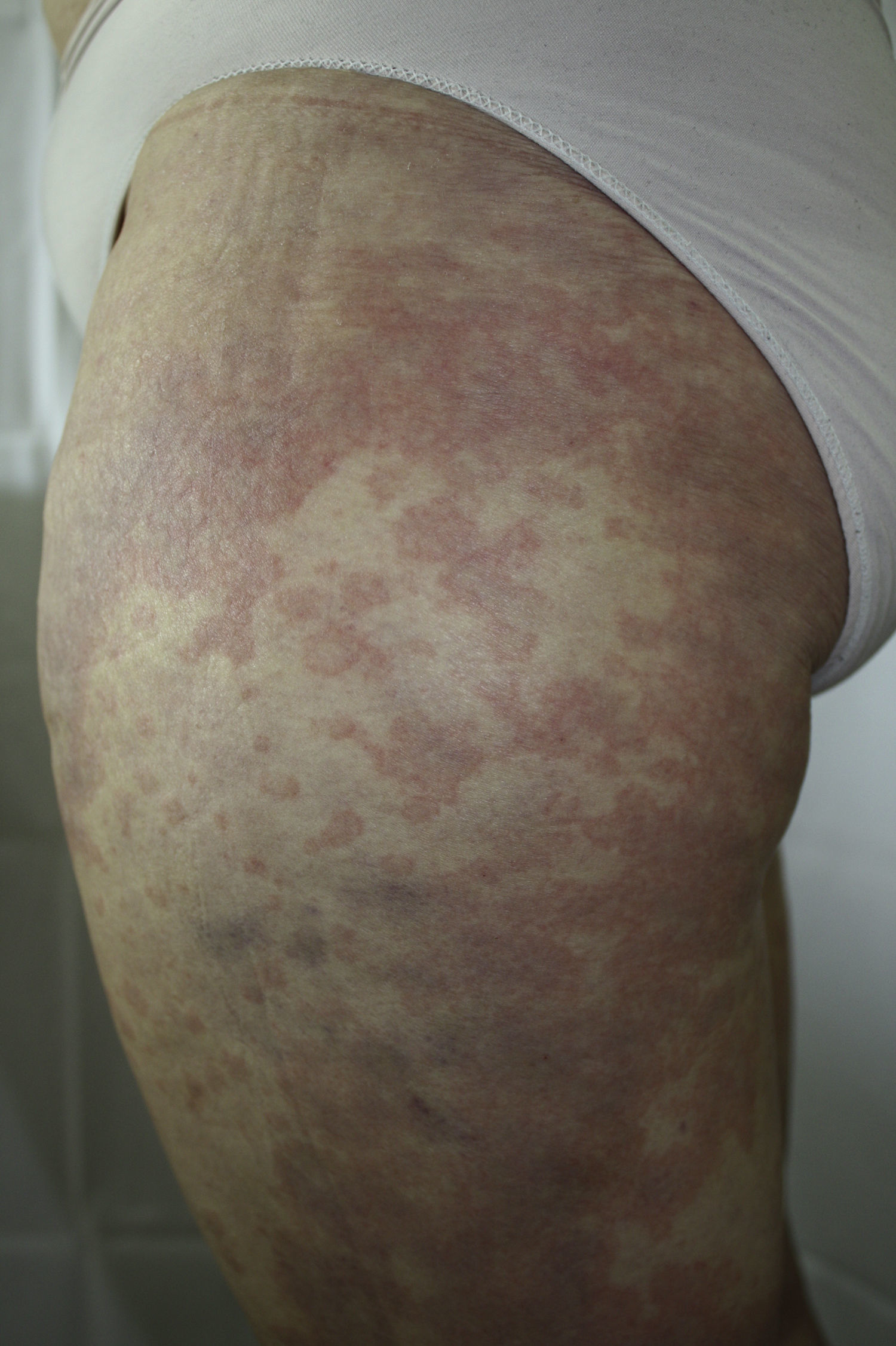
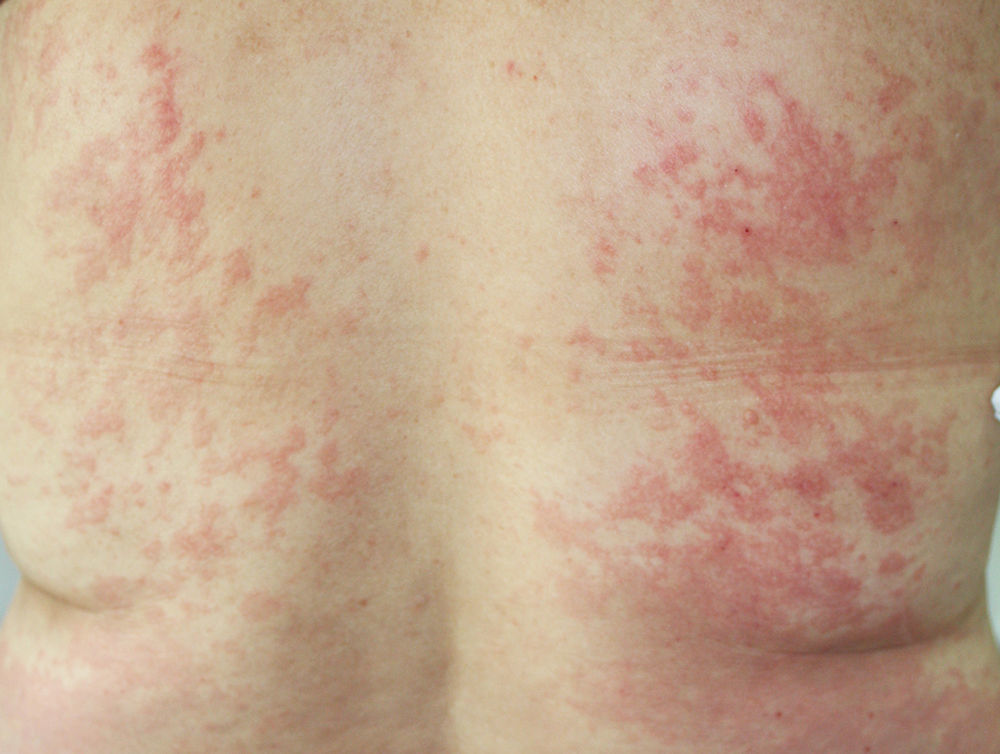
Se trata de una mujer de 58 años de edad, sin otros antecedentes personales de interés, diagnosticada de infección crónica por VHC, genotipo 1. Había realizado previamente tratamiento con interferón pegilado y ribavirina presentando una respuesta transitoria con recaída posterior. Se decidió comenzar triple terapia añadiendo a los fármacos anteriores telaprevir, consiguiéndose una carga viral indetectable en la semana 3 de tratamiento. Acudió a la consulta de Dermatología en la semana 4 de tratamiento por la aparición de lesiones cutáneas, no evanescentes y pruriginosas de 4 días de evolución. En la exploración física presentaba un exantema de aspecto urticariforme (fig. 1) y de morfología anular que afectaba en torno al 30% de la superficie corporal, localizándose en el tercio proximal de las extremidades inferiores y la espalda (fig. 2). Las lesiones desaparecían a la vitropresión y no tenía afectación de mucosas. Se pautó tratamiento tópico con betametasona 17-valerato y se realizaron controles periódicos semanales hasta la finalización del tratamiento. Durante este periodo las lesiones no progresaron y remitieron a las 2 semanas tras la finalización de telaprevir.
A partir de los conocimientos del ciclo replicativo del VHC y de la caracterización de las enzimas virales se han definido nuevas dianas terapéuticas que inhiben dichas enzimas. Telaprevir es un inhibidor de la NS3/4A proteasa, aprobado por la Food and Drug Administration y la Agencia Europea del Medicamento para el tratamiento de la hepatitis crónica C naïve o en previamente tratados con interferón y ribavirina por el genotipo 1. Con este fármaco se ha conseguido incrementar la tasa de respuesta virológica persistente, pudiendo en ocasiones acortar el tiempo de tratamiento1. Sin embargo, sus efectos secundarios cutáneos suponen la limitación más importante del tratamiento. La pauta recomendada de tratamiento incluye 12 semanas con triple terapia (telaprevir, peginterferón y ribavirina) seguidas de 12 a 36 semanas más de peginterferón y ribavirina2. En los estudios fase ii y iii, controlados con placebo, la incidencia de reacciones cutáneas durante el periodo de tratamiento de 12 semanas con telaprevir fue del 56%, en comparación con el 34% observado en los pacientes tratados con placebo y peginterferón alfa/ribavirina3, produciéndose en estos pacientes reacciones locales en el sitio de la inyección y exantemas maculopapulosos pruriginosos localizados en el tronco y en las extremidades, en general bien tolerados y con escasa probabilidad de progresión a cuadros más graves4,5.
El manejo y tratamiento se establece teniendo en cuenta la severidad de las lesiones, la presencia de síntomas sistémicos y anomalías analíticas. El grado i o leve se define como una erupción cutánea localizada o limitada, sin signos sistémicos ni afectación mucosa. El grado ii o moderado es aquel que afecta como máximo al 50% de la superficie corporal y sin despegamiento epidérmico. Puede haber inflamación de las mucosas, sin úlceras y síntomas sistémicos como fiebre, artralgias o eosinofília. El grado iii o intenso es aquel que presenta lesiones cutáneas que afectan a más del 50% de la superficie corporal, o en menor porcentaje si presenta alguna de las siguientes características: presencia de vesículas o ampollas, úlceras en mucosas, desprendimiento epidérmico, lesiones en escarapela, púrpura palpable o eritema que no blanquea a la vitropresión. Por último, el grado iv o potencialmente mortal, se produce si la clínica es de pustulosis exantemática aguda generalizada, síndrome de hipersensibilidad retardada a fármacos (DRESS), necrólisis epidérmica tóxica o síndrome de Stevens-Johnson5,6.
En los pacientes el 90% de estas reacciones fueron grado i o ii, caracterizadas por lesiones de tipo eccematoso, pruriginosas que afectaban a menos del 30% de la superficie corporal, ocurriendo la mayoría de ellas durante las primeras 4 semanas del tratamiento. Solo en un pequeño porcentaje de los pacientes tratados con telaprevir se producen reacciones cutáneas graves, grado iii o iv6. No es necesaria la interrupción del fármaco por reacciones de grado i-ii; en estos pacientes es necesario el control periódico hasta la resolución completa del cuadro por la posible progresión a una reacción cutánea grave7. Solo en caso de reacciones grado iii-iv se debe suspender telaprevir, interrumpiendo secuencialmente ribavirina e interferón en el caso de no mejoría en los siguientes 7 días, sin volver a reintroducirlo posteriormente8. Las lesiones cutáneas se pueden tratar con corticoides tópicos, ya que la asociación con corticoides sistémicos puede producir pérdida de eficacia de telaprevir y modificar los niveles séricos por la interactuación de ambos a través de la vía CYP3A4 y glucoproteína-P20; por ello, otros fármacos como el astemizol y la terfenadina están contraindicados con telaprevir9. Probablemente la excreción fecal tras su metabolización hepática es la causante de síntomas anorrectales como el prurito.
Como conclusión presentamos una reacción cutánea a un nuevo fármaco para el tratamiento del VHC, en cuyo manejo es imprescindible la vigilancia dermatológica para la optimización del tratamiento.