El diagnóstico de laboratorio de las dermatomicosis se basa en identificar la especie causal mediante la realización de cultivos, pero también en el examen directo (ED)1,2. Mediante esta técnica se procura detectar el hongo directamente en la muestra patológica con la ayuda de unos reactivos o colorantes simples.
El realizar el ED ofrece varias ventajas: facilita el diagnóstico en cuadros clínicamente atípicos (como ocurre con la tiña incógnito); otorga seguridad diagnóstica, fundamental si van a plantearse tratamientos largos, costosos y con potenciales efectos secundarios como en la tinea capitis y la onicomicosis; orienta hacia el probable hongo causal (por ejemplo, según el tipo de parasitismo del pelo en casos de tinea capitis); y contribuye al cumplimiento terapéutico del paciente1,2. A pesar de ello, la mayoría de los dermatólogos españoles no realizan ED de forma rutinaria. Mediante este vídeo repasaremos este procedimiento.
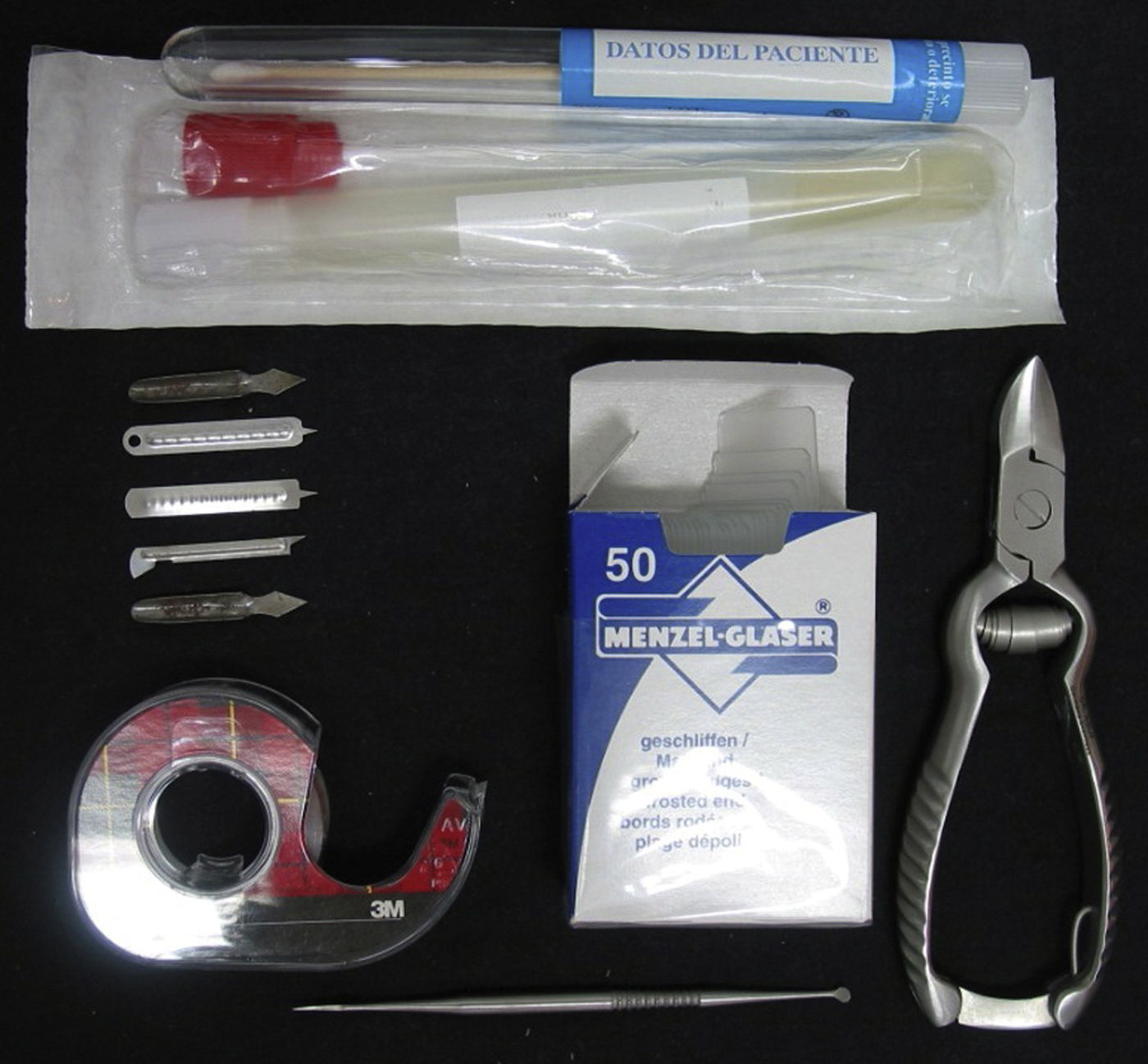
Descripción de la técnicaEn primer lugar es fundamental una correcta toma de muestras. Para ello se deberán retirar los tratamientos antifúngicos al menos 2 semanas antes de obtener la misma. En lo posible se deberá utilizar un instrumental adecuado al tipo de muestra (fig. 1)1–3. En las lesiones húmedas es mejor el empleo de escobillones o hisopos, y para lesiones secas son útiles las hojas de bisturí o los vacinostilos. En el caso de las muestras ungueales es práctico el uso de alicates de manicura (o unas tijeras curvas en su defecto) y del «cuchillo de Le Cron», de uso habitual en Odontología1.
También puede ser de utilidad la toma de lesiones cutáneas con moqueta estéril, que permite la impronta en los medios de cultivo y la posibilidad de infecciones o sobreinfecciones bacterianas. Esto es importante en la tinea pedis, que no pocas veces coexiste con intertrigo por Pseudomonas u otras bacterias gramnegativas, o en infecciones por Candida. No obstante, la toma con moqueta hace dificultoso realizar el examen directo.
Previamente a la toma de muestras debe realizarse una limpieza de la zona frotando suavemente con una gasa o un algodón impregnados en alcohol de 70o. La muestra debe tomarse del borde de la lesión (zona más activa). En las tiñas del cuero cabelludo debemos además procurar coger algunos folículos pilosos (habitualmente se encuentran fragmentos de pelos afectos, que característicamente se desprenderán con facilidad al raspar en la zona, sin necesidad de arrancarlos). Ante la sospecha de onicomicosis distal procuraremos recortar el área de onicólisis más distal para tomar la muestra más proximalmente1.
Siempre se procurará recoger una cantidad suficiente de material. Una parte del material obtenido se depositará en el centro de un portaobjetos limpio (o si la muestra se obtuvo mediante escobillón se frota un poco del mismo) y luego se depositará una gota de la tinción elegida en su superficie. La más utilizada en la actualidad es la solución de Swartz-Lamkins (tinta Parker® permanente negra a partes iguales con potasa al 20%), si bien existen otras como las que combinan potasa y calcoflúor1,4. Posteriormente se colocará el cubre1.
En caso de que el material sean escamas es útil calentar ligeramente la preparación a la llama de un mechero, y/o presionar suave y repetidamente sobre el cubre, hasta que el material queratinoso se haya disuelto. Posteriormente se procede a la observación al microscopio, utilizando primero los aumentos bajos (10×) y posteriormente los altos (20× y 40×).
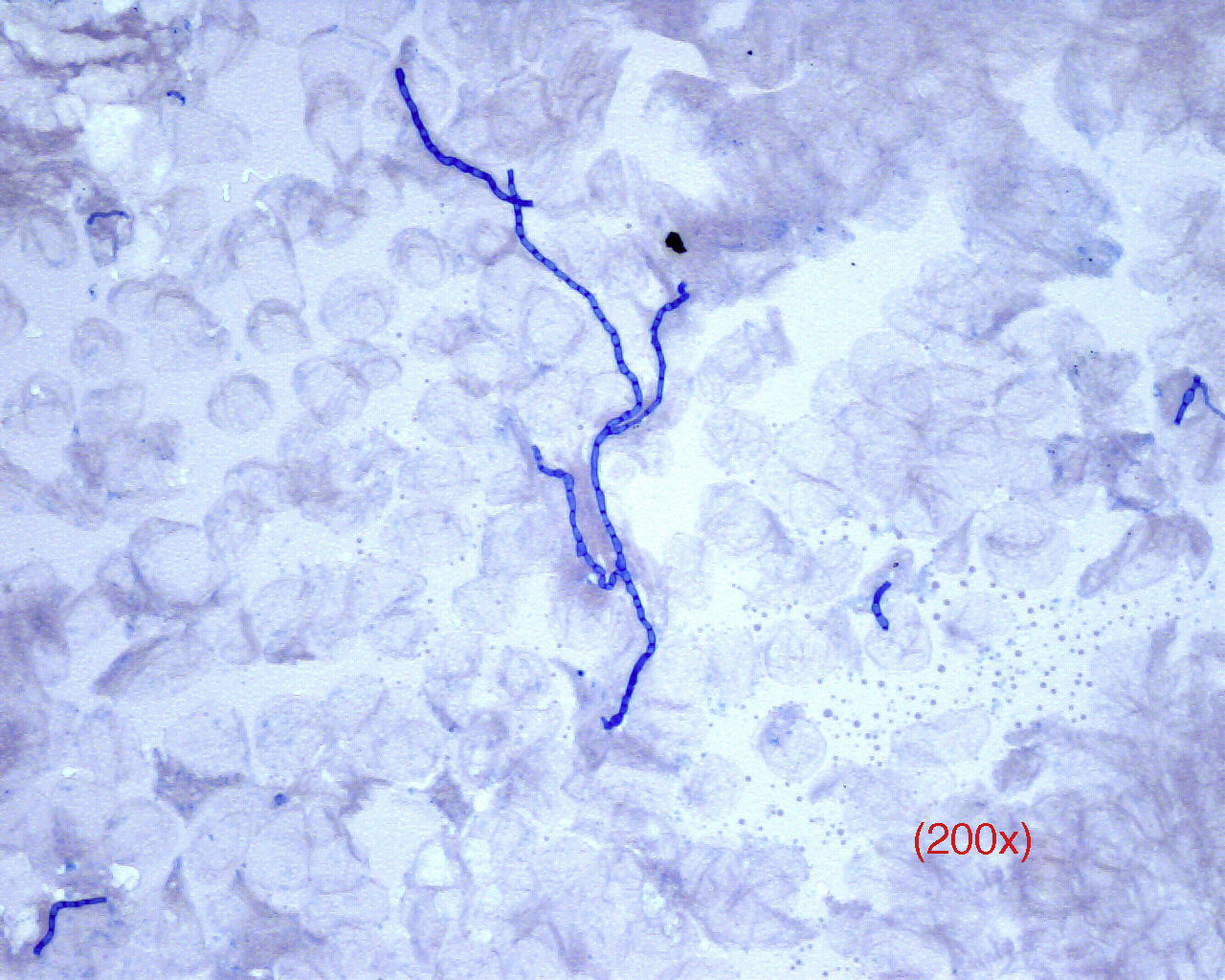
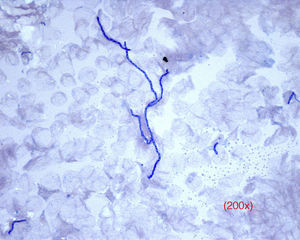
Respecto a la interpretación del ED, los dermatofitos aparecen como filamentos septados y ramificados, de bordes regulares y nítidos, hialinos, que toman lentamente el color azul de la tinta (fig. 2). En casos de tinea capitis es de especial interés prestar atención a la parasitación del pelo (por fuera del mismo, ectothrix, o por dentro, endothrix) para decidir la mejor alternativa terapéutica antifúngica posible mientras se tienen los resultados del cultivo (griseofulvina para ectothrix y terbinafina para endothrix).
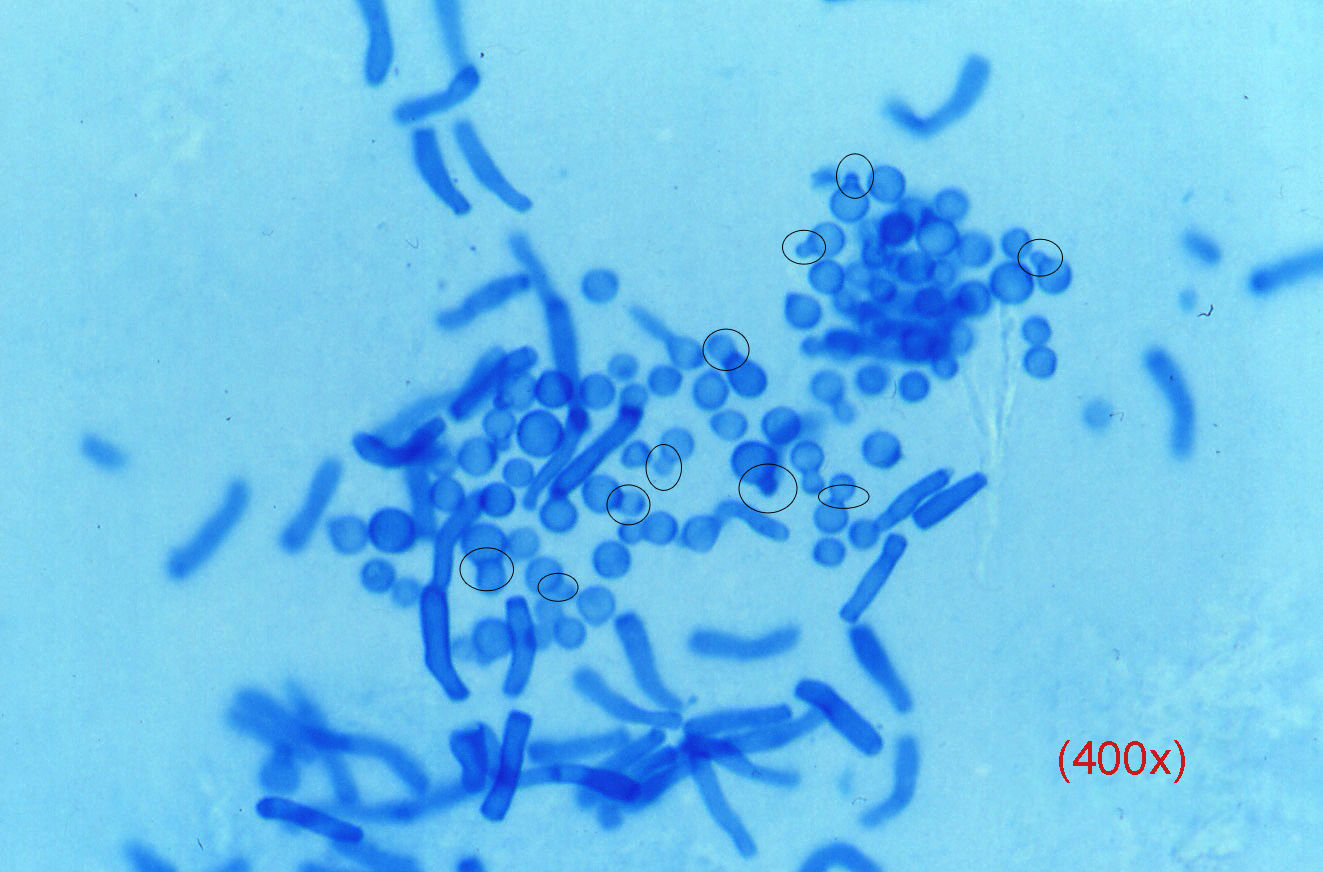
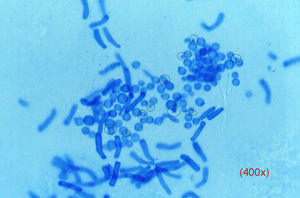
Las levaduras, cuya observación puede resultar más difícil, suelen presentarse como blastoconidias en gemación y pseudomicelio. En el caso de la pitiriasis versicolor la imagen es patognomónica (fig. 3), estando constituida por una mezcla de blastosporos singulares provistos de un nítido collarete de gemación y pseudomicelio corto y grueso, tiñéndose con gran rapidez.
Los mohos oportunistas rara vez se muestran en el ED, salvo en las onicomicosis, donde es posible observar con cierta frecuencia hifas y conidias de morfología peculiar, diferente a la de dermatofitos y levaduras.
Ventajas/inconvenientes del examen directoComo ventajas estamos ante una técnica que aporta gran información de forma inmediata, con bajo coste y siendo preciso escaso aparataje. Por otro lado, tiene una alta sensibilidad, permite la distinción entre dermatofitos y cándidas y es de especial relevancia en casos atípicos (tiña incógnito) y en onicomicosis (aquí su sensibilidad es mucho mayor a la de los cultivos1,4,5). Por otro lado, obtener positividad mediante ED se considera criterio necesario de patogenicidad ante onicomicosis por Candida no albicans y por mohos no dermatofitos.
Como inconvenientes destacar que, como cualquier técnica, requiere una curva de aprendizaje. Además, consume tiempo y no permite distinción entre especies1.
ConclusionesLa realización de una correcta toma de muestras, así como procurar realizar un examen directo, resulta de gran importancia al encontrarnos ante una posible dermatomicosis, aunque el estudio micológico debe completarse realizando además un cultivo.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
A los servicios de Dermatología de los Hospitales Costa del Sol de Marbella y Carlos Haya de Málaga, por su ayuda en la preparación del trabajo.