La terapia fotodinámica (TFD) se ha mostrado eficaz y segura en el tratamiento de las queratosis actínicas (QA) en importantes estudios en los últimos 5 años. Sin embargo, desde entonces, se han publicado varios trabajos con alguna evidencia contradictoria o añadiendo nuevos aspectos de esta terapia para su discusión, como es el tratamiento del campo de cancerización, el diagnóstico de fluorescencia, los resultados en pacientes trasplantados o la ausencia de estudios comparativos con otros tratamientos. En este trabajo revisamos estos nuevos aspectos de la TFD.
Photodynamic therapy (PDT) for the treatment of actinic keratosis has been shown to be effective and safe in large clinical trials published in the last 5 years. However, evidence has since emerged that raises questions or that introduces new issues, such as the management of field cancerization, fluorescence diagnosis and results in transplant recipients. There also remains a need for more studies comparing PDT to additional treatments. We review the literature on these new topics in PDT.
La terapia fotodinámica (TFD) está indicada para el tratamiento de queratosis actínicas (QA), especialmente para aquellos pacientes con múltiples lesiones, daño solar intenso y fototipos claros. Se aprobó para este tratamiento en 2005 en varios países europeos, incluido el nuestro. Su uso racional se sostenía, en aquellos primeros años, en varios ensayos clínicos de adecuado tamaño y diseño, que demostraban una respuesta de las lesiones entre el 69 y el 91%, bien de la TFD aislada, bien comparándola con placebo o crioterapia1–5 (tabla 1). Sin embargo, desde entonces hasta ahora se han publicado nuevos estudios que han revelado evidencias contradictorias o han profundizado en nuevos aspectos hasta ahora no considerados en trabajos previos, y que son de especial interés a la hora de manejar esta técnica, como es el campo de cancerización, la respuesta por localizaciones, las diferentes fuentes de luz, el manejo del dolor, el coste-eficacia, los pacientes trasplantados o el desarrollo de nuevos fotosensibilizantes (tabla 2).
Aspectos generales de la terapia fotodinámica en queratosis actínicas
| La TFD obtiene tasas de curación similares a la crioterapia en las QA (69–91%) |
| La TFD obtiene mejor resultado cosmético que la crioterapia en el tratamiento de las QA |
| Las QA no hipertróficas parecen responder mejor al tratamiento con TFD |
| Las mejores tasas de respuesta de QA a la TFD se obtienen en la cara |
| Dos sesiones obtienen mejor respuesta que una sola |
| La pauta más utilizada son dos sesiones separadas entre 1–3 semanas |
| Los parches de ALA en principio son igual de eficaces que el MAL |
| Es el tratamiento más caro, aunque igual de coste-efectivo que la crioterapia |
| Los pacientes prefieren ser tratados con TFD |
ALA: ácido delta-aminolevulínico; MAL: ácido metilaminolevulínico; QA: queratosis actínica; TFD: terapia fotodinámica.
Aspectos controvertidos de la terapia fotodinámica en queratosis actínicas
| Ausencia de estudios comparativos con otras opciones de tratamiento salvo la crioterapia (imiquimod, 5-fluorouracilo, diclofenaco) |
| Todas las fuentes de luz hasta ahora utilizadas se han mostrado eficaces: ausencia de estudios comparativos |
| El MAL menos concentrado se ha mostrado igual de eficaz |
| Tiempos de oclusión inferiores a tres horas se han mostrado eficaces |
| El papel del diagnóstico de fluorescencia aún no está definido |
| El tratamiento del campo de cancerización aún necesita más estudios dirigidos y comparados con otras opciones de tratamiento |
| Ausencia de estudios comparativos y de seguimiento en pacientes trasplantados |
MAL: ácido metilaminolevulínico
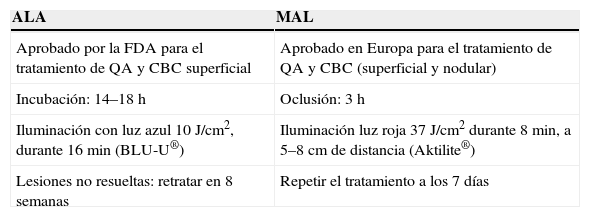
El ácido delta-aminolevulínico (ALA) y su éster, el ácido metilaminolevulínico (MAL) son los fotosensiblizantes más utilizados en Dermatología. Ambos son precursores de la protoporfirina IX (PpIX) a través de la vía intracelular de la enzima ALA-sintetasa. El ALA está aprobado por la Food and Drug Administration para el tratamiento de QA y carcinoma basocelular (CBC) superficial con luz azul. El MAL fue aprobado en Europa para el tratamiento de QA y CBC superficial y nodular. El MAL es más lipofílico, penetra más rápidamente en el tejido diana, por lo que requiere menor tiempo de oclusión y tiene menor absorción sistémica6. En un estudio reciente se ha demostrado que el ALA (no el MAL) es captado por las células endoteliales, lo que permite explicar que el ALA produzca más edema en la dermis de las lesiones tratadas y que el fraccionamiento de la iluminación sólo sea eficaz con este fotosensiblizante y no con MAL7.
En la literatura revisada sólo aparece un estudio que compara la eficacia de ambos fotosensibilizantes en el tratamiento de las QA no hipertróficas. En un estudio con doble enmascaramiento, que comparaba dos zonas (derecha e izquierda) del cuero cabelludo, se trataron a 16 pacientes sin encontrar diferencias estadísticamente significativas en la eficacia de ambos tratamientos8. Sin embargo, el tratamiento con ALA se mostró más doloroso que con el MAL. Existe otro estudio publicado en el que se evalúa el dolor en el tratamiento de QA con ambos fotosensibilizantes y se encuentra que el 14% de los pacientes tratados con MAL interrumpe el tratamiento por mala tolerancia frente al 54% de los pacientes tratados con ALA9. Las diferencias entre ambos fotosensibilizantes se resumen en la tabla 310,11.
Diferencias entre ácido delta-aminolevulínico y ácido metilaminolevulínico
| ALA | MAL |
| Aprobado por la FDA para el tratamiento de QA y CBC superficial | Aprobado en Europa para el tratamiento de QA y CBC (superficial y nodular) |
| Incubación: 14–18h | Oclusión: 3h |
| Iluminación con luz azul 10J/cm2, durante 16min (BLU-U®) | Iluminación luz roja 37J/cm2 durante 8min, a 5–8cm de distancia (Aktilite®) |
| Lesiones no resueltas: retratar en 8 semanas | Repetir el tratamiento a los 7 días |
No se han demostrado diferencias significativas en la eficacia de ambos tratamientos. ALA: ácido delta-aminolevulínico; CBC: carcinoma basocelular; FDA: Food and Drug Administration; MAL: ácido metilaminolevulínico; QA: queratosis actínica.
Recientemente se han desarrollado parches de ALA para TFD que en breve serán comercializados en nuestro país. Estos cuentan con estudios que han llegado a fase III de correcto diseño realizados por un grupo expertos, con Szeimies a la cabeza12,13. En ellos los parches demuestran tener eficacia similar al MAL con tasas de curación del 86 al 89% de las QA, y se han mostrado superiores en un solo tratamiento de manera estadísticamente significativa (p=0,007) a la crioterapia. Tras 12 meses de seguimiento tras una única sesión los resultados se mantienen, y así las lesiones que respondieron al tratamiento persisten aclaradas en porcentaje superior al placebo y a la crioterapia14.
Se trata de un sistema innovador de parches hidrocoloides que facilitan la oclusión y que abarcan 4cm2. Cada parche contiene 8mg de ALA y se ocluye durante 4h sin necesidad de curetaje.
A priori los resultados no son inferiores y están bien estudiados, pero quedan incógnitas por resolver, como es el tratamiento del campo de cancerización (habría que juntar varios parches) y el desarrollo del diagnóstico de fluorescencia con este sistema.
Estudios de terapia fotodimámica con ácido metilaminolevulínico en queratosis actínicas con diferentes fuentes de luzSe han utilizado varias fuentes de luz para TFD, tanto láser como no coherentes, todas ellas en torno a los 600nm, en la última banda Q del espectro de las porfirinas y con adecuada penetración para tratar las QA. El láser más utilizado es el de colorante pulsado (LCP) 595nm, capaz de trabajar a esas longitudes de onda minimizando los efectos secundarios (púrpura, hiper-hipopigmentación, cicatrices). Dentro de las luces no coherentes se han mostrado de utilidad una amplia variedad: luces de banda ancha, luces emisoras de diodos (LED), luz intensa pulsada (LIP), luz variable pulsada (LVP), la luz del día e incluso dispositivos portátiles preparados para ser utilizados en casa por los pacientes. En el momento actual todas ellas se han mostrado eficaces y, hasta ahora, no existe ningún estudio comparativo publicado que demuestre la superioridad de una respecto a otra en cuanto a resultados.
Existen dos publicaciones del tratamiento de QA con MAL y LCP como fuente de luz. El primero, publicado por Alexiades-Armenakas15 en 2006, reporta su experiencia satisfactoria en el tratamiento de múltiples dermatosis como QA, CBC y acné con metilaminolevulinato y LCP 595nm como fuente de luz, pero no aporta datos de resultados. En el segundo trabajo trataron a pacientes con CBC y QA con MAL y compararon los resultados de utilizar LCP 595nm y luz de banda ancha como fuentes de luz, sin apreciar diferencias entre ambas en cuanto a los resultados16.
Estudios recientes valoran la eficacia de los LED, posteriores a las luces de banda ancha utilizadas inicialmente. Algunos autores defienden la superioridad de los LED aludiendo que se trata de lámparas más seguras, que emiten menor calor, trabajan a menor voltaje y requieren menor tiempo de exposición para el tratamiento. Además, permiten una mejor penetración al tener una banda más estrecha de emisión y producen una mejor reacción fotodinámica. Sin embargo, en el momento actual no tenemos estudios que demuestren mejores resultados de las luces LED frente a las de banda ancha; hasta el momento lo que ha sido demostrado es que son similares (las diferencias halladas no son estadísticamente significativas, una no es superior respecto a la otra en la curación de las lesiones)17–19.
La luz intensa pulsada (LIP) y la luz variable pulsada (LVP) también han sido estudiadas como fuentes de luz en TFD. La LVP es una variante de la LIP en la que es posible modificar el número, el tiempo entre pulsos y la longitud y la distancia entre los pulsos. Ambas fuentes de luz se han mostrado eficaces en la TFD y capaces de tratar conjuntamente el fotoenvejecimiento cutáneo. Además, se ha comprobado que la LVP es menos dolorosa que los LED20,21.
La propia luz del día también se ha mostrado útil y eficaz en los interesantes estudios de Wiegell22,23. En ellos utiliza dosímetros para calcular la dosis recibida durante el tratamiento, y tras ocluir a los pacientes con MAL los someten a exposición solar durante un tiempo que en ocasiones llega hasta las 6h. No encuentra diferencias estadísticamente significativas entre ambas fuentes de luz (aclaramiento del 79% de las lesiones con luz del día y del 71% con LED), sin embargo, aprecia que la luz del día es significativamente menos dolorosa que los LED.
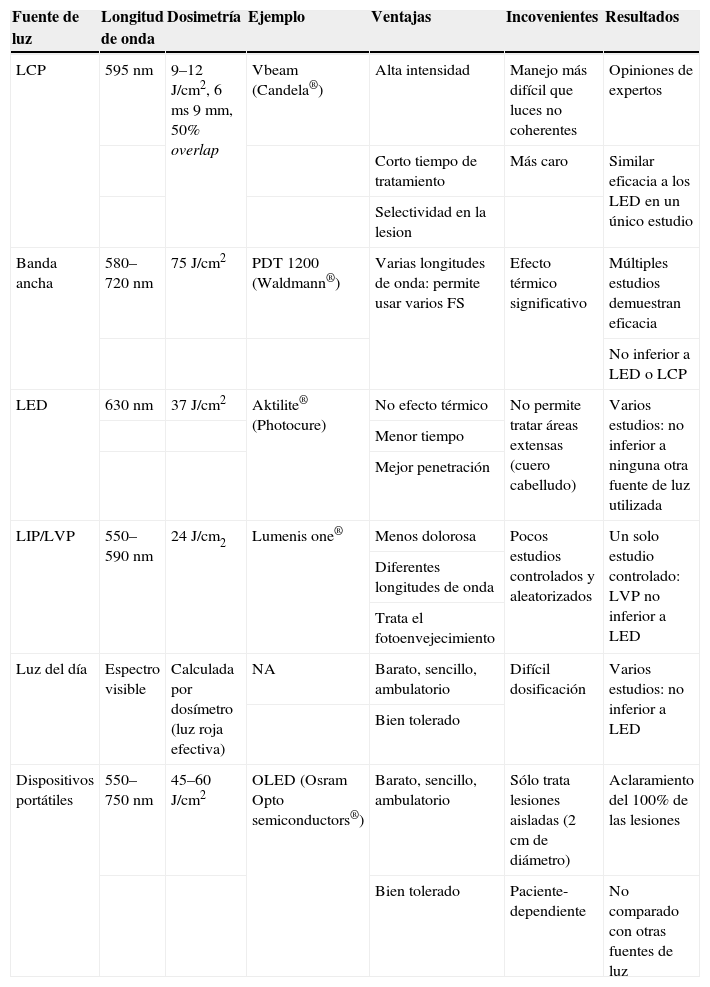
Finalmente, los trabajos del grupo británico de Moseley24,25 se han orientado hacia la búsqueda de dispositivos portátiles móviles que el paciente puede utilizar en su casa tras la oclusión del fotosensibilizante. Estos dispositivos también se han mostrado eficaces. La tabla 4 resume las diferentes fuentes de luz utilizadas en TFD, así como sus dosis y los resultados obtenidos.
Diferentes fuentes de luz utilizadas para el tratamiento de queratosis actínicas con terapia fotodinámica
| Fuente de luz | Longitud de onda | Dosimetría | Ejemplo | Ventajas | Incovenientes | Resultados |
| LCP | 595nm | 9–12J/cm2, 6ms 9mm, 50% overlap | Vbeam (Candela®) | Alta intensidad | Manejo más difícil que luces no coherentes | Opiniones de expertos |
| Corto tiempo de tratamiento | Más caro | Similar eficacia a los LED en un único estudio | ||||
| Selectividad en la lesion | ||||||
| Banda ancha | 580–720nm | 75J/cm2 | PDT 1200 (Waldmann®) | Varias longitudes de onda: permite usar varios FS | Efecto térmico significativo | Múltiples estudios demuestran eficacia |
| No inferior a LED o LCP | ||||||
| LED | 630nm | 37J/cm2 | Aktilite® (Photocure) | No efecto térmico | No permite tratar áreas extensas (cuero cabelludo) | Varios estudios: no inferior a ninguna otra fuente de luz utilizada |
| Menor tiempo | ||||||
| Mejor penetración | ||||||
| LIP/LVP | 550–590nm | 24J/cm2 | Lumenis one® | Menos dolorosa | Pocos estudios controlados y aleatorizados | Un solo estudio controlado: LVP no inferior a LED |
| Diferentes longitudes de onda | ||||||
| Trata el fotoenvejecimiento | ||||||
| Luz del día | Espectro visible | Calculada por dosímetro (luz roja efectiva) | NA | Barato, sencillo, ambulatorio | Difícil dosificación | Varios estudios: no inferior a LED |
| Bien tolerado | ||||||
| Dispositivos portátiles | 550–750nm | 45–60J/cm2 | OLED (Osram Opto semiconductors®) | Barato, sencillo, ambulatorio | Sólo trata lesiones aisladas (2cm de diámetro) | Aclaramiento del 100% de las lesiones |
| Bien tolerado | Paciente-dependiente | No comparado con otras fuentes de luz |
FS: fotosensibilizantes; LCP: láser de colorante pulsado; LED: diodos emisores de luz; LIP: luz intensa pulsada; LVP: luz variable pulsada; NA: no aplica.
Por tanto, podemos concluir que la fuente de luz no es un problema en la TFD, ya que muchas se han mostrado eficaces, y que no existe una fuente de luz ideal común para todas las indicaciones de la TFD. La elección de una u otra dependerá de distintos factores como disposición, coste, tiempo, localización o el proceso a tratar. Sin embargo, existe una franca escasez de estudios comparativos entre fuentes de luz que hacen necesarios más trabajos en este campo.
Localización y características especialesEn los primeros estudios publicados se mostraba cómo las lesiones más hiperqueratósicas respondían peor a la TFD, por lo que necesitaban tratamiento previo mediante curetaje o queratolíticos y más sesiones que las lesiones finas4. Ese hecho se explica por la menor capacidad de penetración del fotosensibilizante y la fuente de luz10. Estudios posteriores han arrojado evidencias contradictorias respecto de esta cuestión; así, un autor tan importante como Szeimies11 publicó en 2009 resultados similares con MAL en lesiones finas y gruesas, justificándolos en que utilizó una luz roja emisora de diodos (LED) y no una luz de banda ancha como se emplea en la mayoría de los estudios. Pero realmente, ¿se pueden justificar resultados similares por la fuente de luz? La longitud de onda de ambas luces que es la que determina la penetración en los tejidos, es la misma, aunque los LED tienen una banda más estrecha de emisión. Pero más controvertido es el estudio de Brathen26 en 2008, donde muestra mejores resultados en lesiones gruesas que en finas, con un periodo de incubación de una hora. Se trata de una pequeña muestra de 4 pacientes sin estudio estadístico que lo justifique y con un tiempo de incubación insuficiente para una QA hipertrófica, por lo que parece un hallazgo incidental.
Con respecto a la localización de las lesiones en varios estudios se halla que responden mejor las de la cara que las del cuero cabelludo y en algunos sólo se muestran los mejores resultados de forma descriptiva2,5,27, pero en otros se encuentran diferencias estadísticamente significativas respecto a localizaciones diferentes28. La principal explicación para estos resultados radica en lo expresado anteriormente: las lesiones en la cara son más finas, en general, que las del cuero cabelludo, por lo que la penetración del fotosensibilizante y la fuente de luz es más fácil. Esta sería también la explicación de por qué las lesiones en el dorso de las manos tienen una peor respuesta que las de la cara13.
Comparación con otros métodos de tratamientoEstudios posteriores han mostrado tasas similares de curación en regímenes de dos sesiones separadas entre 1 y 4 semanas, con resultados comparables a la crioterapia1,2,4. Sin embargo, aún existen escasos estudios comparativos con otros tratamientos utilizados para tratar múltiples QA y el campo de cancerización. En un estudio comparativo con 5-fluorouracilo encuentran que una sesión de TFD con ALA es igual de eficaz que tres semanas de tratamiento con 5-fluorouracilo, con mejor resultado cosmético en los pacientes tratados con TFD29. No existen estudios comparativos con imiquimod ni con diclofenaco tópico. En el caso del imiquimod, este obtiene tasas de curación del 54% de las lesiones en pautas de 8 semanas de tratamiento aplicado tres veces por semana, que son las que se utilizan habitualmente en Europa, por lo que, en principio, se le supone una eficacia superior a la TFD. Los resultados entre ambos tratamientos son similares en los regímenes de 16 semanas (también tres aplicaciones semanales) utilizados en EE.UU., donde imiquimod obtiene tasas de curación del 84% de las QA30.
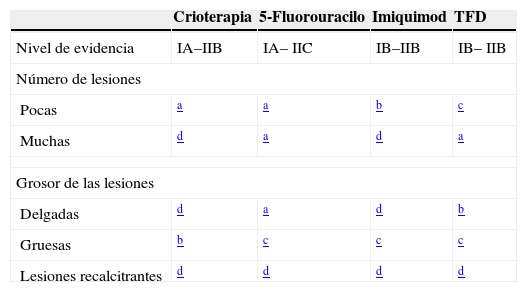
En las guías de tratamiento de las QA de la Asociación Británica de Dermatología se clasifica la TFD como una opción de tratamiento con un nivel de recomendación B y un nivel de evidencia I, superada por la crioterapia y el 5-fluorouracilo, ambos con un nivel de recomendación A y un nivel de evidencia I31. Sin embargo, en las guías clínicas del Foro Dermatológico Europeo, tanto la TFD como el 5- fluorouracilo y la crioterapia se incluyen como II-B, sin ser superadas por otras modalidades de tratamiento32. La tabla 5 resume las recomendaciones de ambas guías clínicas en el tratamiento de las QA. Podemos resumir que la TFD es especialmente ventajosa respecto a otras modalidades de tratamiento cuando tratamos lesiones múltiples, zonas con intenso daño actínico, lesiones localizadas en la cara donde obtenemos buenas respuestas, lesiones recurrentes y cuando el resultado cosmético es importante.
Resumen de las recomendaciones de las guías de tratamiento de queratosis actínicas de la Asociación Británica de Dermatología y del Foro Dermatológico Europeo18,44
Existen varios estudios en los que se investiga la impresión del paciente respecto a las diferentes modalidades de tratamiento, y llama especialmente la atención la prioridad de estos por la TFD. En el estudio de Morton, realizado en 2006, los pacientes comparan la TFD con la crioterapia, el 5-fluorouracilo tópico, el diclofenaco tópico y la escisión quirúrgica. Para ellos la TFD fue más efectiva (sin serlo en el estudio), igual de dolorosa y más cosmética5. Tierney en 2008 realiza un estudio sobre 45 pacientes y el tratamiento de QA con TFD, imiquimod o cirugía. Recopila la evaluación de los pacientes comparando los tratamientos sobre varios ítems: el tiempo de recuperación, el resultado cosmético, el coste del tratamiento, la efectividad y la preferencia. De manera estadísticamente significativa en todos los parámetros, la TFD es la mejor considerada por los pacientes33. Existen otros dos estudios en los que también se objetiva que los pacientes prefieren la TFD frente a otras opciones de tratamiento4,9. Por lo tanto, por lo que está publicado hasta ahora, no podemos asumir la superioridad del tratamiento de las QA con TFD frente a otros tratamientos; sin embargo, los pacientes prefieren ser tratados con TFD.
Tratamiento del dolorEl dolor que experimenta el paciente durante la irradiación de la fuente de luz en la TFD es sin duda la mayor limitación de esta técnica. Entre el 60–68% de los pacientes experimenta dolor leve a moderado34, incluso en alguno de los estudios publicados llega a alcanzar la calificación de insoportable en el 54% de los sujetos9. Es igual de dolorosa que la crioterapia5 y menos que el 5- fluorouracilo, según los pacientes35.
En general, las medidas locales para aliviar el dolor, como el uso de ventiladores o mojar la zona, son suficientes para tolerar la sesión. Ambas han demostrado disminuir de forma significativa el dolor36. El uso de anestésicos tópicos no es adecuado, ya que el pH básico de estos fármacos inactiva el MAL tópico, lo mismo que ocurre con los inyectados localmente con vasoconstrictor, que producen disminución del flujo sanguíneo y del oxígeno, fundamental para la reacción oxidativa de la TFD. El futuro del tratamiento del dolor se centra en los bloqueos nerviosos, especialmente indicado para pacientes con múltiples QA e intenso daño actínico, que son los que más dolor experimentan. En un reciente estudio publicado por los compañeros del Instituto Valenciano de Oncología (IVO), demuestran cómo el bloqueo de los nervios supraorbitario y supratroclear es un método eficaz, seguro y bien tolerado para el control del dolor durante la TFD y es, además, más efectivo que el uso de aire frío en las zonas sometidas a iluminación durante la TFD37 de forma estadísticamente significativa. Haldin et al publicaron también en 2009 la eficacia de los bloqueos nerviosos. Trataron a 10 pacientes y establecieron una comparación con no usar medidas para aliviar el dolor, resultando la diferencia estadísticamente significativa38.
Situaciones especiales de usoPacientes trasplantadosLa TFD se ha mostrado eficaz en el tratamiento de QA en pacientes trasplantados. El primer estudio publicado es el de Dagrieva en 200439, en el que trata a 17 pacientes con un total de 62 lesiones y lo compara con placebo. A las 16 semanas del tratamiento obtiene diferencias globales estadísticamente significativas (p=0,0003) a favor de la TFD. En 2007 se publica otro estudio40 en trasplantados renales que muestra tasas de aclaramiento de las lesiones de un 71%, siendo esta cifra inferior a la obtenida en las extremidades, con un 41%. Sólo existe un estudio comparativo en este grupo de pacientes y es con el 5-fluorouracilo. En dicho estudio la TFD obtiene tasas de curación de hasta el 100% de las lesiones y es significativamente (p=0,002) mejor que el 5-fluorouracilo.
Sin embargo, las evidencias encontradas hasta este momento sobre la capacidad de prevenir el desarrollo de carcinoma epidermoide sobre QA en los pacientes tratados son controvertidas41,42. En un primer estudio publicado en 2004, de adecuada metodología, no se encuentra esa capacidad41. En un segundo estudio, igualmente de adecuado método y tamaño muestral importante (81 pacientes y 889 lesiones), se encuentra una disminución notable de la aparición de nuevas QA, pero esta diferencia no es estadísticamente significativa (p=0,06)42. Aún son necesarios más estudios en este grupo de pacientes para establecer el papel preventivo de la TFD.
Campo de cancerizaciónEl término campo de cancerización fue acuñado en 1953 por Slaughter. Lo aplicó a todas las superficies epiteliales, incluida la piel, y como él mismo definía entonces: “el cáncer no es un fenómeno celular aislado, sino más bien una tendencia anaplásica adquirida por un grupo de células a la vez”43. Las QA son una enfermedad de campo, no limitada a las lesiones, por lo que se han descrito mutaciones en p53 y alteraciones en el ADN mitocondrial hasta de 7cm alrededor de carcinomas escamosos (CE). Se sabe que el riesgo de progresión de las QA a CE está entre el 1,5 y el 15%44. Es precisamente en el tratamiento del campo de cancerización donde la TFD puede ofrecer ventajas frente a la crioterapia, que es el tratamiento estándar con el que se compara en los estudios publicados. Sin embargo, hasta ahora no existen trabajos que comparen la TFD con otros tratamientos de campo, como el imiquimod, el 5-fluorouracilo o el diclofenaco. En este sentido, la mayoría de los estudios publicados hasta ahora buscaba una forma objetiva de medir las QA contando las lesiones una a una y comparándolas con las tratadas con crioterapia, pero si esto fuera real cuando tratamos a los pacientes con TFD sería mucho más ventajoso utilizar la crioterapia; es decir, en la práctica habitual los dermatólogos tratamos áreas de daño actínico, no lesiones aisladas, entonces, ¿por qué los estudios continúan analizando las lesiones una a una si no es lo que habitualmente hacemos? La TFD ya ha demostrado ser igual de eficaz que la crioterapia en el tratamiento de lesiones aisladas, es más, en un estudio reciente obtiene peores resultados que la crioterapia en las piernas27; ahora es el momento de estudiar el tratamiento del campo de cancerización. Es Babilas, en 2008, el primero en publicar su trabajo en QA con TFD orientado al tratamiento del campo18, pero desde entonces sólo hay uno posterior13. Si no tratamos el campo de cancerización no podremos evaluar una de las principales ventajas de esta técnica. Ambos estudios adolecen de seguimientos comparativos controlados a largo plazo que verifiquen si tratar el campo con TFD disminuye, respecto a no hacerlo, el riesgo de aparición de nuevas QA y la progresión a CE.
Otro aspecto interesante del manejo del campo de cancerización es la posibilidad de combinar varios tratamientos en diferentes momentos del seguimiento del paciente. Así, Shafelburg publica un estudio en 2009 en el que trata secuencialmente a los pacientes con TFD y posteriormente con imiquimod. El tratamiento fue bien tolerado y obtiene unas tasas de curación del 90% de las lesiones frente a un 74% con TFD únicamente (p=0,023)45.
El tratamiento del campo de cancerización es el futuro del tratamiento de las QA, sin embargo, aún faltan estudios sobre el uso y resultado a largo plazo de la TFD y que comparen o combinen la TFD con otros tratamientos del campo.
FotodiagnósticoConsiste en cuantificar y estudiar la fluorescencia roja de las lesiones inflamatorias, preneoplásicas y neoplásicas tras la oclusión con el fotosensibilizante y la iluminación con luz de Wood. Esta fluorescencia roja se debe a la acumulación de protoporfirina IX (PpIX) y se ha relacionado con la capacidad de producir daño en las células, es decir, si existe fluorescencia hay acumulación de PpIX y esas áreas son susceptibles de responder al tratamiento. El MAL tópico se ha mostrado como un fotosensibilizante ideal para el diagnóstico de fluorescencia (DDF), ya que es más lipofílico, atraviesa mejor las membranas celulares, se absorbe en menos tiempo y delimita mejor las lesiones.
Existen varios estudios publicados que trabajan sobre la hipótesis de la fluorescencia y su correlación con la respuesta al tratamiento. Así, Ericson46 en 2004 utilizó la intensidad de la fluorescencia medida mediante un sistema de software para calcular el fotoblanqueamiento de las lesiones tratadas (QA y CBC) con diferentes intensidades y su correlación con los resultados obtenidos. Concluyó que los resultados dependen del fotoblanqueamiento obtenido y que este se alcanza mejor a fluencias bajas (30mW/cm2).
Wiegell22 en 2008 publicó un interesante trabajo en el que midió la intensidad de la fluorescencia con sistemas de software a través de los píxeles de las fotografías de fluorescencia. Lo utilizó para comparar la fuente de luz LED con la luz del día tras ocluir a los pacientes con MAL durante tres horas. Encontró que la fluorescencia al terminar la exposición a la luz es mucho mayor en los pacientes tratados con LED, pero esta se iguala y disminuye en los dos grupos de pacientes a las 3–5h. Concluyó que la luz del día es igual de eficaz que la luz LED y es significativamente menos dolorosa. El mismo autor, en un estudio posterior23, midió la intensidad de la fluorescencia de nuevo, tratando a los pacientes con luz del día (dosis efectiva 30J/cm2) y MAL en dos concentraciones, al 8 y al 16%. No encontró diferencias en la intensidad de la fluorescencia ni en la respuesta de los dos grupos tratados. De estos dos trabajos se deduce que la intensidad de la fluorescencia es un parámetro lábil y que aún está por interpretar, que no varía según las concentraciones de MAL y que sí lo hace dependiendo del tiempo, la fuente de luz y las características de la epidermis.
Tras la observación de que la intensidad de la fluorescencia es un parámetro lábil, nuestro grupo trató de profundizar en las posibilidades del DDF correlacionando las áreas que emitían fluorescencia dentro del área tratada con la respuesta en un trabajo que fue publicado en esta revista28. Se realizó fotografía de fluorescencia digital antes y después del tratamiento, y se encontró que la diferencia de las áreas de fluorescencia a las tres semanas se correlacionaba con la respuesta al tratamiento. Sin embargo, nos enfrentamos a una gran limitación, que es la ausencia de un sistema de software capaz de medir esas áreas. Sin lugar a dudas, hoy en día el papel del DDF no está establecido. Medir intensidades no es claramente objetivo y carecemos de sistemas de software específicamente diseñados para ello. Aún son necesarios más trabajos sobre el interesante potencial que puede tener el DDF.
Coste del tratamientoLa TFD es el tratamiento más caro aisladamente si lo comparamos con el resto47, especialmente con la crioterapia, que es el más utilizado habitualmente, pero es igual de coste-efectivo a un año. En un estudio publicado en 2006 se evalúa el coste del tratamiento de pacientes con múltiples QA a lo largo de un año con crioterapia y con TFD, siendo la diferencia al final de este tiempo no significativa (tan sólo una libra más cara la TFD)48. Por lo tanto, no es un tratamiento caro como en un principio pueda parecer, especialmente para el tratamiento de pacientes con lesiones múltiples a medio y largo plazo (intenso daño actínico). Otro estudio publicado en 200949 avala de nuevo esta observación. Encuentran que la TFD como primer tratamiento, seguido de otros de segunda línea, es la mejor combinación para obtener una respuesta completa (91%), mientras que si siempre se utiliza TFD aumenta la probabilidad de obtener un resultado cosmético excelente (73%). En ambas situaciones la TFD se muestra como una opción coste-efectiva, al mismo nivel que otras opciones de tratamiento.
ConclusionesLos primeros años de manejo y desarrollo de la TFD en Dermatología han supuesto un gran avance, pero a su vez han aparecido controversias y nuevos aspectos en los que avanzar en el desarrollo de esta técnica. Parece claro que es un tratamiento preferido por el paciente, con tasas de curación de QA similares a la crioterapia, que obtiene mejores resultados en lesiones no hiperqueratósicas, con un resultado cosmético excelente y es una alternativa coste-efectiva, pero aún no se ha profundizado en otros aspectos como los resultados en el campo de cancerización, pacientes trasplantados, comparación con otros tratamientos y el diagnóstico de fluorescencia. La TFD está empezando su desarrollo y los dermatólogos aún tenemos que seguir trabajando para lograr su perfeccionamiento y mejor conocimiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.