INTRODUCCION
La historia de la sarcoidosis ha estado siempre íntimamente relacionada con la dermatología. Tanto es así que el primer caso publicado de sarcoidosis, atribuido a Hutchinson en 1877, corresponde a un paciente con múltiples placas purpúricas en manos y pies que fueron inicialmente consideradas manifestaciones de gota1. Posteriormente Hutchinson describió nuevos casos y sugirió que representaban una forma de enfermedad cutánea no reconocida hasta este momento2. Las descripciones posteriores también estaban centradas sobre todo en manifestaciones dermatológicas de la enfermedad, de forma que aún no se apreciaba la naturaleza sistémica de la sarcoidosis. Besnier3 utilizó por primera vez el término lupus pernio en 1889. El término sarcoidosis se debe a Boeck4, que denominó a unas lesiones cutáneas similares a las del caso inicial de Hutchinson como «multiple benign sarkoid of the skin». Utilizó el término «sarcoide» porque consideraba que las lesiones eran similares a un sarcoma, pero eran benignas. Otros dermatólogos autores de importantes contribuciones en el estudio de la enfermedad son Schaumann y Kveim. Schaumann fue el primero en darse cuenta de que la sarcoidosis era una enfermedad sistémica con manifestaciones cutáneas diversas y también fue el primero en apreciar que podía cursar sin lesiones cutáneas1,5. Kveim6 observó que la inoculación intradérmica de tejido sarcoide de un ganglio linfático de un paciente con sarcoidosis era capaz de inducir una lesión papulosa de sarcoidosis en 12 de 13 pacientes.
La sarcoidosis es una enfermedad granulomatosa multisistémica que afecta de manera predominante al pulmón y los ganglios linfáticos1,7. Suele afectar a jóvenes y adultos de mediana edad y con frecuencia se presenta con adenopatías hiliares bilaterales, infiltrados pulmonares y lesiones oculares y cutáneas. El diagnóstico se establece cuando los hallazgos clinicorradiológicos están apoyados por la presencia de granulomas no caseificantes1. Deben excluirse los granulomas de causas conocidas y las reacciones sarcoides locales.
EPIDEMIOLOGIA
La sarcoidosis es una enfermedad de distribución mundial que afecta a personas de todas las razas, todas las edades y de ambos sexos. Tiene predilección por presentarse en adultos jóvenes por debajo de los 40 años y por ciertos grupos étnicos y raciales7. A pesar de que por el momento no existe un estudio epidemiológico preciso, diversos datos sugieren que en la patogenia de la sarcoidosis pueden participar factores genéticos y uno o varios agentes ambientales, probablemente infecciosos8.
La aparición preferente de la enfermedad en ciertas áreas geográficas, en ciertas ocupaciones y en determinadas estaciones del año, apoya la posibilidad de que exista un agente causal ambiental para la sarcoidosis. Existen varios estudios que describen brotes de la enfermedad agrupados en diferentes localizaciones geográficas, como en la isla de Man, en Suecia o en Japón9-12. También se ha descrito la aparición de brotes estacionales de sarcoidosis en países como Japón, Suecia y Nueva Zelanda, y en Grecia y España más del 50 % de casos se presentan entre abril y junio8,13-17. Por último, la existencia de brotes ocupacionales de sarcoidosis entre personal sanitario, pilotos de avión, bomberos y oficinistas8,9,18,19, también sugiere que uno o varios agentes ambientales puedan estar implicados en su patogenia.
Por otra parte, las importantes diferencias en la incidencia y severidad de la enfermedad entre distintos grupos raciales sugieren la participación de factores genéticos. Los escandinavos y los afroamericanos presentan una prevalencia mucho mayor que el resto de razas12. Numerosos estudios indican que la sarcoidosis se produce de forma más aguda y grave en pacientes de raza negra que en el resto de grupos étnicos20,21 y la afectación extratorácica, como la uveítis o el eritema nudoso, es más frecuente en negros de Estados Unidos, portorriqueños y escandinavos22.
BASE GENÉTICA
Numerosas evidencias sugieren que existe una importante base genética en la patogenia de la sarcoidosis. Además de las diferencias en prevalencia entre diferentes razas también se ha observado una mayor incidencia en familiares de primer o segundo grado de pacientes afectados de sarcoidosis8,21,23,24. Sin embargo, la sarcoidosis no es la enfermedad de un solo gen sino que es una enfermedad genética muy complicada cuya predisposición viene determinada por una gran variedad de genes. Los antígenos de histocompatibilidad HLA-B7 y HLA-B8 son los alelos de clase I más relacionados con la enfermedad12,25,26. En cuanto a los de clase II, se han detectado diferentes haplotipos implicados en la resistencia o predisposición a la enfermedad, pero no ha sido todavía establecido un patrón distintivo de alelos de clase II12,27,28. Una región cromosómica importante en la patogenia de la sarcoidosis se encuentra en la región centromérica del cromosoma 16. Esta región es determinante en la susceptibilidad para las enfermedades inflamatorias intestinales29,30 y el síndrome Blau. El síndrome Blau es un trastorno granulomatoso autosómico dominante, que se manifiesta en la infancia y que presenta muchas similitudes con la sarcoidosis31. En la vecindad de esta región del cromosoma 6 se encuentran muchos genes que codifican citocinas, como el gen del factor de necrosis tumoral alfa (TNF-α).
INMUNOPATOGENIA
Las enfermedades granulomatosas se consideran el resultado de la respuesta inmunológica a la presentación continuada de un antígeno degradado de forma incompleta12,32. La enfermedad se origina cuando un estímulo antigénico desconocido estimula la activación de las células T quiescentes, generando una liberación de citocinas33,34. Estas citocinas inducirán el reclutamiento, activación y proliferación de células mononucleares y, finalmente, la formación de granulomas. La estimulación antigénica persistente determinará la perpetuación de los granulomas y la evolución clínica de la enfermedad.
Linfocitos y citocinas
La introducción hace más de dos décadas de la técnica de lavado broncoalveolar (LBA) permitió acceder a las células que componían el infiltrado inflamatorio de la sarcoidosis pulmonar. En 1981, Hunninghake y Crystal35 demostraron que el infiltrado inflamatorio estaba formado predominantemente por linfocitos T. Se sabe que en la sarcoidosis, en especial en formas agudas, se produce un aumento de células T alveolares, sobre todo de tipo CD4+. Existen dos tipos funcionales diferentes de células T CD4+ en función del patrón de citocinas que liberan36,37. El tipo Th1 libera interleucina (IL-2), interferón gamma (INF-γ) y linfotoxinas y está relacionado con la inmunidad mediada por células. El tipo Th2 libera IL-4, IL-5, IL-10 e IL-13 y está relacionado con la inmunidad humoral. En la sarcoidosis se ha observado que las células T alveolares liberan espontáneamente citocinas Th138,39, mientras que las citocinas Th2 están ausentes40. La citocina clave para inducir la respuesta Th1 es la IL-2, que es secretada predominantemente por macrófagos alveolares41. Se ha demostrado que un aumento de la secreción de IL-2 es un indicador de mal pronóstico en la sarcoidosis42,43.
Macrófagos y TNF-α
Los linfocitos y las células presentadoras de antígenos secretan abundantes citocinas y factores quimiotácticos de monocitos en el curso de la sarcoidosis44,45, lo cual provoca un aumento absoluto de macrófagos en los tejidos y la formación de granulomas. El estado activo de estos macrófagos en la sarcoidosis se ha demostrado por la liberación masiva y espontánea de citocinas44-47. Hace 15 años, en dos estudios se identificó un aumento en la liberación de TNF-α por los macrófagos alveolares en pacientes con sarcoidosis48,49. Actualmente, ésta es la citocina más estudiada y el punto clave en el mantenimiento de la inflamación y la formación del granuloma34,50. Además, el TNF-α estimula la proliferación de fibroblastos y aumenta la síntesis de colágeno y de esta manera se considera responsable de la evolución a la fibrosis pulmonar en la sarcoidosis51. La determinación de los valores de TNF-α en el fluido del LBA puede ayudar a identificar subgrupos de pacientes con mayor riesgo de progresión de la enfermedad34. También se ha observado que los pacientes que responden a corticoides presentan un descenso de los valores de TNF-α en los macrófagos alveolares49,52, mientras que los pacientes con enfermedad progresiva o los que no responden presentan valores elevados de TNF-α53. Una posible explicación es que el TNF-α disminuye la sensibilidad de los monocitos humanos a la dexametasona54. Estos hallazgos sugieren que las estrategias terapéuticas anti-TNF-α pueden ser beneficiosas en el tratamiento de la sarcoidosis.
Además de la liberación de citocinas, otros factores pueden estar implicados en la perpetuación de la respuesta granulomatosa. Recientemente se ha observado que la persistencia de los granulomas en la sarcoidosis puede ser debida a la reducción de los fenómenos de apoptosis en los macrófagos del granuloma debida a una reducción en la expresión de p2155.
MICROORGANISMOS IMPLICADOS EN LA PATOGENIA
Para establecer de manera epidemiológica un agente causal infeccioso se requiere el aislamiento del agente en los individuos afectados y la provocación de la enfermedad al inocular el supuesto agente infeccioso a un individuo sano. Hasta la fecha estas premisas no se han cumplido en la sarcoidosis. Por otra parte, como comentaremos posteriormente, nunca se ha descrito ningún caso de transmisión de sarcoidosis al realizar un test de Kveim.
Diversos agentes infecciosos como las micobacterias, algunos parásitos y algunos hongos, son capaces de producir respuestas granulomatosas y se han propuesto como posibles etiologías de la enfermedad12. También se ha sugerido que algunos agentes no infecciosos estarían implicados en la patogenia de la sarcoidosis, como el polen de los pinos, el talco, el aluminio, el berilio y el circonio, aunque ninguno de ellos ha sido fehacientemente confirmado como factor etiológico12,56-58. Todos estos agentes tienen en común su persistencia en los tejidos por su lenta biodegradabilidad, lo que parece ser un prerrequisito fundamental para la formación del granuloma.
Las similitudes patológicas entre la tuberculosis pulmonar y la sarcoidosis han sugerido un posible papel etiológico para las micobacterias en la sarcoidosis. El hallazgo de residuos de ácido α-diaminopipélico y de ácido micólico59, así como de ácidos grasos de micobacterias60 en las lesiones de sarcoidosis, sugieren su participación en la patogenia de la enfermedad. Otros estudios han detectado anticuerpos frente a micobacterias en pacientes con sarcoidosis, aunque trabajos más recientes no han confirmado estos hallazgos61,62. De forma similar, también se ha publicado el aislamiento de formas L de micobacterias en hemocultivos de pacientes con sarcoidosis63 pero posteriores estudios no han detectado diferencias con el grupo control64.
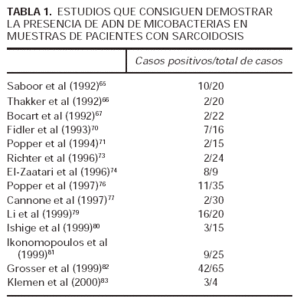
En los últimos años se han llevado a cabo múltiples estudios en los que se ha tratado de detectar la presencia de ADN de micobacterias en diferentes tejidos de pacientes con sarcoidosis12,65-84. En estos estudios la positividad oscila entre el 4,2 y el 80 % de casos65-84 (tablas 1 y 2). Hay un gran número de razones que pueden explicar la variabilidad de los resultados obtenidos, como variabilidad en función de la técnica usada en el procesamiento del ADN, posibilidad de contaminación durante el proceso de extracción del ADN, cantidad de ADN utilizado en la reacción en cadena de la polimerasa (PCR) y segmento de ADN diana escogido85.
Por otro lado, la ausencia de necrosis caseosa en la mayoría de casos, la poca frecuencia con la que se identifica el microorganismo, el hecho de que nunca se haya cultivado éste en tejido sarcoide y la falta de respuesta al tratamiento tuberculostático junto a la anergia tuberculínica, van en contra de que las micobacterias sean el agente etiológico de la sarcoidosis12.
Propionibacterium acnes es una bacteria comensal que suele ubicarse en la piel e intestino de individuos sanos y que genera reacciones granulomatosas cuando se inocula en animales de experimentación86. En diversos trabajos se han detectado evidencias que sugieren un posible papel de P. acnes en la patogenia de la sarcoidosis. En un estudio realizado en 1999 se detectó una mayor cantidad de genoma de Propionibacerium en muestras de pacientes afectados de sarcoidosis80 y en otro estudio internacional en el que colaboraron Japón, Italia, Alemania e Inglaterra, se detectó ADN de Propionibacterium en todas las muestras de ganglios de pacientes con sarcoidosis frente al 7-60 % en los casos control84. Por último, en un reciente estudio, Gazouli et al87 demostraron la presencia de ADN de P. granulosum en muestras de pacientes afectados de sarcoidosis.
Otros agentes infecciosos que han sido propuestos por algunos estudios pero desmentidos por otros incluyen Rickettsia helvetica88, Chlamydia pneumoniae89,90, Borrelia burgdorferi91-94, virus de Epstein-Barr12 y virus del herpes simple tipo 895-97.
SARCOIDOSIS CUTANEA
Las lesiones cutáneas de la sarcoidosis se clasifican en específicas y no específicas5. Las lesiones específicas son aquellas que histológicamente presentan granulomas sarcoides. Las lesiones inespecíficas son aquellas lesiones observadas con mayor frecuencia en pacientes portadores de una sarcoidosis sistémica pero que también pueden observarse aisladas o asociadas a otras enfermedades y cuya biopsia no permite el diagnóstico de la enfermedad5,98. Las lesiones específicas más frecuentes son maculopápulas, placas, lupus pernio, sarcoidosis de las cicatrices y sarcoidosis subcutánea5,98-102. La lesión no específica más importante es el eritema nudoso. Las lesiones cutáneas son más frecuentes en mujeres que en varones (2:1) y más frecuentes en la raza negra que en miembros de otras razas5. James y Williams103 observaron lesiones cutáneas en el 28 % de sus pacientes, de los cuales el 11 % correspondían a lesiones específicas y el 17 % a eritema nudoso.
LESIONES ESPECIFICAS DE SARCOIDOSIS
Se producen lesiones cutáneas específicas de sarcoidosis entre el 9 y el 37 % de pacientes con sarcoidosis sistémica100,104-110. Aunque pueden aparecer en cualquier momento en la progresión de la enfermedad, suelen producirse al inicio de ésta y los pacientes son con frecuencia diagnosticados por el dermatólogo111. También pueden ser un hallazgo de la exploración física en el estudio inicial del paciente que consulta por sintomatología sistémica98 y, por este motivo, es especialmente importante que en la evaluación inicial de todo paciente con sospecha de sarcoidosis se examine toda la superficie cutánea. Puesto que la biopsia cutánea es inocua y fácil de realizar, constituye un procedimiento diagnóstico no invasivo de gran utilidad que permite evitar técnicas diagnósticas agresivas98 y acortar el tiempo preciso para el diagnóstico de la sarcoidosis sistémica112.
La presencia o ausencia de lesiones cutáneas específicas en conjunto, carece de significado pronóstico en cuanto a la evolución de la enfermedad sistémica98,111,113,114. Únicamente en el estudio de Olive y Kataria se detectó una asociación entre presencia de lesiones cutáneas específicas y la presencia de linfadenopatía y hepatosplenomegalia115. Sin embargo, como después se comentará con mayor detalle, algunos tipos de lesiones cutáneas se asocian a formas agudas y otras a formas más crónicas y de evolución menos favorable.
La sarcoidosis es una de las enfermedades que puede producir una mayor variedad de lesiones cutáneas. Continuamente se están describiendo nuevas formas clínicas atípicas que simulan otras enfermedades de la piel, pero que presentan una histología granulomatosa típica de sarcoidosis. Sin embargo, consideramos que es mejor agrupar las lesiones específicas de sarcoidosis según su significado pronóstico en cuanto a la evolución de la enfermedad sistémica, más que por sus características estrictamente morfológicas. Por dicho motivo hablaremos de maculopápulas agrupando a lesiones más o menos superficiales que evolucionan en semanas o pocos meses, aunque algunas máculas estén algo infiltradas o algunas pápulas puedan confluir formando placas, a veces de configuración anular; hablaremos de placas si son más infiltradas y profundas y de evolución más lenta, incluyendo también lesiones redondeadas, sobreelevadas y persistentes que en realidad corresponderían estrictamente a lesiones nodulares; hablaremos de lupus pernio si las lesiones son de curso extremadamente crónico, de tonalidad más violácea y con cierta tendencia a la cicatrización; hablaremos de sarcoidosis de las cicatrices ante cicatrices previamente normales que se vuelven eritematosas e infiltradas y que presentan granulomas sarcoides a nivel histológico; hablaremos de sarcoidosis subcutánea únicamente en casos de infiltrados granulomatosos sarcoides limitados a tejido subcutáneo, con dermis suprayacente normal.
Desde el punto de vista clínico, las características propias de las lesiones granulomatosas de sarcoidosis se deben a la presencia de densas acumulaciones de granulomas de células epitelioides en la dermis116. El color oscila entre amarillo-ocre y marrón-violáceo, siendo este último más marcado en el lupus pernio. Al realizar una diascopia persiste una coloración pálida amarillo-grisácea. La epidermis está raramente afectada y en algunas formas clínicas puede observarse algún grado de dilatación vascular116.
MACULOPAPULAS
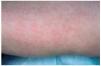
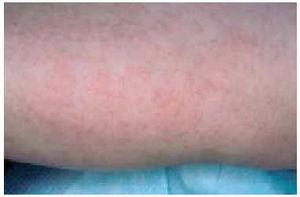
Las lesiones maculopapulosas constituyen en algunas series la forma más frecuente de lesión cutánea específica de sarcoidosis5,98,102,115 (fig. 1). Esta forma incluye lesiones no sobrelevadas y sólo discretamente infiltradas y lesiones sobrelevadas de menos de 1 cm de diámetro. Ambas son de coloración eritematomarronácea y presentan escasa lesión epidérmica. Suelen localizarse en la cara, principalmente alrededor de los ojos y en los pliegues nasolabiales, aunque también pueden encontrarse en la parte occipital del cuello y extremidades y, raramente, en el tronco y las membranas mucosas5,99-101. Las lesiones papulosas pueden simular xantelasmas, acné rosácea, lupus eritematoso, sífilis secundaria, tricoepiteliomas, adenoma sebáceo y granuloma anular117. A la diascopia presentan el típico color en jalea de manzana característico de las lesiones granulomatosas y según algunos autores suelen tener un aspecto más opaco que el lupus vulgar, simulando granos de arena116. En muchos casos son transitorias y parecen presagiar el inicio de la enfermedad99. En otros casos las pápulas pueden extenderse o confluir para formas lesiones anulares o placas5,118. Las lesiones maculopapulosas suelen asociarse a formas agudas de sarcoidosis como adenopatías hiliares, uveítis aguda, adenopatías periféricas o infiltración parotídea y suelen desaparecer en menos de 2 años100,114,119. En este sentido implican un pronóstico más favorable que otras formas de lesión específica de sarcoidosis98,116.
Fig. 1.--Aspecto clínico de lesiones maculopapulosas en extremidades.
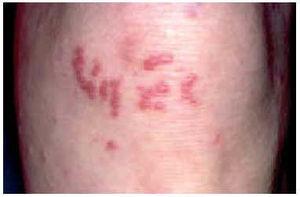
Recientemente se ha descrito una nueva variante clínica asociada con frecuencia a eritema nudoso, denominada sarcoidosis papulosa de las rodillas. Se trata de lesiones papulosas agrupadas en ambas rodillas, muchas veces con algunas lesiones dispuestas linealmente, lo cual les confiere un aspecto liquenoide120 (fig. 2). Histológicamente se ha observado la presencia de cuerpos extraños en una elevada proporción de pacientes (10 de 13 casos) y se considera una forma de transición entre sarcoidosis papulosa y sarcoidosis de las cicatrices. Es signo de buen pronóstico, puesto que suele asociarse eritema nudoso y formar parte del síndrome de Löfgren120. Se observa con mayor frecuencia cuando es buscada de manera prospectiva en pacientes con eritema nudoso, ya que las lesiones suelen ser transitorias y, si no son valoradas por un dermatólogo, pueden pasar inadvertidas.
Fig. 2.--Lesiones papulosas en rodillas, algunas de ellas dispuestas linealmente. Esta forma clínica suele asociarse a formas agudas de sarcoidosis (síndrome de Löfgren).
PLACAS
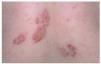
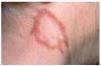
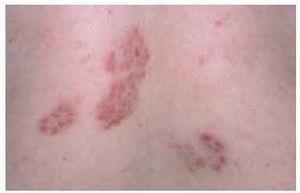
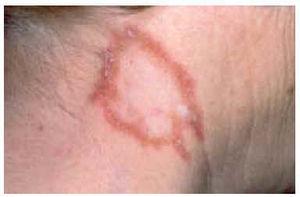
Las lesiones en forma de placa son casi tan frecuentes como las maculopápulas98,121. Consisten en placas redondeadas u ovaladas, infiltradas al tacto, de coloración eritematomarronácea5,98,101 (fig. 3). Cuando se realiza una diascopia se observan diminutos puntos amarillo-grisáceos, más oscuros que los nódulos en jalea de manzana del lupus vulgar5. Las placas presentan un infiltrado granulomatoso más profundo y un curso más crónico que las maculopápulas. En general son lesiones más gruesas, menos numerosas y más lentas en desarrollarse y desaparecer5. Pueden localizarse en las extremidades, cara, cuero cabelludo, espalda y nalgas98,101. Las placas pueden adoptar una configuración anular mediante extensión periférica y curación central, y esta morfología es especialmente frecuente en la frente, cara y cuello100,116 (figs. 4 y 5). En una serie se observaron lesiones anulares en 32 de 188 pacientes con lesiones sarcoides cutáneas114. En algunos casos las placas pueden curar con cicatrización, lo que conduce a alopecia cicatrizal permanente en el cuero cabelludo5,99,100,113. Las placas pueden simular lupus vulgar, necrobiosis lipoídica, morfea, lepra y leishmaniasis117. Suelen ser persistentes y con frecuencia se asocian a formas crónicas de sarcoidosis, como adenopatías hiliares persistentes, infiltrados pulmonares, fibrosis pulmonar, adenopatías periféricas, esplenomegalia o uveítis crónica98,113-115,119,122. Al contrario que el lupus pernio, las placas no están asociadas a quistes óseos ni a lesiones en tracto respiratorio superior99. Los pacientes con lesiones en forma de placa suelen presentar sarcoidosis de curso crónico, con persistencia de actividad de la enfermedad durante más de 2 años en la mayoría de casos98,114.
Fig. 3.--Lesiones cutáneas de sarcoidosis en la espalda en forma de placas de coloración eritematomarronácea. Algunas de las lesiones adoptan una configuración anular.
Fig. 4.--Aspecto típico de una placa anular en la frente.
Fig. 5.--Placa anular en la cara lateral de cuello, de evolución muy crónica y con cicatrización en el centro de la lesión.
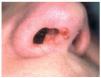
LUPUS PERNIO
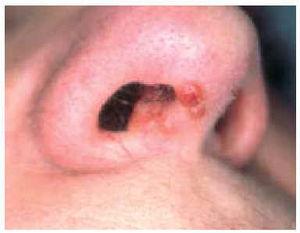
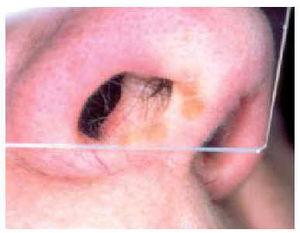
El lupus pernio es la lesión cutánea más característica de la sarcoidosis98,101. Tiende a afectar a personas de mayor edad que otras formas de sarcoidosis, es dos veces más frecuente en mujeres116 y es sobre todo frecuente en mujeres de raza negra1,102,116,123. Suele producirse en pacientes con sarcoidosis de larga evolución y es uno de los marcadores de enfermedad fibrótica crónica1,123. En la serie de Veien et al114, de un total de 188 pacientes con lesiones cutáneas sarcoides 22 correspondían a lupus pernio. Desde el punto de vista clínico consiste en nódulos y placas de coloración rojo-violácea, induradas al tacto, localizadas de forma más o menos simétrica en nariz, mejillas, orejas, labios y frente5,101,116 (fig. 6). En algunos casos pueden observarse pequeños nódulos de aspecto granulomatoso a la diascopia en la periferia de las lesiones116 (fig. 7). Como norma general, las lesiones cutáneas crónicas de sarcoidosis no son dolorosas ni pruriginosas, no tienden a ulcerarse1 y no son tan mutilantes como el lupus vulgar116. Sin embargo, a diferencia de formas más agudas, las lesiones de lupus pernio pueden ser desfigurantes, pueden producir alopecia cicatrizal116 y pueden precisar reconstrucción mediante cirugía plástica116,124. Cuando la nariz se encuentra afectada, con frecuencia también existe infiltración granulomatosa de la mucosa nasal y del tejido óseo y, en algunos casos, ulceración y perforación septal101. En efecto, en más de la mitad de los casos, el lupus pernio se asocia a sarcoidosis del tracto respiratorio superior (nasal, faríngea y/o laríngea)114,123,125,126, sobre todo en pacientes con lesiones en el margen de las ventanas nasales127. En cuanto a su significado pronóstico respecto a la evolución de la enfermedad sistémica, el lupus pernio se asocia de manera característica a fibrosis pulmonar, uveítis crónica y quistes óseos99. En una serie de 35 casos de lupus pernio se produjo afectación intratorácica en el 74 % de los casos, sarcoidosis del tracto respiratorio superior en el 54 %, quistes óseos en el 43 %, lesiones oculares crónicas en el 37 %, adenopatías periféricas en el 37 % y otras lesiones cutáneas específicas, en particulaafectados por lesiones de lupus pernio suelen presentar quistes óseos5 y cuando está afectada la falange terminal las uñas suelen ser distróficas128.
Fig. 6.--Lesiones infiltradas en ventana nasal de un paciente con lupus pernio, que suelen asociarse a la presencia de lesiones en el tracto respiratorio superior.
Fig. 7.--Aspecto de las lesiones de la figura 6 a la diascopia.
El lupus pernio suele seguir un curso extremadamente crónico (desde 2 a 25 años)99,119. La totalidad de casos descritos por Veien et al114 (22 pacientes con lupus pernio) presentaban enfermedad crónica activa a los 2 años de seguimiento.
SARCOIDOSIS DE LAS CICATRICES
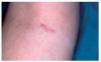
La sarcoidosis de las cicatrices consiste en la infiltración granulomatosa de cicatrices antiguas y constituye uno de los más característicos signos clínicos de la enfermedad98,116. Puede ser la única manifestación cutánea de la sarcoidosis y debe buscarse siempre que se plantee este diagnóstico116. La sarcoidosis de las cicatrices se ha observado en 26 de 188 pacientes con lesiones específicas de sarcoidosis114. Puede producirse tanto en cicatrices secundarias a intervenciones quirúrgicas, como a traumatismos, acné, punciones venosas, vacunaciones o test de Mantoux116,129. También es conocida la propensión de la sarcoidosis de localizarse en antiguos tatuajes, fenómeno que puede considerarse una variante de la sarcoidosis de las cicatrices100,130-134.
Cínicamente las cicatrices se vuelven eritematosas o purpúricas e induradas, mostrando la presencia de granulomas a nivel histológico (fig. 8). Con frecuencia se localizan en las rodillas116. La infiltración de las cicatrices tiende a persistir de acuerdo con la actividad de la sarcoidosis sistémica5,100,113,119. En la fase aguda, la sarcoidosis de las cicatrices puede desarrollarse a continuación de un eritema nudoso y entonces tiene utilidad diagnóstica116. Sin embargo, con mayor frecuencia se asocia a afectación pulmonar y mediastínica de larga evolución, uveítis, adenopatías periféricas, quistes óseos o infiltración parotídea99,100. Por otra parte, cambios en las cicatrices observados en pacientes con sarcoidosis en remisión sugieren una reactivación de su enfermedad102,135. Un total de 22 de 26 pacientes con sarcoidosis de las cicatrices descritos por Veien et al114 presentaron enfermedad activa crónica a los 2 años del diagnóstico.
Fig. 8.--Sarcoidosis de las cicatrices. Se observa una cicatriz eritematosa e infiltrada en codo.
Desde el punto de vista patogénico se ha considerado que la sarcoidosis de las cicatrices representa un fenómeno de Köbner116. Sin embargo, el hecho de que puede producirse años después del traumatismo va en contra de esta explicación. Por otra parte, en los últimos años de ha descrito la presencia de material exógeno en una significativa proporción de pacientes con lesiones específicas de sarcoidosis136,137 y se h a sugerido que dicho material, presente con frecuencia en las cicatrices, puede actuar como estímulo antigénico responsable de la inducción de la formación de granulomas en un punto concreto en un paciente que está desarrollando en este momento una sarcoidosis sistémica129,136-138.
SARCOIDOSIS SUBCUTANEA
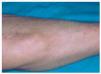
Es una forma poco frecuente de lesión específica de sarcoidosis que se ha observado en el 6 % de los pacientes con sarcoidosis sistémica en una serie106 y en el 1,4 % en otra139. La mayoría de casos se han producido en mujeres, sobre todo en la quinta y sexta décadas de la vida140. Clínicamente consiste en lesiones nodulares subcutáneas, móviles, de consistencia firme, de entre 0,5 y 2 cm de diámetro, no dolorosas y sin afectación epidérmica5,98,141. Pueden oscilar entre 1 a 100 en número y suelen localizarse en las extremidades141 (fig. 9). Son especialmente frecuentes en los antebrazos y también se han descrito en las manos en forma de hinchazón asintomática fusiforme de los dedos142.
Fig. 9.--Las lesiones de sarcoidosis subcutánea son a menudo más palpables que visibles. En este caso pueden observarse lesiones nodulares recubiertas por piel de aspecto normal en antebrazo.
Al contrario que el eritema nudoso, las lesiones de sarcoidosis subcutánea son indoloras y de color de piel normal y pueden persistir durante mucho más tiempo139. Aunque anteriormente se consideraba que solía aparecer en etapas tardías de la enfermedad106,141, artículos más recientes afirman que las lesiones subcutáneas constituyen la primera manifestación de la enfermedad en más del 50 % de casos140 y pueden ser la única manifestación inicial de la misma143. Aunque la evolución de los pacientes en los casos publicados es en general favorable, en el estudio realizado por Kalb et al141 la presencia de lesiones específicas subcutáneas no ayudó a predecir el curso de la enfermedad ni la respuesta al tratamiento.
El diagnóstico diferencial debe incluir toda causa de nódulo subcutáneo sin afectación epidérmica como quistes epidérmicos, lipomas, nódulos reumatoideos, esclerodermia morfea, metástasis cutáneas y lesiones menos frecuentes como tuberculosis y micosis profundas141,144. También se han descrito casos que simulan carcinoma de mama145.
LESIONES INESPECIFICAS. ERITEMA NUDOSO
El eritema nudoso es la forma más frecuente de lesión cutánea inespecífica de sarcoidosis y con frecuencia también es la manifestación inicial de la enfermedad146. Es el marcador de la sarcoidosis aguda y benigna y tiende a afectar a personas más jóvenes (edad media de 30 años) que las lesiones cutáneas infiltrativas (edad media 48 años)114. Del análisis de varias series de diferentes países se desprende que la sarcoidosis es la causa del eritema nudoso en el 37 % de los casos (oscilando entre el 11 y 74 %)146. Por otra parte, la prevalencia del eritema nudoso en la sarcoidosis oscila entre el 4 y el 35 %146, y en un amplio estudio realizado a nivel mundial fue del 17 %108.
La asociación entre eritema nudoso y adenopatías hiliares bilaterales y paratraqueal derecha, con o sin infiltrados pulmonares, es conocida como síndrome de Löfgren147-150. El síndrome de Löfgren es más frecuente en algunas áreas geográficas y en determinadas razas. La mayor incidencia se ha observado en mujeres jóvenes de raza blanca de países nórdicos e Irlanda107,149,151-153 y también es la forma más frecuente de sarcoidosis en España, donde representa más del 40 % de los casos109,110,154,155. Badrinas et al14 describieron la variación estacional de su incidencia en España, puesto que casi la mitad de sus 186 casos se iniciaron en primavera. Estos brotes estacionales sugieren que un factor ambiental no identificado podría desempeñar un papel importante en la etiología de la enfermedad14,16,154. En el síndrome de Löfgren las lesiones de eritema nudoso pueden acompañarse de fiebre, poliartralgias y uveítis anterior. Las adenopatías mediastínicas en ocasiones pueden ser unilaterales o únicamente paratraqueales, produciendo dificultades en el diagnóstico diferencial con tuberculosis y enfermedades linfoproliferativas. Sólo aproximadamente la mitad de los pacientes tienen elevados los valores de la enzima conversora de la angiotensina. Aunque estos valores no son indicadores de la actividad de la enfermedad, un valor normal está asociado a buen pronóstico155,156. Aunque se ha sugerido que en casos característicos el diagnóstico puede ser aceptado sin confirmación histológica, se ha recomendado la biopsia del músculo gastrocnemio como procedimiento diagnóstico poco agresivo110,155. El pronóstico del síndrome de Löfgren es muy bueno, puesto que es una enfermedad autolimitada que suele volverse inactiva en el primer año de evolución16,150,151,155,157-159.
En general, cuando la sarcoidosis cursa con eritema nudoso, ésta suele evolucionar como una enfermedad benigna y autolimitada146,158,160,161. En una serie de 251 pacientes con sarcoidosis que se manifestaron con eritema nudoso, en el 83 % de los casos la enfermedad remitió en menos de 2 años y únicamente el 16 % de los pacientes presentaba enfermedad activa a los 2 años del diagnóstico158. En un estudio multivariante, Mañá et al160 demostraron que la ausencia de eritema nudoso constituye un factor de riesgo para la persistencia de actividad de la enfermedad.
Otras lesiones inespecíficas que pueden producirse asociadas a sarcoidosis, aunque con una frecuencia muy inferior, incluyen calcificaciones, prurigo y eritema multiforme5,102.
HISTOPATOLOGIA
Los cambios histológicos son similares en todos los órganos afectados por la enfermedad116,162. La característica esencial es la repetición monomorfa de agregados de células epitelioides que forman unos granulomas pequeños y uniformes, que se conocen como granulomas sarcoideos116,162-164. Con frecuencia se observan algunos linfocitos en el margen de los granulomas, pero suelen ser escasos y por este motivo se habla de granulomas desnudos116,162. Los granulomas suelen contener pocas o ninguna células gigantes, en general tipo Langhans, que pueden ser algo más abundantes en lesiones antiguas165, aunque se han descrito casos de corta duración con abundantes células gigantes166. La presencia de necrosis caseosa es rara en las lesiones de sarcoidosis162,167. Sin embargo, pueden observarse discretos focos de necrosis de coagulación en el centro de algunos granulomas sarcoides en regresión168. Aunque según los libros de texto la epidermis no suele estar afectada en la sarcoidosis, en un reciente estudio 49 de 62 casos presentaron cambios epidérmicos (hiperqueratosis, acantosis, paraqueratosis o atrofia epidérmica)169. También se han descrito fenómenos de eliminación transepidérmica170.
Las células gigantes pueden contener cuerpos de inclusión116. Los cuerpos de Schaumann son estructuras laminares concéntricas, basofílicas, de 100 μ de diámetro, compuestas de lipomucoglucoproteínas impregnadas de calcio y hierro; los cuerpos asteroides miden entre 10 y 15 μ, están constituidos por fibras de colágeno y morfológicamente tienen un cuerpo central rodeado por espículas radiales, que le dan una imagen en paraguas abierto116. Ninguno de estos cuerpos es específico de sarcoidosis, puesto que se han observado también en otros procesos granulomatosos como tuberculosis, lepra y beriliosis162-164. Siempre se había considerado que la presencia de cuerpos extraños exógenos en el interior de un granuloma cutáneo era un argumento en contra del diagnóstico de sarcoidosis. Sin embargo, recientemente diversos estudios han detectado cuerpos extraños en una considerable proporción de pacientes con lesiones específicas de sarcoidosis (22-24 %)136,137 y sugieren que su presencia no excluye necesariamente el diagnóstico de la enfermedad136,137,171.
Durante el desarrollo del granuloma las células epitelioides se vuelven más numerosas y compactas y aumenta el número de células gigantes116,162. Con el tiempo se desarrolla fibrosis, que es la causa de la cicatrización propia de las lesiones de mayor tiempo de evolución. Cuando el granuloma involuciona, la fibrosis se extiende desde la periferia hacia el centro del mismo, con desaparición gradual de las células epitelioides168.
LA PIEL EN EL DIAGNOSTICO DE LA SARCOIDOSIS SISTÉMICA
El diagnóstico de la sarcoidosis se basa en la presencia de un cuadro clinicorradiológico compatible, la demostración histológica de granulomas no caseificantes con tinciones y cultivos negativos para micobacterias y hongos y la exclusión de otras enfermedades granulomatosas1. En la práctica diaria suelen surgir dificultades a la hora de demostrar la presencia de granulomas. Por dicho motivo, cuando se sospecha el diagnóstico de sarcoidosis es en especial importante detectar la presencia de lesiones en la piel, puesto que una simple biopsia cutánea puede evitar procedimientos diagnósticos agresivos98.
Otro procedimiento diagnóstico en el cual la piel está implicada es el test de Kveim-Stiltzbach. El test de Kveim-Siltzbach fue utilizado por primera vez por Kveim6 en 1941 mediante la inoculación de extractos obtenidos a partir de adenopatías de pacientes con sarcoidosis. El test fue a continuación validado por Siltzbach172,173 en varios estudios sobre un elevado número de pacientes y en la actualidad se obtiene a partir de tejido esplénico de pacientes portadores de sarcoidosis. El test de Kveim-Siltzbach es positivo en el 70-90 % de pacientes con síndrome de Löfgren155,174. En pacientes con enfermedad intersticial pulmonar aislada, pacientes con sarcoidosis limitada a órganos extratorácicos o aquellos con enfermedad de evolución crónica (más de 2 años), los índices de positividad se reducen al 25-50 %173,174. Por otra parte, pueden producirse reacciones falsamente positivas sólo en el 0,7-2 % de los controles, con lo cual un test de Kveim-Siltzbach positivo apoya el diagnóstico de sarcoidosis con un alto grado de especificidad175. El agente responsable de la reacción granulomatosa todavía es desconocido, a pesar de múltiples estudios dirigidos a su identificación174,176-178.
En los últimos años la utilización del test Kveim-Siltzbach se ha visto muy limitada, sobre todo debido a la dificultad en acceder a la suspensión de Kveim. Además, en los años 1990 algunos autores habían desaconsejado su uso debido a la posibilidad de transmisión de agentes infecciosos o de la propia sarcoidosis y habían propuesto una moratoria en el uso del test179. Sin embargo, la meticulosa preparación de los extractos de tejido esplénico, que incluye irradiación, pasteurización y congelación, convierten en remota la posibilidad de transmisión180,181. Por otra parte, nunca se ha descrito ningún caso de transmisión de enfermedad infecciosa alguna mediante el test de Kveim-Siltzbach180. La discusión sobre este tema se ha reactivado en los últimos años debido a la posibilidad de transmisión de la encefalopatía espongiforme bovina182,183. En la actualidad, el Spongiform Encephalopathy Advisory Committee y el Committee on the Safety of Medicines han establecido que sólo bazos obtenidos de pacientes de países libres de la enfermedad pueden ser usados en la elaboración de la suspensión de Kveim182,183. En el Reino Unido se ha suspendido el test. Sin embargo, en Estados Unidos de América éste todavía se utiliza y la American Thoracic Society, la European Thoracic Society y la World Association on Sarcoidosis and Other Granulomatous Disorders, siguen recomendando el uso del test de Kveim-Siltzbach1.
El diagnóstico de la sarcoidosis sistémica puede ser muy difícil en algunos casos, en especial en aquellos pacientes en los cuales sólo un órgano está afectado. Es sobre todo problemática la neurosarcoidosis184, en la cual las exploraciones precisas para el diagnóstico pueden estar asociadas a graves complicaciones. Es en estos casos en los cuales el test de Kveim-Siltzbach puede seguir estando indicado como procedimiento diagnóstico.
FORMAS ATIPICAS
Se han descrito gran variedad de lesiones cutáneas granulomatosas clínicamente atípicas en pacientes con sarcoidosis116. Se trata de formas muy poco frecuentes, pero que deben tenerse en cuenta en el diagnóstico diferencial de lesiones cutáneas con histología granulomatosa. Por ejemplo, cabe tener en cuenta que la sarcoidosis cutánea puede ser causa de alopecia185-190, lesiones atróficas191, lesiones ulceradas192-196 o incluso de eritrodermia116,197,198. En personas de raza negra las lesiones hipopigmentadas son especialmente frecuentes199-201. También se han descrito con cierta frecuencia lesiones ictiosiformes202-204, formas liquenoides205-207 y lesiones tipo granuloma anular208. Otras formas menos frecuentes incluyen lesiones seudotumorales209, lesiones que simulan neoplasia de mama210,211, lesiones verrugosas116,212, lesiones psoriasiformes213-215, lesiones similares a lupus eritematoso116, pústulas foliculares5, erupción papulosa en áreas fotoexpuestas5, eritema palmar214,216, lesiones queratósicas en palmas simulando psoriasis o sífilis116 y erupción granulomatosa pruriginosa217. Las lesiones específicas de sarcoidosis pueden producirse en localizaciones peculiares como la vulva218, el escroto219 o la uña220-222. Finalmente, el desarrollo de edema de extremidades inferiores, en general unilateral, también puede ser una manifestación poco común de sarcoidosis223,224.
TRATAMIENTO DE LA SARCOIDOSIS CUTANEA
El tratamiento de elección de la sarcoidosis con significativa afectación sistémica es la administración de corticoides por vía oral1,98,146. La dosis recomendada para la sarcoidosis pulmonar es de 30 a 40 mg de prednisona al día, con reducción gradual hasta dosis de 5-10 mg al día o a días alternos mantenidas durante al menos un año1,98. En casos de uveítis grave, neurosarcoidosis o afectación cardíaca sintomática pueden ser precisas dosis de 1 mg/kg/día1,98. En pacientes que precisan la administración mantenida de corticoides puede considerarse el tratamiento con antimaláricos y citotóxicos1. Las lesiones cutáneas en general responden al tratamiento de la enfermedad sistémica117,146,225,226 pero con frecuencia recidivan al bajar la dosis de corticoides146. Las lesiones cutáneas no suelen ser por sí solas indicación para tratamiento con corticoides sistémicos y éstos tan sólo pueden estar indicados en lesiones que cursen con importante cicatrización, como placas de evolución crónica y lupus pernio98.
Cuando no hay afectación visceral significativa que justifique el tratamiento con corticoides, las opciones de tratamiento para las lesiones cutáneas son limitadas146 puesto que las recomendaciones terapéuticas suelen estar basadas en datos anecdóticos y no hay ensayos clínicos controlados que demuestren que un tratamiento sea superior a otros7,117, de forma que cada paciente debe ser considerado de manera individual.
Tratamientos no sistémicos
En algunos casos aislados, las lesiones cutáneas han respondido a corticoides tópicos potentes227,228 o a infiltraciones intralesionales de acetónido de triamcinolona a concentraciones de 2 a 5 mg/ml101,229,230. En ocasiones s e han utilizado la crioterapia y la radioterapia116,231. El láser de dióxido de carbono (CO2) o el láser de colorante pulsado pueden ser útiles para lesiones de lupus pernio232-235, aunque también se han descrito reacciones adversas en forma de ulceración de lesiones cutáneas de sarcoidosis inducida por el tratamiento con láser en una de ellas236. Otros tratamientos quirúrgicos utilizados son la dermoabrasión, la exéresis quirúrgica y el injerto para formas ulceradas y cirugía plástica para lesiones cicatrizales237,238. También se ha descrito la respuesta de la sarcoidosis cutánea a terapia fotodinámica tópica239.
Tratamientos sistémicos
Antipalúdicos
Siltzbach y Teirstein240 publicaron en 1964 un estudio sobre el tratamiento de la sarcoidosis con cloroquina. Dichos autores trataron una serie de 43 pacientes con sarcoidosis intratorácica o cutánea en la que obtuvieron mejoría de las lesiones en más de la mitad de los casos. Desde entonces se considera que la cloroquina en dosis de 250 a 500 mg/día o la hidroxicloroquina en dosis de 200 a 400 mg/día241,242 son particularmente útiles en el tratamiento de lesiones cutáneas crónicas y pueden ser utilizadas para reducir las dosis precisas de corticoides en casos sobre todo graves98,101.
Citotóxicos
De todos los inmunosupresores evaluados hasta el momento, el metotrexato parece ser el más eficaz101. También se han utilizado azatioprina y clorambucilo, pero los resultados obtenidos con estos fármacos han sido menos satisfactorios101. La administración de metotrexato en dosis de 15 mg/semana se utiliza cada vez con mayor frecuencia para pacientes con enfermedad crónica y puede ser eficaz frente a enfermedad pulmonar y cutánea226,243-245.
Otros tratamientos
La administración de alopurinol en dosis de 100 a 300 mg/día durante varios meses se ha mostrado efectiva en algunos casos de sarcoidosis cutánea246-249. La talidomida ha sido eficaz en pacientes que no respondieron a otros tratamientos250-252 y su mecanismo de acción se ha analizado recientemente253. También hace poco Baughman et al254 han tratado 15 pacientes con lupus pernio con talidomida. En 10 de 12 casos valorables las lesiones mejoraron objetivamente y los autores consideran que constituye un tratamiento efectivo para formas crónicas de sarcoidosis cutánea y que puede ser una alternativa útil a los corticoides orales254. Entre otros tratamientos utilizados destaca la isotretinoína, que ha sido efectiva en algunos pacientes255,256, mientras que la respuesta a ciclosporina ha sido variable116. La PUVA (psoraleno y luz ultravioleta) ha sido utilizada con éxito en casos de sarcoidosis hipopigmentada257 y eritrodérmica226. En raras ocasiones se han utilizado otros tratamientos como tranilast258, melatonina259 y prospidina260.
Entre los artículos publicados en los últimos 2 años destaca la remisión completa de las lesiones cutáneas en 8 de 12 pacientes mediante minociclina en dosis de 200 mg/día261, la efectividad de micofenolato en 5 pacientes con sarcoidosis mucocutánea y variable grado de afectación sistémica que no habían respuesto a otros tratamientos262 y la remisión completa de las lesiones de 3 pacientes que no habían mejorado con otros tratamientos mediante la administración oral de ácido fumárico263. Finalmente, también en los últimos años se ha publicado la respuesta de diversos casos de sarcoidosis cutánea a infliximab264-267 y etanercept268, lo cual sugiere que la inhibición del factor de necrosis tumoral puede ser útil como tratamiento de la sarcoidosis.
En cuanto a las lesiones inespecíficas (no granulomatosas), el eritema nudoso no precisa por sí mismo tratamiento inmunosupresor. La administración oral de antiinflamatorios no esteroideos (en particular ácido acetilsalicílico o indometacina) o de yoduro potásico suele ser suficiente para aliviar la sintomatología asociada a la paniculitis98.