Se ha reportado un riesgo de reactivación de hepatitis B pasada de hasta el 5% en pacientes tratados con fármacos dirigidos contra el factor de necrosis tumoral para enfermedades distintas a la psoriasis. Nuestro objetivo es investigar el riesgo de reactivación del virus de la hepatitis B en pacientes con hepatitis B pasada y psoriasis tratada con biológicos.
Material y métodosEstudio multicéntrico en el que se incluyeron 20 pacientes con serología sugestiva de hepatitis B pasada (antiHBc+, antígeno HBs–) y diagnóstico de psoriasis tratada con al menos un biológico. Se recogieron variables clínicas, serológicas y de función hepática antes, durante y al final del seguimiento. Se obtuvo una carga viral al final del seguimiento en todos los pacientes.
ResultadosNingún paciente mostró criterios de reactivación de hepatitis B al final del estudio, con una mediana de seguimiento de 40 meses. Sumando los datos de otras series publicadas de pacientes con psoriasis y hepatitis B pasada tratados con biológicos, el riesgo máximo sería de 2,7 reactivaciones por 100 pacientes tratados con un seguimiento medio de unos 30 meses.
ConclusionesEn nuestro estudio el tratamiento con biológicos no provocó ninguna reactivación de hepatitis B. Sin embargo, debido a las graves complicaciones asociadas a la misma, se aconseja descartar portadores ocultos en pacientes con hepatitis B pasada antes de iniciar tratamiento biológico (solicitando una carga viral al inicio del mismo), así como un seguimiento conjunto con un hepatólogo.
A 5% risk of reactivation of hepatitis B virus (HBV) infection has been reported in patients with diseases other than psoriasis treated with tumor necrosis factor inhibitors. The aim of this study was to investigate the risk of HBV reactivation in patients with a past history of HBV infection who were receiving biologic therapy for psoriasis.
Material and methodsThis was a multicenter study of 20 patients with psoriasis who were treated with at least 1 biologic agent. All the patients had serologic evidence of past HBV infection (positive total hepatitis B core antibody and negative hepatitis B surface antibody). We analyzed the clinical, serological, and liver function variables recorded before, during, and at the end of follow-up. The viral load at the end of follow-up was also analyzed for all patients.
ResultsNone of the patients fulfilled the criteria for HBV reactivation at the end of a median follow-up period of 40 months. Combining our data with data from other studies of psoriasis patients with a past history of HBV infection who were treated with a biologic, we calculated a maximum estimated risk of HBV reactivation for a mean follow-up period of 30 months of 2.7 reactivations per 100 patients.
ConclusionsBiologic therapy did not cause HBV reactivation in our series of patients. Nonetheless, because of the potentially serious complications associated with HBV reactivation, it is important to measure viral load in patients with a history of HBV infection prior to initiation of biologic therapy to rule out occult carriage. These patients should also be monitored regularly in conjunction with a hepatologist.
La infección por el virus de la hepatitis B (VHB) constituye un problema de salud pública mundial, con una prevalencia estimada de más de 350 millones de portadores, aunque con marcadas diferencias geográficas1. España se encuentra dentro de los países de endemicidad intermedia. Tras la instauración de los programas de vacunación universal contra el VHB, la prevalencia en el año 2007 de portadores del antígeno HBs (AgHBs) y de hepatitis B pasada disminuyó a un 0,7% y un 8,7%, respectivamente, aunque estos porcentajes son más elevados en grupos de edad avanzada y en población inmigrante2. La infección crónica por VHB es un proceso dinámico en el cual la hepatitis B pasada corresponde a la «fase AgHBs negativo» en la que puede persistir una baja replicación viral3.
La psoriasis es una enfermedad inflamatoria de la piel cuya prevalencia varía considerablemente según las poblaciones estudiadas4. En España, el estudio más reciente sitúa la cifra en 2,3% de afectados5. Los fármacos biológicos dirigidos a bloquear el factor de necrosis tumoral alfa (TNFα) o la interleucina 12/23 han revolucionado el tratamiento de la psoriasis grave. Dado su carácter inmunosupresor, estos agentes pueden favorecer la reactivación de infecciones virales, con casos a veces fulminantes6. La reactivación puede aparecer en cualquier momento del tratamiento, aunque es más frecuente al inicio del mismo o después de finalizarlo debido al fenómeno de reconstitución inmunológica3. El objetivo de este estudio es investigar la evidencia de reactivación de hepatitis B en pacientes con psoriasis y serología sugestiva de hepatitis B pasada tratados con fármacos biológicos.
Material y métodosDe todos los pacientes incluidos entre septiembre de 2008 y octubre de 2013 en BIOBADADERM, registro español de acontecimientos adversos de tratamientos sistémicos en psoriasis, en el que se introducen los pacientes de forma prospectiva y cuyo método ya ha sido descrito previamente7, se seleccionaron aquellos que cumplían los siguientes criterios:
- -
Tratamiento con anti-TNFα o ustekinumab.
- -
Evidencia serológica de hepatitis B pasada previo al tratamiento (presencia en suero del anticuerpo dirigido al core del virus de la hepatitis B [antiHBc] con negatividad para AgHBs y con presencia o ausencia de anticuerpo frente al HBs [antiHBs])3.
- -
Al menos una determinación de ADN viral del VHB durante la terapia biológica.
Se definió la reactivación de la hepatitis B como la detección de ADN de VHB en sangre±el cambio hacia un AgHBs+3.
Se definió hepatitis como la elevación de la alanina transferasa (ALT) 5 veces o más del límite alto de la normalidad8.
Se recogieron de forma retrospectiva de las historias clínicas las variables demográficas sexo, antecedentes personales, tipo de psoriasis, tratamientos hepatotóxicos y/o inmunosupresores concomitantes, tipo y duración del tratamiento biológico recibido: adalimumab (ADA), etanercept (ETA), efalizumab (EFA), infliximab (IFX) y ustekinumab (UST), así como los datos de laboratorio (alanina transferasa, antiHBc, antiHBs, AgHBs, carga viral del VHB) para determinar el estatus serológico al inicio del tratamiento, durante el tratamiento con una periodicidad variable y al final del mismo.
Para calcular los intervalos de confianza de la incidencia de reactivaciones, en ausencia de eventos, se empleó «la regla del 3», según el método descrito por Hanley et al.9.
ResultadosDe entre los 1.030 pacientes con psoriasis tratados con fármacos biológicos incluidos en BIOBADADERM, hasta octubre de 2013, cumplían los criterios de selección antes mencionados un total de 20 pacientes (5 mujeres y 15 hombres). Se detectaron otros 24 pacientes con psoriasis tratados con algún biológico con serología sugestiva de hepatitis B pasada que no fueron incluidos en este estudio por no disponer de una carga viral (no pudiendo descartar una reactivación del virus), aunque ninguno presentaba datos de hepatitis clínica.
Todos los pacientes presentaban antiHBc+, y ningún paciente era portador de HBsAg al inicio del tratamiento. La mediana de seguimiento fue de 40 meses (9-84 meses). Los pacientes recibieron una media de 2 tratamientos biológicos. Se contabilizaron 13 tratamientos con ADA, 14 tratamientos con ETA, 7 tratamientos con IFX, 6 tratamientos con UST y un tratamiento con EFA. La mediana de duración de tratamiento fue de 13 meses para ADA, 16 meses para ETA, 22 meses para IFX, 3 meses para EFA y 18 meses para UST. Al final del seguimiento ningún paciente había desarrollado AgHBs+. De los 13 pacientes que presentaban antiHBs+ al inicio del tratamiento, 2 lo perdieron al final del seguimiento. Tres pacientes antiHBs– al inicio presentaron títulos positivos en la serología final. Los niveles de transaminasas permanecieron en el rango de la normalidad al inicio y al final del tratamiento en todos los pacientes. La mediana de determinaciones serológicas durante el seguimiento fue de 5. Todos los pacientes disponían de una carga viral al final del tratamiento, que fue indetectable en el 100% de los casos. La carga viral inicial se había realizado solo en 7 pacientes, siendo indetectable en todos ellos (tabla 1). Ningún paciente realizó profilaxis para la hepatitis B durante el tratamiento. No se detectó reactivación de hepatitis B, según la definición previa, en ningún caso. Para un nivel de confianza del 95% en nuestro estudio el riesgo de reactivación del virus de la hepatitis B fue del 0%, con un intervalo de confianza del 0% al 14%.
Características serológicas de los pacientes (n=20)
| Basal | Final | |
|---|---|---|
| AntiHBc+ | 20 (100%) | 20 (100%) |
| HBsAg+ | 0 (0%) | 0 (0%) |
| ADN VHB+ | 0 (0%)a | 0 (0%) |
| AntiHBs+ | 13 (65%) | 14 (70%) |
| ALT>5×límite superior | 0 (0%) | 0 (0%) |
Las guías actuales de manejo de la psoriasis determinan que la infección por hepatitis B es una contraindicación relativa para el uso de anti-TNFα10. Recomiendan que los pacientes seropositivos para AgHBs sean tratados con terapia antiviral antes de iniciar el tratamiento. Además, se aconseja monitorizar estrechamente la función hepática y la carga viral en todos los pacientes con serología sugestiva de infección por VHB, puesto que el aumento de la carga viral suele ser lo primero que acontece en caso de reactivación, antes que el aumento de transaminasas y la seroconversión3,11.
Los fármacos anti-TNFα suponen un factor de riesgo de reactivación de la hepatitis B, ya que el TNFα parece inhibir la replicación viral y estimular la respuesta citotóxica de los linfocitos T12. La mayoría de descripciones de reactivación del VHB con anti-TNFα, se han realizado en pacientes afectos de enfermedades diferentes a la psoriasis (enfermedad inflamatoria intestinal o enfermedades reumatológicas). En la revisión publicada por Pérez-Álvarez et al.13 en 2011 (168 pacientes con hepatitis B pasada en tratamiento con anti-TNFα) se reporta un riesgo de reactivación del 5%, con una mortalidad en estos casos del 11%. Lee et al. publicaron un metaanálisis en el que recogían 468 pacientes antiHBc+y AgHBs+procedentes de 9 estudios diferentes, encontrando 8 casos de reactivación de VHB (8/468=1,7%), en 7 de los cuales se detectó ADN del VHB14.
Sin embargo, existe mucha menos experiencia en el caso de la psoriasis, donde se han comunicado casos esporádicos o series cortas, la mayoría de ellos en portadores crónicos del VHB (AgHBs+)15–22. Estos pacientes constituyen el grupo de mayor riesgo de reactivación (20-50%), siendo en estos pacientes obligatoria la profilaxis frente al VHB23. En la infección pasada (antiHBc+con AgHBs–) la reactivación es rara, aunque el riesgo puede aumentar hasta un 10% cuando, con el paso del tiempo, se pierde el antiHBs23. En nuestro estudio 2 pacientes perdieron el antiHBs, pero no hubo reactivación de VHB. Solo hemos encontrado 4 estudios de pacientes con psoriasis tratada con anti-TNFα y hepatitis B pasada17,19,24,25 (tabla 2). Al igual que en nuestra serie de casos, no se produjo ningún caso de reactivación de hepatitis con el uso de anti-TNFα.
Reactivación de la hepatitis B en pacientes con hepatitis B pasada (AgHBs–) y psoriasis en tratamiento con anti-TNF
| Año | N.° de casos | Profilaxis | Mediana de seguimiento (meses) | Resultado | |
|---|---|---|---|---|---|
| Nosotti et al.17 | 2010 | 6 | No | 32 | No reactivación |
| Cassano et al.19 | 2011 | 62 | No | 48 | No reactivación |
| Prignano et al.24 | 2011 | 11 | No | 7,8 | No reactivación |
| Navarro et al.25 | 2014 | 13 | No | 28,6 | No reactivación |
| Serie actual | 2014 | 20 | No | 40 | No reactivación |
La relación entre el VHB y el ustekinumab es menos conocida. Se ha sugerido que la IL12 sería necesaria para mantener el control sobre la replicación del virus, promoviendo la respuesta Th-1 y estimulando la producción de interferón gamma26. Recientemente se ha publicado un caso aislado de reactivación de hepatitis B en un paciente antiHBc+ y AgHBs– en tratamiento con ustekinumab para su psoriasis27. Solamente hemos encontrado 2 estudios en pacientes con hepatitis B y psoriasis tratada con ustekinumab. Navarro et al. describieron 5 pacientes portadores crónicos de AgHBs en los que no hubo reactivación del VHB con tratamiento antiviral asociado22. Chiu et al. publicaron 14 pacientes tratados con ustekinumab, de los cuales 3 presentaban hepatitis B pasada. Ninguno de ellos recibió profilaxis antiviral y no hubo reactivaciones. Los 11 pacientes restantes eran portadores crónicos del virus, 7 de los cuales no habían recibido profilaxis antiviral, y 2 de estos sufrieron reactivación de la hepatitis B28.
De lo anteriormente expuesto cabe destacar 2 conclusiones: la primera es que el riesgo de reactivación depende del estatus serológico, ya que este refleja el control inmunológico sobre la infección, y por tanto el riesgo de reactivación. En portadores crónicos de VHB (AgHBs+) se recomienda profilaxis con antivirales por el riesgo elevado de reactivación. En cambio, en pacientes con hepatitis B pasada (AgHBs– con antiHBc+) ese riesgo es inferior, lo que se traduce en la práctica clínica en que el facultativo no solicite de rutina carga viral en el seguimiento (en nuestro estudio se había solicitado en el 45% de los pacientes). Sin embargo, sería aconsejable en estos pacientes con serología VHB+ tener una determinación de carga viral antes de iniciar la terapia biológica para descartar portadores ocultos, hecho excepcional pero posible. En un trabajo de pacientes con artritis reumatoide tratados con anti-TNF encontraron en 12 pacientes con serología compatible con hepatitis B pasada (antiHBc+, antiHBs– y AgHBs–) 4 pacientes con ADN viral positivo, produciéndose entre ellos una reactivación del VHB29. La segunda conclusión es que el riesgo de reactivación depende de la enfermedad para la que se indique el tratamiento biológico. La explicación podría hallarse en el tratamiento concomitante asociado al fármaco biológico. Es más frecuente la asociación de tratamientos inmunosupresores, como metotrexato, azatioprina o corticoides orales en enfermedades reumatológicas o enfermedad inflamatoria intestinal que en la psoriasis. De hecho, Loras et al. encontraron como único factor de riesgo para la reactivación de la hepatitis B en un análisis multivariante la asociación de 2 o más fármacos inmunosupresores30. Cabe señalar, sin embargo, un estudio prospectivo publicado recientemente con 42 pacientes con artritis reumatoide y hepatitis B pasada, que a pesar de recibir terapia con anti-TNFα y fármacos modificadores de enfermedad no sufren ninguna reactivación del virus31.
En nuestra serie (n=20), donde no se produjo ninguna reactivación, el riesgo máximo de reactivación de la hepatitis B sería de 14%, según la «regla del 3». Según los autores que describieron este método, y con los que coincidimos plenamente, la ausencia de eventos en un estudio no implica que sea imposible que el evento suceda, y proponen un cambio de mentalidad en la interpretación de este tipo de resultados, animando a considerar en lugar de la ausencia del evento, el riesgo máximo de que este ocurra en función del tamaño muestral del estudio. El riesgo máximo de nuestro estudio (14%) está probablemente sobrestimado porque el número de pacientes de nuestra cohorte es pequeño. Además, por el carácter observacional del estudio se excluyeron los pacientes a los que no se ha hecho ninguna determinación de carga viral, siendo estos probablemente los de menor riesgo de reactivación. Si sumamos nuestros casos a los publicados (tabla 2), en los que tampoco hubo ninguna reactivación, el tamaño muestral total alcanzado es de 112. Con este número el riesgo máximo estimado de reactivación de la hepatitis B es de 2,7 casos por cada 100 pacientes con psoriasis y hepatitis B pasada que reciben tratamiento con biológicos, sin profilaxis antiviral, con un seguimiento medio aproximado de unos 30 meses.
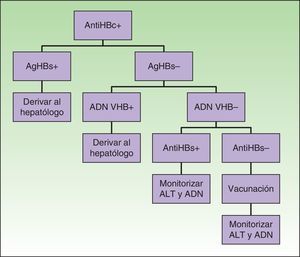
Atención especial merecen los pacientes con serología compatible con hepatitis B pasada con antiHBs–, en los que sería aconsejable descartar portadores ocultos (con un mayor riesgo de reactivación y en los que se recomienda tratamiento profiláctico antiviral, como en los portadores crónicos), solicitando ADN viral antes de iniciar el tratamiento biológico14,28,29(fig. 1).
La importancia de la reactivación del VHB subyace en que es un evento prevenible, y por tanto se puede evitar el riesgo de desarrollar una hepatitis aguda, que en ocasiones puede ser grave e incluso mortal. Por ello, es recomendable un seguimiento estrecho en los pacientes con serología VHB+, y la valoración por parte de un hepatólogo del riesgo de reactivación viral en estos pacientes antes de iniciar el tratamiento biológico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónBIOBADADERM recibe financiación de la Academia Española de Dermatología y Venereología, de la Agencia Española de Medicamentos y Productos Sanitarios y de la industria farmacéutica (Abbott, Merck-Schering Plough, Pfizer-Wyeth). Los laboratorios colaboradores aportan cantidades similares y no participan en el análisis ni en la interpretación de los resultados.
Conflicto de interesesFrancisco Vanaclocha ha participado en ponencias para Abbott, Pfizer, MSD y Janssen.
Ignacio García-Doval ha recibido bolsas de viaje para congresos de Merck/Schering-Plough, Pfizer y Janssen.
Gregorio Carretero ha participado como consultor e investigador para Abbott, Janssen-Cilag, MSD y Pfizer, ha recibido honorarios de Abbott, Jannsen y Pfizer y equipamiento de MSD y Pfizer.
Esteban Daudén ha realizado las siguientes actividades: miembro de Advisory Board, consultor, recepción de becas, apoyo a la investigación, participación en ensayos clínicos, honorarios por impartir ponencias con las siguientes compañías farmacéuticas: Abbvie/Abbott, Amgen, Janssen-Cilag, Leo Pharma, Novartis, Pfizer, MSD-Schering-Plough, Celgene, Lilly.
Diana Patricia Ruiz-Genao ha participado como ponente para Abbott, Pfizer, MSD y Janssen. M. Mercè Alsina-Gibert ha participado como consultora para Pfizer, Abbvie, Jannsen y MSD.
Beatriz Pérez-Zafrilla ha participado como ponente para Pfizer y Wyeth.
Raquel Rivera ha participado como consultora e investigadora para Abbvie, Janssen, MSD, Pfizer-Wyeth, Celgene, Leo Pharma y Novartis.
El resto de los autores declara no tener conflicto de intereses.