Cetuximab y panitumumab son anticuerpos anti-factor de crecimiento epidérmico (anti-EGFR) usados para el cáncer colorrectal metastásico. La mayoría de los pacientes desarrollan una erupción papulopustulosa que podría predecir la respuesta tumoral. Además, producen otros efectos adversos cutáneos, por lo que hemos estudiado si estos también podrían ser predictores clínicos de respuesta. Así mismo, hemos realizado una revisión del tratamiento de la erupción papulopustulosa, ya que no existen directrices basadas en la evidencia.
Material y métodosEstudio retrospectivo de 116 pacientes. Se incluyeron pacientes afectos de cáncer colorrectal metastásico en tratamiento con los anticuerpos anti-EGFR, cetuximab o panitumumab, en el Hospital Universitario Donostia.
ResultadosEl 81,9% de los pacientes desarrolló la erupción papulopustulosa, siendo el riesgo mayor y de mayor intensidad cuantos más ciclos de anti-EGFR se administraban (p=0,03). Todos los pacientes que obtuvieron una respuesta tumoral completa desarrollaron la erupción. Cuanto peor era la respuesta tumoral, menor era la frecuencia de la erupción (p=0,03). También se encontró una asociación entre la xerosis y la respuesta tumoral (el 53,4% de los que obtuvieron respuesta tumoral desarrollaron xerosis, p=0,002). El manejo de la erupción papulopustulosa se llevó a cabo mediante un algoritmo desarrollado por nuestro servicio.
ConclusionesEn la práctica clínica la erupción papulopustulosa grave y la xerosis pueden ser predictores clínicos de buena respuesta al tratamiento anti-EGFR. Los pacientes con esta erupción deben tratarse precozmente, ya que el tratamiento subóptimo de estos efectos secundarios puede conllevar un retraso en la dosis o su interrupción.
Cetuximab and panitumumab are monoclonal antibodies that target the epidermal growth factor receptor (EGFR) in the treatment of metastatic colorectal cancer. Most patients develop a papulopustular rash, which may predict tumor response. We studied whether the other adverse cutaneous effects associated with these monoclonal antibodies are also clinical predictors of response. We also reviewed publications describing approaches to treating the papulopustular rash since no evidence-based guidelines have yet been published.
Material and methodsWe performed a retrospective study of 116 patients with metastatic colorectal cancer receiving anti-EGRF therapy with cetuximab or panitumumab at Hospital Universitario Donostia.
ResultsIn total, 81.9% of the patients developed a papulopustular rash. Patients who received the most cycles of treatment with the EGFR inhibitor were at the highest risk of developing the rash, and these patients also had the most severe rash reactions (P=.03). All of the patients who exhibited a complete tumor response had the rash, and the incidence of rash was lower in patients with poor tumor response (P=.03). We also observed an association between tumor response and xerosis (53.4% of the patients who developed xerosis also exhibited tumor response, P=.002). The papulopustular rash was managed according to an algorithm developed by our department.
ConclusionsSevere papulopustular rash and xerosis may be clinical predictors of good response to anti-EGFR therapy. Patients who develop a papulopustular rash should be treated promptly because suboptimal treatment of this and other adverse effects can lead to delays in taking the prescribed anti-EGFR dose or to interruption of therapy.
Los fármacos inhibidores del receptor del factor de crecimiento epidérmico (EGFR/HER1/Erb1) son agentes antineoplásicos desarrollados en los últimos años para el tratamiento de tumores sólidos en estadios avanzados1,2. La inhibición de las señales mediadas por el EGFR se logra con el uso de anticuerpos monoclonales: cetuximab (Erbitux®) y panitumumab (Vectibix®) —usados principalmente en cáncer colorrectal metastásico1,3, aunque también en carcinoma escamoso de cabeza y cuello y piel2,4— o con agentes de bajo peso molecular: erlotinib (Tarceva®), gefitininb (Iressa®) —utilizados en cáncer de pulmón y cáncer de páncreas— y lapatinib (Tykerb®) —cáncer de mama5— que bloquean la unión con la adenosina trifosfato en la porción intracelular del receptor. A diferencia de la quimioterapia convencional, estos fármacos se utilizan a la dosis biológica óptima, consiguiendo una mayor tolerancia.
El EGFR es una glucoproteína transmembrana que además de en la piel se expresa en un 30-100% de los tumores sólidos, en las células de origen epitelial2. La activación del EGFR por sus ligandos conduce a procesos que regulan la proliferación epidérmica, la diferenciación, la apoptosis, la migración y la síntesis de citocinas inflamatorias6. Por ello, desempeña un papel en el desarrollo y diferenciación normal de los queratinocitos epidérmicos, estimulando su crecimiento, protegiendo frente al daño inducido por UV, inhibiendo la inflamación y favoreciendo la curación de las heridas. La inhibición del EGFR altera la proliferación y diferenciación de los queratinocitos y, por lo tanto, tiene una acción antineoplásica, pero a su vez desemboca en una serie de efectos tóxicos a nivel cutáneo, como una queratinización folicular anormal y una respuesta inflamatoria secundaria5,6. Todos los inhibidores del EGFR presentan una toxicidad cutánea que es dependiente de la dosis7.
Los efectos adversos cutáneos se observan en los sitios de alta expresión del EGFR, siendo la más frecuente la erupción papulopustulosa que acontece en más del 80% de los pacientes7,8. Generalmente suele ser leve, pero en el 50-60% puede ser moderada o grave9,10, condicionando la disminución de la dosis o la interrupción del tratamiento antitumoral. Otros efectos secundarios son la paroniquia, las alteraciones pilosas, el prurito y la xerosis.
En la actualidad se están estudiando marcadores predictivos de eficacia con la finalidad de administrar los fármacos anti-EGFR únicamente a los pacientes que se puedan beneficiar, evitando así toxicidades innecesarias. En la práctica clínica las mutaciones activadoras del KRAS y NRAS constituyen el único marcador predictivo de resistencia a los fármacos anti-EGFR aprobados, y la determinación de la misma ha sido integrada por la European Medicines Agency en la ficha técnica de ambos anticuerpos monoclonales1.
Además de la activación de KRAS y NRAS, se han estudiado otros marcadores predictivos tanto clínicos como genéticos que podrían predecir la respuesta tumoral. En cuanto a los genéticos se ha observado que algunos polimorfismos del gen EGFR, implicados en la regulación génica, se asocian con la erupción y la respuesta tumoral, aunque no existe consenso sobre su valor predictivo1,3,8,11. Recientemente, nuestro grupo ha sugerido que el polimorfismo SNP-216 podría ser de utilidad como marcador predictivo de respuesta12. Entre los marcadores clínicos destaca la aparición de la erupción papulopustulosa3.
Por otro lado, la existencia de predictores clínicos para el desarrollo de la erupción papulopustulosa es controvertido, aunque se han propuesto la edad joven y el sexo masculino como predictores principales11,13.
Material y métodosRealizamos un estudio observacional retrospectivo de 116 pacientes. Se incluyeron pacientes afectos de cáncer colorrectal metastático en tratamiento con anticuerpos monoclonales anti-EGFR de administración endovenosa, cetuximab semanal o panitumumab quincenal, en el Hospital Universitario Donostia, desde enero 2010 a enero de 2013.
Las variables de resultado analizadas fueron las siguientes: erupción papulopustulosa, eccema de cara, xerosis, prurito, paroniquia, fisuras, hipertricosis, tricomegalia, aftas, herpes, inflamación de daño actínico. El grado de erupción papulopustulosa fue determinado según la única escala estandarizada actualmente, modificada de la National Cancer Institute¿s Common Terminology Criteria for Adverse Events12,14. Por otro lado, las variables independientes analizadas fueron: respuesta tumoral, edad, sexo, origen, tipo de anticuerpo anti-EGFR, quimioterapia asociada, quimioterapia previa, toma de cultivo, suspensión del tratamiento antitumoral y tratamiento con tetraciclinas o isotretinoína. La respuesta tumoral se evaluó según los Response Evaluation Criteria in Solid Tumors12,14.
Se excluyeron 4 pacientes del análisis, ya que 3 murieron a causa de su cáncer antes de ser evaluados en dermatología, y el cuarto tuvo que suspender el tratamiento por reacción infusional al cetuximab. El análisis de la respuesta tumoral se realizó en 103 pacientes, ya que en 13 pacientes la respuesta no fue valorable.
Análisis estadísticoLa asociación de las diferentes variables con la aparición o no y la gravedad de la erupción papulopustulosa fueron analizadas mediante el test de Fisher en caso de variable dicotómica y test de Chi cuadrado en caso de más de 2 categorías. La asociación entre la erupción y la edad se analizó con el test «t» de Student. El tiempo de aparición de las lesiones se analizó mediante Kaplan-Meier, definiéndose como casos censurados aquellos que no desarrollaron erupción al mes de inicio del tratamiento.
Se realizaron los mismos estudios para el análisis de la relación de las otras toxicidades con la respuesta tumoral, el sexo, la edad, la quimioterapia asociada, la suspensión del tratamiento antitumoral y el tipo de anti-EGFR. La comparación del tiempo de aparición de la erupción papulopustulosa según los distintos anti-EGFR se realizó mediante el test de log-rank. Se ajustó un modelo de regresión logística ordinal para analizar las variables asociadas al grado de erupción. En él se incluyeron las variables con una p≤0,2.
Todas las pruebas fueron de 2 colas y el nivel de significación se fijó en 0,05. Los análisis se realizaron utilizando el programa SPSS v.21.
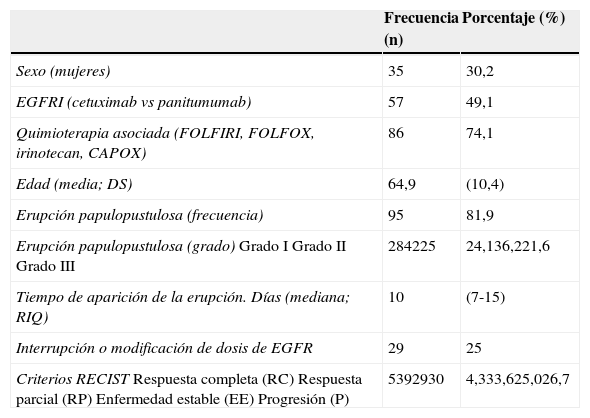
ResultadosSe estudiaron un total de 116 pacientes, 35 mujeres y 81 hombres, de edades comprendidas entre 31 y 83 años, con una media de 64,9 (ver características epidemiológicas y clínicas en la tabla 1).
Características clínicas y epidemiológicas de los 116 pacientes
| Frecuencia (n) | Porcentaje (%) | |
|---|---|---|
| Sexo (mujeres) | 35 | 30,2 |
| EGFRI (cetuximab vs panitumumab) | 57 | 49,1 |
| Quimioterapia asociada (FOLFIRI, FOLFOX, irinotecan, CAPOX) | 86 | 74,1 |
| Edad (media; DS) | 64,9 | (10,4) |
| Erupción papulopustulosa (frecuencia) | 95 | 81,9 |
| Erupción papulopustulosa (grado)Grado IGrado IIGrado III | 284225 | 24,136,221,6 |
| Tiempo de aparición de la erupción. Días (mediana; RIQ) | 10 | (7-15) |
| Interrupción o modificación de dosis de EGFR | 29 | 25 |
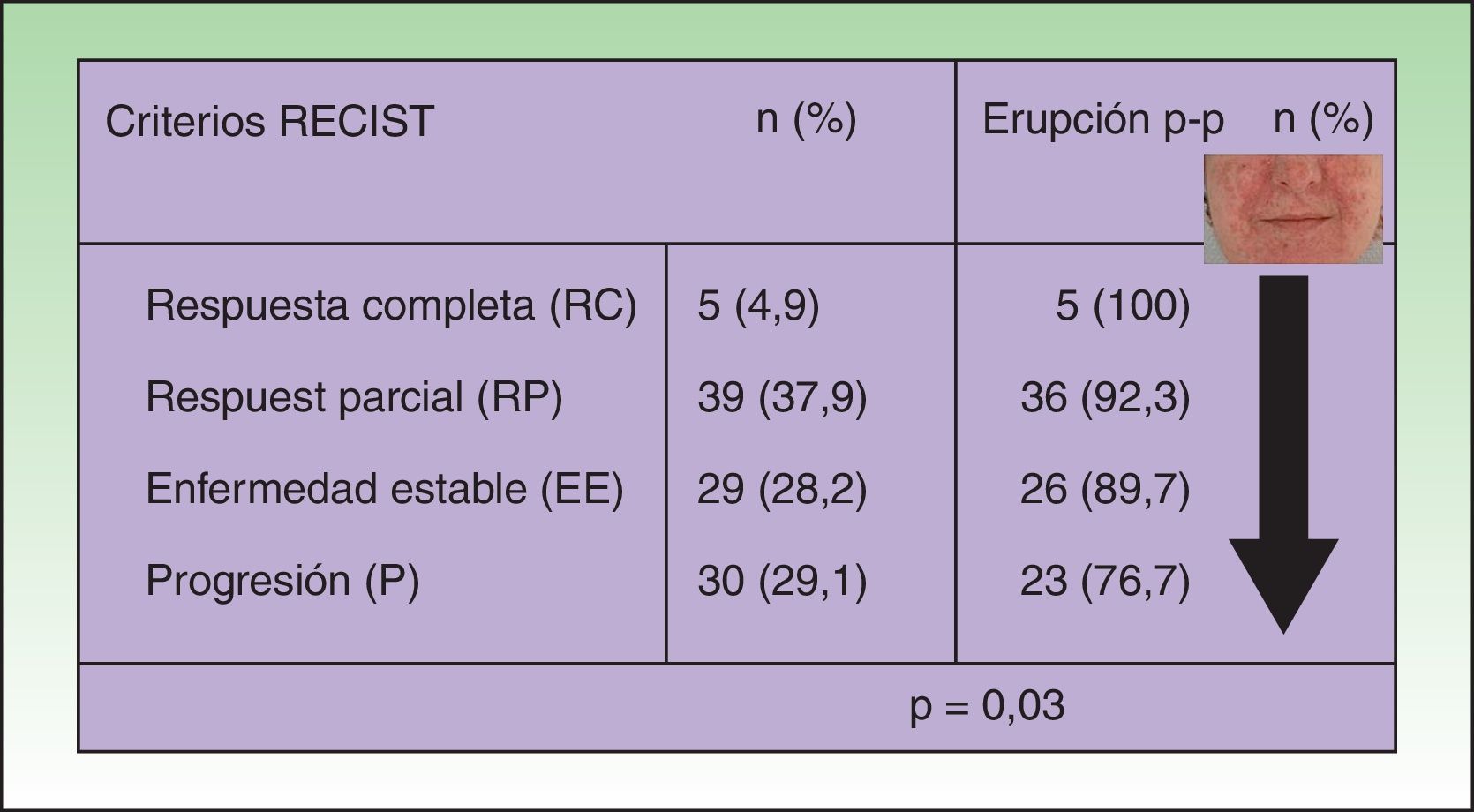
| Criterios RECISTRespuesta completa (RC)Respuesta parcial (RP)Enfermedad estable (EE)Progresión (P) | 5392930 | 4,333,625,026,7 |
CAPOX: capecitabina y oxaliplatino; FOLFIRI: leucovorin, 5-fluorouracilo e irinotecan; FOLFOX: leucovorin, 5-fluorouracilo y oxaliplatino; RECIST: Response Evaluation Criteria In Solid Tumours; RIQ: rango intercuartílico; SD: desviación estándar.
Noventa y cinco pacientes (81,9%) desarrollaron la erupción papulopustulosa, siendo el grado de la erupción moderada-grave (grados 2 y 3) en el 70,5% de los pacientes.
La mediana del tiempo de aparición de las lesiones fue de 10 días, con un rango intercuartílico de 7-15 días. No encontramos diferencias en el tiempo de aparición de lesiones en función del anticuerpo, siendo la mediana de 8 días para el cetuximab y de 10 para el panitumumab.
Se realizó cultivo de las lesiones en 22 casos, siendo positivo solo en 2 casos para Staphylococcus aureus, hecho que confirma la esterilidad de las pústulas descrita en la literatura. Únicamente realizamos biopsia cutánea en 2 pacientes, encontrando una foliculitis neutrofílica.
Observamos el fenómeno de Koebner en pacientes ingresados que desarrollaron la erupción en zonas de apoyo y en pacientes con reservorio u ostomías.
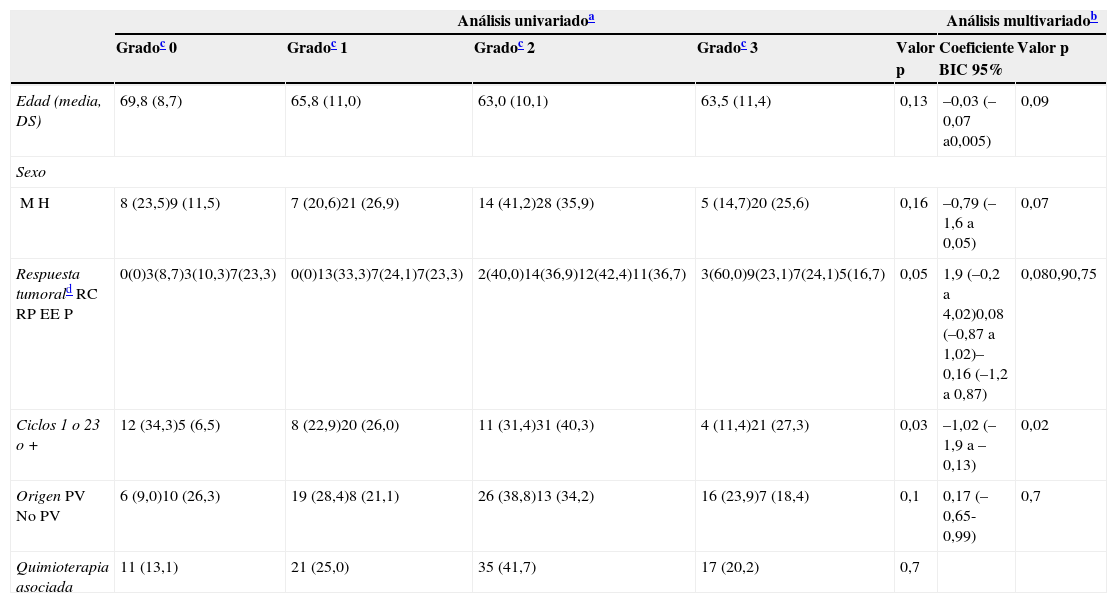
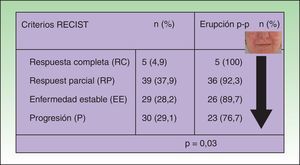
En el análisis univariable de la frecuencia de la erupción papulo-pustulosa (erupción sí o no) como factor predictivo de respuesta tumoral, la erupción fue más frecuente en pacientes con una mejor respuesta tumoral. Todos los pacientes que obtuvieron una respuesta tumoral completa desarrollaron la erupción, y la prevalencia disminuía cuanto peor era la respuesta tumoral (p=0,03 [fig. 1]). Esta significación fue menor al desglosar la erupción por grados, pero se mantenía una tendencia lineal clara (p=0,05 [tabla 2]).
Asociación entre la respuesta tumoral y la aparición de erupción papulopustulosa: el riesgo de desarrollar la erupción fue mayor en los pacientes con respuesta tumoral al anti-EGFR. Todos los pacientes (100%) que obtuvieron una respuesta completa desarrollaron la erupción, disminuyendo la frecuencia cuanto peor fue la respuesta tumoral. En el grupo de pacientes con progresión tumoral solo el 76,7% de pacientes tuvieron la erupción (test de Chi cuadrado: p=0,03).
Factores predictivos de la frecuencia e intensidad de la erupción papulopustulosa
| Análisis univariadoa | Análisis multivariadob | ||||||
|---|---|---|---|---|---|---|---|
| Gradoc 0 | Gradoc 1 | Gradoc 2 | Gradoc 3 | Valor p | Coeficiente BIC 95% | Valor p | |
| Edad (media, DS) | 69,8 (8,7) | 65,8 (11,0) | 63,0 (10,1) | 63,5 (11,4) | 0,13 | –0,03 (–0,07 a0,005) | 0,09 |
| Sexo | |||||||
| MH | 8 (23,5)9 (11,5) | 7 (20,6)21 (26,9) | 14 (41,2)28 (35,9) | 5 (14,7)20 (25,6) | 0,16 | –0,79 (–1,6 a 0,05) | 0,07 |
| Respuesta tumoraldRCRPEEP | 0(0)3(8,7)3(10,3)7(23,3) | 0(0)13(33,3)7(24,1)7(23,3) | 2(40,0)14(36,9)12(42,4)11(36,7) | 3(60,0)9(23,1)7(24,1)5(16,7) | 0,05 | 1,9 (–0,2 a 4,02)0,08 (–0,87 a 1,02)–0,16 (–1,2 a 0,87) | 0,080,90,75 |
| Ciclos 1 o 23 o + | 12 (34,3)5 (6,5) | 8 (22,9)20 (26,0) | 11 (31,4)31 (40,3) | 4 (11,4)21 (27,3) | 0,03 | –1,02 (–1,9 a –0,13) | 0,02 |
| OrigenPVNo PV | 6 (9,0)10 (26,3) | 19 (28,4)8 (21,1) | 26 (38,8)13 (34,2) | 16 (23,9)7 (18,4) | 0,1 | 0,17 (–0,65-0,99) | 0,7 |
| Quimioterapia asociada | 11 (13,1) | 21 (25,0) | 35 (41,7) | 17 (20,2) | 0,7 | ||
DS: desviación estándar; EE: enfermedad estable; RC: respuesta completa; RP: respuesta parcial; P: progresión; PV: País Vasco.
Para analizar los factores clínicos que pudieran predecir el desarrollo de la erupción papulopustulosa, realizamos un análisis multivariado mediante regresión logística ordinal (tabla 2). En el análisis univariado solo el número de ciclos y la respuesta tumoral presentaron una asociación estadísticamente significativa con la erupción, y el primero mantuvo la asociación en el análisis multivariado, siendo el riesgo de erupción de mayor intensidad cuantos más ciclos de anti-EGFR (p=0,02). Por otro lado, el riesgo de desarrollar una erupción grave fue más elevado en pacientes con respuesta completa (p=0,08), así como en los hombres y en los pacientes más jóvenes (p=0,07 y p=0,09, respectivamente).
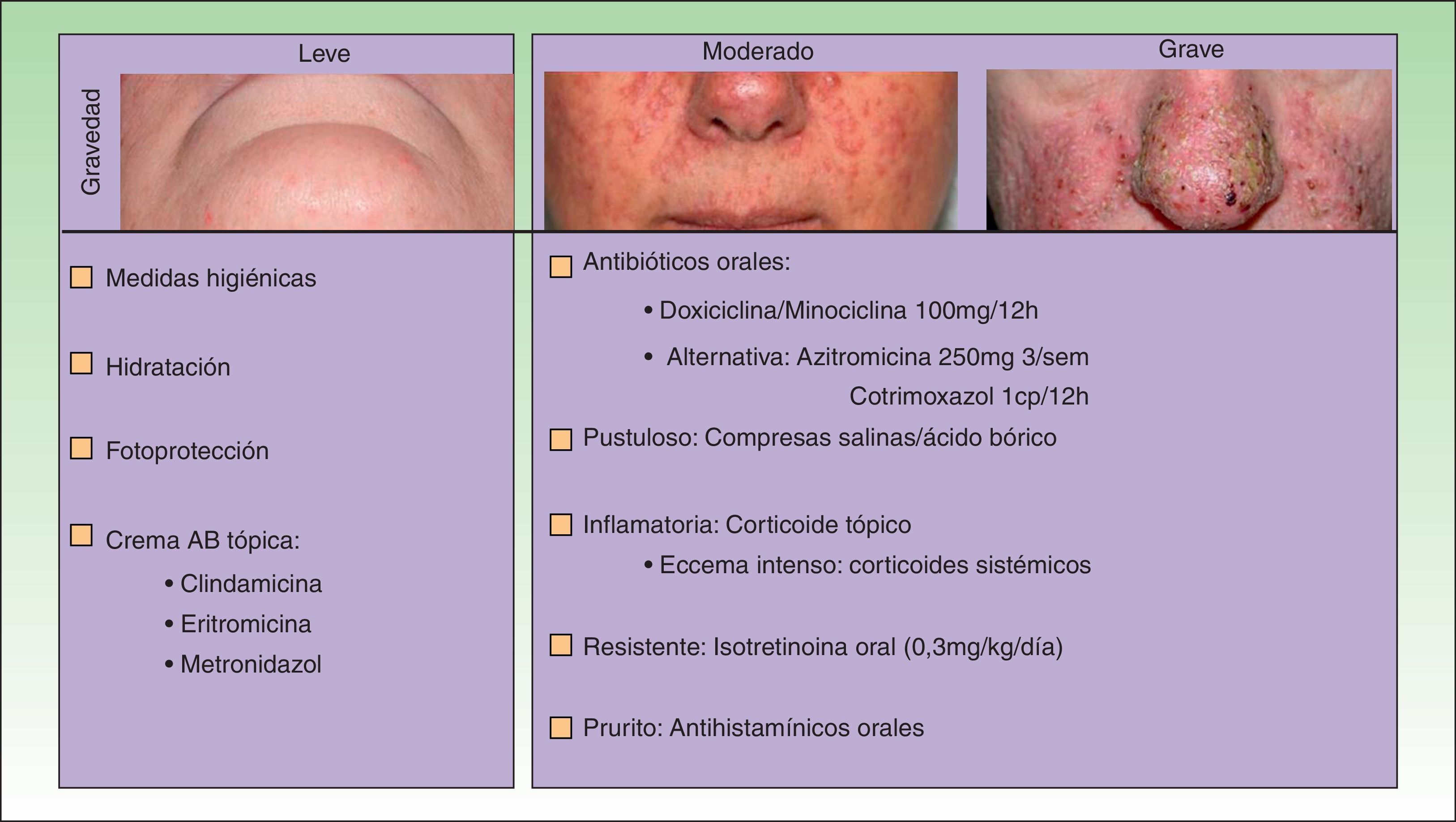
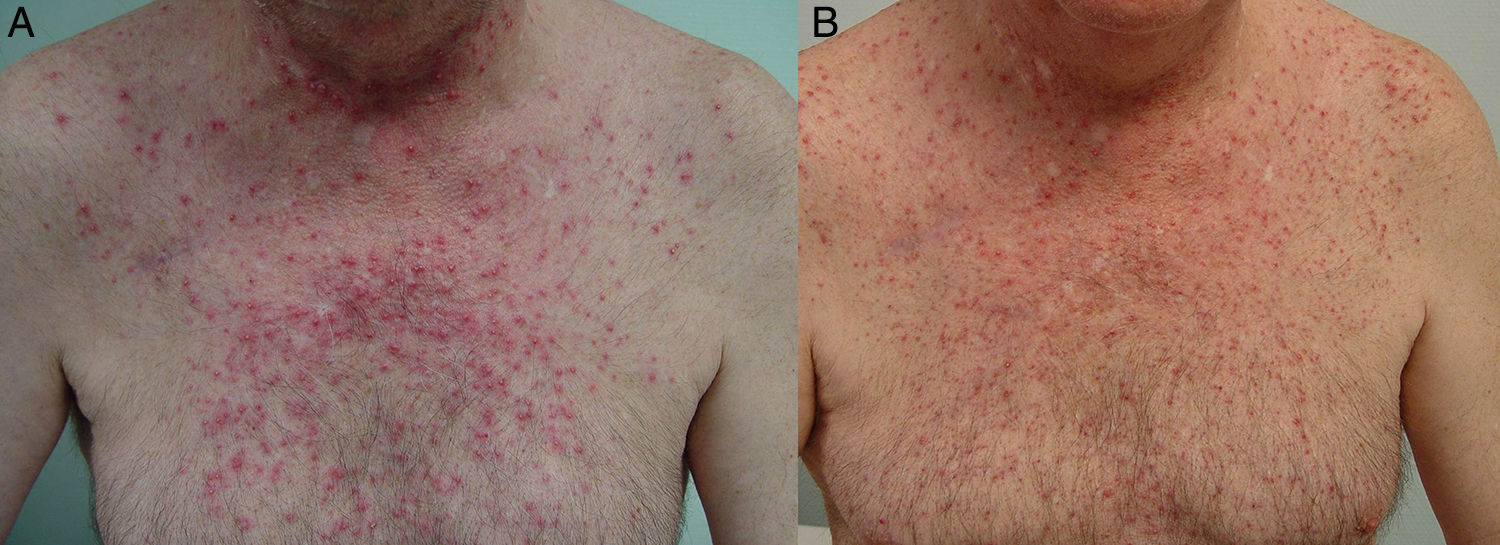
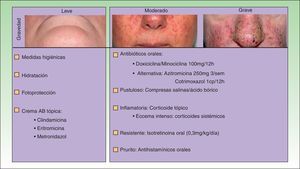
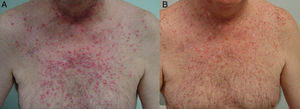
El tratamiento de la erupción se inició cuanto antes para controlar la toxicidad cutánea y evitar interrupciones innecesarias del tratamiento antitumoral. En la figura 2 se resume el algoritmo terapéutico que seguimos en nuestro servicio, según la gravedad de la erupción papulopustulosa. Todos los pacientes con erupciones grado 2-3 fueron tratados con tetraciclinas orales (fig. 3A), con un adecuado control (fig. 3B). Hubo 3 casos de erupciones más resistentes que precisaron isotretinoína, 2 de ellos con buena respuesta. El tercero no toleró la medicación, lo que obligó a suspender el tratamiento anti-EGFR.
En nuestra experiencia ni las tetraciclinas ni la isotretinoína orales influyeron en la respuesta tumoral.
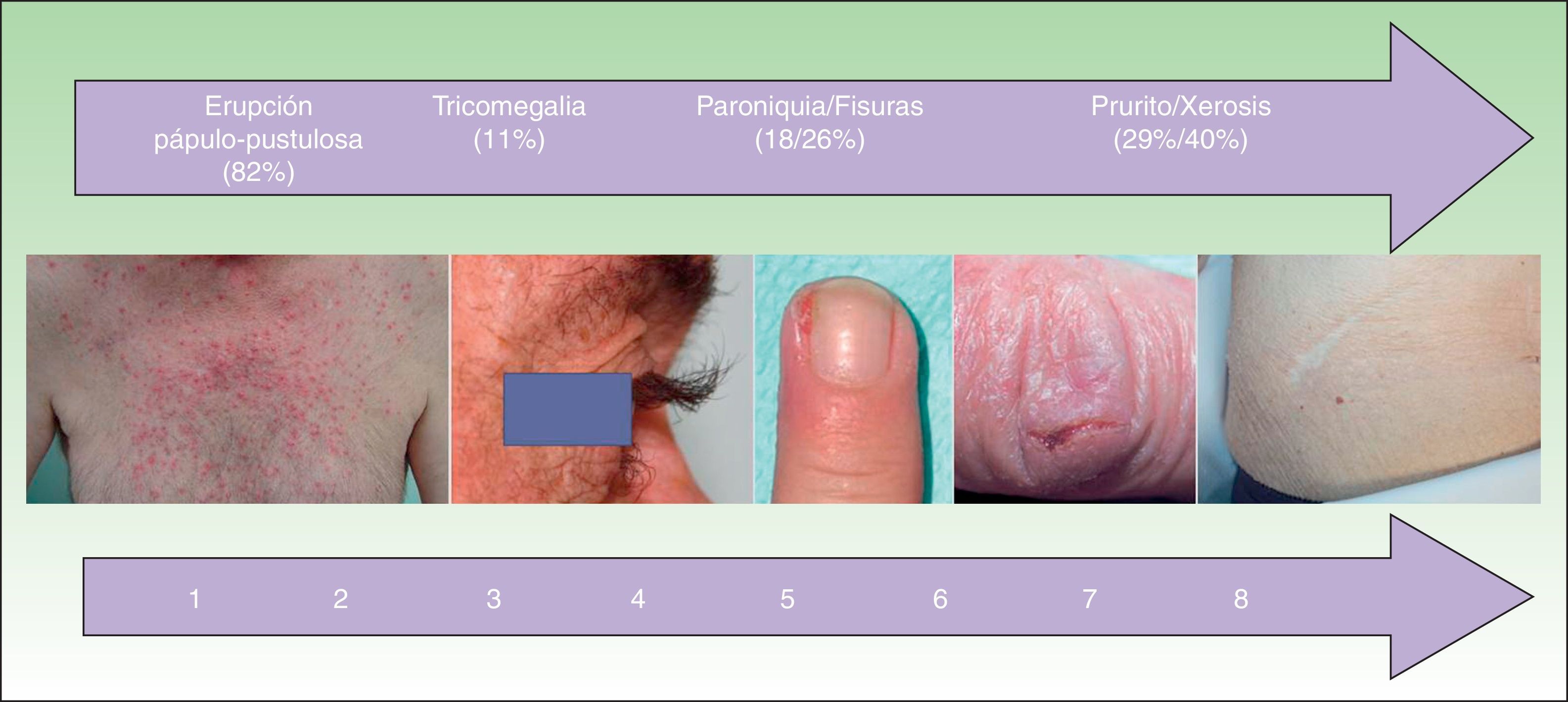
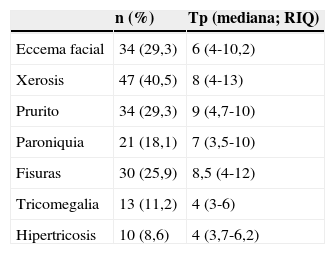
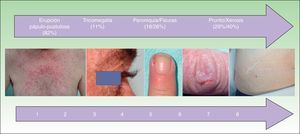
Otras toxicidades cutáneasLas características epidemiológicas de las otras toxicidades cutáneas se recogen en la tabla 3 y en la figura 4. Se estudió la relación entre las diversas toxicidades cutáneas con el sexo, la edad, el anti-EGFR, la quimioterapia asociada y la respuesta tumoral.
Frecuencia y tiempo de aparición de las otras toxicidades cutáneas
| n (%) | Tp (mediana; RIQ) | |
|---|---|---|
| Eccema facial | 34 (29,3) | 6 (4-10,2) |
| Xerosis | 47 (40,5) | 8 (4-13) |
| Prurito | 34 (29,3) | 9 (4,7-10) |
| Paroniquia | 21 (18,1) | 7 (3,5-10) |
| Fisuras | 30 (25,9) | 8,5 (4-12) |
| Tricomegalia | 13 (11,2) | 4 (3-6) |
| Hipertricosis | 10 (8,6) | 4 (3,7-6,2) |
RIQ: rango intercuartílico;Tp: tiempo de aparición (semanas).
El eccema de cara fue más frecuente en pacientes tratados con panitumumab (23 vs 11, p=0,02), y en algunos casos fue tan intenso que precisó corticoides sistémicos.
La xerosis fue más frecuente en los pacientes con respuesta tumoral y en los mayores, aunque en estos últimos sin una significación estadística.Treinta y nueve pacientes (53,4%) de los 73 que obtuvieron respuesta tumoral desarrollaron xerosis, frente a 6 pacientes (20,0%) entre los pacientes con progresión tumoral (p=0,002). En 6 casos la xerosis adquirió un aspecto ictiosiforme. El estudio anatomopatológico de uno de los pacientes mostró lesiones compatibles con una ictiosis adquirida.
Para el resto de las toxicidades no encontramos relación significativa con ninguna variable.
En las paroniquias se tomó cultivo en 5 de los 21 pacientes para descartar una sobreinfección añadida, con 4 casos positivos (2 para Staphylococcus aureus, uno para Streptococcus pyogenes y uno para Candida albicans).
Las alteraciones del pelo más frecuentes fueron la tricomegalia, la hipertricosis y el hirsutismo (tabla 3), pero también hubo 5 pacientes con alopecia difusa (una mujer y 4 hombres).
La afectación mucosa ocurrió en 16 pacientes. Once desarrollaron lesiones herpéticas en la mucosa oral y/o genital, pero a excepción de un paciente con panitumumab en monoterapia, los otros 10 pacientes llevaban tratamiento quimioterápico asociado. Entre los que estaban con quimioterapia asociada hubo 5 casos de aftas orales, 2 de ellos precisaron corticoides sistémicos para el control.
La fotosensibilidad ocurrió en pacientes que asociaban quimioterapia con derivados del 5-fluorouracilo. Sin embargo, 3 pacientes en monoterapia con panitumumab tuvieron una inflamación del daño actínico preexistente, hecho poco descrito con estos fármacos.
Además, uno de los pacientes con psoriasis y artritis psoriática mejoró de su psoriasis pudiendo suspender el tratamiento con metotrexato.
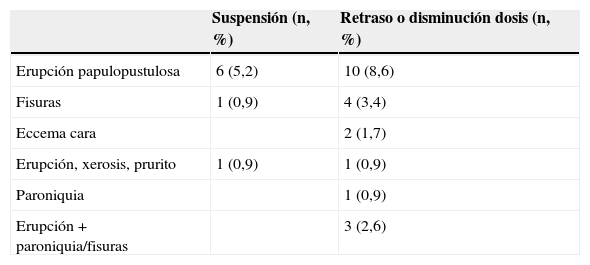
Por último, con respecto a la suspensión del tratamiento antitumoral por la toxicidad cutánea, 8 pacientes (6,8%) tuvieron que suspenderlo y 21 (18,1%) retrasar o disminuir la dosis del tratamiento anti-EGFR (tabla 4), siendo las causas más frecuentes de suspensión la erupción pápulo-pustulosa, las fisuras o la paroniquia.
DiscusiónLa erupción papulopustulosa se podría considerar un marcador in vivo de la actividad del anti-EGFR, pero no se ha descrito relación en la literatura entre la respuesta tumoral y otras toxicidades cutáneas3,8. En esta serie de pacientes objetivamos una asociación entre la xerosis y la respuesta al tratamiento anti-EGFR, ya que los pacientes que obtuvieron una mejor respuesta tumoral desarrollaron más xerosis que los pacientes que tuvieron una progresión de su enfermedad. Este hecho no está publicado, y creemos que, al igual que la erupción papulopustulosa, podría ser un marcador clínico de buena respuesta.
Además, este estudio confirma la asociación previamente descrita3,12 entre la erupción papulopustulosa y la respuesta tumoral, con un mayor riesgo de desarrollar una erupción grave cuanto mejor sea la respuesta tumoral. Estos resultados refuerzan la idea de que ambas, la respuesta tumoral y la toxicidad cutánea, tienen un mecanismo de acción similar. Así, los pacientes con erupción más intensa obtendrían más beneficio del tratamiento con anti-EGFR. Algunos autores proponen que en aquellos pacientes que no desarrollen la erupción se debería aumentar la dosis hasta la aparición de lesiones cutáneas, como postulan los llamados estudios dose to rash15. Otros sugieren que la ausencia de la erupción tras un determinado tiempo debería motivar la retirada del medicamento, pero en la práctica clínica habitual este no es un factor decisivo1. En nuestra opinión, y ya que quizá un pequeño subgrupo de pacientes se podría beneficiar del tratamiento a pesar de no desarrollar la erupción papulopustulosa, esta decisión debería basarse en un conjunto de marcadores clínicos y genéticos que permitieran una terapia dirigida más personalizada.
Por otro lado, en relación con los predictores clínicos para el desarrollo de la erupción papulopustulosa, al igual que Jatoi et al.11 encontramos una tendencia a la significación entre la erupción papulopustulosa, la edad y el sexo. Estos autores publicaron que la erupción era más frecuente en pacientes varones y jóvenes, hipotetizando que los pacientes mayores tienen menor expresión de EGFR, y que tanto los andrógenos como los estrógenos interactúan con este receptor.
Respecto al manejo de la toxicidad cutánea, desde el comienzo del empleo de los anti-EGFR se han publicado múltiples opciones terapéuticas sin llegar a un consenso. Actualmente no existen directrices basadas en la evidencia. Así pues, los datos disponibles se basan en la opinión de los expertos10 y en la experiencia clínica.
Tópicamente varios fármacos se han utilizado sin evidencia de un buen control de la erupción9,16–18, y solo se han realizado 3 estudios aleatorizados. Scope et al.19 utilizaron pimecrolimus en media cara sin encontrar beneficio. Jatoi et al.20 realizaron un tratamiento preventivo con fotoprotector frente a placebo durante un mes, sin resultados satisfactorios. Y por último, Pinta et al.9 encontraron beneficio en la aplicación de una crema de vitamina K1, pero en este estudio el grupo a comparar fueron los datos descritos en los estudios publicados en la literatura9 (tabla 5).
Ensayos clínicos aleatorizados para el tratamiento de la erupción papulopustulosa por anti-EGFR
| Referencia | EGFRI | N | Grupos de tratamiento | Objetivos | Resultados |
|---|---|---|---|---|---|
| Scope et al.27 2007) | Cetuximab | 48 | 1. Minociclina 100mg/d y tazaroteno tópico (0,05%).2. Placebo y tazaroteno tópico (0,05%)Durante 8 semanas | Preventivo | Minocilina oral: redujo la intensidad de la erupciónNo recomiendan el tazaroteno tópico |
| Lacouture et al.14 (2010) | Panitumumab | 95 | 1. Tratamiento preventivoa2. Tratamiento activob | Preventivo | Disminución de la erupción ≥grado 2 |
| Jatoi et al.25 (2008) | Gefitinib, cetuximab, erlotinib | 61 | 1. Tetraciclina oral 500mg 2v/d 28 días.2. Placebo | Preventivo | Disminución de la intensidad de la erupción, no de la incidencia |
| Jatoi et al.26 (2011) | Gefitinib, cetuximab, erlotinib | 65 | 1. Tetraciclina oral 500mg 2v/d 28 días2. Placebo | Preventivo | No disminuye la incidencia ni la intensidad de la erupción |
| Scope et al.19 (2009) | Cetuximab | 24 | 1. Pimecrolimus 2v/d 5 semanas (media cara) | Tratamiento activo | No beneficio |
| Jatoi et al.20 (2010) | Varios | 110 | 1. Fotoprotector SPF60 3v/d 28 días2. Placebo | Preventivo | No beneficio |
| Deplanque et al.28 (2010) | Erlotinib | 147 | 1. Doxiciclina 100mg/d 4 meses.2. No tratamiento | Preventivo | Disminución de la intensidad de la erupción, no de la incidencia |
| Pinta et al.9 (2013) | Cetuximab | 41 | 1. Crema de vitamina K1-2v/d 8semanas | Preventivo | Menor proporción de grado 2 y 3 (comparado con la literatura) |
EGFRI: inhibidores del EGFR; SPF: factor de protección solar; 2v/d: 2 veces al día; 3v/d: 3 veces al día.
Tomando como modelo el tratamiento de otras dermatosis papulopustulosas, como la rosácea o el acné, las tetraciclinas orales son la primera línea de tratamiento para el manejo de esta erupción, basándose en sus propiedades antiinflamatorias y antiangiogénicas, ya descrito por Fernandez-Guarino et al. en 20062,21. También se han publicado casos con buena respuesta a azitromicina22, isotretinoína23 y acitretino24. La isotretinoína se recomienda para casos más resistentes, ya que se desconocen las interacciones que este fármaco pudiera tener con el mecanismo de acción de los inhibidores del EGFR, y algunos autores recomiendan limitar su uso7. En la tabla 5 se resumen los 5 ensayos clínicos aleatorizados publicados hasta la fecha en los que usan las tetraciclinas orales como tratamiento preventivo para evitar esta erupción14,25–28.
Lacouture et al.14 buscaron diferencias entre el tratamiento preventivo frente al tratamiento reactivo con doxiciclina para disminuir la toxicidad cutánea asociada a panitumumab, encontrando como resultado una disminución de la incidencia de la erupción moderada-grave en un 50% (tabla 5).
Jatoi et al., Scope et al. y Deplanque et al.26–28 emplearon tetraciclinas orales, minociclina y doxiciclina, respectivamente, frente a placebo, desde el inicio del tratamiento con anti-EGFR, obteniendo como resultado la disminución de la gravedad y del número de las lesiones, pero no de la incidencia de la erupción. Jatoi et al., en una publicación más reciente, concluyen que las tetraciclinas no son eficaces en la prevención de la erupción26,28, y Scope et al.27 no encontraron beneficio en mantener tetraciclinas más allá de las 8 semanas para el control de la erupción papulopustulosa (tabla 5). Estos resultados son controvertidos para poder estandarizar el tratamiento con tetraciclinas como primera línea terapéutica, y se confirman en un metaanálisis reciente28. Sin embargo, en el algoritmo de las Guías clínicas americanas se ha establecido el uso de la doxiciclina 100mg cada 12-24h durante las primeras 6 semanas de tratamiento con anti-EGFR10. En nuestro algoritmo incluimos las tetraciclinas como primera opción de tratamiento, ya que con ellas hemos conseguido un buen control de la erupción. Habitualmente mantenemos el tratamiento mientras dura la terapia anti-EGFR, o hasta un buen control de la erupción a pesar del tratamiento antitumoral continuado. Para el resto de las toxicidades no hay ningún estudio terapéutico específico, aunque se ha descrito el uso potencial de la doxiciclina en las paroniquias. En general, el manejo se basa en las medidas higiénicas, emolientes y en tratamientos tópicos con antisépticos, antibióticos y corticoides tópicos10. Además, la fotoprotección es fundamental en estos pacientes, ya que algunos desarrollan una inflamación del daño actínico que se explicaría por la inhibición del EGFR que suele ser abundante en el ostium folicular y en las lesiones precursoras de cáncer de piel29.
Finalmente, y aunque también se han descrito casos de empeoramiento30, el paciente con psoriasis que mejoró durante el tratamiento se podría explicar por el efecto antiproliferativo de la inhibición del EGFR, factor implicado en la fisiopatología de la psoriasis7.
ConclusiónLos resultados de nuestro estudio apoyan que la xerosis, además de la erupción papulopustulosa ya conocida, podría usarse como marcador clínico de buena respuesta. Por ello ambos deberían tenerse en cuenta como predictores de pacientes que se benefician del tratamiento anti-EGFR.
Además, los pacientes que desarrollan la erupción papulopustulosa deben ser tratados de forma precoz y mantenida, ya que el tratamiento subóptimo de estos efectos secundarios puede llevar a retrasos de la dosis o a interrupciones del tratamiento anti-EGFR en pacientes que se están beneficiando del tratamiento antitumoral.
En nuestra experiencia, el tratamiento debe ser individualizado y hay que ajustarlo en el tiempo según vaya apareciendo la toxicidad cutánea.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.