Los fármacos inhibidores de los puntos de control inmunitario han supuesto un importante avance en el tratamiento oncológico. Sin embargo, su uso no está exento de reacciones no deseadas, denominadas efectos adversos inmunorrelacionados, siendo los cutáneos particularmente frecuentes. El conocimiento que tenemos sobre los efectos adversos inmunorrelacionados cutáneos procede fundamentalmente de la práctica clínica. Por lo tanto, en este trabajo se revisan en detalle sus características, así como las recomendaciones sobre su tratamiento y sus implicaciones pronósticas. Los más frecuentes son el exantema, el prurito, el vitíligo y la alopecia; sin embargo, estos fármacos pueden producir una amplia variedad de dermatosis. La asociación observada entre ciertos tipos de reacciones cutáneas con una respuesta oncológica favorable al tratamiento debe interpretarse con cautela. El dermatólogo ha de participar en el cuidado multidisciplinar de estos pacientes, pues desempeña un papel fundamental en el diagnóstico y el tratamiento de estas reacciones cutáneas adversas.
Immune checkpoint inhibitors (ICIs) have significantly advanced the treatment of cancer. They are not, however, free of adverse effects. These effects are called immune-related adverse events (irAEs) and often involve the skin. Most of the information on cutaneous irAEs comes from clinical practice. We therefore conducted a thorough review of the characteristics of cutaneous irAEs, recommendations for treatment, and their association with prognosis. The most common events are exanthema, pruritus, vitiligo, and hair loss, although ICIs can cause a wide range of cutaneous dermatoses. The reported association observed between certain reactions and a favorable response to cancer treatment should be interpreted with caution. Dermatologists should be involved in the multidisciplinary care of patients being treated with ICIs as they have an essential role in the diagnosis and treatment of cutaneous irAEs.
Los fármacos inhibidores de los puntos de control inmunitario (IPI) han supuesto una revolución en el tratamiento oncológico al haber demostrado una eficacia y una mejoría de la supervivencia en un amplio espectro de neoplasias en estadios avanzados1-4.
Estos fármacos activan el sistema inmunitario, concretamente de los linfocitos T, para que actúe frente a las células neoplásicas y las destruya. Sin embargo, como consecuencia de dicha activación, se pueden desencadenar diversos fenómenos autoinmunes o autoinflamatorios, los denominados efectos adversos inmunorrelacionados (EAir)4-7. Los EAir se pueden manifestar en cualquier órgano o tejido, pero la toxicidad cutánea es una de las más frecuentes, pues se ha descrito en aproximadamente un tercio de los pacientes que reciben estos fármacos4,7.
La información procedente de los ensayos clínicos sobre la incidencia y el perfil de EAir dermatológicos es difícil de evaluar puesto que en ellos la toxicidad cutánea se registra normalmente en términos genéricos8,9. Por tanto, el conocimiento que tenemos actualmente sobre estas reacciones procede fundamentalmente de la práctica clínica, reflejada en publicaciones de estudios retrospectivos, series de casos y casos clínicos aislados, con las limitaciones que ello implica4,5,9.
Nuestro objetivo al realizar este trabajo ha sido revisar y sintetizar las características de los EAir cutáneos en los pacientes en tratamiento con fármacos IPI, así como describir su tratamiento y sus implicaciones pronósticas.
MétodoSe realizó una búsqueda bibliográfica en las bases de datos PubMed, Web of Science (acotando al periodo comprendido entre enero del 2015 y mayo del 2021) y en la Cochrane Library (sin acotar por periodo), empleando la combinación de términos «IMMUNE CHECKPOINT INHIBITORS» y «SKIN TOXICITY». Dos autores (GJC y MBM) revisaron de forma independiente los títulos y los resúmenes, seleccionando los artículos que informaran sobre la frecuencia y características de los EAir cutáneos en pacientes con cáncer tratados con fármacos IPI, o bien que aportasen datos sobre el tratamiento de los mismos, o su relación con el pronóstico. Se identificaron otros trabajos adicionales relevantes mediante la comprobación de las referencias bibliográficas de los artículos encontrados.
Se incluyeron estudios de cualquier tipo, en inglés o en español, que proporcionasen datos sobre el número o la proporción de pacientes, medidas de asociación, tasas de supervivencia o, en su defecto, describieran de forma detallada las reacciones cutáneas (informando del tipo de reacción cutánea, el tipo de IPI y la latencia de aparición). Los pacientes podían recibir cualquier tipo de fármaco IPI en monoterapia o en combinación. Dos autores (GJC y MBM) leyeron individualmente el texto completo de las publicaciones cuyos resúmenes habían sido seleccionados y de los artículos sin resumen para extraer la información relevante. Se incluyeron los trabajos más actualizados, excluyendo aquellos más antiguos cuyos resultados se sintetizasen en otros artículos recientes o que aportasen información redundante.
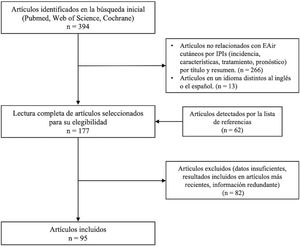
ResultadosLa búsqueda bibliográfica permitió obtener un total de 394 artículos. De ellos se seleccionaron finalmente 95 publicaciones que aportaban información actualizada (fig. 1). Entre estas había 2 revisiones sistemáticas, 4 metaanálisis y un ensayo clínico, mientras que el resto eran estudios retrospectivos, revisiones narrativas, casos clínicos y series de casos.
Patogenia y frecuenciaExisten 2grupos de fármacos IPI, los inhibidores del receptor cytotoxic T-lymphocyte-associated-4 (CTLA-4) y los inhibidores de programmed cell death protein 1 (PD-1) o su ligando PD-L1 (tabla 1). El receptor CTLA-4 controla la respuesta inmunitaria en etapas anteriores a la vía de PD-1/PD-L1, que interviene en fases más tardías a nivel de los tejidos periféricos1. La patogenia de los EAir no se ha aclarado por completo. Sin embargo, se sabe que la activación de las células T CD4/CD8 producida por el bloqueo de estos receptores, si bien es beneficiosa desde el punto de vista oncológico al actuar contra las células tumorales, desempeña un papel fundamental en el desarrollo de los EAir en general y de la toxicidad cutánea en particular1.
Tipos de fármacos inhibidores de los puntos de control inmune (IPI) y fecha de su aprobación por la Agencia Europea del Medicamento (EMA)
| Tipo IPI | Fecha de aprobación EMA |
|---|---|
| Anti-CTLA-4 | |
| Ipilimumab | Julio del 2011 |
| Tremelimumab | Julio del 2019 |
| Anti-PD-1 | |
| Nivolumab | Junio del 2015 |
| Pembrolizumab | Julio del 2015 |
| Cemiplimab | Junio del 2019 |
| Anti-PD-L1 | |
| Atezolizumab | Septiembre del 2017 |
| Avelumab | Septiembre del 2017 |
| Durvalumab | Septiembre del 2018 |
CTLA-4: cytotoxic T-lymphocyte-associated-4; PD-1: programmed cell death protein-1; PD-L1: ligando de PD-1.
A pesar de que los IPI comparten un perfil de seguridad similar, existen diferencias en el tipo, la frecuencia, la latencia y la gravedad de los EAir asociados a cada uno de ellos, debido a sus distintas dianas moleculares y características farmacocinéticas5,6.
En el caso de los EAir cutáneos, el ipilimumab los induce con más frecuencia que los anti-PD-1/PD-L1 (50% vs. 10-30%)2,8-12, de forma dependiente de la dosis y generalmente más tempranos y graves1-3. La combinación del ipilimumab con anti-PD-1/PD-L1 (sobre todo el pembrolizumab) produce las tasas más altas de toxicidad cutánea de cualquier grado6,9. Por otra parte, los fármacos anti-PD1 (principalmente el pembrolizumab) tienen un mayor riesgo de producir EAir dermatológicos que los anti-PD-L1, mientras que el avelumab es el que presenta un riesgo menor5.
Es importante señalar que en un mismo paciente pueden concurrir varios EAir cutáneos y hasta un 9% desarrolla EAir multisistémicos, observándose de forma frecuente las asociaciones dermatitis-neumonitis y dermatitis-tiroiditis. A menudo la toxicidad cutánea aparece en primer lugar10.
Recientemente se ha señalado una asociación entre el tipo de EAir y el tipo de tumor, de tal manera que existe una mayor incidencia de toxicidad cutánea en pacientes con melanoma que en sujetos con otros tumores4. No obstante, consideramos que esta asociación debería interpretarse con cautela, pues podría tratarse de un sesgo de información, ya que los dermatólogos suelen estar implicados en el tratamiento y seguimiento de los pacientes diagnosticados de melanoma.
Tipos y características de la toxicidad cutáneaLos EAir cutáneos que más frecuentemente comunican los ensayos clínicos son el exantema («rash» o «dermatitis»), el prurito, el vitíligo y la alopecia4,5,8,9. Sin embargo, la toxicidad dermatológica inducida por IPI en la práctica clínica es mucho más diversa. La clasificación más utilizada en la actualidad, y en la que nos basamos para realizar esta revisión, la categoriza en 4grandes grupos: dermatosis inflamatorias, dermatosis inmuno-ampollosas, alteraciones de la queratinización y alteraciones de los melanocitos de la epidermis13,14. Sin embargo, algunos autores la consideran imprecisa y realizan ciertas modificaciones. Nosotros englobaremos las alteraciones de los melanocitos dentro de un apartado más amplio, trastornos de la pigmentación, y añadiremos 2apartados adicionales, las alteraciones del pelo y las uñas, y otras dermatosis infrecuentes11.
La gravedad de la toxicidad suele determinarse mediante la Common Terminology Criteria for Adverse Events (CTCAE) que establece 4 grados en función del área de superficie corporal (ASC) afectada (tabla 2)13,15,16. Sin embargo, algunos autores recomiendan considerar también la naturaleza de la dermatosis para precisar mejor la gravedad del cuadro13,15,17,18.
Clasificación de la gravedad de los EAir cutáneos según la CTCAE, tomando como ejemplo el exantema maculopapular
| Grado | Características |
|---|---|
| Grado 1 | Afectación<10% del ASC, con o sin síntomas (prurito, quemazón, tensión) |
| Grado 2 | Afectación entre el 10-30% del ASC, con o sin síntomas; limitación para las AIVD |
| Grado 3 | Afectación> 30% del ASC, con o sin síntomas; limitación para las ABVD |
| Grado 4 | SSJ, NET, dermatitis ampollosa con afectación> 30% del ASC y que necesita ingreso y atención en cuidados intensivos |
ABVD: actividades básicas de la vida diaria; AIVD: actividades instrumentales de la vida diaria; ASC: área de superficie corporal; CTCAE: Common Terminology Criteria for Adverse Events; NET: necrólisis epidérmica tóxica; SSJ: síndrome de Stevens-Johnson.
Fuente: Haanen et al.13.
Junto con el prurito, se trata del EAir cutáneo más frecuente. Aparece aproximadamente en el 25% de los pacientes tratados con ipilimumab, en el 15% de los que reciben anti-PD-1 y alrededor del 10% con anti-PD-L1. Sin embargo, puede afectar al 45% de los tratados con la combinación de anti-CTLA-4/PD-19,13,18. Suele ser de carácter leve (menos del 3% de los casos de grado mayor o igual a 3)9.
Habitualmente, se presenta de forma precoz, en las primeras 2 a 6 semanas de tratamiento, aunque puede aparecer más tarde. La clínica es poco específica, se trata de una erupción maculopapular confluyente y pruriginosa, que afecta al tronco y a veces las extremidades. Puede acompañarse de eosinofilia en sangre periférica18,19.
El patrón histológico más frecuente es el de una dermatitis espongiótica con un infiltrado linfocitario perivascular superficial con eosinófilos, aunque en ocasiones se han descrito otros patrones, incluido el liquenoide18,20,21.
Su carácter leve permite que en la mayoría de los casos se puedan manejar con tratamiento sintomático (antihistamínicos orales y corticoides tópicos [CT]), incluso en casos con afectación de al menos el 30% del ASC, precisando solo las formas refractarias la administración de corticoides sistémicos (CS)13,15,16,18,22.
El exantema maculopapular puede preceder a otros cuadros cutáneos, por lo que requiere seguimiento y es recomendable realizar una biopsia cutánea en aquellos casos clínicamente atípicos, graves, persistentes o recurrentes11,17,18,22-25.
PruritoEs uno de los EAir cutáneos más prevalentes, que se presenta hasta en el 32% de los pacientes que reciben IPI26. Puede acompañar a otras dermatosis, ser la manifestación inicial de otros EAir más graves como el penfigoide ampolloso (PA) o presentarse de forma aislada, y traduce un aumento de la activación del sistema inmunitario en la piel.
En cuanto al manejo, si existe xerosis debe tratarse. Cuando el prurito es leve o intermitente (grados 1-2) se recomiendan CT, antihistamínicos por vía oral y emolientes. Otras veces puede ser constante y de difícil control, afectando en gran medida la calidad de vida del paciente (grado 3). En estos casos se ha descrito el tratamiento con agonistas GABA, aprepitant, fototerapia, naloxona, naltrexona, omalizumab o dupilumab con resultados variables. En muy raras ocasiones se requiere la suspensión del fármaco responsable13,22,26-29.
Erupciones liquenoidesSe han comunicado fundamentalmente con relación a fármacos anti-PD-1/PDL-1 y para algunos autores son el patrón histopatológico más frecuentemente encontrado en los EAir cutáneos producido por este tipo de IPI19,21,23,30,31.
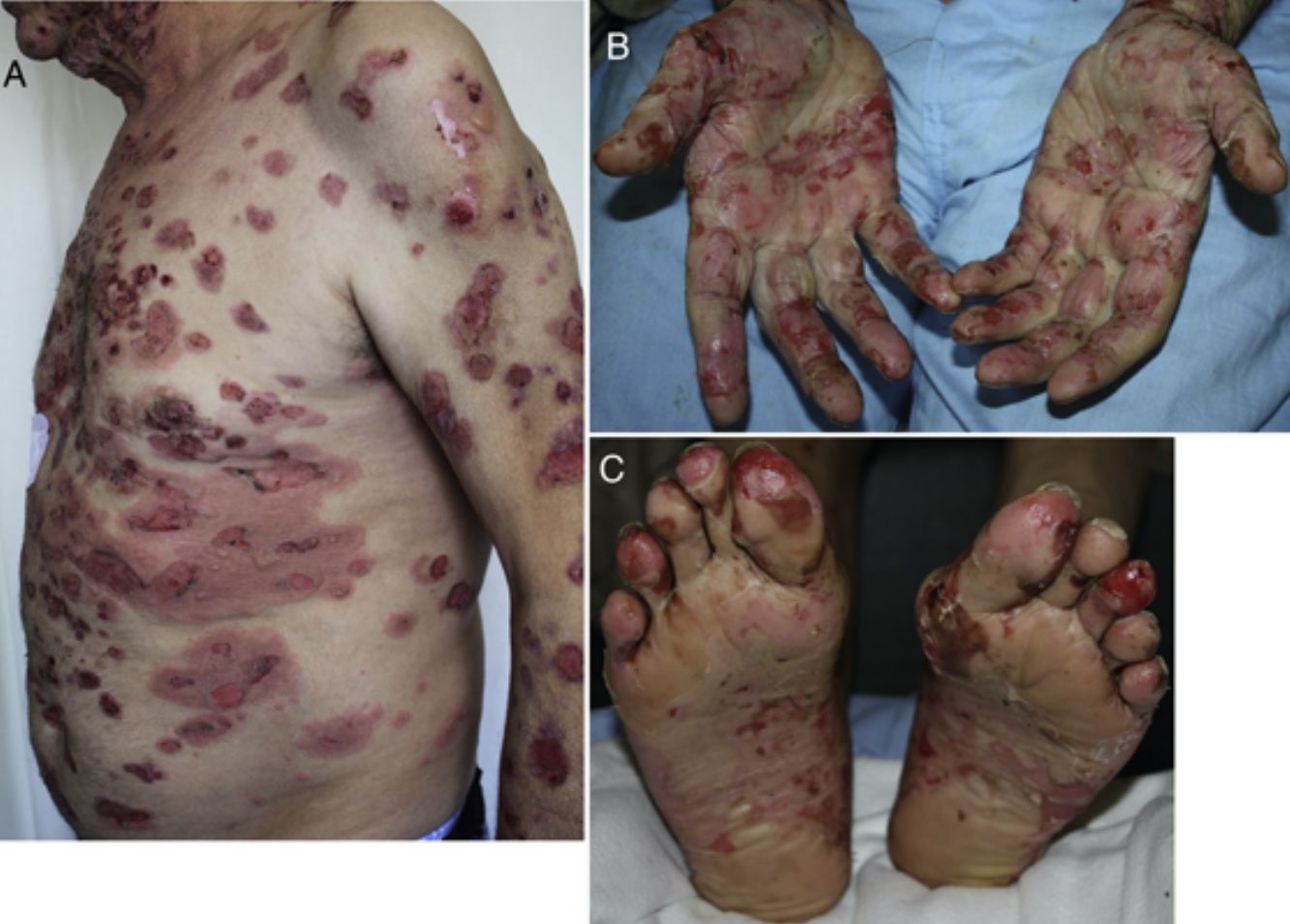
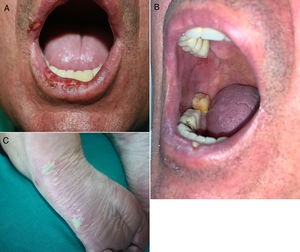
Aparecen más tardíamente que el exantema maculopapular, de media a los 3meses del inicio del tratamiento (rango 1 día-14 meses)23,31,32. La clínica es variable, desde formas similares a un liquen plano a presentaciones más atípicas con lesiones hipertróficas o erosivas, o también como un liquen plano penfigoide o un liquen escleroso. A veces asocian alteraciones ungueales21,23,31,33,34. El prurito es frecuente y puede ser de tratamiento difícil35. No es rara la afectación de las mucosas, que puede ser exclusiva, con estrías blanquecinas o con lesiones erosivas o atróficas (fig. 2 A y B). Ocasionalmente puede tener unas características clínicas solapadas con una dermatitis eccematosa o recordar a una erupción maculopapular. En estos casos el diagnóstico definitivo de dermatitis liquenoide solo puede realizarse histopatológicamente18,21,23,31,33,34, por lo que posiblemente estén infraestimadas17,20,35.
Dermatosis inflamatorias. A y B) Lesiones erosivas orales con histología de dermatitis liquenoide en un varón de 60 años con adenocarcinoma broncopulmonar estadio iv en tratamiento con durvalumab. C) Pustulosis plantar en una mujer de 68 años con adenocarcinoma broncopulmonar estadio iv en tratamiento con pembrolizumab.
La biopsia puede mostrar cambios típicos de un liquen plano clásico, con un infiltrado linfocitario en banda, una hipergranulosis y una acantosis irregular. Sin embargo, muchas veces también hay espongiosis, paraqueratosis, eosinófilos o una dermatitis de la interfase leve, encuadrándose en el diagnóstico de una dermatitis liquenoide20,21,23,33.
Respecto al tratamiento, la primera línea la constituyen los CT, con los que se consigue una respuesta buena, incluso en los casos con una afectación extensa de la superficie corporal. Si la erupción es refractaria se pueden indicar CS, fototerapia, acitretina por vía oral, o incluso metotrexato o apremilast. La suspensión definitiva del fármaco no suele ser necesaria y, en algunos casos, puede reintroducirse sin recurrencia17,23,33,35.
La aparición de este tipo de EAir se ha relacionado con una respuesta oncológica favorable al tratamiento32.
Erupciones eccematosasLos eccemas ocurren principalmente en pacientes que reciben agentes anti-PD-1/anti-PD-L114,19,30.
Suelen aparecer más tarde que los exantemas maculopapulares, generalmente a partir de los 3 meses19,32. Sin embargo, pueden demorarse hasta después de los 2 años de tratamiento30. Las lesiones pueden ser generalizadas o localizadas y se acompañan de prurito en la mayoría de las ocasiones19,30. En la biopsia se observa espongiosis en la epidermis y un infiltrado inflamatorio perivascular en la dermis20.
En función de la gravedad, el tratamiento consiste en CT, CS, tacrolimús tópico, antihistamínicos por vía oral o fototerapia UVB30.
PsoriasisSe ha descrito tanto la aparición de una psoriasis de novo como la exacerbación de una psoriasis previa en relación con la administración de fármacos anti-PD-1 y, con menor frecuencia, con anti-PD-L1 e ipilimumab36. La latencia media del comienzo varía entre 1 y 8 meses, produciéndose la exacerbación de psoriasis previa de forma más precoz que el brote de psoriasis de novo36-38.
La forma de presentación más frecuente es la psoriasis en placas, seguida de la palmoplantar. Pueden aparecer también formas pustulosas (fig. 2C), en gotas, inversa, eritrodérmica, sebopsoriasis o psoriasis ungueal, así como combinarse varios subtipos o asociarse artropatía psoriásica37-40.
La histología suele ser la típica de esta dermatosis, aunque puede verse algo de espongiosis, sobre todo en las lesiones de psoriasis inversa19,20.
La patogenia no está clara, pero parece que el bloqueo de PD-1 produce una activación de las vías Th1/Th17 con la consecuente sobreexpresión de interferón-gamma, interleucina (IL)-2, factor de necrosis tumoral (TNF)-alfa, IL-6 e IL-1714,20,36.
En la mayoría de los pacientes la clínica suele ser leve (ASC afectada ≤ 10%) y responde bien a CT de alta potencia asociados a calcipotriol36,38. Si no se logra una respuesta se recomienda añadir fototerapia (UVB de banda estrecha) o acitretina. Los casos refractarios pueden tratarse con metotrexato, apremilast o, como última opción, con fármacos biológicos (preferentemente anti-TNF-alfa), con resultados variables17,38,39. Los CS se han utilizado, pero es mejor reservarlos cuando se quiere conseguir una respuesta rápida u otras medidas no funcionan38,39. En menos de la mitad de los pacientes es necesario la suspensión temporal o definitiva del fármaco36,38.
Erupciones granulomatosas similares a sarcoidosisEste tipo de reacciones aparecen en un porcentaje variable (0,65-22% de los pacientes que reciben IPI según las series)41-43. Se han comunicado con el uso de anti-PD-1/PD-L1 y de ipilimumab18,41,43.
La latencia varía entre 1,5 a 7 meses desde el inicio del fármaco, aunque pueden aparecer varios meses después de su suspensión. Los órganos más comúnmente afectados son los ganglios mediastínicos e hiliares, los pulmones y la piel. La clínica cutánea consiste en la aparición de unas pápulas o unos nódulos eritematosos coalescentes pruriginosos y, a veces, dolorosos localizados en la cara o en las extremidades41-43. La histología muestra granulomas no necrosantes20,41.
Se ha sugerido que su aparición se deba al incremento de células Th1 y Th17 debido al bloqueo de CTLA-4. También podría tratarse de una reacción paradójica, pues se ha observado que los pacientes con sarcoidosis tienen una expresión aumentada de PD-1 en las células T y, por tanto, el bloqueo de PD-1 podría considerarse una diana terapéutica en esta enfermedad20,41,43.
El tratamiento de las lesiones cutáneas consiste en la administración de CT de alta potencia y, en los casos refractarios, de CS. En ocasiones se ha utilizado la hidroxicloroquina por vía oral41. Se debe descartar la presencia de afectación ganglionar o pulmonar. Cuando las lesiones cutáneas sean persistentes o extensas, los signos radiológicos progresen, haya un deterioro de la función pulmonar o una afectación de otros órganos se deben iniciar el tratamiento con CS y suspender el fármaco IPI. Se puede plantear su reintroducción tras lograr una reducción de la dosis de CS (≤ 10mg/kg/día), si el paciente permanece asintomático41-43.
Dermatosis neutrofílicasSe han comunicado varios tipos de dermatosis neutrofílicas en relación con fármacos IPI, mayoritariamente el síndrome de Sweet. Sus características se detallan en la tabla 344,45.
Dermatosis neutrofílicas asociadas al tratamiento con fármacos IPI
| Tipo | Características | Tratamiento |
|---|---|---|
| Síndrome de Sweet44,45(el más frecuentemente comunicado) | Clínica típica. Exclusivamente descrito con ipilimumab. Latencia media: 9 semanas | CS± CTOtras opciones: dapsona, ciclosporinaValorar suspensión del fármaco |
| Pioderma gangrenoso44 | Úlcera típica. Muy poco frecuente. Exclusivamente asociado con ipilimumab. Latencia media: 16 semanas | CT+CS, infliximabCuidado de la úlcera, manejo del dolor, antibióticos tópicosSuspensión del fármaco |
| Pustulosis exántemática localizada aguda44 | Muy poco frecuente. Vesículas subcórneas con neutrófilos, localizadas | CT. No precisa suspensión del fármaco |
CS: corticoides sistémicos; CT: corticoides tópicos.
La frecuencia de reacciones adversas cutáneas graves por IPI es baja, inferior al 3% de los pacientes que reciben estos fármacos5,9,14,24. Se han comunicado casos de síndrome de Stevens-Johnson, necrólisis epidérmica tóxica (NET), reacción a fármacos con eosinofilia y síntomas sistémicos —drug reaction with eosinophilia and systemic symptoms (DRESS)— y pustulosis exantemática aguda generalizada (PEAG)14,24,44,46-48.
En relación con la NET, hay que señalar que en los casos relacionados con IPI su presentación puede ser atípica y tardía, desarrollándose hasta 12 semanas después del inicio del tratamiento. Muchas veces comienza como una erupción maculopapular que persiste durante semanas hasta que finalmente aparecen las ampollas y el despegamiento cutáneo18,24,48,49.
Está indicado en estos casos la realización de una biopsia con inmunofluorescencia directa (IFD) para descartar una reacción inmunoampollosa48. Se debe suspender el fármaco, ingresar al paciente e instaurar medidas de soporte. A diferencia de la NET por otros fármacos, en estos casos se recomiendan los CS hasta que los síntomas mejoren a grado 1, y una reducción progresiva de la dosis13,15,16,24,48. En algunos casos se han utilizado también infliximab, ciclosporina o inmunoglobulinas por vía intravenosa17,24,49. La tasa de mortalidad alcanza el 50-60%48,49.
Erupciones similares a conectivopatíasLas enfermedades del tejido conectivo cutáneas relacionadas con IPI constituyen una toxicidad emergente50-55. Aparecen de novo en el 0,025% de los pacientes que reciben estos fármacos, con una proporción similar en ambos sexos. Se dan principalmente con los anti-PD-1/PDL-150,52. Se han descrito casos de lupus eritematoso cutáneo subagudo (el tipo más frecuente), de esclerodermia, dermatomiositis y fascitis eosinofílica50. La latencia media de aparición de las lesiones es de 8 meses (rango 0,5-26 meses). Se presentan con la clínica habitual50, con la particularidad de que en la esclerodermia en relación con el pembrolizumab la afectación suele ser difusa y rápida mientras que el nivolumab provoca unas formas más localizadas52.
Dermatosis inmunoampollosasEste grupo está representado fundamentalmente por el PA, aunque también se han comunicado casos aislados de dermatitis herpetiforme y dermatosis IgA lineal11,14,56.
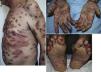
El PA, con una incidencia del 1-8%, se ha descrito fundamentalmente con fármacos anti-PD-1/anti-PD-L1, estando raramente implicado ipilimumab14,19,25,56-58.
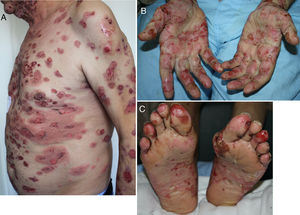
Aparece de media a los 6 meses (rango 2 semanas-25 meses)19,25,56,57,59-61. La clínica es la típica, con ampollas tensas de contenido claro sobre una base eritematoedematosa en cualquier zona de la superficie corporal y prurito intenso (fig. 3A-C). Sin embargo, en ocasiones puede presentarse de forma localizada, afectar a las mucosas o no llegar a desarrollar ampollas56,60,62. Suele estar precedido durante semanas por una fase preampollosa (34,5%) o por un prurito sin lesiones25,57,60,61. En la biopsia se observan los hallazgos típicos, con ampollas subepidérmicas ricas en eosinófilos y la IFD demuestra la presencia de depósitos lineales de IgG y C320,56,60,61,63.
Respecto a la patogenia, se ha propuesto que pudiera ser debido bien a una reactividad cruzada entre antígenos cutáneos y antígenos tumorales (el melanoma y el carcinoma microcítico parecen expresar BP180) o bien al empeoramiento de un penfigoide preexistente subclínico por el estímulo inmunitario. No está claro si la activación de las células B (que producen los anticuerpos anti-BP180) tiene lugar a través de las células T o de forma directa por los fármacos IPI20,62-64.
En una minoría de pacientes el cuadro se puede controlar con CT, pero la mayoría son formas graves (grado ≥ 2) requiriendo CS. Además, en muchos casos es necesario asociar otros fármacos, como doxiciclina-nicotinamida, dapsona, metotrexato, inmunglobulinas por vía intravenosa, omalizumab o rituximab. En la mitad o más es preciso suspender el fármaco IPI y mantener los CS a dosis bajas, ya que el cuadro se hace persistente o recurrente, pudiendo prolongarse durante meses tras la suspensión del IPI11,26,27,56,57,60,61.
Algunos autores han encontrado una asociación entre el desarrollo de esta toxicidad o la elevación de los títulos de IgG anti-BP180, con una respuesta favorable al tratamiento oncológico64,65.
Alteraciones de los queratinocitosSe han comunicado algunos casos de enfermedad de Grover en relación con fármacos anti-CTLA-4 así como con anti-PD-1/anti-PD-L118,19. Se recomienda confirmar el diagnóstico mediante biopsia, que muestra los hallazgos típicos de esta entidad11,17,18,20.
También se ha descrito la aparición de queratosis actínicas, carcinomas basocelulares, verrugas seborreicas, carcinomas epidermoides y queratoacantomas eruptivos en pacientes en tratamiento con fármacos anti-PD-1/anti-PD-L114,30. El mecanismo patogénico con relación a los fármacos IPI se desconoce.
Alteraciones de la pigmentaciónVitíligoEs un efecto adverso frecuente que se ha relacionado tanto con fármacos anti-CTLA-4 como con fármacos anti-PD-1/anti-PD-L1. Aparece principalmente en pacientes con un melanoma, con una incidencia que varía entre el 2,8 y el 48% según las series14,30,66,67. No obstante, también se han comunicado casos de vitíligo en pacientes en tratamiento con fármacos IPI por un cáncer de pulmón68,69.
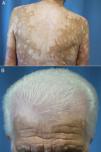
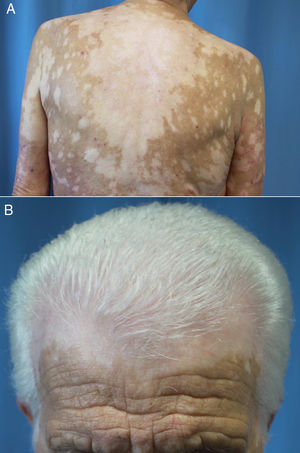
La latencia de comienzo varía entre los 30 y los 758 días tras el inicio del tratamiento66,67,70,71. Se diferencia del vitíligo común en que suele presentarse con un patrón de máculas moteadas que confluyen en máculas más grandes distribuidas en áreas fotoexpuestas (fig. 4A y B) y no se asocia a fenómeno de Koebner66,70,72. Además, según Larsabal et al.70, estos pacientes no tienen antecedentes familiares o personales de vitíligo, tiroiditis o enfermedades autoinmunes y presentan unos niveles más elevados de células CD8 CXCR3 en la sangre y el tejido perilesional70.
Vitíligo extenso en un paciente de 69 años en tratamiento con nivolumab por un carcinoma epidermoide de pulmón estadio iv. No existían antecedentes personales ni familiares de esta dermatosis. A) Máculas moteadas acrómicas confluentes en la espalda. B) Vitíligo del cuero cabelludo asociado a poliosis del cabello.
En su patogénesis se ha propuesto la reactividad cruzada entre las células neoplásicas y los antígenos de los melanocitos (gp100, MelanA/MART-1, tirosinasa, etc.)18,20,66,67.
Las lesiones persisten tras la suspensión del fármaco. No requiere de un tratamiento específico, además de la fotoprotección, aunque se han empleado CT, tacrolimús tópico, fototerapia o láser con respuestas limitadas17,18,59,67,69,73.
Tanto la aparición de un vitíligo como su extensión y su expansión se han relacionado con una respuesta oncológica favorable al tratamiento32,66,72,74-76.
Otras alteraciones pigmentariasSe ha comunicado la repigmentación del pelo canoso, así como la regresión de nevos melanocíticos previos o la aparición de poliosis asociada (fig. 3 B) o no a vitíligo en los pacientes con un melanoma en tratamiento con IPI14,18,67,73.
Anomalías del pelo y las uñasSe han observado distintos tipos de alteraciones del pelo y las uñas que se detallan en la tabla 4. La alopecia, principalmente la alopecia areata, es el trastorno más frecuente, con una incidencia que varía entre el 1 y el 27% según las fuentes consultadas9,18.
Anomalías del pelo y las uñas asociadas a fármacos IPI
| Tipo de toxicidad | Características |
|---|---|
| Alopecia areata | Más frecuente y grave con IpilimumabParcial o universalHistología típica: alopecia no cicatricial con infiltrado linfocitario perifolicular |
| Cambios en la textura del pelo | Engrosamiento del cabelloCambio de textura lisa a rizada |
| Alteraciones ungueales | Distrofia ungueal, a veces asociada a onicomadesis o onicosquiciaCambios de coloraciónOnicólisis difusa y paroniquia de todos los dedosProbable etiología psoriásica o liquenoide |
En la tabla 5 se enumeran algunas dermatosis, en su mayoría inflamatorias, que han sido esporádicamente comunicadas en forma de casos aislados. Se desconocen su patogenia y su significación pronóstica.
Otras dermatosis por IPI esporádicamente comunicadas
| Pitiriasis rubra pilaris14,19 |
| Erupción similar a pitiriasis rosada14,19 |
| Hidradenitis supurativa87 |
| Síndrome de Sjögren18 |
| Erupción acneiforme y rosácea papulopustulosa14,18 |
| Vasculitis18 |
| Paniculitis tipo eritema nudoso18 |
| Acrocianosis88 |
| Angioedema89 |
| Urticaria18 |
| Hipohidrosis90 |
| Seudolinfoma91 |
| Granuloma anular18 |
| Herpes zóster granulomatoso92 |
| Radiosensibilización18 |
| Dermatitis por radiation recall93 |
| Dermatitis de contacto94 |
| Prurigo simple, prurigo nodular14 |
| Fotosensibilidad18 |
| Erupción mucocutánea progresiva relacionada con inmunoterapia95 |
Debido a la frecuencia y la morbilidad de los EAir cutáneos, el dermatólogo desempeña un papel fundamental en el cuidado multidisciplinar de los pacientes que reciben IPI. Su función consiste en precisar el diagnóstico, optimizar la terapia dermatológica y proporcionar una perspectiva adecuada del pronóstico de estas reacciones cutáneas73.
Los dermatólogos deben implicarse de forma temprana en el cuidado de estos pacientes, realizando una evaluación cutánea basal antes de iniciar el tratamiento con IPI o bien facilitando la derivación precoz si aparece una toxicidad cutánea22,67,73. En este contexto clínico, ante una reacción dermatológica se debería realizar una historia detallada y un examen exhaustivo de la piel y las mucosas, además de descartar infecciones, efectos adversos por otros fármacos o enfermedades sistémicas22.
El tratamiento de los EAir cutáneos, como se ha detallado anteriormente, viene determinado por su gravedad. Actualmente, la clasificación de la gravedad se basa principalmente en el ASC afectada siguiendo la clasificación de la CTCAE13,15,16,18. Sin embargo, algunos autores consideran que este sistema de graduación no es adecuado y defienden que su evaluación debería enfocarse en la naturaleza de la dermatosis, su localización y la repercusión sobre la calidad de vida17,77.
Como se ha señalado en los diferentes apartados, los CS representan la piedra angular del tratamiento de las toxicidades cutáneas graves (grado ≥ 2). Sin embargo, el impacto de los CS en la supervivencia de estos pacientes es controvertido. Aunque algunos estudios sugieren que a dosis altas (> 10mg de prednisona/día) podrían reducir la eficacia de los IPI y conllevar un peor resultado oncológico4,78,79, otros han observado que no tienen un efecto negativo en la respuesta antitumoral, siempre que no se estuvieran administrando como tratamiento basal antes de iniciar el fármaco IPI17,80,81. A pesar de ello, los dermatólogos deberían intentar emplear otras modalidades de tratamiento, enfocadas a cada toxicidad en particular cuando sea posible17.
Significación pronósticaCada vez hay más estudios que comunican la relación entre los EAir cutáneos en general y de algunos tipos en particular asociándose a unas tasas de respuesta tumoral mejores y a un aumento tanto de la supervivencia global como de la supervivencia libre de progresión4,10,32,38,64-66,71,72,74-76,82,83. Sin embargo, al igual que otros autores, consideramos que estos datos se deben interpretar con cautela, ya que la mayoría de estos trabajos tienen limitaciones tanto por su carácter retrospectivo como por el número pequeño de pacientes analizados. Además, no se ha aclarado el significado clínico de los EAir graves y el sesgo de supervivencia es difícil de controlar, por lo que es posible que los pacientes que viven más tiempo tengan más probabilidad de desarrollar EAir de cualquier tipo simplemente porque reciben durante más tiempo el tratamiento25,38,78,79,84.
ConclusionesLos IPI representan el futuro del tratamiento oncológico y la toxicidad cutánea derivada de su uso será cada vez más prevalente. Aunque se ha avanzado en su conocimiento, todavía quedan muchos aspectos por resolver en cuanto a su caracterización y clasificación, patogenia, manejo e implicaciones en el pronóstico. El dermatólogo desempeña un papel fundamental en el diagnóstico y tratamiento de estas toxicidades, muchas de las cuales representan un impacto notable en la calidad de vida de los pacientes oncológicos.