La regresión completa de neoplasias melanocíticas, confirmada mediante estudio histológico, se ha descrito de forma excepcional en la literatura. En esos casos es muy complicado discernir si la lesión previa era maligna o benigna, y en ocasiones tan solo la presencia o ausencia de metástasis en el seguimiento posterior del paciente permite establecer dicha distinción.
MétodosSe realizó un análisis descriptivo que incluyó los nevos melanocíticos extirpados en nuestro Servicio de Dermatología en un período de tres años, en los que el estudio histológico demostró una regresión completa de los mismos. Se analizaron exclusivamente aquellas lesiones de las cuales disponíamos de un control dermatoscópico previo a la regresión completa de las mismas, y cuyas características dermatoscópicas sugerían que se trataba de lesiones benignas. Se valoraron diversos parámetros clínicos, dermatoscópicos, histológicos e inmunohistoquímicos.
ResultadosLa media del tiempo en que se produjo la regresión completa fue de 6,4 meses. Los patrones dermatoscópicos predominantes en los nevos con anterioridad a su involución fueron el reticular y la mezcla de reticular-globular. Histológicamente, el hallazgo más llamativo es la presencia de una fibrosis laminar o delicada, distinta a la que se aprecia habitualmente en melanomas. En todos los casos hubo un predominio de linfocitos T CD8.
ConclusionesLas características clínicas, dermatoscópicas e histológicas de las lesiones melanocíticas estudiadas sugieren que existe una forma muy particular de regresión de nevos melanocíticos que se caracteriza por la gran rapidez con que se produce la misma y que se originaría por un mecanismo citotóxico.
The complete regression of melanocytic tumors, confirmed by histology, has rarely been reported in the literature. It is very difficult to determine the malignant or benign nature of a regressed tumor, and on occasions, the only indication of malignancy is the subsequent development of metastasis.
Material and methodsWe performed a descriptive study of melanocytic nevi that had undergone complete, histologically confirmed regression prior to excision in the dermatology department of our hospital over a period of 3 years. We included only lesions in which dermoscopy performed prior to regression showed features that suggested benignity. We assessed various clinical, dermoscopic, histologic, and immunohistochemical features.
ResultsThe mean time to complete regression was 6.4 months. The main dermoscopic patterns observed were reticular and mixed reticular/globular. Unlike what is generally seen in melanomas, the main histologic finding was the presence of fine or lamellar fibrosis. In all cases, there was a predominance of CD8+ T cells.
ConclusionsThe clinical, dermoscopic, and histologic features of the melanocytic nevi studied suggest the existence of a highly characteristic form of tumor regression characterized by very rapid regression and the involvement of a cytotoxic mechanism.
La regresión espontánea de tumores es uno de los fenómenos más fascinantes y a la vez intrigantes que se pueden observar en Medicina. Este raro suceso ha sido descrito en prácticamente todos los tipos de cánceres, y frecuentemente en neoplasias melanocíticas cutáneas, tanto benignas como malignas, en las que el fenómeno es más evidente por la pérdida de pigmento1–3. En la inducción del fenómeno de regresión se han implicado múltiples mecanismos, entre los que destacan la respuesta inmune, la apoptosis, la inhibición de la angiogénesis, la diferenciación terminal celular y la crisis genómica4–6.
En el caso de los tumores melanocíticos parece que el mecanismo inmune es el que se ha relacionado de una forma más consistente2.
Aunque la regresión parcial en el melanoma ocurre entre un 10 y un 35% de los casos, la documentación histológica de regresión completa es muy rara, con una incidencia estimada de un 0,22-0,27%7,8. Hasta la fecha hay menos de 50 casos documentados, aunque probablemente esté infradiagnosticado9–14. Las series más largas de melanomas cifran en aproximadamente un 2,5-4% los casos de melanomas metastásicos en los que el tumor primario es de origen desconocido, lo que hace intuir que muchos de esos casos puedan corresponder a melanomas que han sufrido un proceso de regresión completa con posterioridad al proceso de diseminación7,14–16.
Por el contrario, la regresión completa de nevus melanocíticos es mucho más frecuente. Clásicamente el halo nevo ha sido el paradigma de nevo melanocítico que sufre una regresión, aunque la introducción de la dermatoscopia digitalizada ha permitido identificar patrones de involución distintos al halo nevo clásico17,18.
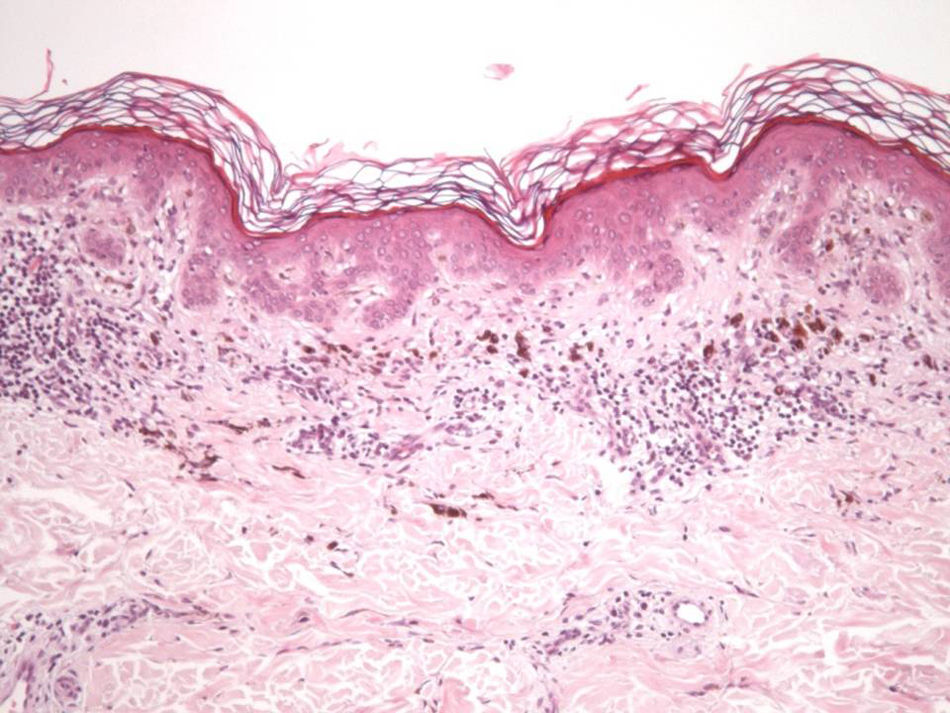
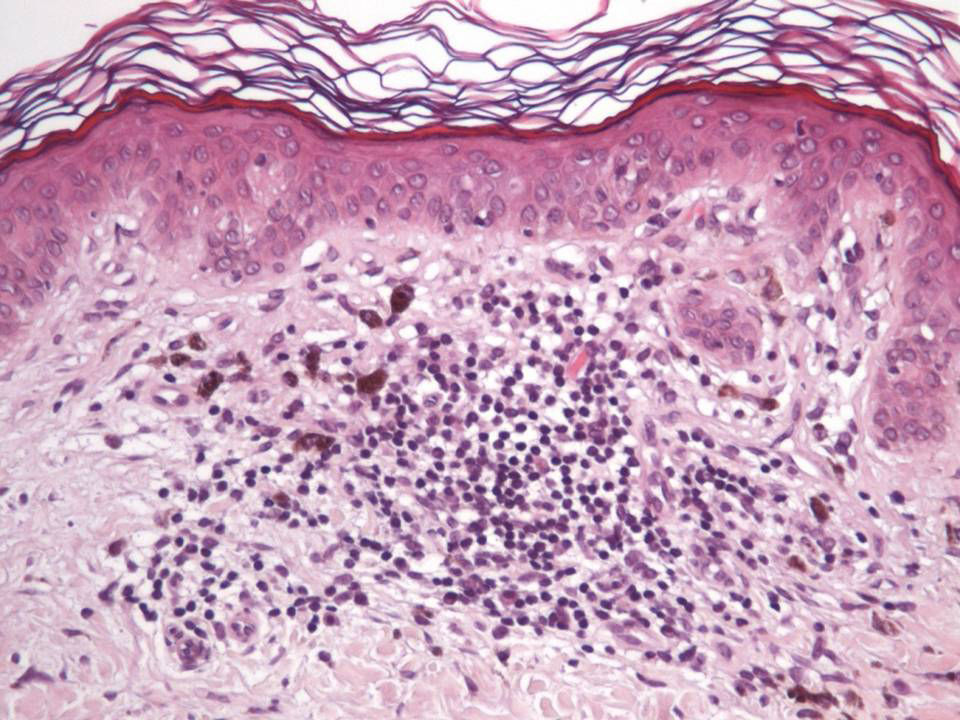
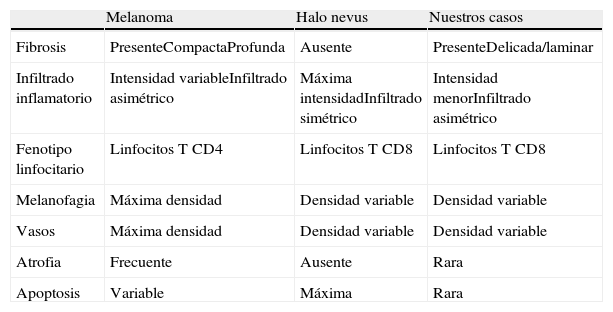
Las características esenciales de una lesión melanocítica que ha sufrido un proceso de regresión espontánea son la sustitución de la población celular tumoral por un estroma fibroso con cantidades variables de melanófagos, inflamación y neovascularización (fig. 1)7,19. Desde un punto de vista exclusivamente histológico, cuando la regresión es completa, es muy difícil determinar la naturaleza biológica de la lesión previa, y en la mayoría de ocasiones tan solo el desarrollo de metástasis en el seguimiento posterior del paciente permite establecer dicha distinción.
El objetivo del presente estudio fue analizar las características clínicas, dermatoscópicas e histológicas de varios nevos melanocíticos que sufrieron una regresión completa confirmada histológicamente, y ver si era posible establecer diferencias clínicas y/o histológicas con las características clinicopatológicas de melanomas que también regresaron por completo.
Material y métodosSe realizó un análisis descriptivo, observacional, retrospectivo, que incluyó las lesiones melanocíticas extirpadas en el Servicio de Dermatología del Hospital Clínico Universitario de Valencia en un período de tres años (del 1 de enero de 2007 al 31 de diciembre de 2009), en las que el estudio histológico demostró una regresión completa de la lesión previa. Se consideró que la regresión era completa cuando en el examen histológico se demostró la ausencia completa de proliferación melanocítica en la epidermis o en la dermis, confirmada mediante técnicas de inmunohistoquímica (Melan-A y proteína S-100), junto con la presencia de un grado variable de infiltrado de células mononucleares, melanofagia y proliferación vascular. Se analizaron exclusivamente aquellas lesiones de las que teníamos constancia previa mediante seguimiento por dermatoscopia digitalizada de que se trataba de un nevo melanocítico con características dermatoscópicas de lesión benigna. Se excluyeron, así mismo, aquellas lesiones en las que se apreció clínicamente la presencia de un halo blanquecino rodeando al nevo.
Las 13 lesiones melanocíticas que se analizaron pertenecían a pacientes controlados de forma periódica en la Unidad de Dermatoscopia digitalizada de nuestro Servicio de Dermatología. Los pacientes se revisaban en períodos de 3 a 6 meses, ya que se trataba de pacientes controlados por presentar múltiples nevos o nevos clínicamente atípicos. Las lesiones se extirparon inmediatamente después de que se produjera el cambio morfológico (en menos de dos semanas).
Se valoraron los siguientes parámetros:
Datos clínicosEdad, sexo, localización de la lesión, tamaño y tiempo en que se produjo la regresión completa.
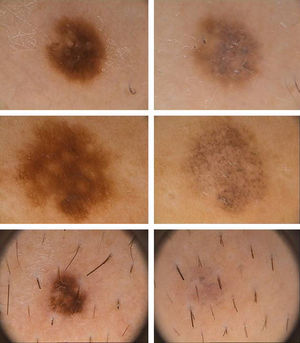
Datos dermatoscópicosLos parámetros dermatoscópicos valorados en cada lesión correspondieron al patrón estructural predominante en el nevo previo a su regresión (globular, reticulado, homogéneo, paralelo o combinación de los anteriores), y a las características dermatoscópicas que se apreciaban en la lesión regresada (pérdida de estructura y del pigmento, presencia de velo grisáceo-blanquecino, de estructuras vasculares, o de puntos grisáceos de pigmento [similares a la pimienta]).
Los datos dermatoscópicos analizados se obtuvieron a partir del análisis de las lesiones pigmentadas con la videocámara del aparato de dermatoscopia digitalizada Fotofinder® (FotoFinder Systems GMBH, Bad Birnbach, Alemania).
Datos histológicosFibrosis: intensidad (nula, leve, moderada, extensa), tipo (compacta, laminar, delicada), acentuación subepidérmica (presente, ausente); infiltrado inflamatorio mononuclear (nulo, leve, moderado, extenso); melanófagos (nulo, leve, moderado, extenso); neovascularización (nula, leve, moderada, extensa); apoptosis de células tumorales (nula, leve, moderada, extensa); atrofia epidérmica (ausente o presente).
Los valores cualitativos se valoraron en función del porcentaje que ocupaba el parámetro estudiado sobre el total del área regresada. Se consideró nulo cuando el porcentaje era 0; leve (hasta 1/3); moderado (hasta 2/3); extenso (a partir de 2/3).
Datos inmunohistoquímicosInmunotinción para linfocitos T CD4 y CD8, Melan-A y S-100. La inmunorreactividad para linfocitos T CD4 y CD8 se evaluó en función del porcentaje de células predominante. En los casos en los que no se constató la presencia de infiltrado inflamatorio no se realizó estudio inmunohistoquímico para linfocitos T CD4 ni CD8.
La proteína S-100 y el Melan-A se utilizaron para ver si existía algún nido residual o hiperplasia lentiginosa residual.
Todas las muestras habían sido fijadas con formol neutro e incluidas en parafina. Sobre secciones tisulares de 4 micras de espesor se realizaron los estudios histológico e inmunohistoquímico.
La evaluación de los parámetros histológicos e inmunohistoquímicos de las lesiones se realizó con un microscopio Olympus® multicabezal.
Los estudios inmunohistoquímicos se realizaron por técnicas de inmunoperoxidasa.
ResultadosClínicosSe estudiaron 13 lesiones en las que había constancia histológica de regresión completa, de las cuales el 53,8% (7 casos) pertenecían a hombres y el 46,2% (6 casos) a mujeres. La media de la edad de los pacientes fue de 36,3 años (rango: 18-66).
La localización más frecuente de las lesiones fue el tronco (69,2% de los casos; 9 casos), predominando el tórax (38,4%; 5 casos) y seguido por la espalda (30,8%; 4 casos). El 15,3% (dos casos) restante se hallaba en las palmas o en las plantas, el 7,6% (un caso) en los brazos y el 7,6% % (un caso) en las piernas.
La media del tamaño de los nevos extirpados fue de 0,5cm (rango: 0,2-2).
La media del tiempo en que se produjo la regresión completa de los nevos melanocíticos (meses trascurridos entre el último control dermatoscópico hasta que se apreció la modificación del nevo) fue de 6,4 meses (rango: de 3 a 11 meses).
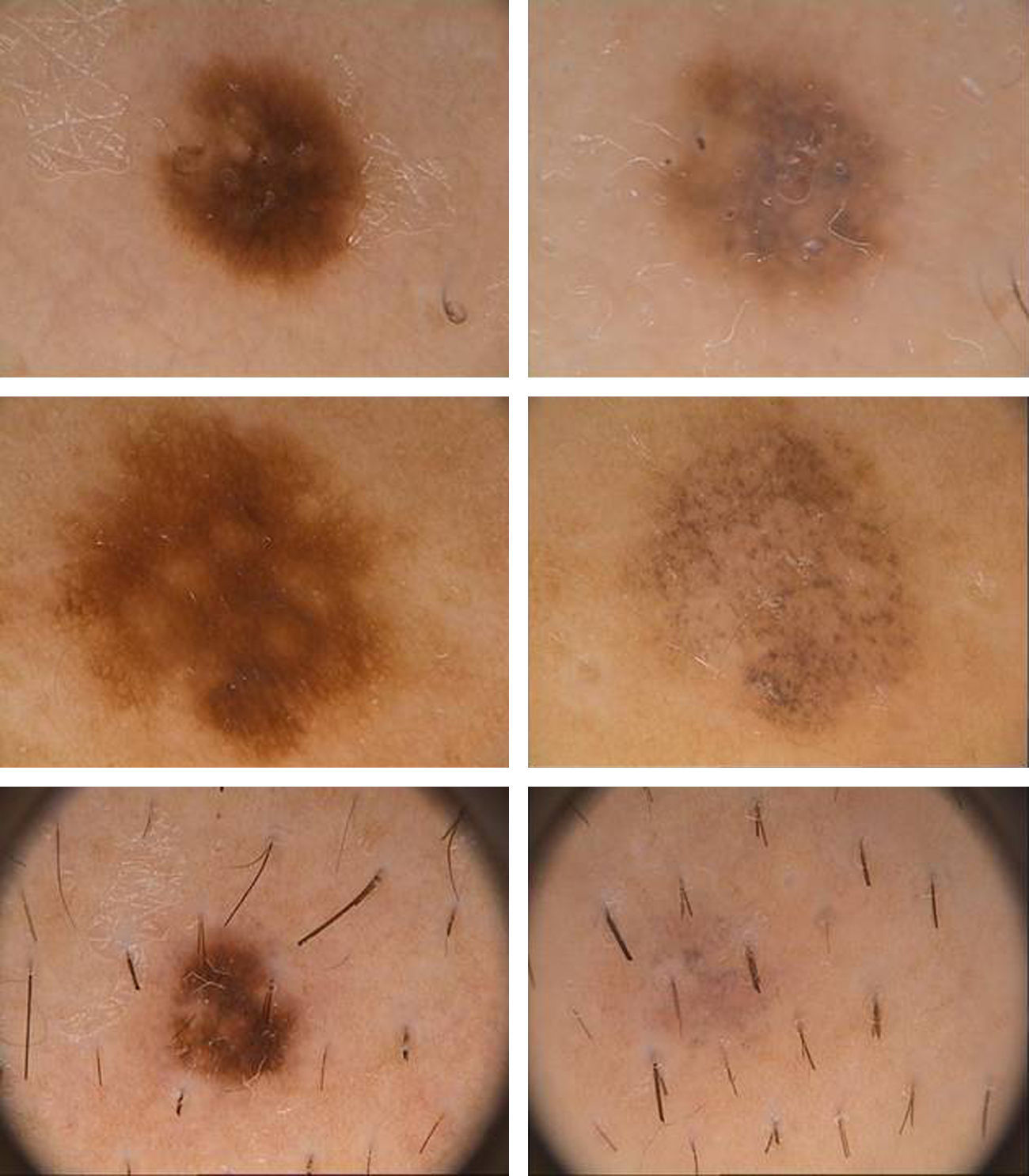
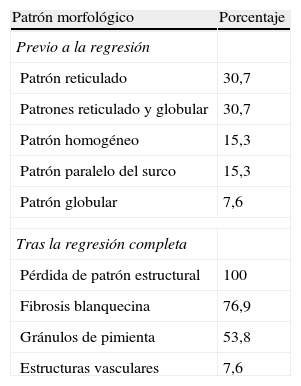
DermatoscópicosDel estudio de los diferentes parámetros morfológicos objetivables con la dermatoscopia se extrajeron valores de frecuencia presentados en la tabla 1.
Valores de frecuencia de los diferentes parámetros morfológicos objetivables con la dermatoscopia
| Patrón morfológico | Porcentaje |
| Previo a la regresión | |
| Patrón reticulado | 30,7 |
| Patrones reticulado y globular | 30,7 |
| Patrón homogéneo | 15,3 |
| Patrón paralelo del surco | 15,3 |
| Patrón globular | 7,6 |
| Tras la regresión completa | |
| Pérdida de patrón estructural | 100 |
| Fibrosis blanquecina | 76,9 |
| Gránulos de pimienta | 53,8 |
| Estructuras vasculares | 7,6 |
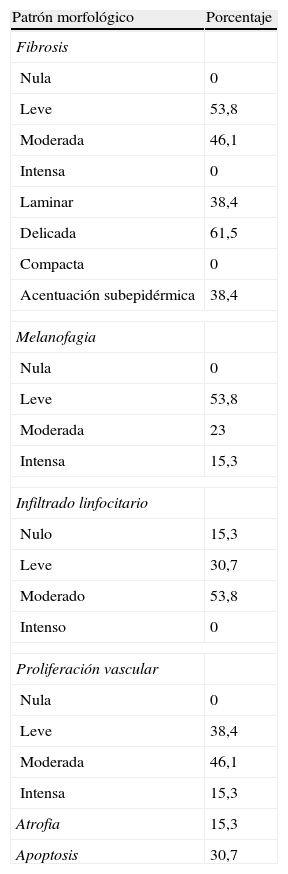
La descripción de los hallazgos histológicos quedan reflejados en la tabla 2, mostrándose ejemplos de los cambios histológicos descritos en las figuras 2-6.
Valores de frecuencia de los diferentes parámetros morfológicos objetivables en el estudio histológico
| Patrón morfológico | Porcentaje |
| Fibrosis | |
| Nula | 0 |
| Leve | 53,8 |
| Moderada | 46,1 |
| Intensa | 0 |
| Laminar | 38,4 |
| Delicada | 61,5 |
| Compacta | 0 |
| Acentuación subepidérmica | 38,4 |
| Melanofagia | |
| Nula | 0 |
| Leve | 53,8 |
| Moderada | 23 |
| Intensa | 15,3 |
| Infiltrado linfocitario | |
| Nulo | 15,3 |
| Leve | 30,7 |
| Moderado | 53,8 |
| Intenso | 0 |
| Proliferación vascular | |
| Nula | 0 |
| Leve | 38,4 |
| Moderada | 46,1 |
| Intensa | 15,3 |
| Atrofia | 15,3 |
| Apoptosis | 30,7 |
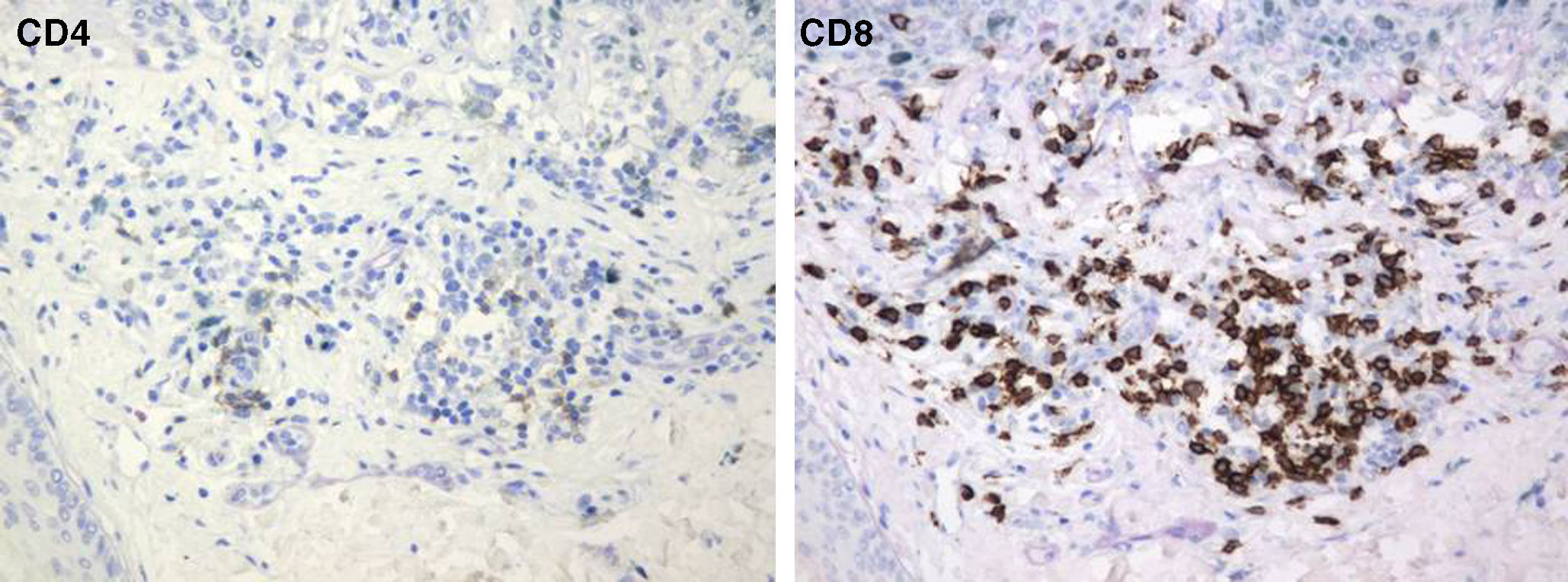
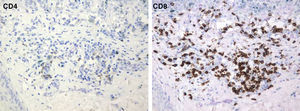
El porcentaje medio de expresión de linfocitos T CD4 y CD8 fue de 23,1 y 76,9% respectivamente.
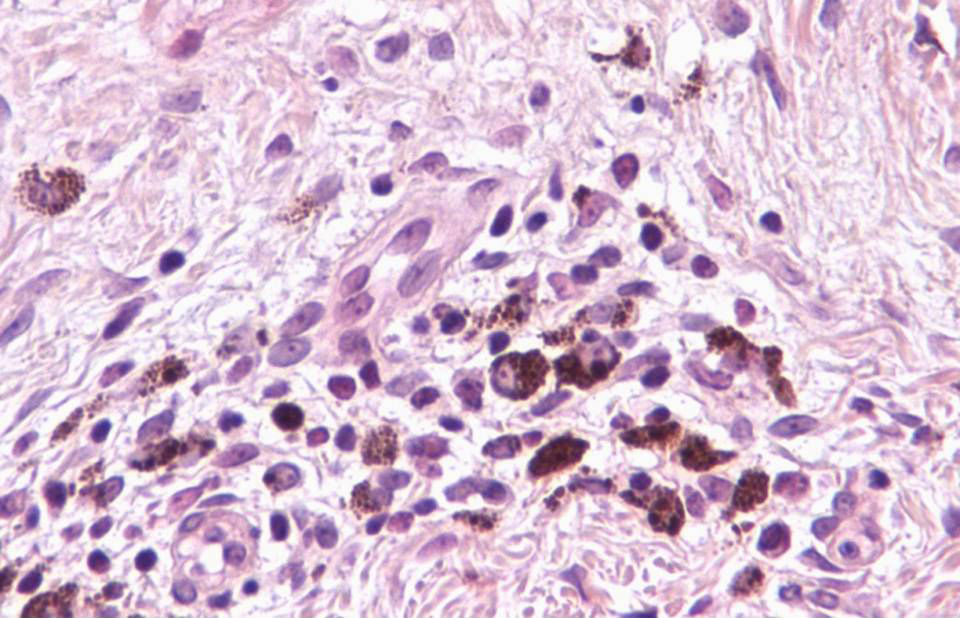
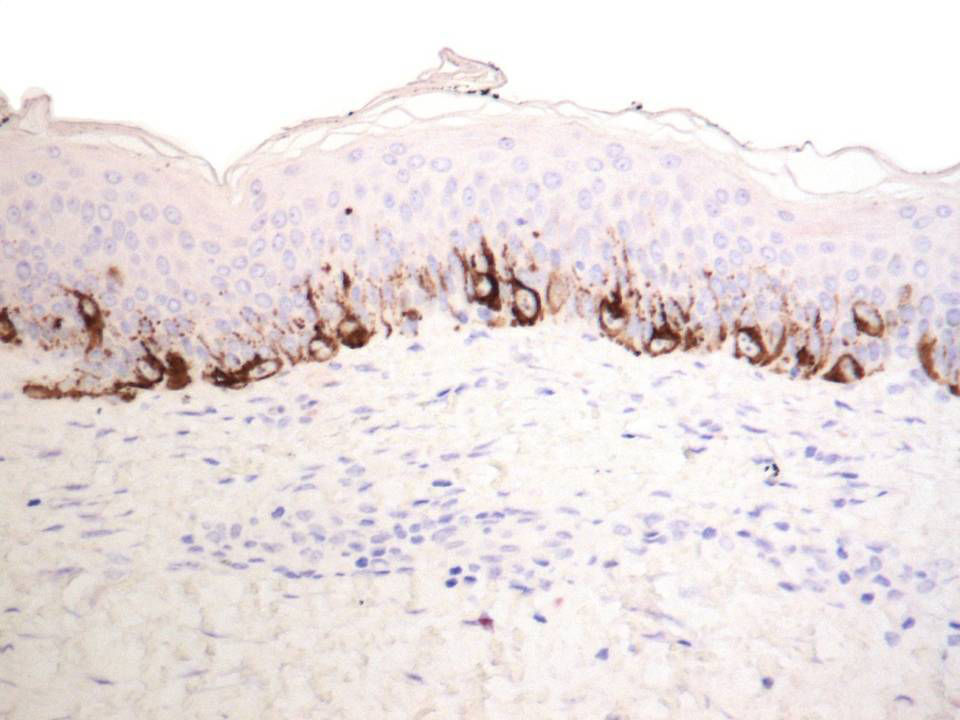
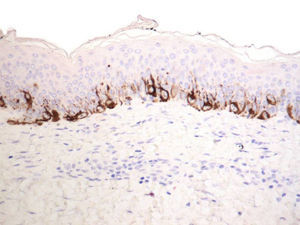
Se objetivó hiperplasia lentiginosa residual (fig. 7) en un 15,38% (mediante Melan-A). En ningún caso se apreció la existencia de nidos residuales.
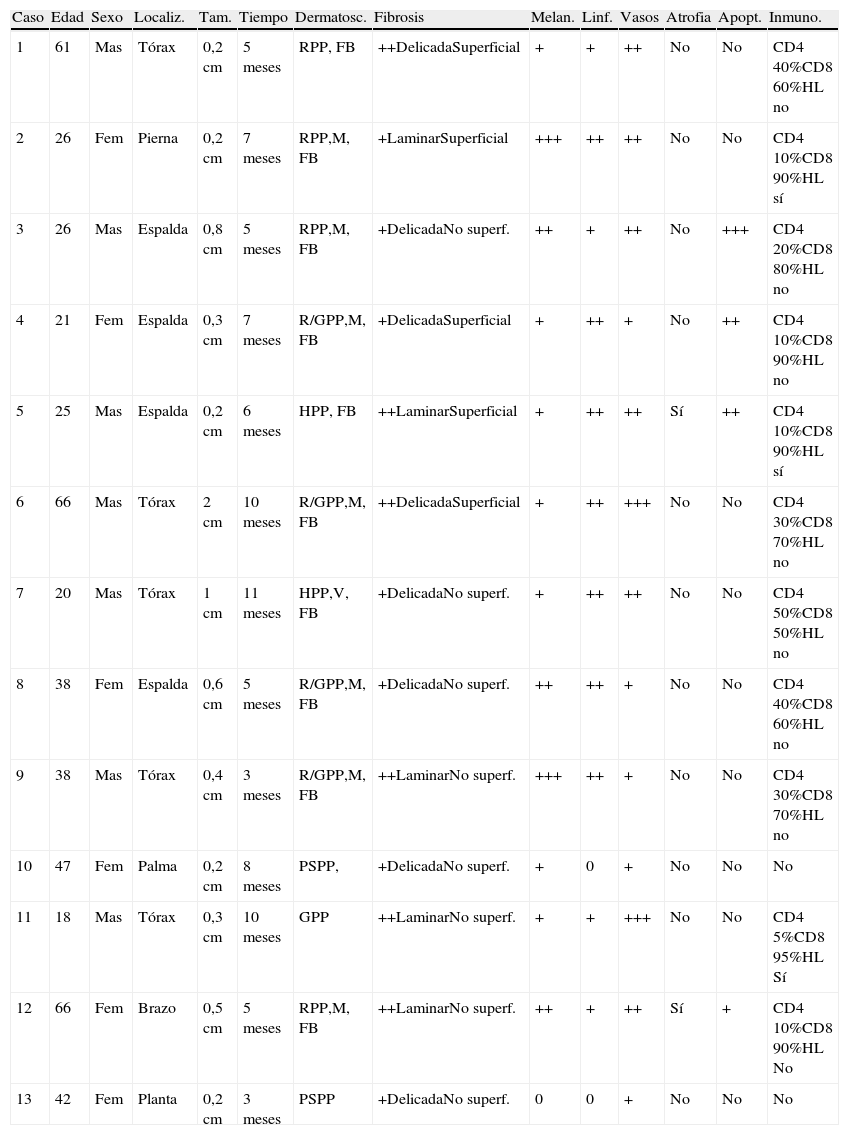
En la tabla 3 se resumen todos los parámetros clínicos, dermatoscópicos, histológicos e inmunohistoquímicos.
Resumen de los parámetros clínicos, dermatoscópicos, histológicos e inmunohistoquímicos presentes en cada caso
| Caso | Edad | Sexo | Localiz. | Tam. | Tiempo | Dermatosc. | Fibrosis | Melan. | Linf. | Vasos | Atrofia | Apopt. | Inmuno. |
| 1 | 61 | Mas | Tórax | 0,2cm | 5 meses | RPP, FB | ++DelicadaSuperficial | + | + | ++ | No | No | CD4 40%CD8 60%HL no |
| 2 | 26 | Fem | Pierna | 0,2cm | 7 meses | RPP,M, FB | +LaminarSuperficial | +++ | ++ | ++ | No | No | CD4 10%CD8 90%HL sí |
| 3 | 26 | Mas | Espalda | 0,8cm | 5 meses | RPP,M, FB | +DelicadaNo superf. | ++ | + | ++ | No | +++ | CD4 20%CD8 80%HL no |
| 4 | 21 | Fem | Espalda | 0,3cm | 7 meses | R/GPP,M, FB | +DelicadaSuperficial | + | ++ | + | No | ++ | CD4 10%CD8 90%HL no |
| 5 | 25 | Mas | Espalda | 0,2cm | 6 meses | HPP, FB | ++LaminarSuperficial | + | ++ | ++ | Sí | ++ | CD4 10%CD8 90%HL sí |
| 6 | 66 | Mas | Tórax | 2cm | 10 meses | R/GPP,M, FB | ++DelicadaSuperficial | + | ++ | +++ | No | No | CD4 30%CD8 70%HL no |
| 7 | 20 | Mas | Tórax | 1cm | 11 meses | HPP,V, FB | +DelicadaNo superf. | + | ++ | ++ | No | No | CD4 50%CD8 50%HL no |
| 8 | 38 | Fem | Espalda | 0,6cm | 5 meses | R/GPP,M, FB | +DelicadaNo superf. | ++ | ++ | + | No | No | CD4 40%CD8 60%HL no |
| 9 | 38 | Mas | Tórax | 0,4cm | 3 meses | R/GPP,M, FB | ++LaminarNo superf. | +++ | ++ | + | No | No | CD4 30%CD8 70%HL no |
| 10 | 47 | Fem | Palma | 0,2cm | 8 meses | PSPP, | +DelicadaNo superf. | + | 0 | + | No | No | No |
| 11 | 18 | Mas | Tórax | 0,3cm | 10 meses | GPP | ++LaminarNo superf. | + | + | +++ | No | No | CD4 5%CD8 95%HL Sí |
| 12 | 66 | Fem | Brazo | 0,5cm | 5 meses | RPP,M, FB | ++LaminarNo superf. | ++ | + | ++ | Sí | + | CD4 10%CD8 90%HL No |
| 13 | 42 | Fem | Planta | 0,2cm | 3 meses | PSPP | +DelicadaNo superf. | 0 | 0 | + | No | No | No |
Apopt: apoptosis; Dermatosc: dermatoscopia; FB: fibrosis blanquecina; Fem: femenino; G: globular; H: homogéneo; HL: hiperplasia lentiginosa; Inmuno.: inmunohistoquímica; Linf.: infiltrado linfocitario; Localiz: localización; M: gránulos de pimienta; Mas: masculino; Melan.: melanófagos; PP: pérdida de patrón estructural; PS: paralelo del surco; R: reticular; superf.: superficial; Tam.: tamaño; V: vasos.
La regresión espontánea de los tumores es un fenómeno enigmático que ha sido descrito en prácticamente todos los tipos de cánceres, y frecuentemente en neoplasias melanocíticas cutáneas, malignas y benignas, en las que es más evidente por la pérdida de pigmento20–25.
A pesar de que la regresión parcial en el melanoma es relativamente frecuente26–30, la regresión completa del mismo es muy rara, y tan solo hay documentados menos de 50 casos7,8,14.
En los melanomas con regresión completa descritos en la literatura existe un claro predominio de varones (el doble que mujeres), con una edad media de 48 años. Las lesiones tenían tamaños que oscilaban entre 0,4 y 3cm. El 47% de los pacientes tenía supervivencias superiores a los 5 años14. A pesar de que la regresión completa en el melanoma se ha considerado un factor de mal pronóstico, hay que tener en cuenta que casi todos los casos de melanomas con regresión completa descritos en la literatura corresponden a melanomas metastásicos, en los que el examen físico detallado del paciente permitió descubrir con posterioridad la lesión sospechosa. Cabe la posibilidad de que haya melanomas que regresen espontáneamente sin provocar metástasis, hecho que es casi imposible poder documentar. Existe un caso descrito en la literatura de un paciente con un melanoma con Breslow de 0,7mm que rechazó la extirpación completa del mismo, y en el que se evidenció una regresión espontánea completa sin presencia de metástasis tras 4 años de seguimiento14. Podría tratarse de melanomas que el sistema inmune consigue destruir de forma muy rápida, sin dar tiempo a que la neoplasia tenga capacidad de metastatizar.
En cuanto a las lesiones melanocíticas benignas, el halo nevo ha sido el paradigma de nevo melanocítico que sufre un proceso de regresión. El halo nevo se caracteriza histológicamente por una progresiva degeneración de los melanocitos, que son destruidos por un infiltrado inflamatorio que inicialmente es muy prominente y va disminuyendo gradualmente. En el estadio final no se aprecian células névicas, y solo hay un moderado número de células inflamatorias31–33. Aunque la etiopatogenia de los halo nevos aún no ha sido plenamente esclarecida, parece que el infiltrado inflamatorio sirve como precursor de la regresión, que se produce probablemente por un mecanismo de citotoxicidad celular mediada por linfocitos T CD818,33–35. El halo nevo sin halo clínico es una variedad de nevo melanocítico que se ha descrito de forma muy excepcional en la literatura. La histología de esta variedad de nevo muestra unas características que son similares a las del halo nevo convencional32.
La evolución biológica del halo nevo se caracteriza por la desaparición de las células névicas sin desarrollo de tejido fibroso, a diferencia de lo que sucede en la regresión del melanoma, en el que la desaparición de las células se acompaña de fibroplasia de la dermis papilar en la última fase16,36. Algunos autores han intentado esclarecer los motivos por los cuales se induce fibrosis en la regresión del melanoma y no en la del halo nevo. De este modo, se ha objetivado que determinadas citoquinas fibrogénicas se expresan más frecuentemente en el melanoma que en el halo nevo, mientras que la expresión de factor de necrosis tumoral alfa (TNF-α), citocina inhibidora de la fibrosis, se expresa de forma mucho más elevada en el halo nevo. Aunque el microentorno de citocinas parece no justificar completamente la evolución fibrótica en el melanoma en regresión (intervienen también interacciones entre el tumor, el estroma y el infiltrado inflamatorio), la elevada expresión de factor de necrosis tumoral alfa (TNF-α) en el halo nevo sugiere que sí desempeñaría un papel importante en la evolución no fibrótica de la lesión16,36–38.
Por otro lado, en el melanoma el infiltrado inflamatorio que conduce a la regresión del tumor es habitualmente asimétrico y parcheado, afectando solo a partes distintas del mismo. El infiltrado inflamatorio parece similar tanto en el halo nevo como en el melanoma en regresión, aunque el número de linfocitos T CD8 activados es más numeroso en el halo nevo, mientras que en el melanoma es mayor el de CD416,32,39–41.
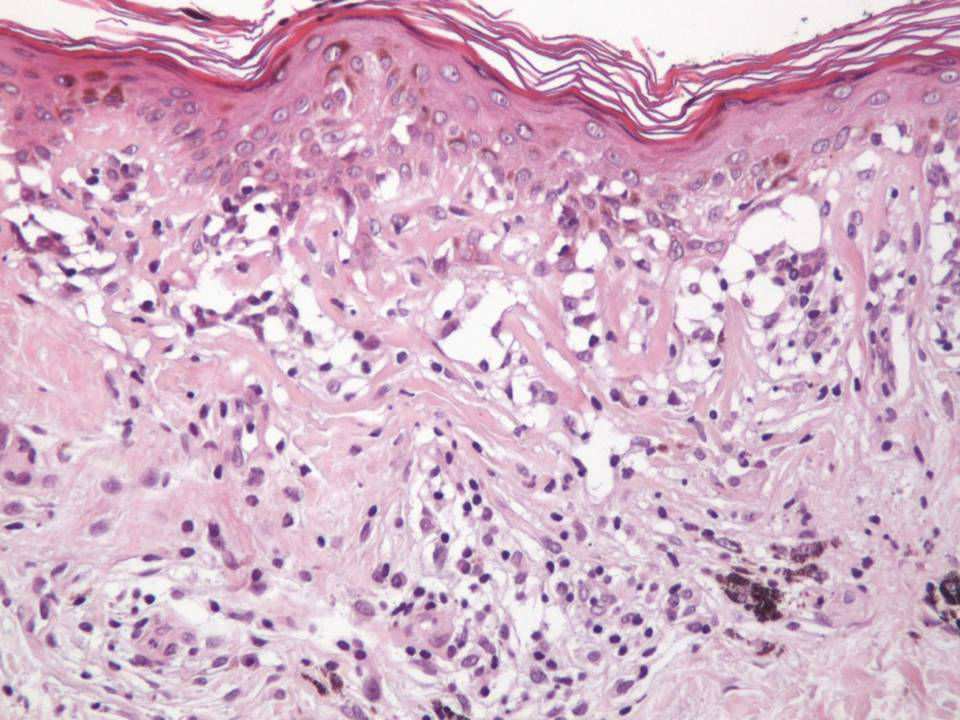
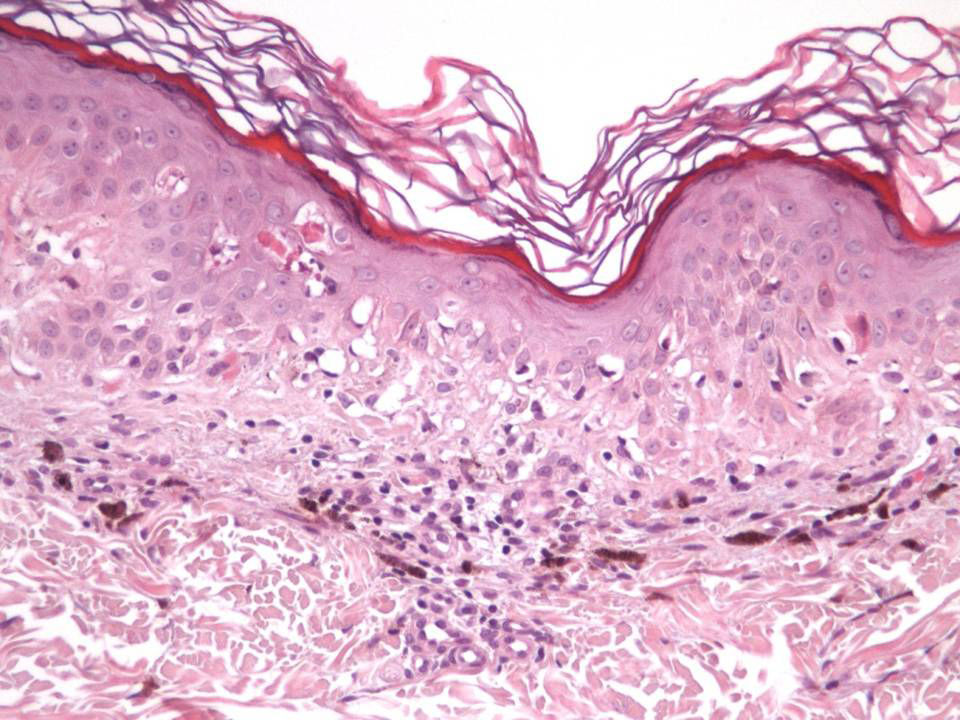
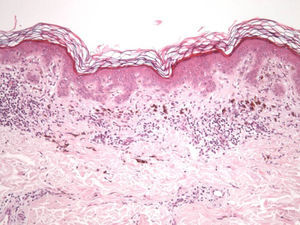
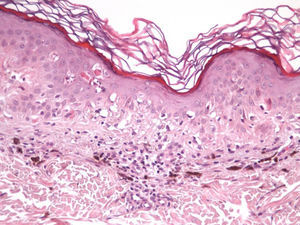
En cuanto a las características clínicas y dermatoscópicas de los nevos analizados en este estudio hemos podido identificar un peculiar patrón de involución, caracterizado clínicamente por la rápida involución de los mismos, e histológicamente por una particular variedad de fibrosis constituida por haces extraordinariamente finos de colágeno, que hemos denominado «delicada» por sus características (fig. 3). En todos los casos se produjo una involución completa del nevo al observarlo con la dermatoscopia en un período de tiempo muy corto (media de 6,4 meses) si se compara con el que tardan en involucionar los halo nevos. La principal característica dermatoscópica fue la pérdida del patrón estructural previo, junto con la presencia de numerosos gránulos de pimienta, que se correlacionan histológicamente con la melanofagia (fig. 8). La lesión residual adoptó en la mayoría de los casos una morfología similar a la que se aprecia en las queratosis liquenoides. A pesar de que disponemos de un seguimiento corto de los pacientes (entre uno y tres años), en ningún caso se ha evidenciado el desarrollo de metástasis.
Determinadas características sugieren que estos casos no son halo nevos convencionales. Del mismo modo, la regresión se produce en estas lesiones de forma distinta a la que se observa en el melanoma. Por un lado, en ninguno de los nevos incluidos en el estudio se apreció clínicamente el desarrollo de un halo blanquecino perilesional. A diferencia de lo que sucede con los halo nevos, en los que es frecuente que los pacientes presenten varias lesiones similares, en ninguno de los sujetos incluidos en el estudio se afectaron otros nevos, y la regresión se produjo de forma muy rápida, comparado con el tiempo que tardan en despigmentar los halo nevos.
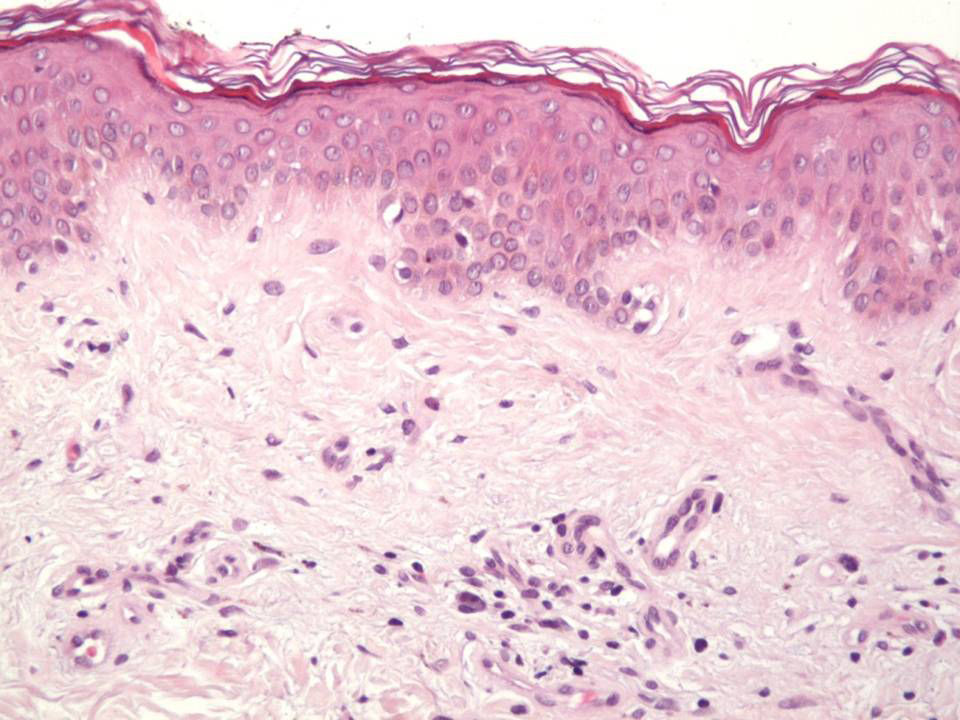
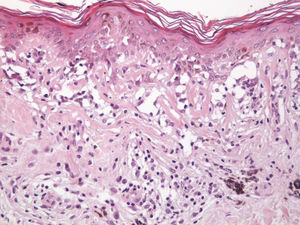
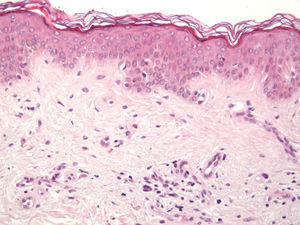
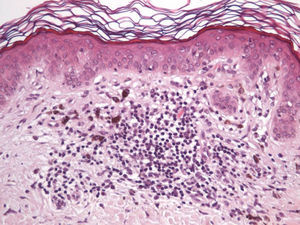
Desde un punto de vista histológico, en estos casos se confirmó la ausencia completa de células névicas con técnicas inmunohistoquímicas. Así mismo, se evidenciaron grados variables de melanofagia (solo extensa en dos casos) (fig. 4), infiltrado inflamatorio (moderado o leve en la mayoría de casos) (fig. 5) y proliferación vascular (fig. 3), y una particular variedad de fibrosis, en muchos casos de localización subepidérmica, constituida por haces muy finos de colágeno (fig. 3), que no ha sido descrita hasta la fecha en halo nevos ni melanomas. En el melanoma lo habitual es que se produzca una fibrosis de tipo compacto, y en el halo nevo no se desarrolla fibrosis en la fase final. En los nevos convencionales que sufren regresión espontánea, la fibrosis no es un hallazgo tan significativo como en el melanoma en regresión, salvo en la entidad recientemente descrita como nevo esclerosante con cambios tipo pseudomelanoma42–45. Estas lesiones se caracterizan porque presentan un patrón trizonal, que está constituido por una proliferación melanocítica atípica con crecimiento pagetoide, un área significativa de esclerosis dérmica conteniendo nidos irregulares de melanocitos y tejido residual del nevo alrededor y por debajo del área cicatricial. Las alteraciones arquitecturales de estas neoplasias melanocíticas son habitualmente tan llamativas que en algunos casos inducen al diagnóstico de melanoma con regresión o melanoma sobre nevus con regresión. A pesar de ello, las alteraciones citológicas esenciales para el diagnóstico de melanoma no se cumplen en la mayoría de estas lesiones, y hasta la fecha no se han descrito casos de regresión completa.
La fibrosis delicada que se describe en este trabajo se distingue de la fibrosis laminar típica del nevo displásico por la ausencia de haces paralelos y/o concéntricos. Por el contrario, existen fibras colágenas delgadas de disposición no ordenada y con mínima celularidad que no presentan signos de actividad significativa. Debido a esto último se puede considerar de manera firme el carácter estable y final del proceso fibrótico y la imposibilidad de que esta fibrosis evolucione a una forma más ordenada (como en el nevo displásico) o en haces más gruesos como en la regresión del melanoma. Por tanto, aunque la extirpación de las lesiones se produjo en todos los casos en un período de tiempo muy corto, en menos de dos semanas desde el momento en que se apreció el cambio, una biopsia realizada tras un período de tiempo más prolongado no mostraría una fibrosis laminar ni en haces gruesos, sino más bien una atenuación del proceso y por tanto una menor diferencia con la dermis normal.
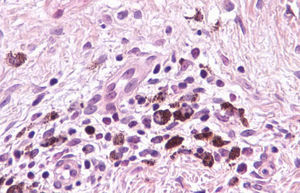
En relación con el resto de características histopatológicas estudiadas, la regresión en el melanoma suele asociarse a melanofagia intensa. De hecho, muchos autores consideran la melanosis nodular (depósito extenso de melanófagos) como un criterio fundamental para considerar la regresión completa de un melanoma14. El infiltrado inflamatorio de los casos de esta serie es menos intenso que el que suele apreciarse en los halo nevos, y mostró un fenotipo con un claro predominio de linfocitos T CD8 (fig. 9), similar al que se observa en el halo nevo, y distinto al del melanoma (existe un predominio de linfocitos T CD4) (tabla 4).
Principales criterios a considerar en el diagnóstico diferencial de lesiones melanocíticas con regresión completa
| Melanoma | Halo nevus | Nuestros casos | |
| Fibrosis | PresenteCompactaProfunda | Ausente | PresenteDelicada/laminar |
| Infiltrado inflamatorio | Intensidad variableInfiltrado asimétrico | Máxima intensidadInfiltrado simétrico | Intensidad menorInfiltrado asimétrico |
| Fenotipo linfocitario | Linfocitos T CD4 | Linfocitos T CD8 | Linfocitos T CD8 |
| Melanofagia | Máxima densidad | Densidad variable | Densidad variable |
| Vasos | Máxima densidad | Densidad variable | Densidad variable |
| Atrofia | Frecuente | Ausente | Rara |
| Apoptosis | Variable | Máxima | Rara |
La etiopatogenia más plausible de la variedad de regresión que se describe en estos casos sería un origen inmune, contra determinados antígenos que se expresarían exclusivamente por los melanocitos que constituyen el nevo afectado, y no por los de la piel adyacente ni por los de otros nevos del paciente, como sucede habitualmente en el halo nevo, que inducirían una destrucción masiva y muy rápida de los mismos. Para entender esta variedad de regresión se podría realizar una analogía con una explosión, en la cual se produciría una destrucción masiva y muy rápida de las células tumorales, lo cual sugeriría un mecanismo citotóxico (confirmado en estos casos por el marcado predominio de linfocitos T CD8), que sería originado por un infiltrado inflamatorio que actuaría de forma muy rápida y desaparecería también precozmente. Los melanocitos expresan de forma muy llamativa moléculas de histocompatibilidad (MHC) de clase I, lo que las hace susceptibles a ser atacadas y destruidas por linfocitos citotóxicos. Probablemente las dianas que inducen el proceso de destrucción son antígenos frente a los que el sistema inmune es normalmente tolerante, que se expresarían en la membrana de los melanocitos, y que sufrirían algún tipo de modificación que desencadenaría la respuesta inmune. Los linfocitos citotóxicos reconocerían los antígenos extraños y podrían ejercer sus efectos tanto por una apoptosis dependiente de ligando FAS, como por un mecanismo de daño directo de la membrana dependiente de perforina. El daño de la célula diana podría amplificar la respuesta inmune vía liberación de antígenos citoplasmáticos que serían normalmente inaccesibles para el sistema inmune26,32.
La fibrosis delicada podría explicarse por la rápida evolución del proceso de regresión y por el carácter superficial de la reparación.
En cuanto a la correlación entre lo que se aprecia en la dermatoscopia y la histología, la pérdida del patrón estructural que se aprecia en todas las lesiones se correlacionaría con la presencia de fibrosis delicada o laminar. Todos los casos en los que la dermatoscopia demostró un gran número de gránulos de pimienta tuvieron una correlación histológica con la presencia de melanofagia moderada o intensa. En cuanto a la proliferación vascular, es el parámetro estudiado que ha mostrado mayor discrepancia en la correlación dermatoscópica-histológica (los vasos tan solo eran evidentes en un 7,6% de los casos por dermatoscopia). Este hecho probablemente se deba a que el dermatoscopio empleado fue la videocámara del Fotofinder®, que se utiliza por contacto con la piel, lo que genera vasoconstricción, motivo que podría justificar dicha discrepancia.
ConclusionesEn los últimos años hemos podido identificar un peculiar patrón de regresión completa de nevos melanocíticos, que presenta unas caraterísticas clinicopatológicas particulares.
Desde un punto de vista clínico, lo más llamativo es la rapidez con la que se produce la regresión, e histológicamente se caracteriza por una peculiar forma de fibrosis delicada, que no se ha descrito hasta la fecha en el melanoma.
En caso de regresión completa de una lesión melanocítica, la presencia de fibrosis constituida por haces extraordinariamente finos de colágeno, unida a un infiltrado inflamatorio con predominio de linfocitos citotóxicos, apoyaría una naturaleza biológica benigna de la lesión involucionada.
Un mejor conocimiento de los mecanismos moleculares que producen la regresión espontánea de estos nevos melanocíticos puede contribuir al descubrimiento de nuevas dianas terapéuticas para el melanoma.
FinanciaciónEste trabajo ha sido realizado gracias a una ayuda (AP-032/10) para proyectos de investigación en biomedicina de la Conselleria de Sanidad de la Generalitat Valenciana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo recibio el Premio Juan de Azúa de la AEDV en el año 2011.