Los linfomas primarios cutáneos son enfermedades poco frecuentes. Este artículo describe el Registro de linfomas cutáneos primarios de la AEDV y sus primeros resultados.
Pacientes y métodosRegistro de enfermedad de pacientes con linfomas cutáneos primarios. Los centros participantes recogieron datos prospectivamente de todos los pacientes, incluyendo datos del diagnóstico, de los tratamientos, de las pruebas realizadas y del estado actual del paciente. Se realizó un análisis descriptivo.
ResultadosEn diciembre del 2017 el registro tenía datos de 639 pacientes pertenecientes a 16 hospitales universitarios. Un 60% eran hombres y los diagnósticos, por orden de frecuencia, fueron: micosis fungoide/síndrome de Sézary (MF/SS) (348 casos; 55%), linfoma cutáneo primario de células B (LCCB) (184; 29%), trastorno linfoproliferativo de células T CD30+ (LTCD30+) (70; 11%) y otro tipo de linfoma T (OLT) (37; 5%). El número de casos incidentes recogidos durante el primer año fue de 105 (16,5%). En los pacientes con MF/SS, el diagnóstico más frecuente fue MF clásica (77,3%). La mitad de estos casos se diagnosticaron en estadio IA. La mayoría de los pacientes estaban en remisión parcial (32,5%) o enfermedad estable (33,1%). Los tratamientos más usados fueron los corticoides tópicos (90,8%) seguidos de fototerapia. En los pacientes con LCCB el diagnóstico más frecuente fue el linfoma de la zona marginal (50%). Casi todos los pacientes tuvieron afectación exclusivamente cutánea y casi la mitad fue T1a. La mayoría (76,1%) estaba en remisión completa. Los tratamientos más utilizados fueron la cirugía (55,4%) y la radioterapia (41,9%). En los pacientes con LTCD30+, el diagnóstico más frecuente fue la papulosis linfomatoide (68,6%). La mayoría fueron clasificados T3b (31,4%). La mitad de los casos estaban en remisión completa. Los tratamientos más frecuentes fueron los esteroides tópicos (68,6%), seguidos de la quimioterapia sistémica (32,9%).
ConclusiónLas características del paciente con linfoma cutáneo primario en España no difieren de otras series descritas en la literatura. El registro facilitará al grupo de linfomas de la AEDV realizar investigación clínica.
Primary cutaneous lymphomas are uncommon. This article describes the Primary Cutaneous Lymphoma Registry of the Spanish Academy of Dermatology and Venereology (AEDV) and reports on the results from the first year.
Patients and methodsDisease registry for patients with primary cutaneous lymphoma. The participating hospitals prospectively recorded data on diagnosis, treatment, tests, and disease stage for all patients with primary cutaneous lymphoma. A descriptive analysis was performed.
ResultsIn December 2017, the registry contained data on 639 patients (60% male) from 16 university hospitals. The most common diagnoses, in order of frequency, were mycosis fungoides/Sézary syndrome (MF/SS) (348 cases, 55%), primary cutaneous B-cell lymphoma (CBCL) (184 cases, 29%), primary cutaneous CD30+ T-cell lymphoproliferative disorder (CD30+ CLPD) (70 cases, 11%), and other types of T-cell lymphoma (37 cases, 5%). In total, 105 (16.5%) of the cases recorded were incident cases. The most common diagnosis in the MF/SS group was classic MF (77.3%). Half of the patients with MF had stage IA disease when diagnosed, and the majority were either in partial remission (32.5%) or had stable disease (33.1%). The most widely used treatments were topical corticosteroids (90.8%) and phototherapy. The most common form of primary CBCL was marginal zone lymphoma (50%). Almost all of the patients had cutaneous involvement only and nearly half had stage T1a disease. Most (76.1%) were in complete remission. The main treatments were surgery (55.4%) and radiotherapy (41.9%). The most common diagnosis in patients with CD30+ CLPD was lymphomatoid papulosis (68.8%). Most of the patients (31.4%) had stage T3b disease and half were in complete remission. The most common treatments were topical corticosteroids (68.8%) and systemic chemotherapy (32.9%).
ConclusionThe characteristics of patients with primary cutaneous lymphoma in Spain do not differ from those described in other series in the literature. The registry will facilitate clinical research by the AEDV's lymphoma group.
Los linfomas cutáneos primarios (LCP) son un grupo heterogéneo de linfomas extraganglionares que muestran un particular tropismo por la piel, aunque durante el transcurso de la enfermedad pueden llegar a afectar a ganglios linfáticos y otros órganos. Según su estirpe, se dividen en LCP de células T, LCP de células B y linfomas derivados de células natural killer1.
Son entidades poco frecuentes y potencialmente graves que requieren un abordaje multidisciplinar con amplio conocimiento de la enfermedad. Por su baja frecuencia, es útil disponer de registros que permitan estudios sobre estas neoplasias.
Desde noviembre del 2016, disponemos del Registro de linfomas cutáneos primarios de la AEDV, un proyecto promovido por la Fundación Piel Sana de la AEDV, donde participan hospitales con unidades dedicadas al diagnóstico y el manejo de esta enfermedad. El objetivo es tener un registro activo de pacientes en España para la realización posterior de estudios sobre epidemiología y evolución de la enfermedad y mantener activa una lista de pacientes que podrían tener interés en otros estudios prospectivos2.
Presentamos el registro y el primer estudio descriptivo con las características clínicas básicas y manejo inicial de los pacientes con LCP incluidos el primer año desde su puesta en marcha.
Pacientes y métodosEl Registro de linfomas cutáneos primarios de la AEDV es un registro de enfermedad multicéntrico prospectivo, si bien en su comienzo se incluyó a pacientes ambispectivos, admitiéndose a pacientes incidentes y prevalentes, siempre y cuando los prevalentes no se hubieran perdido en su seguimiento y tuvieran nuevas consultas de revisión. Los centros se pueden unir al estudio si tienen una consulta monográfica o especializada de linfomas cutáneos. Todos los pacientes deben cumplir los criterios diagnósticos propuestos por la World Health Organization (WHO)1. En cada centro participante se incluyó a todos los pacientes diagnosticados de linfoma cutáneo que acudieron a la consulta de forma consecutiva, con el único criterio de exclusión de la negativa a participar del paciente.
Los pacientes fueron introducidos en la base de datos del registro a través de un sistema de recogida de datos electrónico (Openclinica 3.1). El estudio fue clasificado por la AEMPS como no EPA (no postautorización) y aprobado por el CEIC del Hospital 12 de Octubre (16/175).
El registro incluye un sistema de control de calidad, con una formación online previa para todos los investigadores y una auditoría constante de los datos mediante monitorización online.
El estudio presenta visitas de inclusión y seguimiento. En la visita de inclusión se recogieron datos demográficos y relacionados con el diagnóstico, como la fecha, el tipo de linfoma según la clasificación WHO y el estadio según el consenso actual para la clasificación TNM propuesta por la International Society for Cutaneous Lymphomas (ISCL) y la Cutaneous Lymphoma Task Force de la EORTC3,4. También se recogió información sobre las pruebas diagnósticas y los tratamientos acumulados durante el seguimiento.
En las visitas de seguimiento se recogieron los siguientes datos: la fecha de la última visita y el estado actual de la enfermedad: remisión completa (100% de aclaramiento desde la última visita), remisión parcial (50-99% de aclaramiento desde la última visita), enfermedad estable (< 25 a < 50% de aclaramiento desde la última visita), enfermedad progresiva (≥ 25% de progresión desde la última visita), fallecimiento o recaída, así como la presencia en ese momento de enfermedad cutánea, ganglionar, visceral y sanguínea.
En este trabajo se han separado los linfomas en 4grandes grupos: micosis fungoide/síndrome de Sézary (MF/SS), trastornos linfoproliferativos de células T CD30+ (LTCD30+), otros LCP de células T (OLT) y LCP de células B (LCCB). Se ha realizado un análisis descriptivo utilizando los porcentajes y los datos absolutos de las variables cualitativas, la media y la desviación estándar en las variables continuas simétricas y la mediana junto a cuartiles en las variables continuas no simétricas.
ResultadosEn el momento del análisis, diciembre del 2017, el registro tiene datos de 16 hospitales universitarios. Había datos recogidos de 639 pacientes (383 hombres y 256 mujeres): 348 (55%) con MF/SS, 70 (11%) con LTCD30+, 37 (6%) con OLT y 184 (29%) con LCCB. El número de casos incidentes recogidos durante el primer año de funcionamiento fue de 105 (16,5%).
Micosis fungoide/síndrome de SézaryLa edad media al diagnóstico fue de 55,9 años (DE 14,9) con una mediana del tiempo hasta el diagnóstico de 5,4 años (RI 5,4-10) y una razón mujer/hombre de 1:1,7. El diagnóstico más frecuente fue MF clásica en el 77,3%. El SS correspondió al 4,6% de los casos. Algo más de la mitad de los casos de MF se diagnosticaron en estadio IA. Solo el 14,9% de los casos tuvieron enfermedad avanzada (≥ IIB). La mayoría de los pacientes estaban en el momento de la última visita con la enfermedad estable (37%) o en remisión parcial (32,5%). Los tratamientos más usados fueron los corticoides tópicos (90,8%) seguidos de fototerapia. La mayoría de los pacientes recibieron 2 (37,4%) y 3 o más tratamientos (32,2%). Las características de estos pacientes se pueden ver en la tabla 1.
Datos clínicos y tratamiento de pacientes con MF/SS
| Edad al diagnóstico en años | ||
| Media (DE) | 55,9 (14,9) | |
| Tiempo hasta el diagnóstico en años | ||
| Mediana | 5,4 | |
| P25-P75 | 1,9-10 | |
| Mín.-máx. | 0-34,2 | |
| Sexo | n | % |
| Hombre | 220 | 63,2 |
| Mujer | 128 | 36,8 |
| Total | 348 | 100 |
| Diagnóstico | n | % |
| Micosis fungoide clásica | 269 | 77,3 |
| Micosis fungoide foliculotropa | 61 | 17,5 |
| Piel laxa granulomatosa | 2 | 0,6 |
| Síndrome de Sézary | 16 | 4,6 |
| Total | 348 | 100 |
| Estadio | n | % |
| IA | 178 | 51,2 |
| IB | 102 | 29,3 |
| IIA | 11 | 3,2 |
| IIB | 29 | 8,3 |
| III | 2 | 0,6 |
| IIIA | 1 | 0,3 |
| IIIB | 6 | 1,7 |
| IVA1 | 11 | 3,2 |
| IVA2 | 2 | 0,6 |
| IVB | 1 | 0,3 |
| Desconocido | 5 | 1,4 |
| Total | 348 | 100 |
| Estado actual | n | % |
| Remisión completa | 98 | 28,2 |
| Remisión parcial | 113 | 32,5 |
| Enfermedad estable | 115 | 33,1 |
| Enfermedad progresiva | 20 | 5,8 |
| Recaída | 2 | 0,6 |
| Total | 348 | 100 |
| Tratamiento | n | % |
| Esteroides tópicos | 316 | 90,8 |
| Mostaza nitrogenada | 8 | 2,3 |
| BCNU tópica | 13 | 3,7 |
| Bexaroteno tópico | 6 | 1,7 |
| PUVA | 164 | 47,1 |
| RePUVA | 13 | 3,7 |
| UVB banda estrecha | 123 | 35,3 |
| Baño de electrones | 19 | 5,5 |
| Radioterapia | 29 | 8,3 |
| Quimioterapia sistémica | 30 | 8,6 |
| Cirugía | 2 | 0,6 |
| Retinoides sistémicos | 24 | 6,9 |
| Interferón | 42 | 12,1 |
| Anticuerpos de fusión con toxinas | 0 | 0,0 |
| Inhibidores de histona de acetilasas | 1 | 0,3 |
| Trasplante de médula ósea | 4 | 1,2 |
| Número de tratamientos | n | % |
| 0 | 7 | 2,0 |
| 1 | 99 | 28,5 |
| 2 | 130 | 37,4 |
| 3 o más | 112 | 32,2 |
| Total | 348 | 100 |
La edad media al diagnóstico fue de 53 años (DE 15,2), con una mediana del tiempo hasta el diagnóstico de 2,5 años (RI 0,7-9,1) y una razón mujer/hombre de 1,2:1. El diagnóstico más frecuente fue la papulosis linfomatoide (PL) con el 68,6% de los casos. La mayoría de los pacientes se clasificaron como T3b (31,4%). En el momento de la última visita la mitad estaba en remisión completa. Los tratamientos más frecuentes fueron los esteroides tópicos (68,6%), seguidos de quimioterapia sistémica (32,9%). El 50% de los casos requirió solo un tratamiento y el 25,7%, dos. Las características de estos pacientes se pueden ver en la tabla 2.
Datos clínicos y tratamientos de pacientes con LTCD30+
| Edad al diagnóstico en años | ||
| Media (DE) | 53 (15,2) | |
| Tiempo hasta el diagnóstico en años | ||
| Mediana | 2,5 | |
| P25-P75 | 0,7-9,1 | |
| Mín.-máx. | 0-25,4 | |
| Sexo | n | % |
| Hombre | 32 | 45,7 |
| Mujer | 38 | 54,3 |
| Total | 70 | 100 |
| Diagnóstico | n | % |
| Papulosis linfomatoide | 48 | 68,6 |
| Linfoma anaplásico de célula grande | 21 | 30 |
| Otros linfomasa | 1 | 1,4 |
| Total | 70 | 100 |
| TNM | n | % |
| T1 | 4 | 5,7 |
| T1a | 12 | 17,1 |
| T1b | 2 | 2,9 |
| T2 | 1 | 1,4 |
| T2a | 1 | 1,4 |
| T2b | 2 | 2,9 |
| T2c | 5 | 7,1 |
| T3 | 6 | 8,6 |
| T3a | 4 | 5,7 |
| T3b | 22 | 31,4 |
| Desconocido | 11 | 15,7 |
| Total | 70 | 100 |
| N0 | 58 | 82,9 |
| N1 | 1 | 1,4 |
| Desconocido | 11 | 15,7 |
| Total | 70 | 100 |
| M0 | 59 | 84,3 |
| M1 | 0 | 0 |
| Desconocido | 11 | 15,7 |
| Total | 70 | 100 |
| Estado actual | n | % |
| Remisión completa | 36 | 51,4 |
| Remisión parcial | 22 | 31,4 |
| Enfermedad estable | 12 | 17,1 |
| Total | 70 | 100 |
| Tratamiento | n | % |
| Esteroides tópicos | 48 | 68,6 |
| PUVA | 8 | 11,4 |
| UVB de banda estrecha | 11 | 15,7 |
| Radioterapia | 11 | 15,7 |
| Baño de electrones | 1 | 1,4 |
| Quimioterapia sistémica | 23 | 32,9 |
| Cirugía | 15 | 21,4 |
| Número de tratamientos | n | % |
| 0 | 3 | 4,3 |
| 1 | 35 | 50,0 |
| 2 | 18 | 25,7 |
| 3 o más | 14 | 20,0 |
| Total | 70 | 100 |
Se incluyó a 37 pacientes dentro de este grupo, siendo el trastorno linfoproliferativo de células T pequeña/mediana pleomórfico CD4+ el linfoma más frecuente con 26 casos (70,3%), seguido por el linfoma T subcutáneo paniculítico con 5 casos y el linfoma de células T periférico, no especificado, con 5 casos. Hubo un caso de linfoma de células T acral CD8+.
Linfomas cutáneos primarios de células BLa edad media al diagnóstico fue de 53,7 años (DE 16,8), con una mediana del tiempo hasta el diagnóstico de 3,8 años (RI 0,1-28,6) y una razón mujer/hombre de 1:1,5. Los diagnósticos más frecuentes fueron el LCP de la zona marginal (LZM) y el LCP centrofolicular (LCF). Prácticamente todos los casos tuvieron afectación exclusivamente cutánea y casi la mitad fueron clasificados T1a. La mayoría de los pacientes estaban en el momento de la última visita en remisión completa (76,1%). Los tratamientos más usados fueron la cirugía (55,4%) seguido de la radioterapia (41,9%). La mitad de los pacientes se trataron con 1 solo tratamiento y el 46,3% requirió 2 o más. Las características de estos pacientes se pueden ver en la tabla 3.
Datos clínicos y tratamientos de pacientes con LCCB
| Edad al diagnóstico en años | ||
| Media (DE) | 53,7 (16,8) | |
| Tiempo hasta el diagnóstico en años | ||
| Mediana | 3,8 | |
| P25-P75 | 1,6-8,7 | |
| Mín.-máx. | 0,1-28,6 | |
| Sexo | n | % |
| Hombre | 111 | 60,3 |
| Mujer | 73 | 39,7 |
| Total | 184 | 100 |
| Diagnóstico | n | % |
| LCP de células B de la zona marginal γ | 92 | 50 |
| LCP de células B centrofolicular | 84 | 45,6 |
| LCP de células B difuso de célula grande tipo piernas | 6 | 3,2 |
| Otros linfomasa | 2 | 1,1 |
| Total | 184 | 100 |
| TNM | n | % |
| T1 | 10 | 5,4 |
| T1a | 90 | 48,9 |
| T1b | 9 | 4,9 |
| T2a | 26 | 14,1 |
| T2b | 7 | 3,8 |
| T2c | 5 | 2,7 |
| T3 | 1 | 0,5 |
| T3a | 8 | 4,4 |
| T3b | 16 | 8,7 |
| Desconocido | 12 | 6,5 |
| Total | 184 | 100 |
| N0 | 171 | 92,9 |
| N1 | 0 | 0 |
| Desconocido | 13 | 7,1 |
| Total | 184 | 100 |
| M0 | 171 | 92,9 |
| M1 | 0 | 0 |
| Desconocido | 13 | 7,1 |
| Total | 184 | 100 |
| Estado actual | n | % |
| Remisión completa | 140 | 76,1 |
| Remisión parcial | 19 | 10,3 |
| Enfermedad estable | 14 | 7,6 |
| Enfermedad progresiva | 4 | 2,2 |
| Recaída | 7 | 3,8 |
| Total | 184 | 100 |
| Tratamiento | n | % |
| Esteroides tópicos | 49 | 26,6 |
| PUVA | 1 | 0,5 |
| Radioterapia | 77 | 41,9 |
| Quimioterapia sistémica | 12 | 6,5 |
| Cirugía | 102 | 55,4 |
| Interferón | 2 | 1,1 |
| Ac. anti-CD20 (tipo rituximab) IV | 29 | 15,8 |
| Ac. anti-CD20 (tipo rituximab) IL | 32 | 17,4 |
| Número de tratamientos | n | % |
| 0 | 5 | 2,7 |
| 1 | 94 | 51,1 |
| 2 | 54 | 29,4 |
| 3 o más | 31 | 16,9 |
| Total | 184 | 100 |
γ: actualmente no se considera una entidad independiente por la WHO.
DE: desviación estándar; IL: intralesional; IV: intravenoso; LCP: linfoma cutáneo primario; M: vísceras; N: ganglios linfáticos; PUVA: psoralenos y radiación ultravioleta A; T: piel.
Tomado de Swerdlow et al.1.
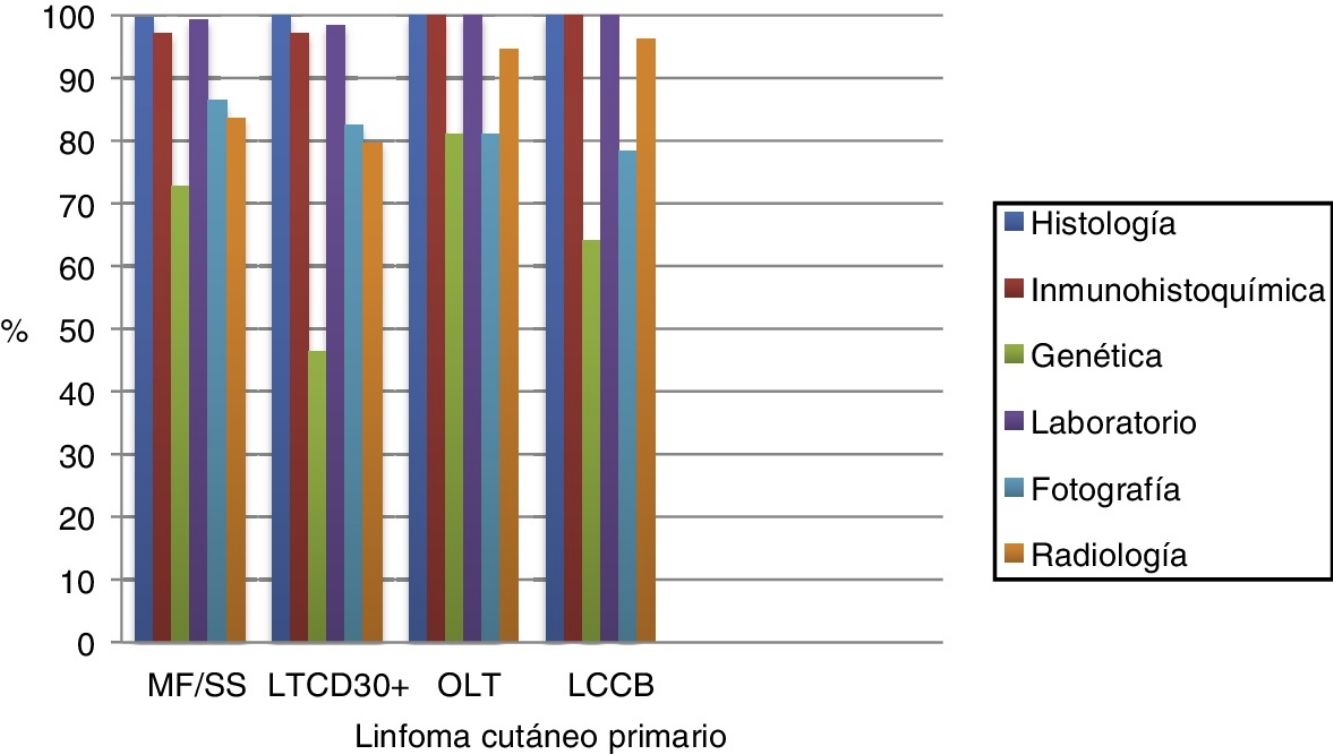
Prácticamente a todos los pacientes se les realizó estudio histológico, inmunohistoquímico y analítico para el diagnóstico. El estudio molecular se realizó en el 72,7% de los pacientes con MF/SS, en el 46,4% de los LTCD30+, en el 81% de OLT y en el 64,1% de los LCCB (fig. 1).
DiscusiónLos LCP son enfermedades raras con una frecuencia estimada de 1/100.000 casos al año5. Los datos provenientes de Alemania6, Reino Unido7, Noruega8 y Dinamarca9 reflejan una tasa de incidencia entre 2,9 y 4 casos×106/año.
Esta baja frecuencia hace imprescindible la creación de registros multicéntricos para conocer las características de estas enfermedades en nuestro entorno y poder realizar estudios clínicos.
Hasta ahora, las publicaciones del Grupo de Trabajo de Linfomas Cutáneos de la AEDV empleaban bases de datos propias de los centros10-12. El Registro de linfomas cutáneos primarios facilitará la investigación colaborativa y ha superado las expectativas iniciales, puesto que en solo un año ha incluido 16 centros y 638 pacientes.
Este trabajo describe los pacientes del registro en 4grandes grupos: MF/SS, LTCD30+, OLT y LCCB.
La proporción de los diagnósticos en nuestra serie es similar a la descrita en la literatura13, siguiendo el esquema del 75% de linfomas T frente al 25% de linfomas B. La MF fue la enfermedad más frecuente (55%), seguido de los linfomas B (29%) con sus variantes de LZM y LCF, y los LTCD30+ (11%), en concreto la PL.
El perfil de paciente con MF fue el esperado, con una media de edad de 55 años, una razón mujer/hombre de 1:1,5 y con una mediana del tiempo hasta el diagnóstico de 5 años. Como se describe en las series europeas13, la mayoría de los pacientes se diagnosticaron en estadios iniciales y se manejaron con tratamientos dirigidos a la piel. Esto difiere de algunas series americanas14 donde la enfermedad avanzada aparece en más del 30% de los casos, probablemente por las diferencias en la accesibilidad al sistema sanitario. El hecho de que la mayoría de los pacientes estén en remisión parcial y con enfermedad estable probablemente se relaciona con la mayor proporción de pacientes en estadios iniciales y el curso crónico de la enfermedad. Este hecho se refleja también en la necesidad de aplicar más de 2 tratamientos en la mayoría de los pacientes.
Con una media de 54 años y leve predominio del sexo masculino, los LCCB no difieren de otros estudios publicados7. En nuestro trabajo, no observamos grandes diferencias de proporción entre los LZM y los LCF, contrariamente a los primeros estudios13, donde predomina el LCF, aunque este hecho ya ocurre en países como Austria6. Es posible que factores etiológicos poco frecuentes en nuestro país, como la Borrelia burgdorferi, el refinamiento diagnóstico en casos de LZM con centros foliculares reactivos o la ausencia de marcadores específicos, justifiquen el equilibrio entre estos subtipos de linfoma.
La mayoría de los pacientes presentaron al diagnóstico una lesión solitaria de menos de 5cm de diámetro y se manejaron en su mayoría con un solo tratamiento, cirugía o radioterapia, como recomiendan la EORTC y la ISCL15, encontrándose, en su mayoría, en remisión completa.
El perfil de los linfomas T CD30+ tampoco difiere de lo descrito en la literatura13,16,17, posicionándose como el segundo tipo de linfoma T cutáneo más frecuente (29%), con predominio de la PL sobre el linfoma T anaplásico de células grandes.
El registro aporta información sobre las pruebas realizadas a los pacientes y pone en evidencia que el 30% de los pacientes con linfomas T y el 36% de los pacientes con linfomas B no tienen estudio de reordenamiento genético y, aunque no es imprescindible para el diagnóstico de algunos linfomas, sí sería deseable realizarlo en la mayoría de los pacientes con sospecha clínica. Es posible que no todos los centros dispongan de la técnica y sabemos por experiencia que muchas lesiones únicas, principalmente linfomas B o trastornos linfoproliferativos de célula pequeña/mediana CD4+, son extirpadas completamente con otra sospecha clínica, o como en el caso de la PL, con juicio clínico de picaduras o pitiriasis liquenoide.
Entre las limitaciones del registro está la posibilidad de que los diagnósticos no sean precisos. Está previsto que un comité de expertos revise todos los casos complicados cuando se realicen publicaciones sobre linfomas concretos del registro. Sabemos que el diagnóstico de esta enfermedad no siempre es sencillo, como en el caso de estadios incipientes de la MF, que requieren criterios diagnósticos precisos18, o casos «overlaps» entre el LZM y LCF o entre la PL y los linfomas anaplásicos de células grandes CD30+.
Además, tenemos que tener en cuenta que en muchos centros los enfermos graves son controlados por hematólogos y no frecuentan tanto las consultas de dermatología, pudiendo influir sobre el tipo de remisión y tratamientos. Otra limitación es que el registro incluye a pacientes atendidos en centros de nivel terciario que pueden no ser totalmente representativos del total de pacientes con LCP2. Aun así, la inclusión de pacientes consecutivos en todos los centros y el gran número de centros participantes debe limitar el sesgo de selección.
ConclusiónEste primer estudio describe unas características clínicas del paciente con linfoma primario cutáneo en España, similar a otras series publicadas en la literatura.
Pone de manifiesto el buen funcionamiento del Registro de linfomas cutáneos primarios de la AEDV y permite ser optimista, por la buena evolución en tan solo un año, con el objetivo de obtener una buena base de datos que nos permita realizar estudios epidemiológicos, tanto retrospectivos como prospectivos para el mayor conocimiento de estas enfermedades. Ahora que está en marcha, es necesario mantenerlo activo y sentará las bases para futuros trabajos en distintas entidades que permitan conocer mejor su comportamiento, manejo y pronóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.