La introducción del tratamiento antirretroviral de gran actividad (TARGA) en 1996 supuso un cambio radical en la historia natural de la infección por el virus de la inmunodeficiencia humana (VIH) al lograr reducir drásticamente la mortalidad en estos pacientes. No obstante, estos tratamientos no están exentos de limitaciones que incluyen efectos adversos, fracaso del tratamiento, interacciones farmacocinéticas, aparición de resistencias y respuestas inmunes anómalas. En este artículo se revisa la situación actual de las reacciones cutáneas adversas a fármacos en los pacientes con infección por el VIH.
The introduction of highly active antiretroviral treatment (HAART) in 1996 radically changed the clinical course of human immunodeficiency virus (HIV) infection as it led to a dramatic reduction in mortality in these patients. However, these treatments have their limitations, including adverse effects, therapeutic failure, pharmacokinetic interactions, the development of resistance, and abnormal immune responses. In this article we review the current situation of cutaneous drug reactions in HIV-infected patients.
TARGA es el término con el que desde 1996 se conoce a la combinación de fármacos antirretrovirales que presenta una elevada eficacia. Dicha combinación incluye dos fármacos inhibidores de la transcriptasa inversa análogos de los nucleósidos (ITIAN) con al menos un tercer fármaco, generalmente un inhibidor de la proteasa (IP) o un inhibidor de la transcriptasa inversa no análogo de los nucleósidos (ITINAN).
Tras la introducción del TARGA la historia natural de la infección por el virus de la inmunodeficiencia humana (VIH) sufrió un cambio radical. Por primera vez la mortalidad experimentó un descenso claro, la utilización de recursos hospitalarios disminuyó, así como la incidencia de infecciones oportunistas y de neoplasias asociadas al VIH1-3. El tratamiento antirretroviral por sí mismo era capaz de controlar infecciones y procesos que habían sido refractarios a tratamiento previo tales como candidiasis oral, molusco contagioso, criptosporidiasis/microsporidiasis, infección por Mycobacterium avium-complex (MAC), leucoencefalopatía multifocal progresiva (LMP), sarcoma de Kaposi y linfomas4. Del mismo modo, tras el inicio del TARGA la incidencia de neumonía por Pneumocystis jiroveci, esofagitis candidiásica, infecciones por micobacterias, citomegalovirus o toxoplasmosis se vio disminuida5,6.
A pesar de la eficacia demostrada del TARGA en la reducción de la morbimortalidad asociada al VIH, sus limitaciones son notables; estas incluyen efectos secundarios en algunos casos tan graves que obligan a la suspensión definitiva del fármaco, fracaso del tratamiento por mala adherencia al mismo, interacciones farmacocinéticas y aparición de resistencias, a menudo consecuencia de la falta de cumplimiento terapéutico. Es importante destacar, además, la aparición de respuestas inmunes anómalas en algunos pacientes durante las primeras semanas de tratamiento TARGA, produciéndose exacerbaciones o reactivaciones de procesos infecciosos, los cuales se presentan con manifestaciones clínicas inusuales7,8. Tal es el caso de linfadenitis por MAC9, reacciones tuberculosas paradójicas10, uveítis por citomegalovirus11, exacerbación de criptococosis12, empeoramiento de LMP13,14. También se ha descrito en este contexto el desarrollo de fenómenos autoinmunes, como disminución transitoria del número de plaquetas15, hipertiroidismo12 o crioglobulinemia16, que puede ser interpretado como el resultado del aumento de la respuesta inmune.
En las tablas 1 a 5 se exponen los fármacos antirretrovirales disponibles en la actualidad, junto con sus nombres comerciales y las dosis recomendadas17. A los tratamientos que tradicionalmente han formado parte del TARGA hay que sumar un nuevo fármaco, el enfuvirtide. Se trata de un fármaco antirretroviral peptídico, el primer inhibidor de la fusión aprobado y el único fármaco antirretroviral que se administra rutinariamente por vía parenteral (subcutáneo). Presenta actividad frente a cepas del VIH-1 resistentes, pero debe administrarse como parte de regímenes de tratamiento seleccionados, para minimizar el riesgo de resistencias farmacológicas18.
Inhibidores de la transcriptasa inversa análogos de los nucleósidos (I): zidovudina, didanosina, zalcitabina y estavudina
| Nombre genérico | Zidovudina, AZT | Didanosina, ddI | Zalcitabina, ddC | Estavudina, d4T |
| Nombre comercial | Retrovir®, Zidovudina Combinopharm®, *Combivir®, **Trizivir® | Videx® | Hivid® | Zerit® |
| Dosis recomendada | 250-300mg BID | < 60kg: 250mg QD o 125mg BID; > 60kg: 400mg QD o 200mg BID | 0,75mg TID | < 60kg: 30mg BID; > 60mg: 40mg BID |
Tomada de López-Aldeguer J et al17. BID: dos veces al día; QD: una vez al día; TID: tres veces al día.
Inhibidores de la transcriptasa inversa análogos de los nucleósidos (II): lamivudina, emtricitabina, abacavir y tenofovir
| Nombre genérico | Lamivudina, 3TC | Emtricitabina, FTC | Abacavir, ABC | Tenofovir disoproxil fumarato, TDF |
| Nombre comercial | Epivir®, *Combivir®, **Trizivir®, ***Kivexa® | Emtriva®, ****Truvada® | Ziagen®, **Trizivir®, ***Kivexa® | Viread®, ****Truvada® |
| Dosis recomendada | 150mg BID; 300mg QD | 200mg QD | 300mg BID | 300mg QD |
Tomada de López-Aldeguer J et al17. BID: dos veces al día; QD: una vez al día.
Inhibidores de la transcriptasa inversa no nucleósidos
| Nombre genérico | Nevirapina | Efavirenz |
| Nombre comercial | Viramune® | Sustiva® |
| Dosis recomendada | 200mg QD × 14 días, seguidas de 200mg BID | 600mg QD |
Tomada de López-Aldeguer J et al17. BID: dos veces al día; QD: una vez al día.
Inhibidores de la proteasa (parte I): indinavir, ritonavir, saquinavir, nelfinavir, amprenavir
| Nombre genérico | Indinavir | Ritonavir | Saquinavir | Nelfinavir | Amprenavir |
| Nombre comercial | Crixivan® | Norvir® | Invirase® (I); Fortovase® (F) | Viracept® | Agenerase® |
| Dosis | 800mg TID | 600mg BID (= 7,5ml BID) | (I) No recomendado sin ritonavir.(I) 1.000mg + 100mg ritonavir BID.(F) 1.200mg TID | 750mg TID o 1.250mg BID | 1.200mg BID (cáps.) |
Tomada de López-Aldeguer J et al17. BID: dos veces al día; TID: tres veces al día.
Inhibidores de la proteasa (parte II): fosamprenavir, lopinavir/ritonavir, atazanavir, tipranavir
| Nombre genérico | Fosamprenavir | Lopinavir/ritonavir | Atazanavir | Tipranavir |
| Nombre comercial | Telzir® | Kaletra® | Reyataz® | (Se comercializará próximamente) |
| Dosis | FOS-APV/RTV 700/100mg c/12h | 400/100mg BID | 300/100mg c/24h o 400mg c/24h | Cáps. 250mg |
| Recomendación | Con o sin alimentos | Tomar con comida | Tomar con comida | |
| Presentación comercial | Cáps. 700mg | Cáps. 133/33mg. Sol. oral 80/20mg/ml | Cáps. 100, 150 y 200mg | Cáps. 250mg |
Tomada de López-Aldeguer J et al17. FOS-APV/RTV: fosamprenavir-amprenavir/ritonavir.
Las toxicodermias tienen una frecuencia muy elevada en los pacientes infectados por el VIH (3-22 % según las series)19-23. Esto está condicionado, por una parte, por la gran cantidad de fármacos a los que están expuestos estos pacientes (fármacos antirretrovirales, otros antivirales, antibióticos, quimioterápicos, antineoplásicos, anticonvulsivantes, etc.). Por otra parte los pacientes con infección por el VIH parecen tener una predisposición especial a desarrollar reacciones adversas medicamentosas, cuya incidencia aumenta conforme se agrava la inmunodeficiencia. La hipergammaglobulinemia policlonal con la que habitualmente cursa la infección crónica por el VIH favorecería las reacciones de hipersensibilidad a los fármacos. Las infecciones por el virus de Epstein-Barr y el citomegalovirus, que tienen una prevalencia muy alta en estos pacientes, podrían desempeñar un papel análogo al que cumplen en la aparición del exantema inducido por ampicilina u otras aminopenicilinas en los pacientes con mononucleosis infecciosa19-23.
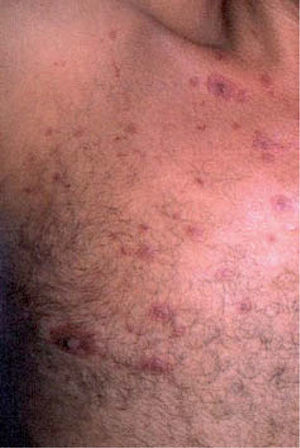
La asociación de trimetoprim con sulfametoxazol (TMP-SMZ) o cotrimoxazol, otras sulfamidas y los antibióticos betalactámicos son los fármacos que con mayor frecuencia se han implicado como causa de toxicodermias en los pacientes infectados por el VIH19-23. Los IP son inhibidores del sistema enzimático del citocromo P450 y pueden aumentar los niveles plasmáticos de los numerosos fármacos que se metabolizan por esta vía, y por consiguiente favorecer la aparición de efectos adversos. Otros antimicrobianos como las aminopenicilinas (fig. 1), la clindamicina y la rifampicina también inducen toxicodermias con más frecuencia en los pacientes con infección por el VIH que en otros grupos, aunque su asociación está menos documentada que en el caso de las sulfonamidas. Fármacos anticonvulsivantes como la carbamacepina y la fenitoína, causantes de toxicodermias muy graves como necrólisis epidérmica tóxica (NET), deben administrarse ajustando estrechamente las dosis a los pacientes que reciben IP, según los niveles plasmáticos obtenidos. Además, estos fármacos, al igual que otros inductores del citocromo P450 (ketoconazol, TMP-SMZ, macrólidos), aumentan los niveles de los IP y pueden favorecer la aparición de reacciones adversas19-23.
En la tabla 6 se exponen las toxicodermias clásicas en los pacientes con infección por el VIH.
Toxicodermias relevantes en pacientes con infección por VIH19-23
| Fármacos | Toxicodermias |
| Trimetoprim-sulfametoxazolAminopenicilinasClindamicinaRifampicina | Exantemas (fig. 1), SSJ, NET |
| Pentamidina | Exantemas |
| GanciclovirFoscarnet | Exantemas, flebitisÚlceras genitales y orales, flebitis |
| Talidomida | Exantemas |
| Anticonvulsivantes | Síndrome de hipersensibilidad (DRESS), exantemas, SSJ, NET |
| Dapsona | Exantemas, SSJ, síndrome de hipersensibilidad a las sulfonas |
DRESS: drug reaction with eosinophilia and systemic symptoms; NET: necrólisis epidérmica tóxica; SSJ: síndrome de Stevens-Johnson.
En términos generales, el TARGA se ha vinculado con tres efectos cutáneos fundamentales: el síndrome lipodistrófico, el efecto similar a los retinoides y las dermatosis de la reconstitución inmune, que desarrollaremos a continuación.
Síndrome lipodistróficoEn el verano de 1997, aproximadamente un año después de la introducción de los IP en EE.UU., aparecieron referencias anecdóticas acerca del desarrollo de obesidad abdominal en los pacientes que recibían tratamiento con estos fármacos en algunos sitios de internet, dirigidos principalmente a personas infectadas por el VIH (www.pinkpage.com y www.thebody.com). Ese mismo año Hengel et al publicaron en The Lancet un caso de lipomatosis simétrica benigna que relacionaron con el indinavir24, y Herry et al publicaron el caso de un paciente con hipertrofia mamaria, que atribuyeron también a indinavir25. Se publicaron nuevos casos de distribución anómala de la grasa corporal en pacientes con infección por el VIH que recibían tratamiento antirretroviral hasta que en 1998 se describió formalmente esta entidad como síndrome lipodistrófico26, siendo rápidamente identificado como uno de los principales factores limitantes del tratamiento antirretroviral a largo plazo.
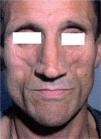
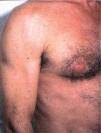
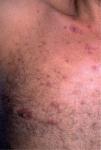
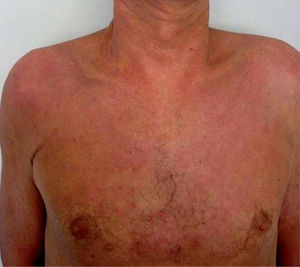
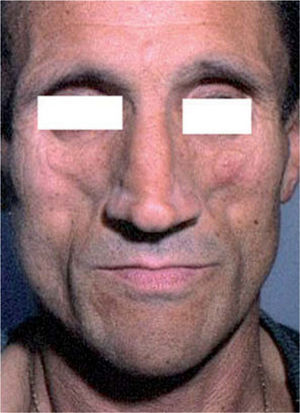
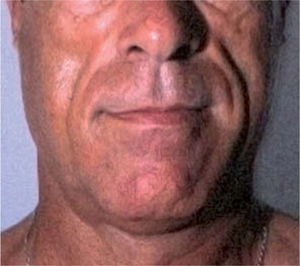
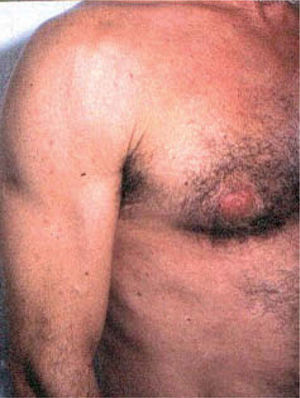
El síndrome lipodistrófico se caracteriza por una redistribución de la grasa corporal consistente en la pérdida de la grasa subcutánea o lipoatrofia, que afecta principalmente a la cara (figs. 2 y 3), las nalgas y las extremidades, así como el aumento de la grasa visceral abdominal, hipertrofia mamaria (fig. 4) y aumento de la grasa dorsocervical (giba de búfalo). También se han descrito alteraciones metabólicas asociadas que incluyen la disminución de la tolerancia a la glucosa (47 %), diabetes con o sin resistencia insulínica (1 %) y trastornos de los triglicéridos y el colesterol (60 %), los cuales incrementan el riesgo de aterogénesis y enfermedad vascular27,28.
En la cara, la atrofia de los cúmulos adiposos bucales, parotídeos y preauriculares produce la prominencia de los arcos cigomáticos y puede plantear el diagnóstico diferencial con los estados de caquexia asociados a las enfermedades oportunistas y el síndrome consuntivo (wasting syndrome).
La lipohipertrofia central suele aparecer antes que la lipoatrofia periférica. Tanto una como otra son indoloras, pero los pacientes pueden referir molestias como sensación de plenitud y distensión abdominal. La pérdida de grasa subcutánea en las piernas da lugar a la prominencia de las venas superficiales y de los músculos (aspecto pseudoatlético); en la cara, la atrofia de los cúmulos adiposos bucales, parotídeos y preauriculares produce la prominencia de los arcos cigomáticos y puede plantear el diagnóstico diferencial con los estados de caquexia asociados a las enfermedades oportunistas y el síndrome consuntivo (wasting syndrome)21,28.
La hipertrigliceridemia es la alteración metabólica que se asocia con más frecuencia. La hipercolesterolemia presenta las características que clásicamente se asocian al riesgo cardiovascular (cifras elevadas de lipoproteínas de baja densidad [LDL] y bajas de lipoproteínas de alta densidad [HDL]). La resistencia a la insulina, fisiopatológicamente relacionada con la hipertrigliceridemia, se manifiesta analíticamente por el aumento sérico de la insulina y del péptido C y, ocasionalmente, por intolerancia a la glucosa o una franca diabetes mellitus tipo 227,28.
No hay en la actualidad criterios objetivos establecidos para el diagnóstico del síndrome de redistribución de la grasa corporal asociado a la infección por el VIH. El diagnóstico se basa fundamentalmente en la impresión subjetiva del enfermo y en la exploración física por el médico, que puede complementarse con mediciones antropométricas, como el índice cintura-cadera.
Aunque en la descripción inicial el síndrome se asociaba al uso de IP29, su etiopatogenia permanece oscura y probablemente sea multifactorial. Se ha propuesto la implicación de diversos factores que incluirían las alteraciones del metabolismo de los lípidos y del ácido retinoico inducidas por los IP, la toxicidad mitocondrial producida por los ITIAN, especialmente la estavudina, la reconstitución inmunitaria, la propia infección por el VIH y la interacción de citoquinas y hormonas30-33. Otros factores que contribuyen a su desarrollo son la duración del tratamiento con TARGA y de la infección por el VIH, los cambios en la carga viral, la raza y el sexo27.
Las consecuencias para los pacientes incluyen la alteración de la percepción de la imagen corporal así como su estigmatización. En un estudio realizado por Durán et al se analizaron varios factores asociados al cumplimiento terapéutico, siendo los síntomas de lipodistrofia referidos por el paciente un factor independiente asociado a la disminución del cumplimiento34.
No existe un tratamiento eficaz de las alteraciones de la distribución de la grasa corporal. Las medidas que se describen a continuación han demostrado, en el mejor de los casos, una eficacia parcial, y algunas de ellas no están exentas de riesgos17:
- 1.
Medidas generales (dieta, ejercicio físico). Es necesario evitar modificaciones de peso superiores al 5 % del peso adecuado. Además, el ejercicio físico aeróbico mejora las alteraciones metabólicas y la lipoacumulación intraabdominal.
- 2.
Sustitución de los antirretrovirales (IP, análogos de nucleósidos). La retirada del IP puede mejorar las alteraciones metabólicas y la lipoacumulación intraabdominal; asimismo, la retirada de los análogos de timidina mejora la lipoatrofia.
- 3.
Utilización de fármacos con efectos metabólicos (metformina, glitazonas, hormona del crecimiento). La pioglitazona (30mg/día) ha resultado eficaz en un ensayo clínico. La hormona del crecimiento puede disminuir la lipoacumulación intraabdominal pero este efecto puede alcanzarse igualmente con otras medidas más sencillas, seguras y baratas.
- 4.
Cirugía plástica. Relleno facial en los casos de lipoatrofia, cirugía reductora en los lipoacúmulos accesibles. Es el único tratamiento actual con resultados evidentes. El relleno facial puede hacerse con grasa autóloga (generalmente subcutánea abdominal) o con materiales sintéticos (poliacrilamida, polialquilimida, ácido poliláctico u otros).
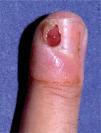
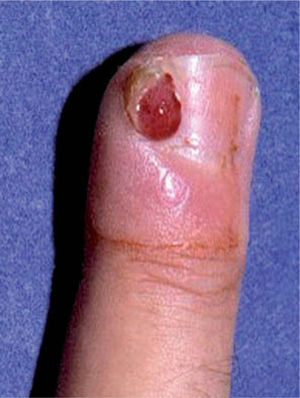
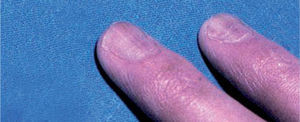
En abril de 1998 Zerboni et al publicaron una carta en The Lancet en la que comunicaron 12 pacientes con infección por el VIH y paroniquia en los dedos de las manos (fig. 5) y los pies, con cultivos fúngicos y bacterianos negativos. Los autores interpretaron la paroniquia como un efecto adverso de la lamivudina, ya que este era el único fármaco común en los 12 pacientes en los tres meses previos35. En agosto de ese mismo año, Bouscarat et al comunicaron 42 pacientes con paroniquia y enclavamiento ungueal en el primer dedo de los pies, vistos en el transcurso de un año en dos hospitales franceses. En 28 de ellos se asociaba a xerosis cutánea intensa. Los autores atribuyeron estos trastornos al indinavir y llamaron la atención sobre su semejanza con los efectos adversos de los retinoides orales. En 6 de los pacientes la interrupción del tratamiento con indinavir por diversos motivos llevó a la regresión total o parcial de las alteraciones ungueales y cutáneas36.
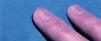
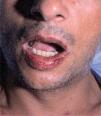
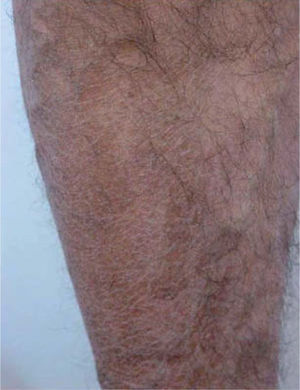
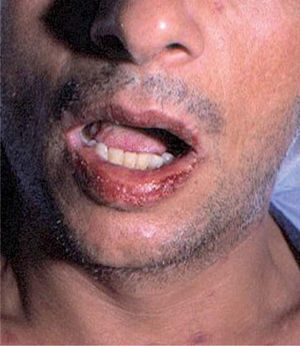
Posteriormente se publicaron numerosos casos de paroniquia de manos y pies, que en su mayoría se relacionaron con indinavir o lamivudina e indinavir, pero también con IP distintos al indinavir, como el ritonavir37-42. La xerosis cutáneo-mucosa (fig. 6), el eccema asteatósico, el prurito, la queilitis descamativa o erosiva, el rizamiento de cabello previamente liso y la alopecia corporal o del cuero cabellu-do son otros fenómenos pseudorretinoides que se han descrito en relación con el tratamiento antirretroviral, especialmente con indinavir37,41.
Existe cierta confusión en la literatura en cuanto a los fármacos responsables de este cuadro, así como a su concepto nosológico (las alteraciones ungueales y la queilitis fueron incluidas en el primer congreso internacional sobre lipodistrofia celebrado en San Diego, EE.UU., en 1999 como parte del síndrome de lipodistrofia). Por otra parte, la imputación a un fármaco de fenómenos comunes como la sequedad cutánea, el prurito o las uñas enclavadas, muchas veces parece arbitraria (de hecho algunos de los casos publicados como alopecia asociada a indinavir en revistas no dermatológicas corresponden claramente a casos de alopecia areata).
La patogenia del efecto retinoide es desconocida. La clínica remeda los efectos adversos producidos por los retinoides orales, siendo la queilitis descamativa y la xerosis cutánea las manifestaciones más frecuentes37. La hiperlipidemia se ha descrito como parte de este síndrome. Otros efectos conocidos de los retinoides orales como las mialgias, las cefaleas y las lesiones tipo granuloma piógeno en una localización distinta del perioniquio no han sido por el momento referidos en relación con el efecto retinoide por antirretrovirales.
Dermatosis de la reconstitución inmunitariaLa recuperación de la función del sistema inmunitario después de iniciar el TARGA puede llevar a la aparición o reactivación, aparentemente paradójica, de infecciones y enfermedades hasta ese momento inaparentes, posiblemente porque la respuesta inflamatoria es necesaria para la expresión de la enfermedad43-46. Las dermatosis que se han relacionado con el fenómeno de reconstitución inmunitaria se presentan en la tabla 743-49.
Dermatosis relacionadas con el fenómeno de reconstitución inmunitaria43-49
| Herpes zóster (la referencia más frecuente) |
| Herpes simple |
| Foliculitis eosinofílica |
| Otras foliculitis |
| Micobacteriosis atípicas |
| Lepra tuberculoide |
| Enfermedades autoinmunes |
| Alopecia areata universal (un caso asociado a enfermedad de Graves-Basedow) |
| Lupus eritematoso tumidus |
| Sarcoidosis |
| Lipodistrofia (?) |
Las enfermedades inducidas por la recuperación inmunitaria aparecen entre unas semanas y tres meses después de iniciar el TARGA y se asocian con la disminución de la carga viral y la recuperación de la tasa de linfocitos T CD4+. Muestran las características clínicas típicas de estas enfermedades en los pacientes inmunocompetentes, en lugar de las características atípicas propias de la inmunodepresión grave. Así, el herpes zóster que aparece en la reconstitución inmunitaria es monometamérico, sigue un curso leve sin complicaciones y no se cronifica ni se presenta con formas atípicas (multimetamérico, ectimatoso y verrugoso crónico) propias de los enfermos inmunodeprimidos con cargas virales elevadas y linfocitopenia CD443-49.
Toxicodermias por TARGASe han descrito múltiples reacciones adversas en los pacientes que reciben TARGA. En algunos casos se ha podido identificar el fármaco causal. Existen, asimismo, patrones de reacción cutánea que se asocian con más frecuencia a determinados fármacos antirretrovirales, tal y como desarrollaremos a continuación.
Toxicodermias por inhibidores de la transcriptasa inversa análogos de los nucleósidosZidovudinaLa zidovudina fue el primer análogo de los nucleósidos que se aprobó; sus efectos colaterales cutáneos están bien documentados, especialmente la hiperpigmentación mucocutánea y ungueal. Se han descrito varios patrones de hiperpigmentación de las uñas asociados a la zidovudina, tales como pigmentación total, bandas transversas y bandas longitudinales múltiples (fig. 7). La afectación de las uñas varía desde la afectación incompleta de las manos y los pies, la afectación completa de las uñas de las manos pero respetando las uñas de los pies, la afectación completa de las uñas de las manos y los pies, o la afectación exclusiva de las de los pies. La pigmentación varía de un color azul claro a azul grisáceo oscuro y marrón50-56. Esta pigmentación se localiza en la zona proximal y se extiende hasta afectar la totalidad de la uña en pocos meses. La hiperpigmentación puede aparecer antes de un mes tras el inicio del tratamiento con zidovudina51.
También se ha documentado la hiperpigmentación de la piel en relación con la zidovudina. Greenberg y Berger51 documentaron hiperpigmentación aislada de la frente y del abdomen, así como hiperpigmentación generalizada, acentuada en áreas de flexión y nudillos, en pacientes que recibían zidovudina. Bendick et al52 observaron la aparición de máculas hiperpigmentadas de color marrón en las palmas de las manos y plantas de los pies y máculas hiperpigmentadas circunscritas en la parte volar de los dedos. La hiperpigmentación de las mucosas se presentó como máculas marrones hiperpigmentadas punteadas en las partes laterales de la lengua52.
El patrón de hiperpigmentación asociado a la zidovudina es similar a otros patrones vistos con otros fármacos, especialmente con agentes citostáticos. La pigmentación es reversible, selectiva y relativamente dosis dependiente. La hiperpigmentación mucocutánea y ungueal se debe al aumento de melanina. Esta producción aumentada parece deberse a una mayor producción y dispersión de los melanosomas por un número normal de melanocitos después de la estimulación de estos por la zidovudina51,57.
También se ha descrito hipertricosis después de iniciar el tratamiento con zidovudina. Sahai et al51,58 observaron un aumento acentuado de la longitud de los pelos en el dorso de las manos y oscurecimiento de los pelos púbicos (de grises a negros). Del mismo modo se ha documentado hipertricosis de las pestañas por zidovudina59. El mecanismo de la misma es desconocido. La hipertrofia de las células foliculares inducida por la zidovudina continúa siendo solo una hipótesis.
Asimismo se han observado, en relación con la zidovudina, vasculitis leucocitoclástica60 y respuestas aumentadas a picaduras61. En los tres pacientes estudiados por Diven et al, estas respuestas aumentadas ocurrieron entre pocas semanas y 3 meses tras el inicio del tratamiento con zidovudina. Se ha especulado que estas reacciones podrían ser un reflejo de la respuesta aumentada de la función de las células T tras la introducción del tratamiento61.
DidanosinaLa didanosina es un nucleósido análogo de la pirimidina que se activa cuando es transformado a la forma trifosfato. Se ha asociado con pancreatitis y neuropatía periférica, sin embargo se han reportado pocas reacciones cutáneas. Herranz et al62 observaron vasculitis leucocitoclástica después de 4 días de administrar didanosina. Las lesiones desaparecieron cuando se suspendió el fármaco. También se ha reportado síndrome de Stevens-Johnson en un paciente de 35 años de edad63. La didanosina ha sido implicada como el agente causal de un caso de papuloeritrodermia de Ofuji, caracterizado por pápulas sólidas y pruriginosas y lesiones eritrodérmicas que, característicamente, respetaban la cara y los pliegues del cuerpo. Como manifestaciones sistémicas de la papuloeritrodermia de Ofuji se pueden presentar linfadenopatía, eosinofilia, niveles elevados de IgE y linfopenia64-66.
LamivudinaLa lamivudina es un análogo nucleósido que no solo se usa en el tratamiento de la infección por el VIH, sino que también inhibe la replicación del virus de la hepatitis B67. La lamivudina se utiliza ampliamente en la terapia múltiple debido a su capacidad para retrasar la aparición de resistencias a la zidovudina. Se ha descrito un caso de dermatitis de contacto alérgica. Después de un contacto prolongado con la medicación el paciente presentó una erupción vesicular eritematosa en la parte proximal de la palma de la mano que se extendió a la muñeca. Las pruebas epicutáneas con el fármaco resultaron positivas68. La dermatitis de contacto alérgica parece ser muy poco frecuente y no predice futuras reacciones. La lamivudina también ha sido implicada en casos de alopecia69, así como de paroniquia70.
ZalcitabinaLa zalcitabina es un análogo nucleósido que tiene mayor efecto cuando se utiliza en combinación con la zidovudina. Entre los efectos colaterales comunicados se citan úlceras orales y esofágicas, toxicidad hepática y, especialmente, neuropatía periférica23. En estudios de fase I las lesiones cutáneas consistentes en máculo-pápulas eritematosas generalizadas se presentaron en el 70 % de los pacientes tratados con altas dosis de zalcitabina intravenosa71-73. Con la dosis estándar, solo el 2 % de los pacientes presentó erupción cutánea 74. En el 60 % de los pacientes afectados las lesiones cutáneas fueron transitorias, resolviéndose tras suspender el fármaco75. Asimismo se han observado dos casos de síndrome de hipersensibilidad (DRESS: drug reaction with eosinophilia and systemic symptoms) asociados a zalcitabina que se presentaron entre 2 y 6 semanas tras el inicio del tratamiento76,77.
AbacavirLas reacciones de hipersensibilidad aparecen en alrededor del 5-8 % de los pacientes adultos78,79. Su patogenia es desconocida. Se caracterizan por fiebre, exantema (generalmente máculo-papuloso y menos frecuentemente urticariforme), alteraciones gastrointestinales (náuseas, vómitos, diarrea, dolor abdominal), artromialgias, parestesias, debilidad, síntomas respiratorios (tos, disnea), hipertransaminasemia y leucopenia77,80-82. Asimismo se han descrito sendos casos de rabdomiólisis 83 y de coagulación intravascular diseminada84. La reacción de hipersensibilidad es más grave, incluso puede ser mortal en reexposiciones sucesivas85. También se ha comunicado necrosis epidérmica tóxica en relación con abacavir86.
EstavudinaSe ha descrito un caso de hidradenitis neutrofílica ecrina en un paciente hemofílico con infección por el VIH en tratamiento con este fármaco87.
TenofovirSe han comunicado en relación con la administración de este ITIAN exantemas máculo-papulosos y urticariales, así como reacciones vesículo-ampollosas y liquenoides88,89.
EmtricitabinaSe han descrito alteraciones de la pigmentación cutánea asociadas al tratamiento con este fármaco90. Generalmente se trata de hiperpigmentación palmoplantar. También se han comunicado exantemas máculo-papulosos y urticariales, así como reacciones vesículo-ampollosas y pustulosas88.
Toxicodermias por inhibidores de la proteasaIndinavirDe todos los IP, indinavir presenta el perfil con mayor número de manifestaciones cutáneas documentadas. Indinavir ha sido implicado como agente causal de porfiria aguda91, síndrome de hipersensibilidad92, síndrome de Stevens-Johnson93, exantema máculo-papuloso94 y ginecomastia95,96.
Las dos manifestaciones cutáneas mejor conocidas asociadas a su uso son la alopecia97,98 y la paroniquia con lesiones de tipo granuloma piógeno 99-101. Los patrones de alopecia incluyen caída difusa del cabello, placas alopécicas circulares circunscritas y disminución de pelo en piernas, muslos, región púbica y región torácica o axilar. La pérdida de cabello se desarrolla en los primeros 6 meses de tratamiento. Se han sugerido dos explicaciones: agresión inmunitaria de los folículos pilosos en la reconstitución inmunitaria y aumento de la acción de los retinoides por indinavir97,98.
Las paroniquias asociadas con indinavir parecen ser idiosincrásicas, ocasionalmente recurrentes, independientes de la dosis, y se resuelven al suspender la medicación. La mayoría de los casos aparece entre 1 y 9 meses tras el inicio del tratamiento y afecta a las uñas de las manos y los pies. Clínicamente cursa con enclavamiento ungueal y formación de tejido de granulación hipertrófico. La posible interferencia del indinavir con el metabolismo endógeno de los retinoides se ha sugerido como mecanismo etiopatogénico. Este mismo mecanismo explicaría otros hallazgos asociados con indinavir tales como xerosis cutánea, eccema asteatósico, ictiosis adquirida, alopecia corporal y del cuero cabelludo, rizamiento del cabello y queilitis descamativa y erosiva99-101.
RitonavirLas manifestaciones cutáneas de ritonavir incluyen exantemas medicamentosos, reacciones de hipersensibilidad, sangrados espontáneos (articulares, tejidos blandos de palmas y plantas, y músculos) y hematomas. Las biopsias cutáneas de estos pacientes sugieren una reacción de hipersensibilidad mediada por IgA. En cuanto al sangrado espontáneo, aunque ritonavir es el fármaco más frecuentemente implicado, también se ha detectado con otros IP. El mecanismo responsable de este sangrado es desconocido, aunque la escasa eficacia de los factores de la coagulación administrados sugiere que no está directamente relacionado con la acción de los factores VIII o IX102-104.
Lopinavir/ritonavirLa administración de lopinavir con ritonavir a dosis bajas mejora significativamente las propiedades farmacocinéticas y la actividad de lopinavir frente a la proteasa del VIH-1. La formulación conjunta se creó para una administración más fácil y para garantizar que los dos fármacos se tomaban juntos en el tratamiento, asociados a otros agentes antirretrovirales. Entre los efectos adversos más frecuentes en adultos cabe destacar la diarrea, seguida por otros trastornos gastrointestinales, la astenia, las cefaleas y las erupciones cutáneas. Se han descrito exantemas máculo-papulosos pruriginosos debidos al uso de esta combinación de fármacos. El estudio histopatológico mostró un infiltrado inflamatorio inespecífico constituido por neutrófilos y linfocitos, pero sin eosinófilos ni dilatación capilar en la dermis papilar105,106. Asimismo, se ha comunicado un caso de pustulosis exantemática generalizada en un paciente que recibió lopinavir/ritonavir como profilaxis postexposición al VIH107.
NelfinavirEl nelfinavir es un IP frecuentemente usado en niños. Los efectos adversos asociados a su uso incluyen diarrea, náuseas y astenia. A nivel cutáneo se han comunicado casos de exantema máculo-papuloso generalizado y urticaria. El exantema máculo-papuloso se presenta con una frecuencia del 3-28 % según las series, y suele iniciarse entre 5 y 9 días tras el inicio del tratamiento. La urticaria se observa entre 8 y 10 días tras el inicio del tratamiento con nelfinavir108.
SaquinavirFue el primer IP aprobado por la Food and Drug Administration (FDA), sin embargo, debido a su complejo régimen de administración, desempeña un papel limitado en la multiterapia. Su biodisponibilidad ha mejorado con la introducción de la presentación en cápsulas de gelatina blanda109. Los efectos adversos más frecuentes incluyen dolor abdominal, diarrea y náuseas. A nivel cutáneo se han descrito casos de exantema fijo medicamentoso (dos casos)110 y ginecomastia 111. No está claro si la ginecomastia puede ser una faceta más del síndrome de lipodistrofia o un hallazgo independiente.
AtazanavirEl atazanavir es el primer IP de administración en dosis única diaria para el tratamiento de la infección por el VIH-1. En su perfil de efectos secundarios cabe destacar la hiperbilirrubinemia asintomática, las náuseas, los vómitos, la diarrea, el dolor abdominal, las cefaleas y la neuropatía periférica. A nivel cutáneo se han descrito exantemas máculo-papulosos112,113.
AmprenavirEl amprenavir es un IP habitualmente bien tolerado. No obstante, las reacciones de hipersensibilidad cutánea a este fármaco, fundamentalmente exantemas máculo-papulosos, se producen en más del 28 % de los pacientes, requiriendo la interrupción del tratamiento en un 3 % de los casos. Se han comunicado casos de desensibilización con dosis incrementales de amprenavir, lo que permite la tolerancia del mismo114.
FosamprenavirEl fosamprenavir es un profármaco oral del amprenavir. En los ensayos clínicos en los que se ha administrado con o sin ritonavir, conjuntamente con abacavir y lamivudina, los efectos secundarios más frecuentemente registrados han sido diarrea, náuseas, vómitos, dolor abdominal y exantemas máculo-papulosos115.
TipranavirTripanavir es un IP aprobado para su uso en combinación con ritonavir. Se han descrito en relación con su administración esxantemas urticariales, exantemas máculo-papulosos y posible fotosensibilidad88.
Toxicodermias por inhibidores de la transcriptasa inversa no análogos de los nucleósidosNevirapinaLa toxicidad principal de la nevirapina es un exantema máculo-papuloso que suele aparecer a las 4-6 semanas de tratamiento. La incidencia varía entre el 9 y el 32 %, según las series, y requiere la discontinuación del fármaco en un 6-7 % de los pacientes. La nevirapina se ha asociado también con casos de eritema multiforme (figs. 8 y 9) y de Stevens-Johnson en aproximadamente el 1 % de los pacientes116. Se ha comunicado un caso de síndrome de hipersensibilidad con eosinofilia y síntomas sistémicos entre 2 y 6 semanas tras el inicio de nevirapina117.
La delavirdina presenta una incidencia de exantema máculopapuloso del 18-50 %, según las series, en los pacientes tratados con este fámaco. Se ha comunicado, asimismo, un caso de Stevens-Johnson asociado con su administración118.
EfavirenzSe han comunicado casos de exantemas máculo-papulosos generalizados119,120, vasculitis leucocitoclástica121 y reacción de hipersensiblidad grave con fallo renal y afectación hepática y pulmonar sin cambios cutáneos y eosinofilia sanguínea 122 en relación con la administración de efavirenz. También se han descrito reacciones de fotosensibilidad y síndrome de Stevens-Johnson88.
Toxicodermias por enfuvirtidaEl único efecto adverso descrito en relación con el uso de este fármaco son las reacciones en el lugar de la inyección, generalmente de intensidad leve-moderada, las cuales pueden ser un factor que limite el tratamiento de forma ocasional18. Más raramente se han comunicado reacciones de hipersensibilidad88.
ConclusiónEs importante destacar que, aunque son indudables los múltiples beneficios que se derivan del TARGA, todavía existe un largo camino por recorrer, fundamentalmente en términos de manejo de los efectos secundarios de estos tratamientos, principalmente de los predecibles como la lipodistrofia, el efecto pseudorretinoide, o las reacciones de reconstitución inmunitaria. Estos efectos a menudo van a determinar una peor adherencia al tratamiento y, en definitiva, el fracaso del mismo. Es necesario, además, conocer las reacciones adversas que se pueden presentar en el contexto de la administración de los diferentes fármacos antirretrovirales y continuar comunicando las que aparezcan, pues toda esa información nos permitirá la rápida detección de estos cuadros, en caso de presentarse, y evitar la morbilidad añadida en los pacientes con infección por el VIH.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.