Debido a un uso cada vez más extendido de los fármacos inhibidores del PD1 y del PDL1 en la terapia contra el cáncer se observa un creciente interés en conocer y describir detalladamente sus efectos adversos1–2. Los efectos secundarios dermatológicos son los más frecuentes y precoces. A pesar de que se conoce que están producidos por una activación de los linfocitos T debida al bloqueo de los receptores PD1 y el ligando PDL1, no está aún bien establecido el mecanismo por el que se genera un direccionamiento aberrante de las células inmunitarias contra los antígenos dérmico-epidérmicos3–4. Se describe, a continuación, una serie que recopila la experiencia con los efectos secundarios cutáneos relacionados con estos fármacos en un centro de referencia.
Se seleccionaron todos los pacientes incluidos en el Registro del Servicio de Farmacia del Hospital General Universitario de Valencia que alguna vez habían recibido terapia con inhibidores de la respuesta inmune desde 2014 hasta 2021. La serie contenía 313 pacientes, de los cuales 10 habían recibido tratamiento con durvalumab, 139 con pembrolizumab, 112 con nivolumab, 51 con atezolizumab y 1 con avelumab.
Se identificó a aquellos cuyas alteraciones en la piel se podían atribuir a los efectos secundarios del tratamiento con anti-PD1 o anti-PDL1. De ellos se obtuvieron los datos relevantes para caracterizar las alteraciones dermatológicas encontradas y se determinó el tiempo de aparición entre el inicio del tratamiento con inhibidores de la respuesta inmune y su aparición. Los efectos secundarios se clasificaron en las siguientes categorías: alopecia, eccema, eritema nudoso, granuloma anular, reacciones liquenoides o liquen plano, penfigoide, prurito, psoriasis, pustulosis palmo-plantar, sarcoidosis, toxicodermia, vitíligo y xerosis. También se obtuvo información del tumor primario que padecían por su posible relevancia en el desarrollo de los efectos secundarios.
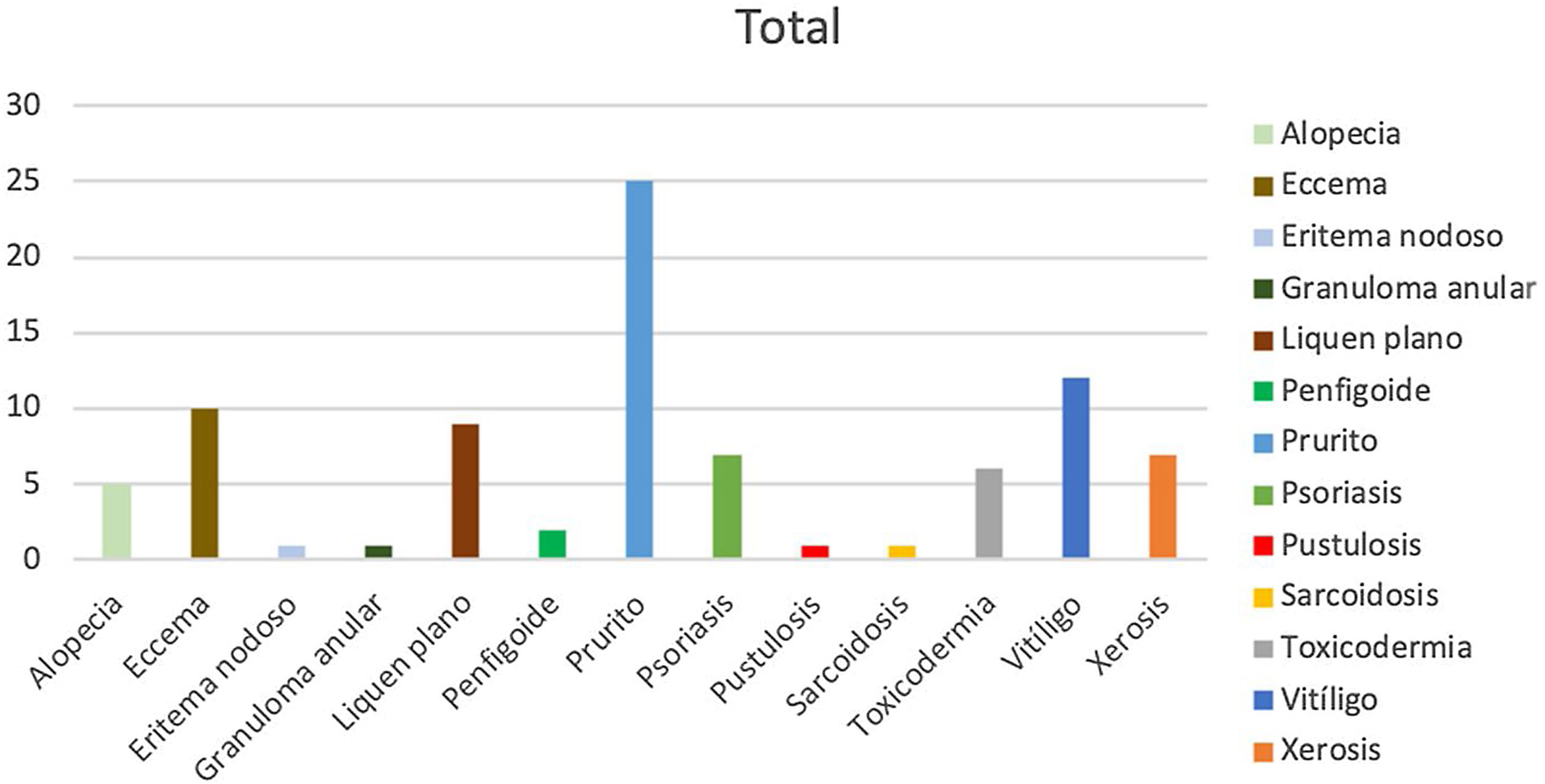
De los 313 pacientes analizados, 40 (12%) presentaron reacciones adversas dermatológicas secundarias al uso de fármacos anti-PD1 o anti-PDL1. El tratamiento con un mayor número de efectos adversos fue el nivolumab, con una incidencia del 16%, seguido del pembrolizumab, con un 14%. De los 51 pacientes de la serie que recibieron atezolizumab solamente uno presentó un efecto secundario. Se observó un número de efectos secundarios dermatológicos significativamente menor en los pacientes con anti-PDL1, con una incidencia del 3,2%, respecto a los tratados con anti-PD1, con un 15,1% (prueba de chi cuadrado, p<0,05). Todos los efectos secundarios respondieron favorablemente a los tratamientos tópicos y/o sistémicos, no siendo necesario en ningún caso modificar o suspender el tratamiento con inmunoterapia. La neoplasia con una mayor incidencia fue el melanoma, con un 40,8% de sus pacientes afectados, mientras que solo el 6,7% de pacientes con una neoplasia pulmonar desarrollaron efectos adversos. Un 30% de los pacientes presentó un único efecto secundario, manifestándose en la mayoría (70%) más de una alteración. Fue llamativo que 2 pacientes desarrollaron 6 efectos, tratándose en ambos casos de pacientes con melanoma como tumor primario. La reacción cutánea más frecuente en la serie fue el prurito (n=25), seguido del vitíligo (n=12) y el eccema (n=10) (fig. 1).
El presente estudio permite establecer una asociación entre el uso de fármacos anti-PD1 y anti-PDL1 y el desarrollo de efectos secundarios dermatológicos. Los efectos más frecuentes fueron el prurito, el vitíligo y el eccema, similares a otras series publicadas5. El tamaño de la muestra nos ha permitido detectar efectos que aparecen con una frecuencia menor, como la sarcoidosis, la pustulosis o el penfigoide ampollar6–7.
En la serie estudiada hemos podido relacionar la incidencia de los efectos secundarios según el tipo de tumor primario, independientemente del fármaco administrado, destacando los pacientes afectos de melanoma en el que observamos efectos adversos en el 40% de pacientes, superior a las incidencias observadas en otros estudios. No obstante, no se puede descartar un sesgo de selección dado que los pacientes con melanoma siguen un control regular por dermatología, por lo que es más probable que se detecten los efectos secundarios que afecten a la piel y los anejos. Además, el vitíligo, uno de los efectos adversos más frecuentes del tratamiento con inhibidores del PD1 y del PDL18, es un efecto casi exclusivo de los pacientes con melanoma, lo que podría explicar esta mayor incidencia de efectos adversos si lo comparamos con los que presentan otros tumores primarios.
La aparición de efectos adversos se ha asociado con una mayor supervivencia en los pacientes que los padecen9–10. Esto se atribuye a una activación más potente del sistema inmune que actúa tanto contra las células tumorales como contra los tejidos sanos. Los efectos adversos observados fueron tolerables. En los casos con manifestaciones más graves (6 pacientes con prurito intenso con alteración del sueño, un paciente con un eccema generalizado, un paciente con un liquen plano extenso, 2 pacientes con un penfigoide ampollar y un paciente con sarcoidosis) requirieron tratamiento sistémico, aunque en ninguno de ellos fue necesario suspender el tratamiento con inmunoterapia. Es necesario identificar y controlar estos efectos adversos de forma precoz para que no conlleven una interrupción del tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.