Bajo el término de precáncer cutáneo se han englobado tradicionalmente distintas entidades, clínica e histológicamente reconocibles, asociadas a un cierto riesgo de evolución a carcinoma escamoso cutáneo invasivo aunque en la actualidad se tiende a interpretarlas como carcinomas in situ. En este documento de consenso se abordan distintos aspectos de estas lesiones como son su evaluación a través de las características clínicas e, histopatológicas de las mismas, la evaluación inicial del paciente afecto, la identificación de los factores de riesgo para su desarrollo, los distintos métodos hoy día existentes para su estudio y diagnóstico así como las diferentes estrategias terapéuticas.
Certain clinically and histologically recognizable skin lesions with a degree of risk of progression to squamous cell carcinoma have been traditionally grouped as precancerous skin conditions but now tend to be classified as in situ carcinomas. This consensus statement discusses various aspects of these lesions: their evaluation by means of clinical and histopathologic features, the initial evaluation of the patient, the identification of risk factors for progression, and the diagnostic and treatment strategies available today.
Bajo el término de precáncer cutáneo se han englobado tradicionalmente distintas entidades, clínica e histológicamente reconocibles, asociadas a un cierto riesgo de evolución a carcinoma escamoso cutáneo invasivo. En la actualidad, se tiende a interpretarlas como carcinomas in situ, es decir, el estadio intraepidérmico de la neoplasia1. Entre ellas se encuentran fundamentalmente las queratosis actínicas (QA) y la enfermedad de Bowen (EB). Otras muchas menos frecuentes son las queratosis arsenicales, las queratosis postirradiación ionizante y las debidas al alquitrán. Otras que no se considerarán por afectar a las mucosas y/o semimucosas y no a la piel son la leucoplasia, la eritroplasia y la queilitis actínica.
Queratosis actínicasIntroducciónLas QA son lesiones cutáneas muy frecuentes en la práctica clínica diaria. En nuestro país, se las considera entre uno de los 5 diagnósticos más frecuentes en las consultas dermatológicas2. De hecho su prevalencia entre los pacientes españoles de 45 años o más que acuden a consultas externas de Dermatología se ha estimado recientemente en el estudio EPIQA en el 28,6%3. Además, si tenemos en cuenta la cada vez más prolongada esperanza de vida y los cambios de hábito de exposición solar, iniciados hace ya bastantes décadas, y la práctica cada vez más frecuente de deporte y actividades recreativas al aire libre, no cabe duda de que la incidencia y, consecuentemente, la prevalencia de esta enfermedad irán creciendo día a día en los próximos años y por ende lo hará también el cáncer cutáneo. No es de extrañar pues que el cáncer cutáneo no melanoma, incluyendo las QA, se haya convertido en un problema de salud pública, con el consiguiente coste económico para los sistemas nacionales de salud y la sociedad4.
Definición y nomenclaturaEl término «queratosis actínica» puede ser considerado como una forma de carcinoma escamoso in situ de la piel. Sin embargo, algunos autores prefieren considerarla como una lesión precancerosa que representaría el primer paso de un continuo que se inicia como una displasia queratinocitaria del estrato basal epidérmico y que en su evolución podría acabar en un carcinoma escamoso invasivo (proceso de cancerización). Dicho de otro modo, sería el punto inicial del proceso de carcinogénesis de los queratinocitos epidérmicos, inducido por la radiación actínica, fundamentalmente por la radiación ultravioleta (RUV)5. En cualquier caso, no parece aconsejable, al menos en la comunicación con los pacientes, utilizar el término de carcinoma in situ. La finalidad no es otra que evitar la alarma y carga emocional y psicológica innecesaria que puede representar, para un paciente o sus familiares, el emplear la palabra carcinoma para describir una lesión que con casi toda seguridad vamos a curar de forma relativamente sencilla y cuyo potencial de convertirse en un tumor invasivo es realmente bajo.
Otros términos utilizados de forma sinónima para la QA son: queratosis solar, carcinoma escamoso in situ tipo QA, neoplasia queratinocítica intraepidérmica y queratosis senil, si bien este último debe ser evitado6.
Identificación del paciente de riesgoLa principal causa de la QA es la exposición a la radiación no ionizante, principalmente la RUV, que induce directa (RUV-B) e indirectamente (RUV-A) mutaciones características en el ADN y el ARN de los queratinocitos epidérmicos a través de la formación de dímeros de ciclobutano y estrés fotooxidativo7,8. Por tanto, la exposición solar crónica es su principal causa (más del 80% de las QA se localizan en áreas crónicamente expuestas al sol) y todos aquellos factores o variables que comportan una mayor exposición solar crónica o una mayor vulnerabilidad a la RUV o un defecto en la capacidad de reparar el ADN lesionado servirán para identificar al paciente de riesgo. Entre estos factores se encuentran9:
- a.
Sujetos de edad avanzada, género masculino, con actividad profesional al aire libre (agricultores, pescadores navegantes…), actividad recreacional/deportiva al aire libre (tenis, golf…), que viven en países cálidos, en latitudes cercanas al ecuador y usuarios de fuentes artificiales de RUV, factores todo ellos que comportan una mayor exposición solar crónica.
- b.
Sujetos con fenotipo cutáneo i o ii que comporta una mayor vulnerabilidad a la RUV.
- c.
Sujetos con síndromes genéticos caracterizados por alteraciones en los mecanismos de reparación del ADN, inestabilidad cromosómica y fotosensibilidad (xeroderma-pigmentosum, síndrome de Rothmund-Thomson etc.).
- d.
También los pacientes inmunodeprimidos son considerados pacientes de riesgo, especialmente los pacientes receptores de un trasplante de órgano sólido que están crónicamente inmunodeprimidos como consecuencia de la terapia inmunosupresora para evitar el rechazo del órgano trasplantado.
En la valoración inicial de un paciente con QA es importante, además de una anamnesis general, como con cualquier otra enfermedad, recoger una serie de datos que pueden tener importancia a la hora de diseñar una estrategia terapéutica y de seguimiento. Entre estos datos figuran10:
- 1.
Tratamientos previos realizados para conocer la eficacia y tolerancia a los mismos.
- 2.
Historia previa de cáncer cutáneo no melanoma.
- 3.
Hábito de exposición solar, durante el trabajo y/o de actividades de ocio al aire libre, uso de lámparas de rayos UVA.
- 4.
Tratamiento inmunosupresor que está o haya estado realizando por cualquier motivo.
- 5.
Sintomatología subjetiva (picor, dolor, quemazón…) acompañante.
- 6.
El motivo de la consulta (síntomas subjetivos, preocupación sobre el cáncer cutáneo, motivos cosméticos).
- 7.
Además, deberemos también realizar una anamnesis dirigida a identificar los signos de sospecha de evolución de una QA a un carcinoma escamoso invasivo10 y que aparecen resumidos en la tabla 1.
Tabla 1.Signos de sospecha de la evolución de una queratosis actínica a carcinoma escamoso invasivo
Cuando aparece inflamada o indurada Diámetro mayor de 1-2cm Presencia de sangrado Si experimenta un rápido crecimiento Aparición de ulceración Falta de respuesta al tratamiento (no responde al tratamiento o se produce una rápida recurrencia tras respuesta inicial)
Ante un paciente con QA es preciso realizar:
- 1.
Una exploración dermatológica completa, prestando especial atención a las zonas expuestas al sol (cara, calota craneal de pacientes calvos, orejas, escote, dorso de manos y antebrazos), ya que raramente el paciente presenta una única QA, siendo múltiples las lesiones en la mayoría de ellos. Además estos pacientes también tienen con mayor frecuencia otros tumores de la piel asociados a la exposición solar, incluyendo carcinomas basocelulares, carcinomas escamosos o melanoma6.
- 2.
Será preciso una descripción detallada de la localización y tamaño de las lesiones, así como de la variedad clínica que se trate, pues no todos los tratamientos están indicados en todas las variedades y en todas las localizaciones.
- 3.
Además, en la exploración deberá anotarse la presencia de signos de daño actínico crónico (telangiectasias, alteraciones de la pigmentación, elastosis, arrugas) cicatrices o áreas de hipopigmentación como resultado de tratamientos previos (crioterapia, cirugía, etc.), así como la presencia o no de un campo de cancerización evidente.
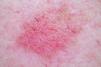
Las QA suelen manifestarse como una mácula, pápula o placa, de superficie rasposa al tacto, del color de la piel o algo eritematosa, de tamaño entre pocos mm a 2-3cm. Su número es variable (desde lesión única a múltiples lesiones) y habitualmente están localizadas en áreas de piel con signos de daño crónico actínico, como consecuencia de su exposición crónica al sol, como son la cara, la calota craneal de personas calvas, el escote, las orejas, el dorso de manos y antebrazos y el labio inferior (queilitis actínica). En general, no causan molestias subjetivas o estas son discretas, siendo este uno de los motivos de retraso en la consulta al dermatólogo.
Además de la forma clásica, se han descrito otras variedades de QA sobre la base de su apariencia clínico-patológica10.
- –
QA pigmentada: se trata de una mácula o pápula aplanada, hiperqueratósica de superficie hiperpigmentada o reticulada sin eritema asociado.
- –
QA liquenoide: similar a la forma clásica de QA pero con un pronunciado eritema rodeando la base de la lesión, que traduce la aparición de un infiltrado liquenoide subyacente a la QA.
- –
QA hipertrófica o hiperqueratósica: caracterizada por una pápula o placa con importante componente queratósico sobre una base inflamatoria que la hace fácilmente identificable. Con el tiempo, puede dar lugar a un cuerno cutáneo.
- –
QA atrófica: se manifiesta en forma de mácula eritematosa, ligeramente descamativa, mostrando en la histología una epidermis atrófica.
El diagnóstico de las QA es fundamentalmente clínico, basado en la exploración de la piel. La presentación clínica, descrita en el apartado anterior, y una historia con los factores de riesgo típicos constituyen los pilares diagnósticos6.
Para la valoración de la gravedad clínica individual de cada lesión se ha sugerido una escala en 3 grados11:
- –
Grado I (leve): lesiones ligeramente palpables (se palpan mejor que se ven).
- –
Grado II (moderada): lesiones moderadamente gruesas y visibles (se palpan y se ven con facilidad).
- –
Grado III (severa): lesiones muy gruesas e hiperqueratósicas.
El diagnóstico clínico alcanza un valor predictivo positivo entre el 74 y el 94%12.
En el diagnóstico diferencial hay que considerar al carcinoma escamoso invasivo, el carcinoma basocelular superficial, la EB, la poroqueratosis, las verrugas víricas, el lupus eritematoso cutáneo crónico discoide, el acantoma de células grandes, el lentigo senil y la queratosis seborreica. La variedad pigmentada debe diferenciarse del lentigo maligno y de la queratosis seborreica reticulada, siendo útil en estos menesteres la dermatoscopia, si bien en ocasiones hay que recurrir a la biopsia.
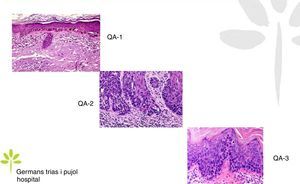
Diagnóstico histopatológicoAunque el diagnóstico de las QA es fundamentalmente clínico, en algunas ocasiones requiere examen histopatológico, bien sea para descartar invasión dérmica y, por tanto, que se trate de un carcinoma escamoso invasivo, o bien para diferenciarlo de otras entidades.
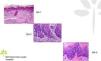
Las QA se caracterizan microscópicamente por una proliferación intraepidérmica de queratinocitos atípicos con pérdida de polaridad, pleomorfismo, hipercromasia nuclear y mitosis, características indistinguibles de las de los queratinocitos de los carcinomas escamosos invasivos, lo que hace que sean consideradas como carcinomas escamosos in situ. En función del grado de afectación intraepidérmica por la atipia queratinocítica, se distinguen 3 grados13,14 (fig. 1):
- a.
Grado 1: limitada al tercio inferior de la epidermis.
- b.
Grado 2: afecta a los 2 tercios inferiores de la epidermis.
- c.
Grado 3: afecta a la totalidad de la epidermis.
Pese a ello, en la práctica clínica diaria, la gran mayoría de dermatopatólogos y patólogos no incluyen en el informe anatomopatológico esta clasificación. Si bien inicialmente se creyó que esta escala de afectación intraepidérmica corría paralela a la probabilidad de evolución a carcinoma escamoso invasivo, hoy se considera que este riesgo ocurre ya en la QA de grado 1, no siendo en absoluto necesario la progresión al grado 2 y 3 para que ello ocurra15.
Los criterios histológicos16 de las QA en sus fases iniciales se resumen en la tabla 2 y sus características histopatológicas en lesiones plenamente desarrolladas en la tabla 3.
Características histopatológicas de las queratosis actínicas en fase inicial
| Queratinocitos atípicos (núcleos aumentados de tamaño, pleomórficos e hipercromáticos con incremento de la actividad mitótica) distribuidos desordenadamente en la capa basal de la epidermis |
| Hiperqueratosis con focos de paraqueratosis |
| Infiltración linfocítica de densidad variable en la dermis superior |
| Elastosis actínica |
Características histopatológicas de las queratosis actínicas plenamente desarrolladas
| Epidermis de silueta variable con acantosis o atrofia. A veces, las crestas interpapilares están dispuestas en forma de yemas o columnas |
| Los queratinocitos epidérmicos atípicos pueden permanecer afectando solo al tercio inferior de la epidermis por un tiempo indefinido, o bien extenderse a las capas superficiales de la epidermis, hasta afectar en algunas ocasiones todo su espesor |
| La atipia queratinocitaria puede extenderse en profundidad siguiendo el epitelio anexial, tanto en las lesiones con atipia únicamente basal como en las que muestran atipia en todo el espesor epidérmico |
| Hiperqueratosis con frecuente paraqueratosis |
| Elastosis actínica en la dermis |
| Infiltración linfocítica de densidad variable en la dermis superior |
En algunas variedades pueden observarse células disqueratósicas y acantolíticas sobre hendiduras suprabasales (QA acantolítica); en otras ocasiones, existe hiperpigmentación melánica y en otras el infiltrado linfocitario de la dermis superficial es intenso y dispuesto en banda acompañado de apoptosis en queratinocitos basales (QA liquenoide).
Otros medios diagnósticosSi bien, como ya se ha comentado, el diagnóstico de QA en la práctica clínica diaria es fundamentalmente clínico, recurriendo a la histopatología en casos de duda, el avance tecnológico ha llevado a la utilización de otras metodologías no invasivas y complementarias para su diagnóstico. Hay que aclarar, sin embargo, que ninguna de ellas, salvo la dermatoscopia, se utiliza de forma rutinaria en la práctica clínica diaria por la mayoría de los dermatólogos. Siempre es conveniente realizar una fotografía de las lesiones y del campo de cancerización para evaluar la respuesta al tratamiento.
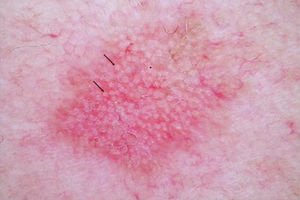
DERMATOSCOPIAEs una herramienta ampliamente usada en dermatología en el diagnóstico de tumores cutáneos. En el caso de las QA, se ha descrito una patrón característico «en fresa» (fig. 2) consistente en un eritema o seudorretículo rojizo más la presencia de vasos grandes fuera de foco, con un halo blanquecino entre ostiums foliculares prominentes17. Otros criterios muy característicos de las QA son las rosetas y la hiperqueratosis. En el caso del carcinoma escamoso, la dermatoscopia permite la identificación de estructuras que obligan a la realización de una biopsia diagnóstica. Se ha descrito en dermatoscopia un modelo de progresión desde la QA incipiente hasta el carcinoma escamoso bien diferenciado que resulta útil para distinguir estas entidades18.
En ciertas lesiones clínicamente equívocas la dermatoscopia mejora significativamente la precisión diagnóstica para diferenciar la QA del carcinoma basocelular superficial. En las QA pigmentadas la dermatoscopia es indispensable para diferenciarlas del lentigo maligno y del carcinoma basocelular pigmentado, orientando así la realización de una biopsia en estos casos.
FOTODIAGNÓSTICOConsiste en la administración de un fármaco fotosensibilizante o un precursor del mismo, el cual se acumula en células y tejidos metabólicamente activos. Al ser iluminados en presencia de oxígeno con una luz de adecuada longitud de onda, produce especies reactivas de oxígeno y radicales libres que inducen la fotooxidación de los tejidos con la subsiguiente destrucción de los mismos. En dermatología se utiliza como precursor del fotosensibilizante el ácido-delta-aminolevulínico o su derivado 5-metilo aminolevulinato, que se convierte en el producto fotosensibilizante, la protoporfirina ix, la cual emite una fluorescencia rojo coral al ser iluminada con luz de adecuada longitud de onda facilitando la identificación de las lesiones neoplásicas. Su eficacia como método diagnóstico, no ha sido del todo confirmada pero puede ayudar a delimitar el campo de cancerización19. No está disponible en todos los centros hospitalarios y consume recursos.
Desde el punto de vista terapéutico, en la actualidad, con la finalidad de evitar la necesidad de aparataje especial, se está llevando a cabo la iluminación con la luz de día: exponerse 2 h a la luz entre las 10 y las 18 h de un día no lluvioso. Esta modalidad ha demostrado en los ensayos clínicos efectos terapéuticos similares a la iluminación con lámpara en consulta pero con una tolerancia mucho mejor al no producir apenas molestias.
MICROSCOPIA DE REFLECTANCIA CONFOCAL IN VIVOConsiste en el examen no invasivo de la piel por medio de un microscopio con luz láser de 830nm. Este microscopio permite obtener imágenes in vivo de la piel en tiempo real, con resolución celular y una penetración de 200-300 micras. Actualmente, se han desarrollado equipos manuales que permiten un examen rápido, en pocos minutos, de múltiples lesiones.
La microscopia confocal de reflectancia ha mostrado la mayor sensibilidad y especificidad en el diagnóstico, especialmente en las lesiones dudosas en dermatoscopia cuando se debe descartar un carcinoma basocelular, un carcinoma escamoso o en las lesiones pigmentadas. En la actualidad, en España, es más utilizada en el campo de la investigación que en la aplicación clínica de la práctica diaria ya que desafortunadamente son pocos los centros hospitalarios que disponen de esta tecnología. Puede ser una herramienta especialmente útil en la detección de QA subclínicas en el campo de cancerización o en áreas de piel con daño actínico grave al poder mostrar pleomorfismo y disrupción arquitectural del estrato espinoso20.
TOMOGRAFÍA DE COHERENCIA ÓPTICAConsiste en el examen no invasivo de la piel con un microscopio que utiliza luz del espectro de infrarrojos permitiendo obtener imágenes de la piel a partir del principio de interferencia (inferometría). La resolución del equipo de TCO es inferior a la del microscopio confocal de reflectancia pero consigue una penetración superior, entre 500 micras a varios milímetros según los equipos utilizados y el tejido examinado. Este equipo se ha utilizado en el estudio de las QA y del cáncer cutáneo en trabajos de investigación y en el seguimiento de tratamientos de estas lesiones21.
Campo de cancerizaciónLa existencia de un campo de cancerización es un factor fundamental a la hora del diseño de una estrategia terapéutica y debería ser siempre evaluado en un paciente con QA.
El campo de cancerización correspondería al área de piel con daño actínico que puede estar rodeando a cada QA y que muestra sus mismas alteraciones genéticas. En esta área podríamos encontrar QA clínicamente visibles, QA subclínicas (diagnosticables solo microscópicamente) y focos de queratinocitos con alteraciones genéticas detectables solo por estudios moleculares, y piel normal22,23.
El problema de la evaluación del campo de cancerización es la imposibilidad de delimitarlo de una forma clara clínicamente por lo que su extensión se estima de una forma bastante aleatoria. Probablemente, la microscopia de reflectancia confocal podría ser de gran ayuda en este sentido; sin embargo, su disponibilidad en la práctica clínica diaria es muy escasa, al menos en España.
La existencia del campo de cancerización tiene implicaciones terapéuticas importantes, pues si solo tratamos la lesión o las lesiones clínicamente visibles, las eliminamos pero el campo persiste y con el tiempo surgirán nuevas lesiones. Por el contrario, si tratamos el campo, eliminamos no solo las lesiones evidentes sino también las subclínicas y posiblemente los clones de células destinadas a convertirse en QA.
En cualquier caso, el tratamiento de campo de cancerización es un concepto más teórico que práctico dada la imposibilidad de fijar sus límites clínicos de una forma fehaciente y la ausencia de evidencias de que el tratamiento del campo de cancerización disminuya el riesgo de tener un carcinoma escamoso invasivo.
Historia natural de las queratosis actínicas y necesidad de tratamientoLa QA es considerada hoy día como una enfermedad crónica con el potencial de progresar a carcinoma escamoso invasivo, de persistir como tal o de regresar de forma espontánea a piel normal24.
Sin embargo, los datos existentes sobre las tasas de progresión y regresión son escasos y poco fiables, con limitaciones metodológicas muy importantes. Por otro lado, tampoco existen factores pronósticos indicativos de la posible evolución individual de la QA en uno u otro sentido.
En base pues al riesgo inherente de progresión a carcinoma escamoso invasivo y su carácter crónico, y ante la imposibilidad de reconocer factores predictivos de esta evolución, el tratamiento de estas lesiones es recomendable24.
Otras razones para tratarlas serían consideraciones cosméticas y el alivio de la sintomatología que, en general, es escasa.
Estrategias terapéuticasModalidades terapéuticasEl armamentario terapéutico es muy amplio e incluye modalidades ablativas, no ablativas y mixtas.
De un modo general, las ablativas se utilizarían para el tratamiento de lesiones individuales, únicas o escasas en número pero no para el tratamiento del campo de cancerización10. Estas modalidades incluyen el raspado con/sin electrocoagulación, crioterapia, láser CO2, láser ER:YAG y cirugía. Las modalidades no ablativas y mixtas, en su mayoría están indicadas para el tratamiento tanto de las lesiones como del campo de cancerización6,10. En nuestro país disponemos de preparados comerciales de 5-fluorouracilo (5-FU) al 0,5%+ácido salícílico al 10%; imiquimod al 5 y al 3,75%; diclofenaco al 3% en gel de ácido hialurónico al 2,5%; ingenol mebutato al 0,05 y 0,015% y de 5-FU al 5% en formulación magistral10. La modalidad mixta está representada por la terapia fotodinámica, que a menudo requiere pretratamiento de la QA con raspado con el objeto de facilitar la penetración de la sustancia fotosensibilizante aplicada (ALA o MAL).
El modo de aplicación de las diferentes modalidades terapéuticas aparece recogido en la tabla 4.
Modalidades terapéuticas para las queratosis actínicas
| Modalidad terapéutica | Modo de aplicación |
|---|---|
| Legrado | 1 vez |
| Crioterapia | 1 vez. Se puede repetir varias veces |
| Láser CO2 | 1 vez. Se puede repetir varias veces |
| Láser ER:YAG | 1 vez. Se puede repetir varias veces |
| 5-FU al 5% | 1-2 veces/día durante 2-4 semanas |
| 5-FU al 0,5% + ácido salicílico al 10% | 1 vez/día durante 6-12 semanas |
| Imiquimod al 5% | 1 vez/día, 2-3 días/semana durante 4-16 semanas |
| Imiquimod 3,75% | 1 vez/día/2 semanas-descansar 2 semanas y repetir |
| Diclofenaco al 3% en gel de AH al 2,5% | 2 veces/día durante 60-90 días |
| Ingenol 0,015% (lesiones de cara y cc) | 1 vez/día durante 3 días |
| Ingenol 0,05% (lesiones tronco-extremidades) | 1 vez/día durante 2 días |
| ALA-PDT | 1-2 sesiones. Incubación mínima de 1h |
| MAL-PDTa | 1-2 sesiones. Incubación mínima 2,5h |
Es de capital importancia recordar que las modalidades ablativas y no ablativas no son incompatibles y de hecho la combinación de una modalidad para tratar la lesión con otra para tratar el campo de cancerización en un mismo paciente es frecuente y su tolerancia y eficacia mayor en términos de aclaramiento total y recidivas25-27.
El tratar el campo de cancerización, además de las lesiones clínicamente visibles, es en cierta manera un tratamiento preventivo, ya que evita que lesiones subclínicas puedan progresar a lesiones clínicamente visibles y puedan acabar en un carcinoma escamoso28. Además, al evitar o retrasar la aparición de nuevas lesiones permite aumentar el intervalo de las visitas de seguimiento.
Factores a considerar en la elección del tratamientoLa decisión de utilizar un tratamiento dirigido a la lesión o dirigido al campo de cancerización, así como la modalidad a utilizar, dependerá de numerosos factores que hay que valorar individualmente en cada paciente. Estos factores quedan recogidos en la tabla 5.
Factores a considerar en la elección del tratamiento de las queratosis actínicas
| Relacionados con la enfermedad y paciente |
| Número, localización y extensión de las lesiones |
| Edad, comorbilidades, inmunosupresión |
| Historia previa de cáncer cutáneo y tratamientos previos |
| Estado mental y cumplimiento esperado |
| Aspectos cosméticos |
| Coste del tratamiento |
| Posología |
| Preferencias del paciente |
| Relacionados con el tratamiento |
| Disponibilidad y accesibilidad al tratamiento |
| Eficacia, seguridad, tolerabilidad de tratamiento previsto y resultado a largo plazo |
| Relacionados con el médico |
| Experiencia con el procedimiento |
| Preferencias en el tratamiento |
Resulta muy difícil ante tantos factores establecer un algoritmo de decisión terapéutica que cubra todas las situaciones clínicas. De hecho, las diferentes estrategias no son del todo coincidentes entre las guías de práctica clínica de diferentes países6,10,24,29,30. Sin embargo, como punto de partida es útil el establecer una estrategia basada inicialmente en el número de lesiones a tratar6, su distribución (aisladas o agrupadas en zonas) y la presencia/ausencia de campo de cancerización, para luego ir modelando las diferentes alternativas sobre la base de los otros factores.
Ante pacientes con lesiones únicas o escasas en número (5 o menos) y no agrupadas, es decir, asentadas en áreas anatómicas distintas, pueden emplearse tratamientos dirigidos a la lesión o tratamientos tópicos farmacológicos (tabla 4). En nuestro país, y en muchos otros, no hay duda de que la crioterapia es el tratamiento más utilizado en esta situación, lo que no significa que sea el más eficaz ni eficiente, y su tasa de recurrencias es elevada10,31. Llama la atención que en las recientes guías europeas, basadas en la evidencia, aparezca la crioterapia, pese a la escasa evidencia existente y los escasos estudios clínicos comparativos, como tratamiento muy recomendado6. En esta situación los demás tratamientos ablativos dirigidos a la lesión (terapia fotodinámica y láser CO2 o Erb-YAG) ven limitado su uso en nuestro país por su escasa disponibilidad y el elevado coste. Finalmente, el legrado, la coagulación y la cirugía ven limitado su uso por el riesgo de cicatrices. A pesar de ello, son alternativas terapéuticas necesarias en algunos casos de lesiones muy hiperqueratósicas o en aquellos casos donde existan dudas diagnósticas, ya que permiten el estudio anatomopatológico10.
Entre los tratamientos farmacológicos tópicos, si la lesión es moderadamente o muy hiperqueratósica, debería emplearse el 5-FU al 0,5% con ácido salicílico al 10%, por indicación de la ficha técnica y los buenos resultados mostrados, tanto valorados por el paciente como por el facultativo32, así como de cualquier otro si la lesión carece de componente hiperqueratósico10. En las lesiones no o escasamente hiperqueratósicas el diclofenaco al 3% en gel de ácido hialurónico al 2,5% resulta algo menos eficaz que el resto33, pero por el contrario es el mejor tolerado34,35. Los demás tratamientos farmacológicos tópicos pueden producir importantes reacciones inflamatorias locales. Estas reacciones cutáneas locales pueden incluir eritema, escamas, costras, edema, vesículas, pústulas, erosiones, ulceraciones y cicatrices con hiper o hipopigmentación, con mayor o menor gravedad. En general, aparecerán a los pocos días de iniciar el tratamiento y permanecerán mientras dure el mismo y hasta unos días/semanas después de haberlo finalizado33. Estas reacciones cutáneas locales limitarán en muchas ocasiones la adherencia al tratamiento. En este sentido, el ingenol mebutato, con tiempos de tratamiento más cortos, es el único tratamiento en el que la reacción cutánea local aparece una vez finalizado el tratamiento, por lo que solo en pocas ocasiones afectará a la adherencia36. Además, algunos de estos tratamientos, como el diclofenaco sódico o la terapia fotodinámica, pueden producir fotosensibilidad, y otros como el imiquimod pueden producir sintomatología sistémica en forma de malestar general y cuadro seudogripal asociado a la reacción cutánea local6. Teniendo en cuenta el mecanismo de acción inmunológico de varios de estos tratamientos farmacológicos, se recomienda evitar la aplicación de corticoides tópicos para el manejo de la reacción cutánea local.
Si las lesiones son numerosas (6 o más) y afectan a distintas zonas anatómicas del tegumento, deben regir los mismos principios que en la situación anterior si bien en este caso la estrategia más indicada son los tratamientos farmacológicos tópicos por el dolor que producen los tratamientos ablativos y su riesgo de sobreinfección, trastornos de la pigmentación y cicatrización6.
Otra situación clínica estaría representada por el paciente con al menos 6 QA pero agrupadas en una zona anatómica o la presencia de menos de 6 lesiones pero con cambios importante de daño actínico crónico e hiperqueratosis en la vecindad (campo de cancerización). En esta situación los tratamientos ablativos no tienen cabida y la decisión entre terapia fotodinámica o tratamiento farmacológico tópico y cuál de ellos elegir dependerá de la decisión pactada entre el facultativo y el paciente una vez analizados los pros y contras de cada uno de ellos, buscando el mejor equilibrio entre eficacia y tolerancia, y coste/beneficio37. Los tratamientos ablativos en estas situaciones deberían quedar reservados para el tratamiento de alguna lesión aislada que no respondiese a los tratamientos tópicos o a la TFD, o fuese muy hiperqueratósica, pero nunca para el tratamiento del campo de cancerización.
Una última situación viene representada por los pacientes inmunodeprimidos con QA. En esta situación, dado, en general, el carácter múltiple de las lesiones, su posiblemente más rápida transición a carcinoma escamoso invasivo, y en ocasiones la dificultad diagnóstica, lo más habitual es hacer tratamientos combinados, dirigidos a la lesión y al campo de cancerización, y en este sentido la combinación de tratamientos ablativos, con tratamientos farmacológicos tópicos, y terapia fotodinámica es la norma32. Especialmente cauteloso se debe ser en la utilización de fármacos inmunoestimulantes en extensas áreas en pacientes inmunodeprimidos iatrogénicamente, ya que podrían empeorar la enfermedad de base. Sin embargo, se ha demostrado la seguridad de imiquimod al 5%, 5-fluoracilo al 5%, diclofenaco sódico al 3% y terapia fotodinámica en este grupo de pacientes32.
Tratamiento preventivo y/o coadyuvanteFotoprotecciónEl tratamiento de las QA debe acompañarse siempre de medidas de protección solar, sea cual fuere el tratamiento aplicado y la situación clínica10.
La fotoprotección forma parte del tratamiento integral de las QA, ya que la RUV es su principal causa. Entre las medidas de protección solar hay que considerar: protegerse de la radiación solar buscando la sombra durante las horas de mayor irradiación (10 a 15h); utilizar sombreros de ala ancha, gafas de sol y ropa fotoprotectora, y aplicarse filtros solares con factor de protección solar de 30 o superior de forma regular. Diversos trabajos han puesto de manifiesto la utilidad de la aplicación diaria de filtros solares no solo en prevenir la aparición de nuevas QA, sino también de provocar la regresión de alguna de ellas38,39.
QuimioprofilaxisAdemás, en pacientes de riesgo con múltiples lesiones y que desarrollan múltiples carcinomas escamosos invasivos (situación clínica frecuente en los receptores de trasplante de órgano sólido) podría plantearse la quimioprofilaxis con retinoides orales. Estos en algunas ocasiones se han mostrados eficaces en reducir el número de nuevas lesiones (QA y carcinoma escamosos)40. Pese a ello, esta medida es muy poco utilizada y controvertida dada la mala tolerancia al fármaco administrado a las dosis verdaderamente eficaces, el escaso número de estudios existentes al respecto y la inconsistencia de los resultados entre ellos10,38,41,42.
SeguimientoEl paciente con QA debe ser considerado como un paciente crónico y, por tanto, debe procederse a su seguimiento y revisiones periódicas. El número y la frecuencia de las revisiones estarán en función de la edad de inicio de la enfermedad, sus factores de riesgo y los antecedentes de cáncer cutáneo no melanoma6. En las visitas de seguimiento debe insistirse en la necesidad de la autoexploración para la detección precoz de lesiones sospechosas. Estas visitas de seguimiento bien podría realizarlas el médico de atención primaria, derivando al paciente al especialista en caso de duda bien diagnóstica o bien de la elección de la estrategia terapéutica más adecuada10.
Enfermedad de BowenIntroducciónLa EB, nombre aplicado tradicionalmente al carcinoma escamoso in situ de piel queratinizante, es mucho menos frecuente que las QA, aunque no disponemos de datos de prevalencia. No obstante, de manera análoga a lo que ocurre con las QA, la incidencia irá en aumento debido a la práctica cada vez más frecuente de actividades al aire libre y la más prolongada esperanza de vida.
Definición y nomenclaturaEn la EB, el término «carcinoma escamoso in situ» hace referencia a una lesión intraepitelial en la que los queratinocitos atípicos proliferan de forma clonal ocupando todo el grosor de la epidermis. Esta lesión, al igual que las QA, si no recibe tratamiento tiene la capacidad de progresar hacia un carcinoma escamoso invasor43.
Identificación del paciente de riesgoA diferencia de las QA, la EB no siempre aparece en las áreas de piel fotoexpuesta, ya que en su patogenia participa tanto la radiación actínica (RUV) como otros tipos de radiaciones (ionizantes), ciertos tóxicos como el arsénico o incluso infecciones víricas por diferentes tipos de virus del papiloma humano oncogénico44. De esta manera, los factores de riesgo para el desarrollo de esta enfermedad serán los mismos que los mencionados en las QA, a los que hay que añadir los sujetos con prácticas sexuales de riesgo que puedan adquirir infección por algún serotipo de virus del papiloma humano de alto riesgo oncogénico45.
Evaluación inicial del paciente con enfermedad de BowenAnamnesisEn la valoración inicial de un paciente con EB, además de una anamnesis general, como en cualquier otra enfermedad, se recomienda recoger una serie de datos que pueden tener importancia a la hora de diseñar una estrategia terapéutica y de seguimiento. Entre estos datos figuran:
- 1.
Tratamientos previos realizados para conocer la eficacia y tolerancia a los mismos.
- 2.
Historia previa de cáncer cutáneo no melanoma.
- 3.
Hábito de exposición solar, durante el trabajo y/o de actividades de ocio al aire libre, uso de lámparas de rayos UVA, etc.).
- 4.
Tratamiento inmunosupresor que es o ha sido realizando por cualquier motivo.
- 5.
Sintomatología subjetiva acompañante (picor, dolor, quemazón…).
- 6.
El motivo de la consulta (síntomas, preocupación sobre el cáncer cutáneo, motivos cosméticos).
- 7.
Además, deberemos también realizar una anamnesis dirigida a identificar los signos de sospecha de evolución de una EB a un carcinoma escamoso invasivo, que básicamente serán si la base de la lesión se encuentra infiltrada, presenta alguna lesión tumoral en su superficie o se ha ulcerado.
- 8.
Finalmente, preguntar por hábitos sexuales y presencia en su pareja de infección por virus del papiloma humano o diagnóstico de neoplasia intraepitelial de cérvix46.
Ante un paciente con sospecha de EB es preciso realizar:
- 1.
Una exploración dermatológica completa, ya que puede aparecer en cualquier parte del tegumento cutáneo, tanto en áreas descubiertas como cubiertas. Por otra parte, la exhaustiva exploración cutánea es necesaria ya que se ha sugerido una alta incidencia previa o concomitante de otros cánceres cutáneos no melanoma, principalmente carcinoma basocelular47.
- 2.
Será preciso una descripción detallada de la lesión, que normalmente suele ser única, incluyendo tamaño, color, grado de hiperqueratosis, presencia o no de ulceración, sangrado espontáneo, infiltración de la base, etc.
- 3.
La asociación de EB a cáncer visceral fue señalada durante años, aconsejando en los pacientes con este diagnóstico una anamnesis y exploración destinadas a descartar esta posibilidad. Sin embargo, estudios más recientes no han podido confirmar esta asociación48.
La EB suele manifestarse casi siempre de la misma manera. Suele ser una lesión única con crecimiento lento y progresivo, en forma de placa anular de 1-2cm diámetro, eritematosa, no infiltrada, bien delimitada, con bordes irregulares y una costra o escama suprayacente. En ocasiones, presenta una marcada hiperqueratosis acompañante y puede ser pigmentada. También pueden alcanzar varios centímetros de diámetro o aparecer múltiples lesiones.
La EB genital se relaciona con la infección por el virus del papiloma humano y puede aparecer tanto en la zona del pubis como en el cuerpo del pene o en la zona perianal. En estos casos, la lesión suele ser también una placa única o múltiple, bien delimitada, hiperqueratósica. Cuando afecta a la mucosa genital la denominamos eritroplasia de Queyrat; en este caso, la lesión se presenta en forma de máculo-placa eritematosa, difícil de delimitar, que puede tener pequeñas erosiones superficiales. La EB que afecta a la zona periungueal, también relacionada con el virus del papiloma humano, se presenta en forma de placa eritemato-escamosa alrededor del margen cuticular de la uña, pudiendo acompañarse de onicólisis o discoloración ungueal49.
Diagnóstico de la enfermedad de BowenDiagnóstico clínicoEl diagnóstico definitivo de la EB suele requerir una biopsia cutánea. La presentación clínica, descrita en el apartado anterior, es muy indicativa. La dermatoscopia puede ayudar al mostrar vasos glomeruloides y escamas50, pero en general se requiere de una biopsia para poder excluir otros diagnósticos. Entre ellos vale la pena mencionar el carcinoma escamoso infiltrante, el carcinoma basocelular superficial, el eccema numular, los condilomas acuminados, la poroqueratosis, el lupus eritematoso cutáneo crónico discoide y la queratosis seborreica.
Diagnóstico histopatológicoLa EB se caracteriza microscópicamente por una proliferación intraepidérmica de queratinocitos atípicos ocupando todo el grosor de la epidermis, incluyendo la porción intraepidérmica de los anejos cutáneos. Estos queratinocitos atípicos son característicamente pleomórficos e hipercromáticos. Pueden ser también vacuolados y tener un citoplasma claro y prominente que recuerda a las células de Paget. Se produce también una pérdida de maduración y polaridad, además de numerosas figuras de mitosis. De manera característica, va acompañado de hiperqueratosis en mayor o menor grado y paraqueratosis, así como de acantosis con un completo desorden arquitectural. La dermis superficial suele estar ocupada por un infiltrado inflamatorio crónico compuesto por linfocitos, células plasmáticas e histiocitos. Existen algunas variedades, como la EB psoriasiforme, atrófica y acantolítica.
Historia natural de la enfermedad de Bowen y necesidad de tratamientoA diferencia de las QA, la EB se presenta habitualmente de forma única y es persistente. A no ser que se realice un tratamiento adecuado, la lesión irá creciendo de forma progresiva en superficie y adquirirá capacidad invasora en profundidad, convirtiéndose en un carcinoma escamoso invasivo. El riesgo estimado de progresión se cifra en el 3-5%, siendo algo superior, en torno al 10%, cuando se manifiesta en forma de eritroplasia de Queyrat44.
Estrategias terapéuticasModalidades terapéuticasEl armamentario terapéutico, al igual que en las QA, es amplio e incluye modalidades ablativas, no ablativas y mixtas. En función del tamaño de la lesión, la localización y las preferencias del médico y el paciente, se optará por uno u otro tratamiento, pero en general, en este caso, el tratamiento combinado, con métodos ablativos y no ablativos, no suele ser necesario.
Las distintas modalidades ablativas incluyen la cirugía, el legrado (raspado) con electrocoagulación, la crioterapia, el láser CO2 y el láser ER:YAG. Las modalidades no ablativas y mixtas aprobadas en nuestro país a día de hoy para el tratamiento de la EB son el imiquimod al 5% y la terapia fotodinámica con MAL o ALA, pese a que en la práctica clínica diaria se utilizan en mayor o menor grado los mismos productos que para las QA.
En un reciente estudio, el grupo Cochrane51 identificó solo 9 estudios aleatorizados en la EB. Concluyó que la terapia fotodinámica con MAL era un tratamiento efectivo, con mayor eficacia que la crioterapia y sin diferencias significativas con el 5-FU. Sin embargo, la eficacia fue mayor si en vez de MAL se utilizaba ALA51.
El modo de aplicación de las diferentes modalidades terapéuticas aparece recogido en la tabla 6.
Modalidades terapéuticas en la enfermedad de Bowen
| Modalidad terapéutica | Modo de aplicación |
|---|---|
| Legrado | 1 vez |
| Crioterapia | 1 vez. Se puede repetir varias veces |
| Láser CO2 | 1 vez. Se puede repetir varias veces |
| Láser ER:YAG | 1 vez. Se puede repetir varias veces |
| Imiquimod 5% | 1vez/día, 5 días/semana durante 6 semanas |
| ALA-PDT | 1-2 sesiones. Incubación mínima de 1h |
| MAL-PDT | 1-2 sesiones. Incubación mínima 2,5h |
La decisión de utilizar un tratamiento quirúrgico, ablativo o tópico dependerá de numerosos factores, de manera similar a las QA, que hay que valorar individualmente en cada paciente44.
La exéresis quirúrgica y el estudio anatomopatológico de la muestra es el único tratamiento que garantiza que los márgenes quedan libres, confirmando también que la lesión estaba confinada al epitelio. Los otros tratamientos los aplicamos sin tener la certeza al 100% de que la lesión es únicamente intraepitelial en toda su extensión. Por este motivo, antes de utilizarlos, debemos realizar una biopsia confirmatoria del diagnóstico de la lesión y tomar muestras de todas aquellas áreas que puedan indicarnos que la lesión ya está invadiendo la dermis.
Conflicto de interesesCarlos Ferrándiz ha recibido honorarios por conferencias y/o consultoría de Almirall, Leo-Pharma y Spherium Biomed. Maite Fernández-Figueras ha recibido honorarios como conferenciante y/o ayudas para la investigación de Almirall, Galderma, Leo-Pharma, Novartis y Roche. Carla Ferrándiz-Pulido ha recibido honorarios por conferencias y/o asesorías y/o ayudas a congresos de Almirall, Leo-Pharma, Isin, Galderma e IFC. Carlos Guillén ha recibido honorarios por consultorías y/o por ser conferenciante por parte de Galderma, Almirall, Meda, Leo-Pharma, Bio Frontera, Isdín. J. Malvehy ha recibido honorarios como consultor y/o ayudas para la investigación de: Almirall, Leo Farma, Meda, Amgen, ISDIN, Novartis, Roche, Scibase, GSK, Bristol Meyers-Squibb, Cantabria y MAVIG.