El pioderma gangrenoso es una patología inflamatoria que se ha visto asociada a multitud de enfermedades sistémicas. Presentamos el caso clínico de un varón con lesiones de pioderma gangrenoso que aparecieron en el contexto de una hidrosadenitis supurativa de más de 20 años de evolución. La clínica de pioderma se desarrolló en un solo brote y se resolvió totalmente tras tratamiento inmunosupresor. En la literatura pocas veces ha sido descrita esta asociación. Además, en los casos publicados no se ha podido establecer una relación entre la actividad de ambas enfermedades, observándose que evolucionan de manera independiente, sin tener actividad inflamatoria paralela ni respuesta común a los fármacos administrados.
Pyoderma gangrenosum is an inflammatory disease that has been found to be associated with many systemic illnesses. The case presented here is of a man with a 20-year history of hidradenitis suppurativa who developed pyoderma gangrenosum. The pyoderma lesions appeared as a single outbreak which resolved totally after immunosuppressive treatment. This association has been reported only rarely in the literature. Furthermore, in the cases reported, no relationship was apparent between the activity of both diseases. In all cases the clinical course appeared independent, with no apparent overlap in inflammatory activity or response to the drugs administered.
El pioderma gangrenoso (P.G.) es una entidad de etiología incierta que fue descrita por Brusting et al en 19301. Presenta una clínica característica, con la formación de úlceras dolorosas de bordes eritematovioláceos. Las extremidades inferiores son el lugar donde con mayor frecuencia aparecen las lesiones, aunque pueden hacerlo en cualquier otra localización. El P.G. ha sido asociado a multitud de patologías sistémicas, destacando la enfermedad inflamatoria intestinal, las artritis seronegativas y diversas alteraciones hematológicas2. Sin embargo, la presentación de un P.G. en el contexto de una hidrosadenitis supurativa (H.S.) ha sido descrita pocas veces en la literatura3.
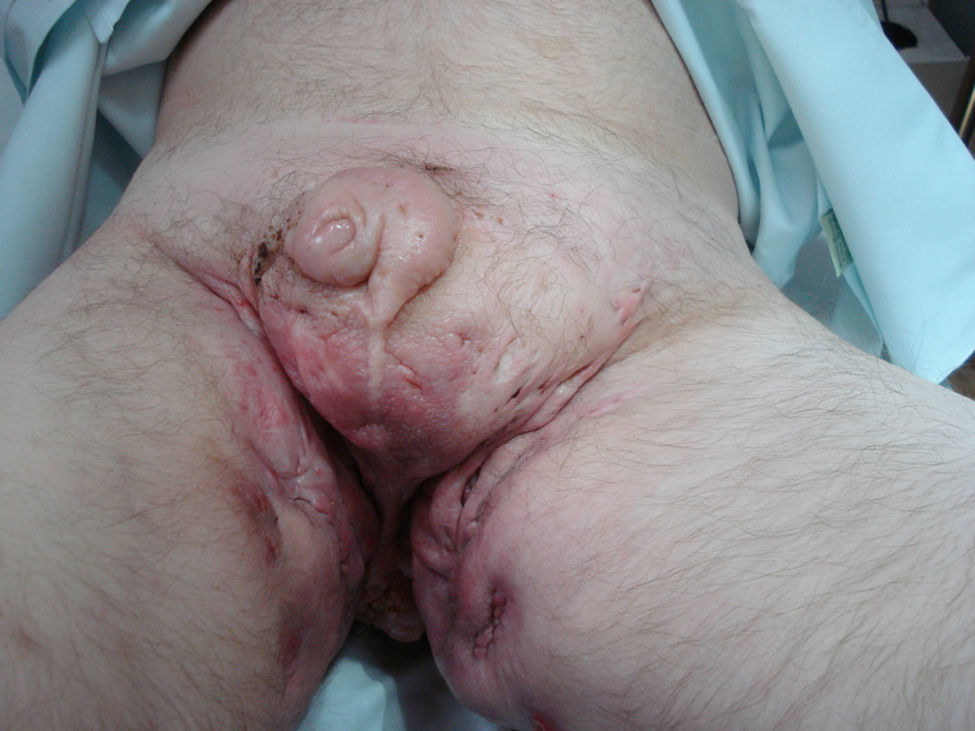
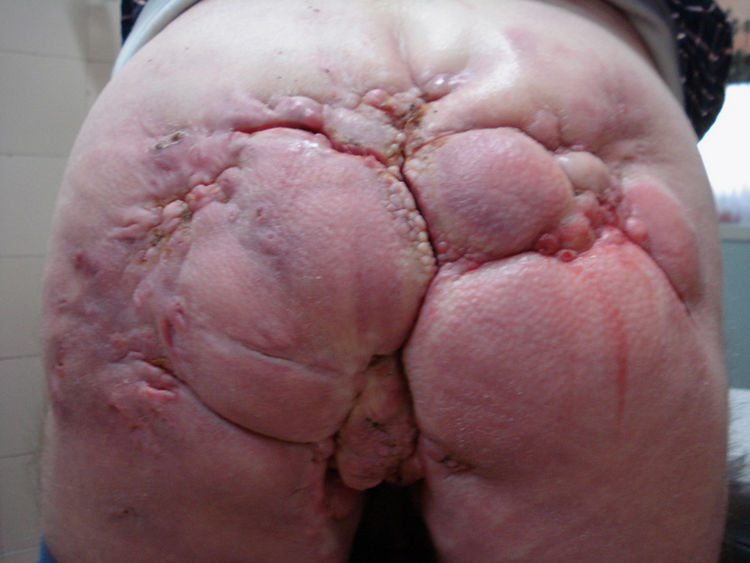
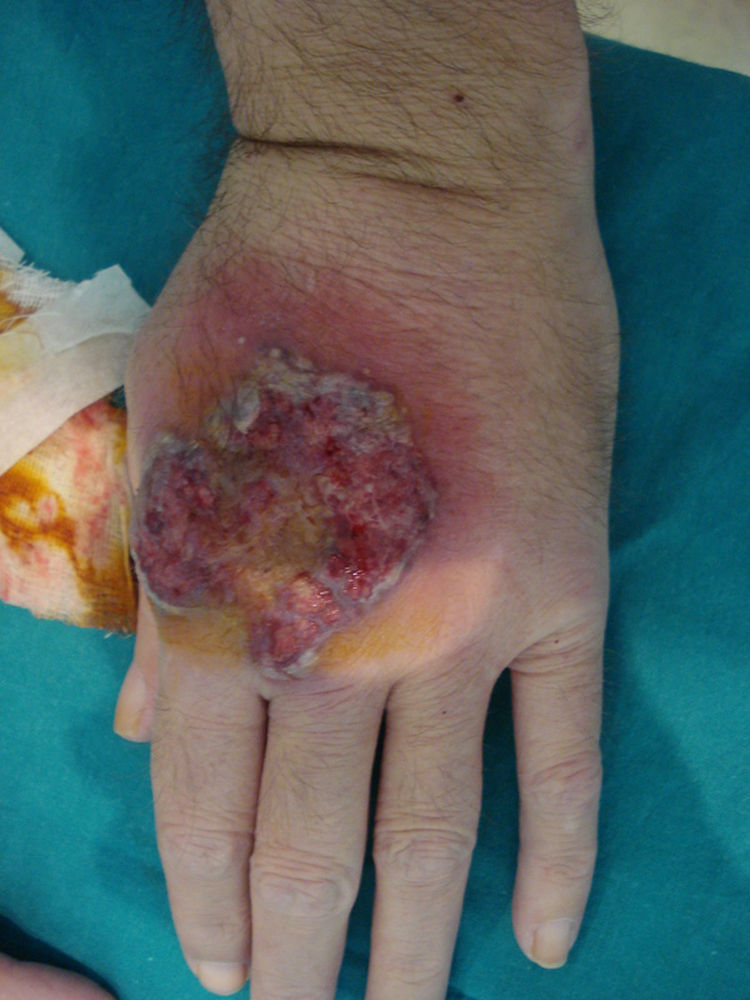
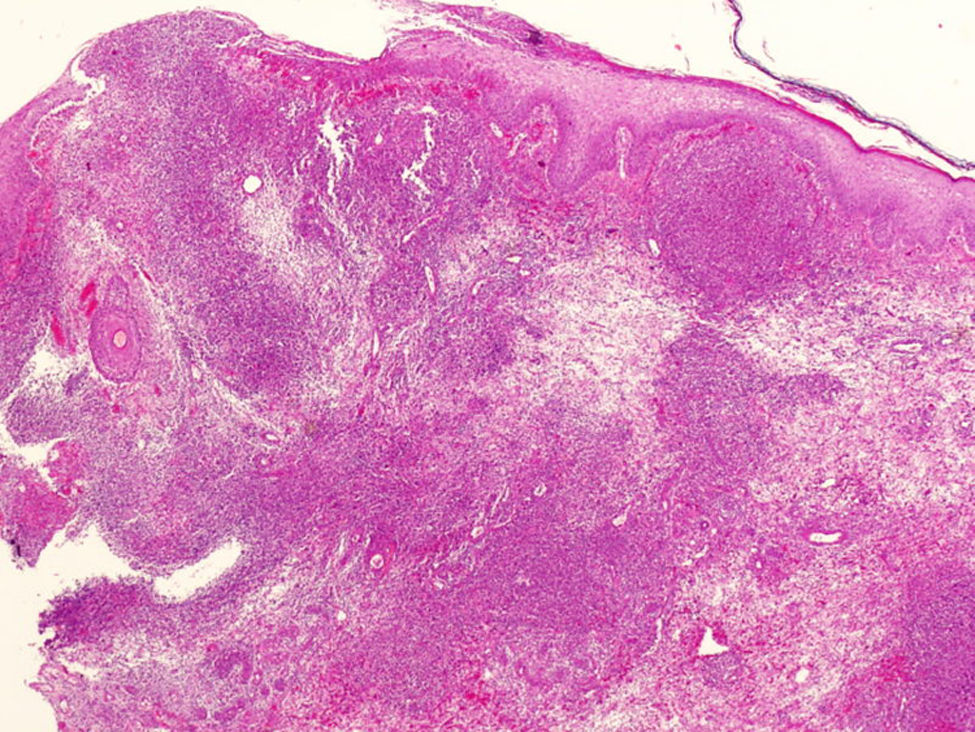
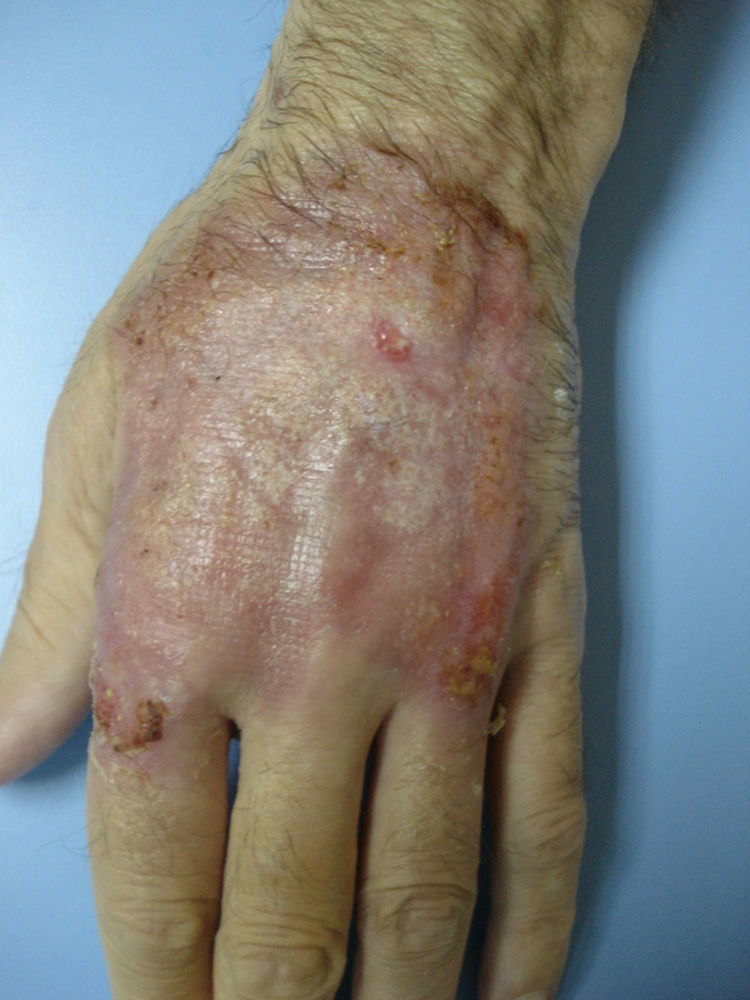
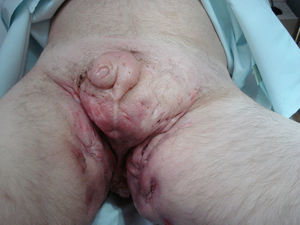
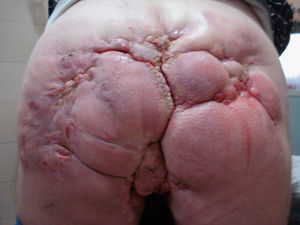
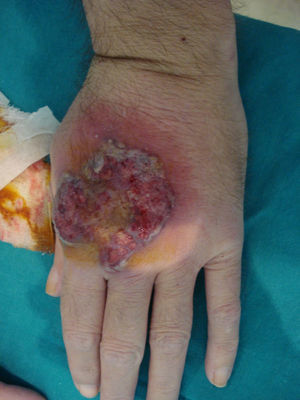
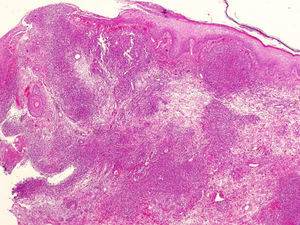
Caso clínicoDescribimos el caso clínico de un varón de 52 años, diagnosticado de H.S. hace más de 20 años. El tratamiento más requerido durante este tiempo ha sido la cirugía (sobre todo el drenaje de abcesos). Además, le han sido administrados diversos tratamientos sistémicos como retinoides orales, antibióticos, corticoides y ciclosporina, siempre con escasa respuesta terapéutica. Como secuelas de su enfermedad presenta lesiones cicatriciales muy desfigurantes en áreas glútea, inguinal y genital (figs. 1 y 2). Tras un periodo de 2 años de tratamiento con infliximab se pudo objetivar una discreta mejoría, con disminución del número y de la gravedad de los brotes inflamatorios. Aún así, el tratamiento se suspendió tras la aparición de lesiones pustulosas en miembros inferiores que curaron con la instauración de tratamiento antibiótico sistémico. Nueve meses después, inició un cuadro de lesiones pustulosas en antebrazo izquierdo junto a una úlcera profunda, exudativa y muy dolorosa en dorso de mano derecha (fig. 3). Ante la sospecha de una infección cutánea, se tomó muestra de exudado para cultivo y se administró antibioterapia sistémica. Al no obtener respuesta clínica, se realizó una biopsia del borde de la úlcera. En el estudio histológico se observó un infiltrado inflamatorio denso de predominio «neutrofílico» con formación de múltiples focos de «abcesos» que llegaban hasta dermis profunda (fig. 4). El cultivo resultó negativo. La correlación clínico-histológica del cuadro estableció el diagnóstico de P.G.
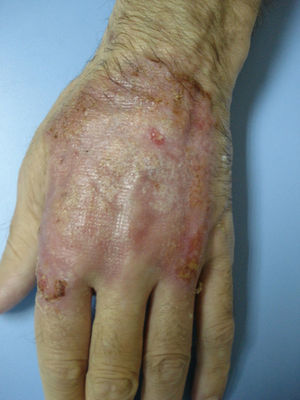
Se realizó un estudio de extensión que descartó la existencia de enfermedad inflamatoria intestinal y de neoplasia oculta. Se administró ciclosporina oral a dosis de 250mg al día y se pautó tacrolimus tópico. De esta manera se obtuvo mejoría de las lesiones y cicatrización de la úlcera en un plazo de dos meses tras los que se retiró la medicación (fig. 5). Desde entonces no ha vuelto a presentar nuevas lesiones de P.G. aunque sí continúa con brotes de H.S. que dan lugar a la formación de nuevos trayectos fistulosos en áreas glútea y genital.
DiscusiónEn 1930, Brunsting et al describieron 5 pacientes con lesiones que fueron agrupadas bajo el término de pioderma gangrenoso1. Desde entonces han sido numerosas las publicaciones que han documentado la asociación de P.G. con distintas enfermedades sistémicas2. Sin embargo, la asociación de P.G. con H.S. es un hecho infrecuente. La serie más larga descrita hasta la fecha consta de 6 pacientes y fue recogida por Ah-Weng et al4. Se trataba de pacientes con historia de H.S. de larga evolución (de 18 a 30 años). Destacaba una paciente que había desarrollado lesiones de P.G. sobre cicatrices previas de antiguos brotes de hidrosadenitis. Las lesiones se localizaban en axilas e ingles, simulando una exacerbación de H.S., hecho que podría haber llevado a la confusión o al error diagnóstico. Entre las patologías concomitantes, el acné vulgar grave aparecía en el 50% de los pacientes durante la adolescencia. Aunque esta asociación es comunicada en pocas ocasiones, sin embargo existen largas series descritas que lo relacionan con otras entidades. Powell et al recogieron 86 pacientes con P.G. y buscaron una patología sistémica subyacente, hallando en un 36% de los pacientes una enfermedad inflamatoria intestinal, en un 37% una artritis, y en un 10% una gammapatía monoclonal2. De esta serie destacan 4 pacientes (5%) en los que el P.G. se asociaba a una H.S.2. En otra revisión realizada de similares características, también se halló un paciente con P.G. en el contexto de una H.S.5.
Rosner et al intentaron relacionar en 10 pacientes la presencia de espondiloartropatía con H.S. y acné vulgar y hallaron el caso de un paciente que además tenía clínica de P.G.6. En otro caso publicado en el que se planteaba el tratamiento con colchicina en la enfermedad de Behçet, se pudo observar que entre las patologías concomitantes existía un P.G. y una H.S.7 En la tabla 1 se resumen las características de los 16 pacientes publicados con P.G. asociado a H.S.
Resumen de pacientes recogidos en la literatura con P.G. asociado a H.S.
| Ref D | N.o Pacientes | Edad/sexo | Años de evolución H.S. | Pioderma gangrenoso | Enfermedades concomitantes | |||
| Duración | Localización | Tipo | Tratamiento dosis/día | |||||
| García-Rabasco et al | 1 | 52 | 25 | 2 meses | Antebrazo izquierdo | Ulcerativo | Ciclosporina 250mg/día | Anemia ferropénica |
| Dorso mano derecha | Leucocitosis reactiva | |||||||
| Ah-Weng et al4 | 6 | 45/F | 22 | 2 años | Cuello/axilas | Ulcerativo | Prednisona 40mg/día | Lupus Eritematoso Sistémico |
| Azatioprina 150mg/día | Glomerulonefritis | |||||||
| Inminoglobulina iv 2mg/kg/mes | ||||||||
| Ciclofosfamida i.v 500mg/3 veces/semana | ||||||||
| Hidroxicloroquina 200mg/día | ||||||||
| 42/M | 20 | 6 años | Muslos/abdomen | Superficial | Ciclosporina 5mg/kg/día | Acné vulgar grave | ||
| Trimetoprim 200mg/día | ||||||||
| 51/M | 30 | 1 semana | Dorso de manos | Ulcerativo | Prednisona 60mg/día | Acné vulgar grave | ||
| 35/F | 18 | 3 años | Piernas | Ulcerativo | Prednisona 12,5mg/día | – | ||
| Ciclosporina 4,5mg/kg/día | ||||||||
| 57/F | 25 | 1 mes | Axilas/ingles | Superficial | Prednisona 30mg/día | Anemia ferropénica | ||
| 44/M | 20 | 4 meses | Piernas | Ulcerativo | Minociclina 200mg/día | Acné vulgar grave | ||
| Dapsona 100mg/día | ||||||||
| Ciclosporina 4mg/kg/día | ||||||||
| Von den Driesch5 | 1 | – | – | Axilas/ingles | Superficial | Corticoides orales | – | |
| Shenefelt3 | 1 | 42/M | 12 | 3 meses | Piernas | Ulcerativo | Prednisona 30mg/día | Acné quístico |
| Triamcinolona intralesional | Artritis seronegativa | |||||||
| Sulfasalazina 500mg/8h | ||||||||
| Minociclina 100mg/12horas | ||||||||
| Buckley et al13 | 1 | 48/M | 8 | 4 meses | Pierna derecha | Ulcerativo | Minociclina Ciclosporina 4,5mg/kg/día | |
| Powell FC et al2 | 4 | – | – | – | – | – | – | – |
| Rosner et al6 | 1 | 24/M | – | – | – | – | – | Acné conglobata |
| Espondiloartritis | ||||||||
| Raynor et al7 | 1 | 33/F | <1 | 1mes | Piernas | Bulloso | Colchicina 0,6mg/12h | Enfermedad de Behçet |
H.S: hidrosadenitis supurativa; P.G: pioderma gangrenoso.
En los casos descritos en los que aparece P.G. asociado a H.S., se ha observado una evolución totalmente independiente de ambas entidades, sin observar actividad inflamatoria paralela ni respuesta común a los fármacos administrados. Normalmente la clínica de P.G. aparece cuando la H.S. tiene más de 20 años de evolución4. En el caso de nuestro paciente el P.G. apareció en el contexto de una H.S. de estas características; por el momento solo ha presentado un brote inflamatorio de P.G. que se ha resuelto totalmente tras tratamiento inmunosupresor con ciclosporina oral. A pesar de haber intentado establecer una asociación entre ambas patologías, no hemos observado paralelismo en la actividad inflamatoria ni en la respuesta al tratamiento recibido.
Tampoco ha sido posible establecer relación de tipo causal. La inflamación de las glándulas apocrinas da lugar a brotes repetidos de H.S. en forma de abcesos y fístulas que curan dejando importantes cicatrices8. La etiopatogenia de esta entidad es incierta y el agente o agentes etiológicos que provocan su inicio y su cronicidad son desconocidos. Se ha postulado que podría existir cierta predisposición genética; además, en ocasiones se ha visto un perfil hormonal anormal en estos pacientes9. Se sabe que existe una base inmunológica que está alterada, ello estaría provocado por la existencia de neutrófilos disfuncionales que son incapaces de impedir la inflamación apocrina y perpetúan la clínica de H.S.10.
Por otro lado y de igual forma, la patogenia del P.G. permanece desconocida. Se ha observado un depósito de inmunoglobulinas y de complemento en el endotelio de los vasos que podría sugerir un daño vasculítico en algunos casos de P.G.11. Además no se ha podido obtener ningún dato que sugiera una etiología bacteriana, fúngica o vírica. Las úlceras presentes son asépticas y en el estudio histopatológico sólo se observan focos de material purulento con neutrófilos en periferia sin agente infeccioso o reactivo aparente.
El único nexo en común que podría explicar la asociación entre P.G. y H.S. es la disrregulación de los neutrófilos presente en ambas patologías. Esta alteración se manifiesta con defectos en la quimiotaxis, en la fagocitosis y en la producción de linfocina12.
El tratamiento del P.G. varía en función del número de lesiones existentes, de su evolución y de la sintomatología que provoquen. En ocasiones el P.G. asociado a H.S. puede ser resistente al tratamiento convencional; en uno de los casos publicados, el P.G. supuso un problema en el manejo de un paciente con una H.S., un acné noduloquístico y una artritis seronegativa, consiguiendo mejoría global tras la administración conjunta de sulfasalazina y minociclina3. En otro caso en el que se administró ciclosporina oral, se obtuvo una mejoría tanto de las lesiones de P.G. como de las de H.S.13.
Los casos hasta ahora publicados son escasos, aunque podría ocurrir que la asociación entre P.G. y H.S. estuviera infradiagnosticada. El haber observado casos de P.G. sobre cicatrices de H.S. nos hace sospechar que algunas de estas lesiones podrían quedar ocultas por brotes de H.S. El hecho de que ambas patologías se manifiesten con formación de abcesos y lesiones inflamatorias hace suponer que esta asociación no es infrecuente. El acné noduloquístico es una patología que también se ha visto relacionada a éstas estrechamente y parece que forma parte del espectro de enfermedades inflamatorias que evolucionan en brotes, como el P.G. y la H.S. Por ello consideramos que esta asociación no sería un hallazgo casual ya que nos encontramos ante dos entidades que comparten ciertos mecanismos patogénicos y algunos rasgos clínicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.