La psoriasis es un proceso inflamatorio crónico que se ha asociado con múltiples comorbilidades, especialmente las formas más graves y asociadas a artritis. El estado de inflamación sistémica es, probablemente, la conexión entre todas estas enfermedades concomitantes. Algunos trabajos recientes indican que los pacientes con psoriasis pueden tener mayor riesgo de fracturas patológicas y osteoporosis. Las guías actuales de abordaje de las comorbilidades de la psoriasis no incluyen valoración de la salud del hueso. Por eso, en este artículo nos proponemos revisar la evidencia disponible sobre la relación entre psoriasis y osteoporosis. Repasaremos primero el concepto de osteoporosis, abordaremos también el papel de la vitaminaD en el hueso y, por último, proponemos un algoritmo de manejo y tratamiento de la osteoporosis en el paciente con psoriasis.
Psoriasis is a chronic inflammatory disease associated with multiple comorbidities, particularly in patients with arthritis or more severe forms of the disease. The link between all these comorbidities is probably systemic inflammation. Several recent studies have indicated that patients with psoriasis may be at an increased risk of pathologic fractures and osteoporosis. Current guidelines on comorbidities in psoriasis do not recommend assessment of bone health. In this article, we review the available evidence on the association between psoriasis and osteoporosis. We first examine the concept of osteoporosis and the role of vitaminD in bone health and then propose an algorithm for managing and treating this condition in patients with psoriasis.
La psoriasis es una enfermedad inflamatoria cutánea caracterizada por placas eritematosas y descamativas, crónica y recurrente, que afecta al 0,1-2,9% de la población mundial1,2; en España, la prevalencia estimada es del 2,3%3. Entre el 7 y el 42% de los pacientes con psoriasis presentan artritis inflamatoria4. La psoriasis se ha relacionado con múltiples comorbilidades además de la artropatía, entre ellas la enfermedad cardiovascular, la hipertensión, la obesidad, la diabetes, la dislipemia y el hígado graso, así como un mayor riesgo de mortalidad5. El estado de inflamación sistémica es, probablemente, la conexión entre todas estas enfermedades concomitantes. Algunas de estas comorbilidades han sido revisadas en anteriores artículos6-8.
Recientemente otras entidades, como la osteoporosis (OP), están siendo consideradas entre las comorbilidades de la psoriasis9. Algunos trabajos indican que los pacientes con psoriasis pueden tener mayor riesgo de fracturas patológicas10,11, al igual que sucede en otras enfermedades inflamatorias, como la artritis reumatoide (AR) y la dermatitis atópica, en donde se ha descrito una incidencia de OP 4,72 veces mayor que en individuos sin ella12. Tres mecanismos potenciales explicarían la relación entre las enfermedades inflamatorias y una pérdida acelerada de hueso: primero por el efecto directo de algunas citocinas y moléculas proinflamatorias en el hueso, que acelerarían la pérdida ósea (como la IL-1, la IL-6, la IL-11, la IL-15, la IL-17, el RANKL y el TNF-α)13; en segundo lugar, algunos tratamientos empleados en las enfermedades inflamatorias pueden contribuir a la pérdida de hueso, como los corticoides, especialmente cuando se usan de forma sistémica12, y en tercer lugar, la inmovilidad y la falta de ejercicio (que pueden tener los pacientes con enfermedades musculoesqueléticas crónicas) también aumentan la resorción ósea.
Las guías actuales de abordaje de las comorbilidades de la psoriasis no incluyen la salud del hueso14,15. Por eso, en este artículo nos proponemos revisar la evidencia disponible sobre la relación entre psoriasis y OP. Para introducir el tema, repasaremos primero el concepto de OP, también el papel de la vitaminaD en el hueso y, por último, proponemos un algoritmo de manejo y de tratamiento de la OP en el paciente con psoriasis.
OsteoporosisConceptoLa OP se define como una enfermedad generalizada del esqueleto que se caracteriza por una baja masa ósea y una alteración de la microarquitectura que condicionan un incremento de la fragilidad del hueso y, por lo tanto, un aumento del riesgo de fracturas. La repercusión que estas tienen en términos de calidad de vida, morbimortalidad, así como el impacto socioeconómico que suponen, hace importante realizar intervenciones dirigidas a su prevención. Por todo ello, la OP debe considerarse en la actualidad como un verdadero problema de salud pública16.
El concepto actual de OP, entendida como una alteración de la resistencia ósea, ha trascendido el mero aspecto cuantitativo de la densidad mineral ósea (DMO) y engloba aspectos también cualitativos o de calidad ósea. La DMO se puede medir con la densitometría, y aunque la DMO se asocia estrechamente con la presencia de fracturas, ya que el riesgo de fractura se duplica por cada disminución de una desviación estándar (DE) de la DMO medida por absorciometría fotónica dual de rayosX (DEXA), actualmente se considera un factor de riesgo más que, junto a otros factores clínicos, nos ayuda a valorar el riesgo de fractura que presenta un paciente, siendo la prevención de la fractura el objetivo final de nuestra actitud clínica.
Densitometría óseaLa Organización Mundial de la Salud (OMS)17 estableció en 1994 una clasificación de la DMO para el diagnóstico de la OP en mujeres posmenopáusicas, en la que se establecen 4 categorías según los resultados de la densitometría por DEXA de columna lumbar o cuello femoral (tabla 1). La escala utilizada para la medición de la masa ósea (escala T-score) implica una comparación entre la masa ósea individual y la de mujeres sanas jóvenes (30-35años), contrapuesta a la Z-score, en la que la comparación se establece con la media de la masa ósea de mujeres de la misma edad.
Categorías diagnósticas de osteoporosis (OMS 1994)
| Categoría | Definición | Valor predictivo de fractura |
|---|---|---|
| Normal | T-score entre +1 y 1 | Bajo riesgo de fractura |
| Osteopenia | T-score entre −1 y −2,5 | Moderado riesgo de fractura |
| Osteoporosis | T-score < 2,5 | Alto riesgo de fractura |
| Osteoporosis severa | T-score < 1,5 más fracturas |
Estos criterios no son aplicables en mujeres premenopáusicas y en hombres de menos de 50años, ya que la relación entre la disminución de la DMO y el riesgo de fractura está menos definida en estas poblaciones que en las mujeres posmenopáusicas, por lo que debería utilizarse la Z-score, considerándose que una disminución de −2,0DE se encuentra por debajo del rango esperado para su edad18.
Sin embargo, los estudios ponen de manifiesto que aproximadamente la mitad de las fracturas de cadera se producen en mujeres sin OP densitométrica19, por lo que una de las limitaciones de la densitometría es su baja sensibilidad para identificar a los sujetos que sufrirán una fractura.
Factores de riesgo clínicos de osteoporosisA la densitometría solo se le puede atribuir menos de un tercio de la predicción del riesgo de fractura. La edad y los factores de riesgo clínicos son importantes en la predicción de fracturas. Cuanto mayor sea el número de factores de riesgo en un mismo individuo, mayor es el riesgo futuro de sufrir una fractura.
Los factores de riesgo clínicos que se han mostrado más consistentes entre los diferentes estudios20 en su asociación con el riesgo de fractura son:
- -
Edad avanzada (RR>2): es uno de los principales factores para el desarrollo de fractura. La edad influye además en la trascendencia de la disminución de la masa ósea: en edades más jóvenes (50-60años) el descenso de la DMO supone mucho menor riesgo de fractura que en edades más avanzadas.
- -
Antecedente familiar (padres y hermanos) de fractura de cadera (RR>2).
- -
Antecedente personal de fractura previa (periférica y/o vertebral) después de los 50años (RR>2). Incluye la fractura vertebral radiológica o morfométrica.
- -
Índice de masa corporal ≤19 (RR>2).
- -
Sexo femenino (RR>1 y >2).
- -
Tabaquismo (RR> 1 y> 2).
- -
Alcohol (consumo diario ≥30g/dl) (RR> 1 y >2).
Otros factores de riesgo clínicos relevantes e incluidos en las escalas de riesgo se relacionan con la toma de medicamentos (p.ej., corticoides, anticomiciales…) o con la presencia de enfermedades que pueden producir OP secundaria (p.ej., AR, diabetes tipo1, anorexia nerviosa, hipogonadismo...).
Más factores asociados al desarrollo de fracturas por tener un mayor riesgo de caídas son la inestabilidad postural, el haber sufrido dos o más caídas durante el último año, la incapacidad para levantarse de una silla y la pérdida de capacidad visual.
Radiografía convencionalLa radiografía convencional no ha demostrado ser un método sensible ni específico para valorar los cambios de masa ósea. Es necesaria para la comprobación de la presencia de fracturas. Suele ser suficiente practicar un estudio lateral de columna dorsal (centrado en D7) y de columna lumbar (centrado en L2), aunque puede ser conveniente en algunas ocasiones disponer de una radiografía en proyección anteroposterior.
La práctica de una radiografía convencional se contemplará en los pacientes que presenten dolor raquídeo, en los que exista una disminución de la talla (pérdida documentada de 2cm en la estatura o de 4-6cm en la talla recordada en la juventud) y en los que presentan valores densitométricos de OP (índice score T <−2,5T), porque con frecuencia las fracturas vertebrales son asintomáticas y pueden haber pasado desapercibidas al paciente; la detección de su presencia es importante tanto para el seguimiento del enfermo como para la valoración precisa de su riesgo de sufrir fracturas sucesivas.
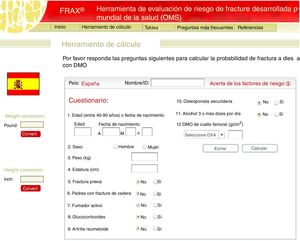
Valoración del riesgo de fracturaHace más de una década la densitometría definía en la práctica clínica la enfermedad osteoporótica y se usaba para la toma de decisiones en la prevención de las fracturas osteoporóticas. Hoy se recomienda la valoración del riesgo de fractura. Se han desarrollado diferentes escalas de valoración del riesgo. Suponen una ayuda imprescindible para la toma de decisiones clínicas, estiman el riesgo absoluto de fractura en los siguientes años (habitualmente se considera el riesgo a 10años), a partir de la edad y de los factores de riesgo clínicos que han demostrado más consistencia. Se han desarrollado distintos modelos para la valoración de la probabilidad de presentar una fractura basados en la combinación de varios factores de riesgo independientes. Uno de los más empleados es el modelo FRAX®, muy difundido a nivel internacional. Introducido en 2008 por un grupo de expertos liderados por Kanis21 y auspiciado por la OMS, es un algoritmo para el cálculo del riesgo de fractura accesible a través de internet y dirigido a determinar el riesgo absoluto a 10años de fractura de cadera y de fractura osteoporótica clínica mayor (vertebral clínica, antebrazo, húmero proximal) en los pacientes de entre 40 y 90años en función de la presencia o no de los factores de riesgo más predictivos de fractura, sin/con inclusión de la DMO y específico por país (fig. 1). En la población general, la evaluación del riesgo por encima de un determinado umbral (>10% para fracturas mayores y/o >3% para fractura de cadera, según países y autores) aconsejaría una intervención terapéutica activa. Dado que FRAX parece infraestimar el riesgo de fractura en la cohorte española22, nuevos estudios han reevaluado su utilidad en nuestra población23, proponiéndose ahora tratamiento en pacientes con >7,5% de riesgo de fractura osteoporótica mayor a 10años y con >3% de riesgo para fractura de cadera.
Sin embargo, hay que tener en cuenta que es una herramienta orientativa, dado que tiene importantes limitaciones, no tiene en cuenta el número de fracturas previas ni la dosis de corticoides, no diferencia fractura vertebral de otras fracturas y no valora caídas. Además, no ha sido estudiada de manera específica en pacientes con psoriasis.
Osteoporosis y psoriasisMecanismos patogénicos que relacionan psoriasis y osteoporosisEn condiciones fisiológicas existe un equilibrio entre la formación y la resorción ósea necesario para la homeostasis esquelética. En situaciones patológicas este equilibrio se altera a favor de la resorción ósea mediada por osteoclastos. La activación metabólica de los osteoclastos para potenciar la capacidad de reabsorción ósea requiere mecanismos de señalización complejos entre células de linaje osteoclástico, células mesenquimales y linfocitos24,25. Estas interacciones son controladas por varias citocinas y por el ligando del activador del receptor del factor nuclear-κB (NF-κB) conocido como RANKL. El RANKL es producido por diversas células, incluyendo algunas del sistema inmunitario, células de la pared vascular y osteoblastos. Este factor pertenece a la familia del factor de necrosis tumoral (FNT). Cuando se fija a su receptor (RANK), presente en la membrana de los precursores osteoclásticos, induce una serie de señales que promueven la diferenciación de estos y la formación de osteoclastos25. Además de RANKL, los osteoblastos producen osteoprotegerina (OPG), que es un inhibidor del RANKL. Se trata de una proteína soluble que se fija al RANKL e impide la interacción de este con su receptor RANK. Este sistema OPG-RANKL es esencial en el proceso conocido como osteoclastogénesis.
En situaciones de inflamación, las célulasT producen RANKL que estimula la resorción ósea mediada por osteoclastos. Las citocinas de IL-1 y FNT pueden aumentar los efectos de RANKL, favoreciendo la resorción ósea mediante la estimulación directa de precursores de osteoclastos y osteoclastos maduros. También se sabe que algunas citocinas proinflamatorias, como la IL-17, se asocian a resorción ósea osteoclástica en otras enfermedades inflamatorias como la AR13.
El FNT actúa como estimulador de la osteoclastogénesis a través de la expresión de una serie de factores de transcripción como el NF-κB, que es crítico para la osteoclastogénesis. El efecto del FNT en otras células óseas, como osteoblastos y osteocitos, es menos conocido. En modelos de AR se ha descrito una disminución de la actividad osteoblástica mediante la inhibición de la vía de señalización Wnt/b-catenina26.
Los mecanismos humorales y celulares propuestos para explicar la pérdida ósea tienen nexos comunes con la patogenia de la psoriasis. El FNT y la IL-17 son citocinas relevantes en la patogenia de la psoriasis (al igual que en la OP), y se revelan como posibles dianas terapéuticas sobre las que poder actuar para suprimir la hiperreactividad del sistema inmune y restaurar el equilibrio entre la resorción y la formación ósea. Tratamientos que controlan la inflamación articular muestran efectos beneficiosos sobre el remodelado óseo sistémico en pacientes con AR tratados con anti-FNT, que se traduce en un aumento de la DMO medida por DEXA27,28.
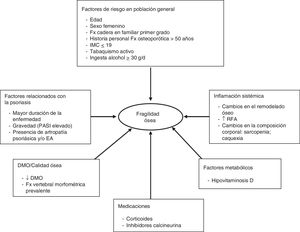
Factores de riesgo óseo relacionados con la psoriasisSe han descrito otros factores de riesgo de OP y de fractura de trascendencia en el paciente con psoriasis cutánea, como son la duración, la actividad y la extensión de la enfermedad cutánea (psoriasis moderada-severa)10,29,30 y la presencia de artropatía psoriásica (APs)10,31-35 y/o espondilitis anquilosante (EA)36. Los cambios que ocurren en las articulaciones de los enfermos con APs son debidos a una sinovitis inflamatoria. La artritis psoriásica es primariamente una entesitis. Posteriormente la afectación se extiende a los tejidos perientesiales para hacer una sinovitis, una osteítis… Una de las características principales de las artritis inflamatorias crónicas es la de destruir cartílago y hueso, lo que se asocia a OP sistémica y mayor susceptibilidad de padecer fracturas por fragilidad37. También en la EA se ha encontrado una masa ósea baja, sobre todo en hombres, de etiología no suficientemente aclarada38. La OP también puede ocurrir debido a la inactividad física y a la disminución de la movilidad de la columna relacionada con el dolor, la rigidez y la anquilosis39.
En la psoriasis ambos sexos presentan alta prevalencia de OP y fracturas; algunos estudios, al contrario de lo que ocurre en la población general, encuentran una mayor prevalencia en varones con psoriasis11,34,40. En un trabajo en población española41, los pacientes con psoriasis mostraron valores significativamente más bajos de DMO en columna y cadera que los controles. Otro de los trabajos encuentra disminución de la DMO solo en los pacientes con APs, no en los pacientes con psoriasis, si bien el Psoriasis Area and Severity Index (PASI) medio era de 7,8 y la duración de la enfermedad era menor que los pacientes con APs42. En algunos estudios objetivan niveles séricos de vitaminaD significativamente más bajos en pacientes con psoriasis y OP, y se considera también un factor de riesgo en esta población43. La importancia de la vitaminaD en la psoriasis se analiza con más detalle en otro apartado de esta revisión.
En la figura 2 se exponen los diferentes factores que pueden contribuir a la fragilidad ósea en los pacientes con psoriasis.
En la tabla 2 se muestra un resumen de los estudios sobre OP y psoriasis.
Estudios sobre psoriasis y osteopenia/osteoporosis
| n | Osteopenia | Osteoporosis | Resultados | |
|---|---|---|---|---|
| Borman et al.31 | 47Con APs | 27,5%50% | 5% | A >duración de la APs <DMO de columna lumbar y femoral |
| Attia et al.32 | 50 | Los pacientes con APs, más OP.A>n.° de articulaciones afectas> riesgo de OP | ||
| Balato et al.34 | 10226 con APs | 24%46% | 5%17% | Más osteopenia en varones |
| D’Epiro et al.29 | 4319 con APs | Duración>de la psoriasis en los pacientes con OPN/OP | ||
| Keller et al.30 | 17.507 OP52.571 controles | OR psoriasis 1,65 (IC95%: 1,42-1,94)OR psoriasis grave 1,96 (IC95%: 1,37-2,81) | Población Taiwán | |
| Chandran et al.33 | Revisión sistemática 21 estudiosAPs | Prevalencia 1,4% al 68,8% | Edad, sexo femenino, posmenopausia, duración de la artritis, presencia de erosiones y dosis acumulada de esteroides se asocian a <DMO | |
| Solak et al.43 | 43 psoriasis vs 41 controles | 44,4% | 18,5% | >% de OPN y OP en psoriasisLas mujeres con OP tenían niveles de vitaminaD más bajos |
| Dreiher et al.40 | 7.936 psoriasis vs 14.835 controles | Varones 3,1 vs 1,7%, p<0,001, OR 1,86 (IC95%: 1,44-2,39)Mujeres 22,3 vs 20,2%, p=0,008, OR 1,13 (IC95%: 1,03-1,25) | Ajustando factores de confusión, la psoriasis se asoció significativamente a OP en varones, OR ajustado 1,70 (IC95%: 1,31-2,19), p<0,001) | |
| Kathuria et al.36 | 183.725 psoriasis 28.765 APs | OR 2,86 (IC95%: 2,70-3,02) | OR 2,97 (IC95%: 2,89-3,06) | |
| Martinez-Lopez et al.41 | 57 psoriasis vs 61 controles | Niveles bajos de DMO | La edad factor de riesgo, el alto IMC factor protector |
APs: artritis psoriásica; DMO: densidad mineral ósea; IMC: índice de masa corporal; OP: osteoporosis; OPN: osteopenia; OR: odds ratio.
Respecto a las fracturas, principal consecuencia de la OP, existen muy pocos estudios en pacientes con psoriasis y los resultados son contradictorios10,11,35,36,44. Solo uno de los trabajos no encuentra una clara asociación entre psoriasis y riesgo de fractura y OP; como limitaciones, el diagnóstico de psoriasis es autorreportado y no recoge la gravedad de la psoriasis; los propios autores señalan que no pueden excluir que ciertos subgrupos de psoriasis, como los más graves, las psoriasis de comienzo precoz o la APs, puedan estar asociados a un mayor riesgo44. En la tabla 3 se presenta un resumen de los estudios sobre fracturas patológicas y psoriasis.
Estudios sobre psoriasis y riesgo de fracturas
| n | Fracturas | Resultados | |
|---|---|---|---|
| Pedreira et al.35 | 52 mujeres con psoriasis45 mujeres con APs98 controles | Mayor riesgo en psoriasis y APs | Caídas recurrentes y una mayor duración de la enfermedad aumentaron el riesgo de fractura |
| Ogdie et al.10 | Psoriasis 158.323APs 9.788Controles 821.834 | Psoriasis leve aHR 1,07 (1,05-1,10)Psoriasis grave aHR 1,26 (1,15- 1,39)APs aHR 1,26 (1,06-1,27) | Población Reino Unido |
| Kathuria et al.36 | 183.725 psoriasis28.765 con APs | Psoriasis: fracturas vertebrales (1,17; 1,09-1,25), pélvicas (1,18; 1,06-1,31), femorales (1,68; 1,60-1,78) y tibiales/fibulares (1,28; 1,16-1,41)APs: fracturas de estrés (2,87; 1,08-7,64), vertebrales (1,45; 1,24-1,70), pélvicas (1,75; 1,41-2,18), femorales (2,07; 1,85-2,32) y tibiales/fibulares (1,60; 1,28-2,01) | Población EE.UU. |
| Modalsli et al.44 | 2.804 psoriasis autorreportada | HR ajustada por edad y sexo 1,03 (IC95%: 0,82-1,31) | No aumento de riesgo de fractura ni OP (población Noruega) |
| Paskins et al.11 | 24.219 psoriasis (802 grave)1.008 APs94.820 controles | Psoriasis: HR 1,10 (IC95%: 1,04-1,16)/aHR 1,14 (IC95%: 1,08-1,21)APs: HR 1,26 (0,95-1,65)/aHR 1,62 (1,20-2,18) | Mayor riesgo en hombres que en mujeres y parece que mayor en pacientes con APsEl uso de metotrexato no se asoció a mayor riesgo (HR0,91; IC95%: 0,72-1,15) |
aHR: hazard ratio ajustado; APs: artritis psoriásica; DMO: densidad mineral ósea; HR: hazard ratio; OP: osteoporosis.
Otros factores relacionados con la asociación entre psoriasis y OP son los fármacos que se utilizan para el tratamiento de la enfermedad (glucocorticoides, metotrexato o ciclosporina) y que pueden afectar a la densidad ósea. Los que más influyen serían los glucocorticoides orales cuando son empleados en periodos de tiempo prolongados (durante más de 3meses en una dosis equivalente de 5mg/día de prednisona o superior).
Los efectos óseos negativos de los corticoides sistémicos son bien conocidos. El uso continuado con altas dosis acumuladas de corticoides tópicos podría ser un factor de riesgo para OP en los pacientes con psoriasis. Se han publicado casos de múltiples fracturas óseas por el uso continuado de corticoides tópicos en la psoriasis45. Sin embargo, Haeck et al.46 no encontraron asociación significativa entre disminución de DMO y el uso de corticoides tópicos y sistémicos en pacientes con dermatitis atópica.
La asociación de los retinoides con alteraciones radiológicas óseas no ha podido demostrarse. La prevalencia de hiperostosis vertebral difusa, calcificaciones ligamentosas y OP en la población anciana que no usa fármacos retinoides hace difícil la interpretación de estos hallazgos. Aunque puede existir una relación entre el uso de estos fármacos y las alteraciones esqueléticas, parece que afectan a un número limitado de pacientes después de un uso prolongado y cursan generalmente de manera asintomática47.
El efecto del metotrexato (Mtx) en la DMO ha sido poco estudiado. En pacientes con AR el uso de bajas dosis de Mtx no se asoció a los 3años de seguimiento con pérdida ósea en la columna lumbar ni en la cadera. Sin embargo, en pacientes que estaban tratados también con prednisona (>5g/día) el Mtx se asoció con una mayor pérdida ósea en la columna lumbar, sugiriendo un efecto adicional en la pérdida ósea esperada por el efecto del corticoide48. Uehara et al.49 han mostrado en un estudio realizado in vitro que el Mtx dificulta la formación ósea inhibiendo la diferenciación de precursores osteoblásticos. A pesar de ello, el efecto terapéutico controlando la actividad de la inflamación sistémica de la enfermedad compensaría su posible efecto deletéreo óseo. Estudios recientes no han encontrado un mayor riesgo de fractura en los pacientes con psoriasis tratados con Mtx comparado con otros pacientes con psoriasis que no habían recibido este fármaco11.
Los fármacos inhibidores de la calcineurina (ciclosporina, tacrolimus) podrían interferir con la diferenciación osteoblástica al inhibir la vía de señalización de la calcineurina-NFAT. Los diferentes estudios realizados in vitro muestran resultados contradictorios en sus efectos óseos. En conjunto, parecen estar asociados con pérdida ósea pero sus efectos en fracturas no están bien establecidos. Sin embargo, la mayoría de los estudios han sido realizados en pacientes con trasplante de órganos tratados también con corticoides, lo que dificulta obtener conclusiones definitivas50.
Como se ha mencionado previamente, los tratamientos anti-FNT han mostrado efectos beneficiosos en pacientes con AR sobre el remodelado óseo sistémico, con un aumento de la DMO medida por DEXA, debido al control de la inflamación crónica y a la mejoría de la actividad física27,28.
Manejo y tratamiento de la osteoporosis y del riesgo de fractura en el paciente con psoriasisNo hay guías específicas para el tratamiento de la OP en la psoriasis. Por todo lo expuesto, se aconseja una valoración ósea en pacientes de ambos sexos con psoriasis moderada-severa, con APs asociada, y en los pacientes en tratamiento crónico con corticoides orales; también, en presencia de los otros factores mencionados que se han mostrado más predictivos de riesgo de fractura en la población general, como la edad >65años y la presencia de fracturas previas. En estos pacientes los dermatólogos deberíamos valorar el riesgo de fractura mediante la evaluación de los factores de riesgo clínicos y usando calculadoras de riesgo de fractura (FRAX). La realización de una densitometría ósea y/o una radiografía dorsal y lumbar lateral que permite la detección de fracturas morfométricas prevalentes y aumenta la probabilidad de precisar un tratamiento farmacológico debe ser valorada por otros especialistas, como reumatólogos, endocrinólogos y, como siempre, el médico de atención primaria.
El control de la enfermedad para minimizar la pérdida ósea asociada a la inflamación sistémica y el mantenimiento de la mínima duración y dosis posible de glucocorticoides son medidas esenciales. En los pacientes en tratamiento crónico con corticoides deben seguirse las guías publicadas para la prevención y tratamiento de la OP inducida por glucocorticoides51.
El objetivo fundamental del tratamiento de la OP es la disminución del riesgo de fractura. La estrategia terapéutica comprenderá medidas farmacológicas encaminadas fundamentalmente a incrementar la resistencia ósea y las medidas no farmacológicas, con el objetivo de mantener en lo posible un buen estado de salud, disminuir el riesgo de caídas y minimizar sus consecuencias.
Llevar hábitos de vida saludables constituye la primera opción para prevenir la OP.
- -
Fomentar la actividad física puede mejorar la agilidad, la fuerza, la postura y el balance muscular, y reducir el riesgo de caídas.
- -
Cubrir las necesidades nutritivas con una dieta saludable que incluya una ingesta adecuada de calcio (1.000-1.200mg/día).
- -
La luz solar como fuente de vitaminaD. Es importante garantizar una exposición solar diaria en manos, cara y brazos al menos durante 10 a 15min al día. Las recomendaciones sobre exposición solar deben valorar el potencial riesgo de lesiones dermatológicas, teniendo en cuenta que la utilización de protectores solares puede reducir la efectividad de la exposición para la síntesis de vitaminaD.En pacientes con niveles insuficientes de vitaminaD se aconseja suplementar con 800UI diarias de vitaminaD. Con esta dosis se consiguen niveles entre 20-40ng/ml en población caucásica adulta y ancianos, que son los necesarios para conseguir efectos beneficiosos en salud ósea y con los que se ha descrito eficacia en la prevención de fracturas.
- -
Evitar el consumo de tabaco y alcohol.
- -
Programas de prevención de caídas.
En general, la decisión sobre cuándo administrar el tratamiento farmacológico se basa en la valoración del riesgo absoluto de fractura, y este viene muy determinado por la edad. El tratamiento intentará ser individualizado teniendo en cuenta, además, las circunstancias de cada paciente. En España, todos los fármacos antiosteoporóticos comercializados han demostrado eficacia frente a la fractura vertebral en ensayos clínicos de buena calidad metodológica, en mayor o menor grado. Algunos también han demostrado eficacia frente a fracturas no vertebrales, incluida la fractura de cadera. En general, los estudios de farmacoeconomía establecen que los fármacos antiosteoporóticos son coste-efectivos en poblaciones con factores de riesgo importantes —edad avanzada, DMO baja e historia de fractura previa—, y que los bisfosfonatos tienen el mejor perfil farmacoeconómico, por lo que, en general, se consideran los fármacos de primera elección en el tratamiento de la OP.
La intervención farmacológica se realiza con agentes terapéuticos capaces de actuar en las dos fases del remodelado óseo. Hay dos categorías principales:
- -
Fármacos antirresortivos o anticatabólicos, que inhiben la resorción ósea actuando sobre los osteoclastos o sus precursores, disminuyen la tasa de activación del remodelado óseo, incrementan la DMO y preservan la microarquitectura del hueso. En este grupo se incluyen: raloxifeno, bazedoxifeno, bisfosfonatos (alendronato, risedronato, ibandronato, zoledronato) y denosumab.
- -
Anabólicos, que al actuar sobre los osteoblastos o sus precursores producen un aumento del remodelado óseo, con un incremento de la formación de hueso en mayor medida que la resorción, lo que aumenta la masa y la resistencia del hueso. Entre los anabólicos, la única molécula comercializada actualmente es la teriparatida.
En pacientes en tratamiento con fármacos para el manejo de la OP se deben utilizar suplementos de calcio y vitaminaD, ya que los datos de eficacia procedentes de los ensayos clínicos se refieren al fármaco asociado a calcio y a la vitaminaD.
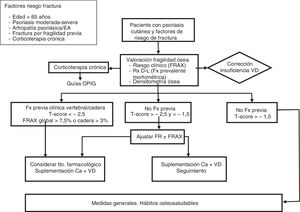
En la figura 3 se propone un algoritmo de manejo y tratamiento de la OP para el paciente con psoriasis.
Propuesta de algoritmo de manejo y tratamiento de la osteoporosis en el paciente con psoriasis.
DMO: densidad mineral ósea; EA: espondilitis anquilosante; FR: factores riesgo; Fx: fractura; IMC: índice de masa corporal; OPIG: osteoporosis inducida por glucocorticoides; Rx D-L: radiología dorsolumbar lateral.
Se argumenta que la insuficiencia de vitaminaD podría explicar el aumentado riesgo de OP en pacientes con psoriasis. En un metaanálisis reciente52 se mostró que los niveles de calcidiol sérico estaban disminuidos en pacientes con psoriasis comparados con controles sanos. Además se asociaron negativamente con la gravedad de la enfermedad establecida por el PASI. A la disminución de los niveles de vitaminaD podrían contribuir la poca exposición solar o la manera de vestir de los pacientes por ocultar las lesiones cutáneas52.
Kathuria et al.36 mostraron que la prevalencia de osteomalacia está aumentada en pacientes con psoriasis. Esta alteración de la mineralización del hueso se produce en general por una alteración del cociente Ca/P. En casi la mitad de los casos es debida a una alteración de la vitaminaD, regulador principal de la absorción del calcio. Con los ésteres del ácido fumárico que se emplean como tratamiento en la psoriasis se ha descrito un síndrome osteomalácico asociado con un aumento en la eliminación urinaria de fosfatos producido por una disfunción tubular proximal (síndrome de Fanconi). Mujeres con psoriasis tratadas de manera prolongada con fumaratos parecen especialmente susceptibles a este efecto53. La osteomalacia va a manifestarse la mayoría de las veces en forma de OP densitométrica y con presencia de fracturas de estrés atípicas.
Pero además de por sus efectos óseos, la vitaminaD adquiere un papel importante en la psoriasis por sus efectos extraóseos. La amplia distribución del receptor de la vitaminaD (VDR) y de la enzima α-1-hidroxilasa (CYP27B1), la enzima requerida para convertir el calcidiol circulante en calcitriol, capacita a numerosos tipos celulares a formar su propio calcitriol si se aseguran unos niveles circulantes adecuados de calcidiol sérico, asistiendo así a una acción/regulación de la hormonaD no solo desde un punto de vista endocrino, sino también paracrino o autocrino, que explica sus acciones no calcémicas, regulando más de 200genes que intervienen en la diferenciación y proliferación celular, en la secreción de diferentes hormonas y en la actividad inmunológica entre otras acciones54.
Las acciones de la vitaminaD sobre el sistema inmune se ejercen en numerosos eslabones de la cadena inmunológica modulando el reconocimiento de antígenos, bloqueando la coestimulación de ciertas moléculas, induciendo una regulación de las célulasT hacia líneas más supresoras, antagonizando la acción de citoquinas inflamatorias y estimulando las proinflamatorias, y modulando el tráfico de monocitos y macrófagos. A través de estas acciones inmunes regula el sistema inmune cutáneo, estimula la expresión de péptidos antimicrobianos (p.ej., catecidilina) y ejerce un papel importante en la regulación de la célula dendrítica en la inmunidad innata55.
Otra de las acciones extraesqueléticas de la vitaminaD de especial interés es su acción antiproliferativa. Con niveles séricos superiores a 30ng/ml se produce un aumento en la inducción génica por parte del calcitriol de la síntesis de proteínas con efectos inhibidores de la angiogénesis e inductores de la apoptosis de células tumorales, las denominadas proteínas p21 y p27. De esta manera la hormonaD podría regular la proliferación, la diferenciación y la apoptosis del queratinocito y regular la permeabilidad y la integridad de la barrera cutánea y podría explicar el efecto beneficioso de los análogos de la vitaminaD en el tratamiento de la psoriasis53,56.
Conclusiones- 1.
Existe una base fisiopatológica que justifica una asociación entre psoriasis y OP. La producción excesiva de citocinas proinflamatorias y la activación de la osteoclastogénesis justifican esta relación.
- 2.
Los estudios sobre afectación de la DMO y aumento del riesgo de fracturas son todavía limitados y algo contradictorios. No obstante, considerados globalmente parecen apoyar esta asociación, más consistente en pacientes con APs, psoriasis más graves o de mayor duración. El papel de otras comorbilidades y otros factores de confusión (influencia del tratamiento) está pendiente de aclarar.
- 3.
La identificación de los sujetos con alto riesgo de fragilidad ósea está justificada en los pacientes con psoriasis según la evidencia disponible. Es importante para el adecuado manejo de estos pacientes con alto riesgo de fractura la colaboración con otros especialistas, como reumatólogos, endocrinólogos y médicos de atención primaria.
- 4.
Está justificado poner en marcha estudios bien diseñados para definir esta potencial comorbilidad de la psoriasis por la repercusión de la fragilidad ósea en la morbimortalidad de la población.
Abbvie ha facilitado reuniones para los integrantes del grupo pero ninguno de sus empleados ha participado en el desarrollo y elaboración del material científico, las discusiones o el texto escrito.