Mycobacterium chelonae es una micobacteria atípica incluida entre las micobacterias de crecimiento rápido no cromógenas1. Es de distribución universal, encontrándose normalmente en fuentes de origen ambiental, como el agua y el suelo2–5. M. chelonae es una de las micobacterias que más frecuentemente producen infección cutánea en los pacientes inmunocomprometidos. En estos pacientes las lesiones pueden ser más profundas y/o diseminadas. Puede manifestarse en forma de abscesos, nódulos eritematosos y dolorosos2, foliculitis, celulitis y lesiones de distribución esporotricoide3. La mayoría de los casos son nosocomiales, generalmente en relación con procedimientos traumáticos, quirúrgicos o cosméticos, aunque en muchas ocasiones estos antecedentes pueden no ser evidentes2–5.
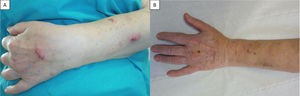
Una mujer de 70 años, con antecedentes de sarcoidosis en estadio iii en tratamiento con inhaladores de salmeterol/propionato de fluticasona y terbutalina y prednisona 10mg diarios, acudió a la consulta de dermatología por unas lesiones en el antebrazo izquierdo de un mes de evolución. La paciente no recordaba antecedente traumático previo. No refería fiebre ni otra sintomatología sistémica asociada. A la exploración física se apreciaban 2 nódulos eritematosos, infiltrados, uno en el dorso de la mano izquierda y otro en el dorso del antebrazo izquierdo, de distribución esporotricoide (fig. 1A). Ante la sospecha de una micosis profunda o de una sarcoidosis cutánea se tomó una biopsia cutánea en cuyo estudio histológico se observaba un infiltrado inflamatorio intenso en la dermis profunda, constituido por linfocitos, histiocitos y agregados de polimorfonucleares con restos celulares. Con la tinción de Ziehl-Neelsen se apreciaban unas estructuras alargadas de color rosa (fig. 2). Con el diagnóstico histopatológico de dermatitis nodular granulomatosa y supurativa de probable origen infeccioso, se realizó extracción de ADN para su estudio microbiológico por PCR que, junto con el cultivo, confirmó el diagnóstico de infección cutánea por M. chelonae. Se pautó tratamiento con claritromicina 500mg/12horas durante 4 meses, con una respuesta inicial buena. Tras finalizar el tratamiento se constató una recidiva, por lo que se realizó un estudio de sensibilidad antibiótica, siendo únicamente sensible a claritromicina, etionamida y tobramicina. Durante el seguimiento se detectó una hipogammaglobulinemia con IgG de 380mg/dl (valores normales>650mg/dl) y una linfopenia B de 30cél./ml (valor normal>100). Revisando su historia tenía antecedentes de infecciones respiratorias y bronquiectasias, lo que llevó al diagnóstico de inmunodeficiencia primaria (IDP) por déficit predominante de anticuerpos, iniciándose tratamiento sustitutivo con inmunoglobulinas intravenosas a dosis de 0,4mg/kg cada 3 semanas que, junto con el tratamiento antibiótico con claritromicina durante 2 meses más, resolvió las lesiones de forma definitiva (fig. 1B).
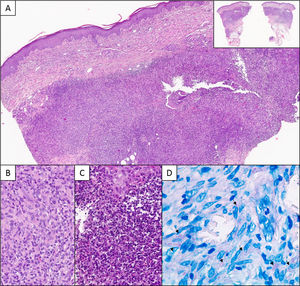
A. Corte histológico que muestra un infiltrado dérmico profundo granulomatoso de patrón nodular (detalle panorámico en la esquina superior derecha) (H-E 40×). B. Detalle del infiltrado, constituido por linfocitos e histiocitos (H-E 200×). C. Áreas supurativas con abundantes neutrófilos y restos celulares (H-E 400×) D. Técnica histoquímica de Ziehl-Neelsen. Flechas señalando estructuras alargadas de color rosa (630×).
La infección por M. chelonae de distribución esporotricoide se debe a la propagación ascendente de la micobacteria a lo largo de las cadenas linfáticas6, patrón poco habitual del cual se han descrito tan solo 15 casos en la literatura (tabla 1), ninguno de ellos en un paciente con sarcoidosis. El diagnóstico diferencial ha de hacerse fundamentalmente con otros patógenos que habitualmente se presentan con dicho patrón, como Sporothrix schenckii, Mycobacterium marinum, Nocardia o Leishmania.
Casos de infección cutánea por M. chelonae de distribución esporotricoide descritos en la literatura
| Caso | Edad/sexo | Localización | Enfermedad de base | Inmunodepresión | Tratamiento | Recidiva | Tratamiento tras recidiva |
|---|---|---|---|---|---|---|---|
| Greer, 197912 | 76/M | Pierna | No | Isoniacida+amitiozona | No | ||
| Higgins, 198813 | 65/M | Antebrazo | Hepatitis crónica activa | Sí | Eritromicina+amikacina | No | |
| Murdoch, 198914 | 61/M | Pierna | Trasplante renal | Sí | Piracinamida+rifampicina 6 meses | Sí | Eritromicina |
| Jopp-McKay, 199015 | 52/M | Pierna | Trasplante renal | Sí | Minociclina 2 meses | Sí | TMP-SMX+Cirugía |
| Zahid, 199416 | 70/H | Mano | EPOC | Sí | Ciprofloxacino+claritromicina 6 meses | No | |
| Endzweig, 200117 | 59/H | Pierna | Trasplante renal | Sí | Cirugía+ciprofloxacino+TMP-SMX+imipenem | Sí | Cirugía+amikacina+cefoxitina+claritromicina |
| Haas, 200118 | 66/M | Antebrazo | Artritis reumatoide | Sí | TMP-SMX+claritromicina | Sí | Azitromicina+ciprofloxacino+Cirugía |
| Demitsu, 200119 | 46/H | Antebrazos | Insuficiencia cardiaca congestiva. Diabetes mellitus | No | Minociclina 2 meses | Sí | Cirugía |
| Rosón, 200220 | 42/M | Antebrazo | No | Minociclina | No | ||
| Phillips, 200821 | 43/M | Antebrazo | Panuveítis bilateral | Sí | Imipenem+piperacilina-tazobactam+amoxicilina-clavulánico 5 meses | No | |
| de Vasconcelos, 201522 | 60/H | Antebrazo | Artritis reumatoide | Sí | Claritromicina 6 meses | No | |
| Orrin, 201623 | 65/M | Pierna | Neumonía organizada criptogenética | Sí | Claritromicina 9 meses | No | |
| Boulavsky,201724 | 75/M | Pierna y pie | Nefritis lúpica | Sí | Claritromicina+amikacina+levofloxacino | No | |
| Kemp, 20173 | 54/M | Antebrazo | Lupus eritematoso sistémico | Sí | Linezolid+claritromicina 4 meses | No | |
| DuBow, 20196 | 31/M | Pierna | Lupus eritematoso sistémico | Sí | Linezolid+claritromicina 8 meses | Sí | Linezolid+claritromicina 3 meses |
| Nuestro caso | 70/M | Antebrazo | Sarcoidosis.IDP | Sí | Claritromicina 4 meses | Sí | Claritromicina 2 meses+IGIV |
EPOC: enfermedad pulmonar obstructiva crónica; H: hombre; IDP: inmunodeficiencia primaria; IGIV: inmunoglobulinas intravenosas; M: mujer; TMP-SMX: trimetoprim-sulfametoxazol.
Ante una infección por micobacterias atípicas, especialmente si se presenta con un patrón poco frecuente como el esporotricoide, es recomendable descartar una alteración del sistema inmune. Las manifestaciones dermatológicas más frecuentes de las IDP son las infecciones cutáneas. La susceptibilidad puede ser específica a determinados patógenos, dependiendo del componente del sistema inmunitario que se vea afectado7. Las IDP debidas a mutaciones en los genes de?IFNγ, que presentan un defecto en la función fagocítica sin alteración en la inmunidad humoral, son susceptibles a infecciones graves diseminadas causadas por micobacterias atípicas8. En nuestro caso se encontró un déficit de IgG con linfopenia B. Los déficits de anticuerpos cursan habitualmente con infecciones bacterianas del aparato respiratorio, que también había presentado la paciente.
La biopsia es fundamental para el diagnóstico. Histopatológicamente se pueden encontrar diferentes patrones entre los que destacan un infiltrado difuso de histiocitos, microabscesos, paniculitis, granulomas tuberculoides o sarcoideos y/o vasculopatía reactiva9. Los bacilos ácido alcohol resistentes se evidencian mediante tinciones específicas como Ziehl-Neelsen, aunque un resultado negativo no descarta una micobacteriosis5,10. El diagnóstico se confirma mediante el cultivo o con técnicas moleculares como la PCR-RFLP2,10.
Respecto al tratamiento M. cheloane suele mostrar un patrón de resistencia impredecible, por lo que las pruebas de susceptibilidad son imprescindibles. Si bien en la mayoría de los casos con infecciones localizadas el tratamiento con claritromicina en monoterapia es suficiente, es recomendable el uso de terapia combinada debido al desarrollo potencial de resistencias durante la terapia, a menudo prolongada6,11. En algunos casos el tratamiento quirúrgico adyuvante puede estar indicado5.
En conclusión, ante la presencia de lesiones cutáneas de distribución esporotricoide se debe descartar una infección por micobacterias atípicas, especialmente si aparecen en un paciente inmunodeprimido.