INTRODUCCION
Las manifestaciones cutáneas de las enfermedades malignas constituyen una afección relativamente infrecuente que ha ido aumentando en los últimos años. Habitualmente aparecen tras el diagnóstico del cáncer primario, pero pueden ser el primer signo clínico de un tumor de origen desconocido o la primera señal de recaída de un paciente oncológico.
En la actualidad, el cáncer metastásico de origen primario desconocido es considerado como un síndrome que se caracteriza por la presencia de metástasis generalizadas que afectan a varios órganos, con afectación del estado general, mala respuesta a los tratamientos quimioterápicos y con una supervivencia media de 3-4 meses. Estos tumores, de comportamiento muy agresivo, presentan una diseminación tumoral muy temprana en ausencia clínica del tumor primario y constituyen el 5-10 % de todos los pacientes oncológicos.
Tan sólo un 2 % de las neoplasias internas se manifiestan inicialmente con metástasis cutáneas (MC), éstas son poco frecuentes especialmente en fases iniciales de la enfermedad. Suelen aparecer en estadios avanzados de la enfermedad y se consideran de un pronóstico infausto.
CASO CLINICO
Un paciente varón de 67 años, ex fumador de 2 paquetes de cigarrillos al día y con antecedentes personales de diabetes mellitus tipo 2 e hipertensión arterial, acudió a la consulta de Dermatología para la valoración de una lesión única en el tórax de crecimiento rápido, de menos de un mes de evolución, que le producía escozor local y un sangrado muy leve.
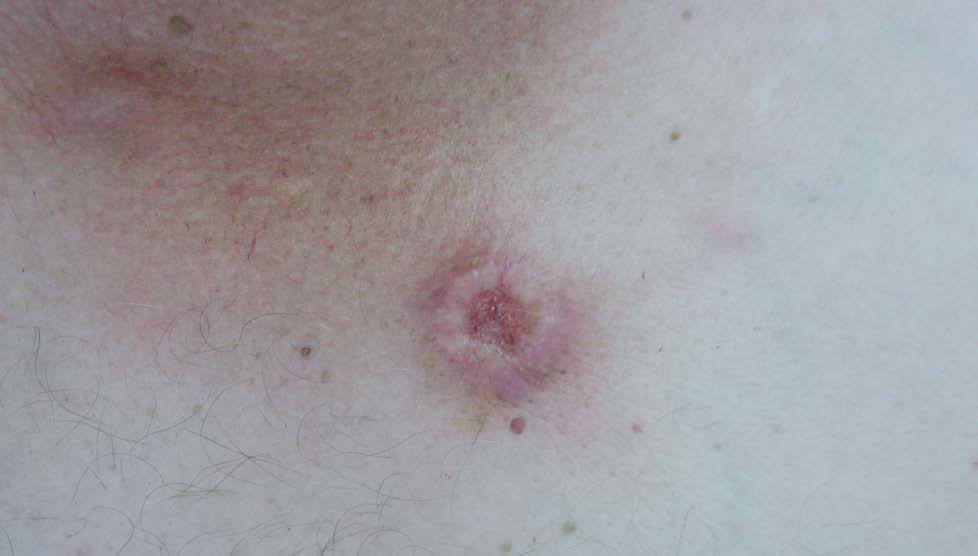
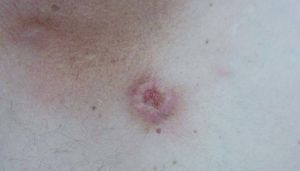
A la exploración física se apreciaba a nivel preesternal, una lesión tumoral de 2 cm de diámetro, de fondo úlcero-costroso y bordes eritemato-violáceos infiltrados, duros y levemente dolorosos a la palpación (fig. 1). También se observó una lesión nodular en epigastrio, de 0,5 cm de diámetro, dura, mal delimitada y adherida a planos profundos. No se observaron visceromegalias, ni adenopatías en las cadenas regionales accesibles. El resto de la exploración fue compatible con la normalidad.
Fig. 1.--Lesión tumoral úlcero-costrosa con bordes eritemato-violáceos infiltrados, duros y dolorosos a la palpación, localizada a nivel preesternal.
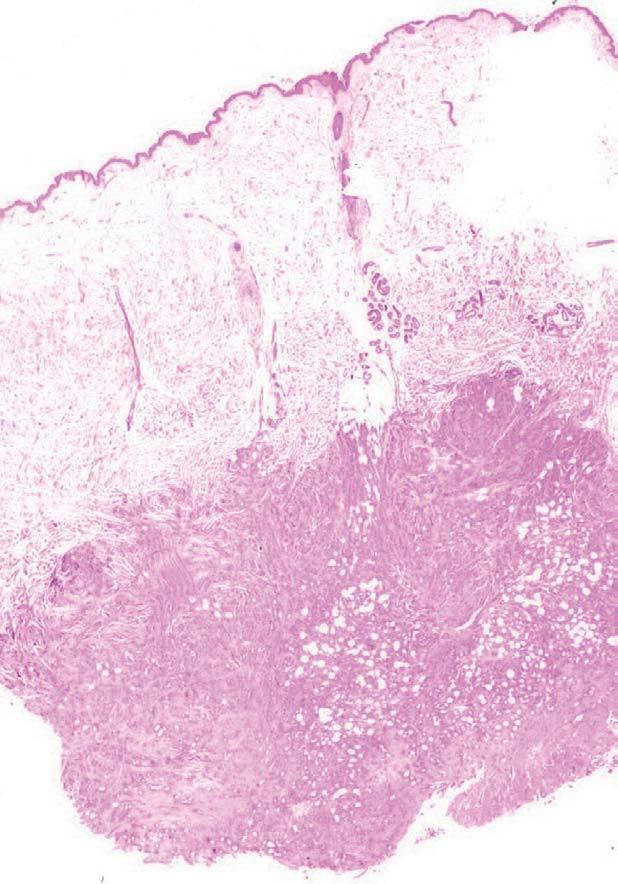
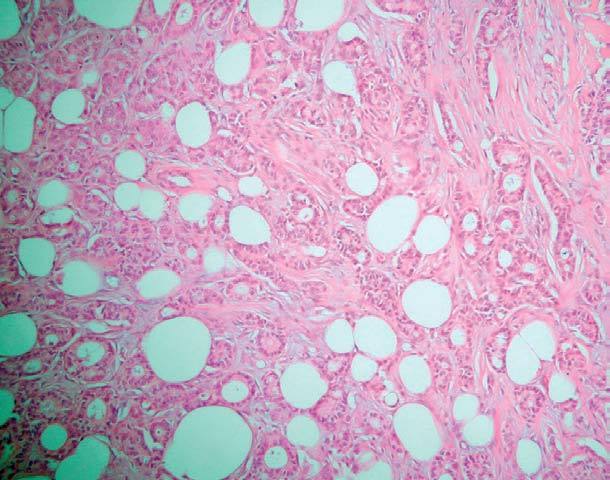
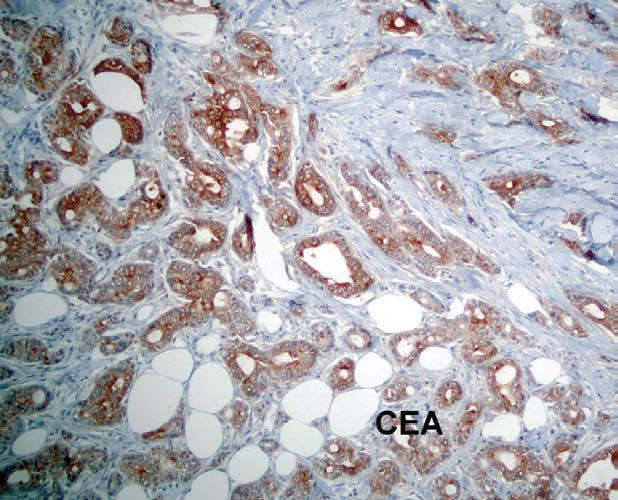
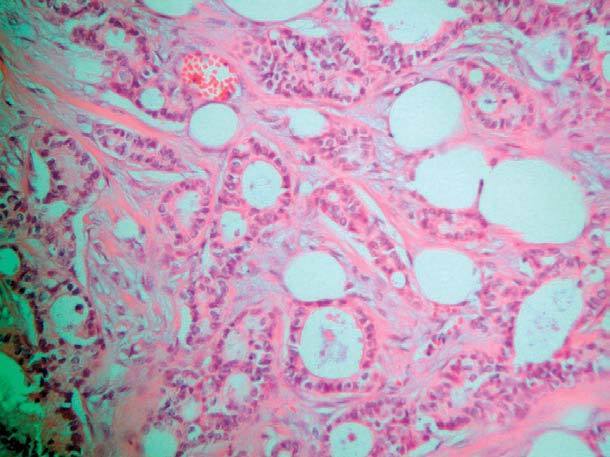
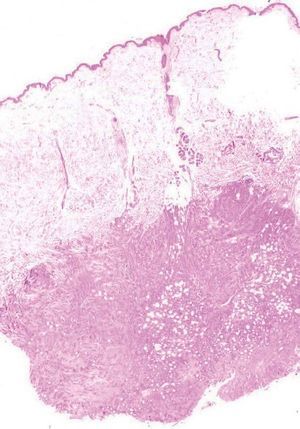
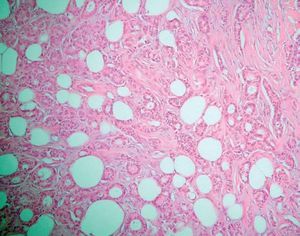
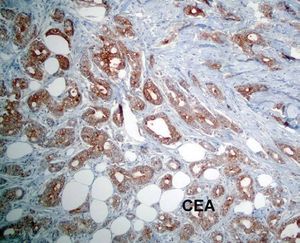
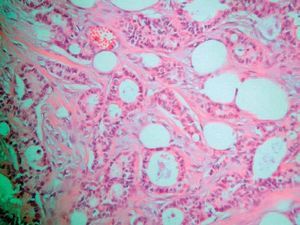
El estudio anatomopatológico de una biopsia realizada en la lesión nodular epigástrica destacó una proliferación celular densa a nivel de la dermis profunda y del tejido celular subcutáneo que respetaba la epidermis y los anejos cutáneos (fig. 2), constituida por células epiteliales dispuestas siguiendo un patrón glandular moderadamente bien diferenciado (fig. 3). Con técnicas de inmunohistoquímica estas células tumorales mostraron una clara positividad para antígeno carcinoembrionario (CEA) (fig. 4) y una negatividad para receptores estrogénicos (fig. 5).
Fig. 2.--Estudio histopatológico que demuestra una proliferación celular densa en la dermis profunda y en el tejido celular subcutáneo, sin afectar a la epidermis y a los anejos cutáneos (H&E, x 10).
Fig. 3.--Se observa a mayor aumento cómo el tumor está constituido por células epiteliales siguiendo un patrón glandular moderadamente bien diferenciado (H&E, x 40).
Fig. 4.--Tinciones de inmunohistoquímica que nos ponen de manifiesto una clara positividad para antígeno carcinoembrionario (CEA).
Fig. 5.--Tinciones de inmunohistoquímica con receptores estrogénicos que muestran una negatividad para estos receptores en las células tumorales.
Se realizó una analítica completa con los siguientes resultados. Bioquímica: glucosa 140 mg/dl, fosfatasa alcalina 1.173 U/l (98-279), transaminasa glutámico oxalacética (GOT) 21 U/l (6-38), transaminasa glutámico pirúvica (GPT) 31 U/l (0-35), lactato deshidrogenasa (LDH) 1080 U/l (225-450). Hemograma: hematíes 3,54 10 6 mml, hemoglobina (Hb) 11,4 g/dl, leucocitos 11.260 (69,3 % N, 18,7 % L, 9,3 % M, 1,9 % E), plaquetas 203.000, velocidad de sedimentación globular (VSG) 28 mm en la primera hora. Estudios de coagulación: sin alteraciones. Marcadores tumorales: antígeno prostático específico (PSA), subunidad beta de la gonadotrofina coriónica humana (BHCG) y alfafetoproteína (AFP) normales, CEA 23,6 ng/ml (0,0-5,0), antígeno carcinoso (CA) 19,9 44 U/ml (0,0-37,0), CA 15,3 41 U/ml (0,0-28,0). Posteriormente se realizaron pruebas de imagen en búsqueda del tumor primario: radiografía de tórax que no evidenció patología; tomografía axial computarizada (TAC) de tórax, abdomen y pelvis que sólo puso de manifiesto la existencia de un aneurisma aórtico, sin lesiones en colon, páncreas y sin apreciar adenopatías retroperitoneales ni pélvicas ni metástasis óseas. Los estudios endoscópicos fueron normales.
El paciente fue valorado por el servicio de Oncología y después de reevaluar las pruebas complementarias realizadas, y en ausencia de otros datos relevantes en la anamnesis, se realizó el diagnosticó de MC de adenocarcinoma moderadamente bien diferenciado de origen primario desconocido.
Se instauró tratamiento quimioterápico con gemcitabina y cisplatino a intervalos de 21 días. Después del tercer ciclo no se obtuvo respuesta clínica ni analítica, motivo que justificó la suspensión de dicho tratamiento.
De forma progresiva el paciente desarrolló nuevas lesiones cutáneas en la punta nasal, en el tronco y en el cuero cabelludo, con tendencia al sangrado abundante de las mismas. Presentó un episodio de sangrado severo a nivel de la lesión del tórax anterior que requirió de radioterapia externa con fines hemostáticos y transfusión de 4 concentrados de hematíes. El deterioro orgánico del paciente fue progresando rápidamente, con desarrollo posterior de metástasis óseas. A los cinco meses del diagnóstico se produjo su exitus sin poder realizar el estudio necrópsico.
DISCUSION
Las metástasis de origen primario desconocido ocurren en alrededor de un 5-10 % de los enfermos diagnosticados de cáncer 1. Pocos diagnósticos generan tanta angustia e incertidumbre al paciente y a su médico. Como se sabe el tratamiento del cáncer se fundamenta en el reconocimiento de la neoplasia primaria, por ello estos enfermos nos plantean grandes retos diagnósticos y terapéuticos 2.
La frecuencia de MC de una neoplasia se estima actualmente entre el 0,2-9 % 3,4. Generalmente se trata de tumores primarios conocidos y se correlaciona con los tipos más frecuentes de cánceres primarios en cada sexo, el carcinoma de mama en la mujer y el de pulmón en el varón 5. En el caso de MC de origen primario desconocido, el tumor es identificado en tan sólo un 27 % de los casos antes del fallecimiento del paciente, en el 57 % en la autopsia y en el 16 % restante no se logra encontrar el origen primario ni aun mediante exámenes post mortem 6. La mayoría de los estudios han revelado que son los cánceres de pulmón y páncreas los primarios que más comúnmente se presentan inicialmente como cáncer de origen desconocido (COD) 7-9.
La búsqueda exhaustiva y generalmente infructuosa del tumor primario es un tema muy controvertido en la literatura. En la evaluación del COD se considera más importante el reconocimiento de los subgrupos de pacientes con tratamiento eficaz que la propia búsqueda del tumor primario (pues sólo se consigue identificar en una minoría de casos), sin que ello modifique el pronóstico y la actitud terapéutica. Actualmente hay un consenso sobre esta estrategia diagnóstica; debe ser limitada y conservadora, explorando únicamente las regiones que generan sintomatología (pues está demostrado que la exploración de regiones asintomáticas no genera rédito diagnóstico) 7,10. Debe constar de una historia clínica y un examen físico minucioso, exámenes de laboratorio completos, radiografía de tórax, TAC de abdomen y pelvis, tomografía por emisión de positones (PET) y mamografías en la mujer 11. La TAC sólo identifica el 10-35 % de los COD, pero generalmente nos ayuda ya que pone de manifiesto otros focos metastásicos 12.
El análisis anatomopatológico tiene una misión fundamental en la evaluación del COD a través de estudios histológicos, inmunohistoquímicos y, siempre y cuando sea apropiado, mediante técnicas de microscopía electrónica. Esta evaluación histológica proporciona una orientación imprescindible para realizar una valoración clínica adecuada del paciente, con el fin de clasificar subgrupos e identificar aquellos individuos para los que hay tratamiento eficaz 2,13. Esto nos permite por un lado una aproximación diagnóstica hacia ciertos tumores concretos como linfomas, melanomas, sarcomas o tumor de células germinales, y por otro lado la agrupación del resto de los pacientes en cuatro categorías histopatológicas (tabla 1) 2,14. Cada grupo presenta características diagnósticas, terapéuticas y pronósticas específicas. Tan sólo en las neoplasias poco diferenciadas es preciso añadir a las técnicas de inmunohistoquímica, la microscopía electrónica y el análisis citogenético.
El adenocarcinoma bien o moderadamente bien diferenciado constituye un 60 % de COD y suele tratarse generalmente de pacientes de edad media con enfermedad diseminada en el momento del diagnóstico. Se considera que las localizaciones más frecuentes del tumor primario son el aparato digestivo (especialmente páncreas y árbol biliar) y el pulmón. Las metástasis se localizan con mayor frecuencia en hígado, pulmón, ganglios linfáticos y hueso y muy excepcionalmente en la piel 14.
A pesar del desarrollo de la quimioterapia en estos últimos años, se trata de una enfermedad altamente agresiva y de muy mal pronóstico, con supervivencias que oscilan entre 5-12 meses 15 y con una mortalidad superior al 70 % durante el primer año del diagnóstico 16. El criterio para iniciar el tratamiento oncológico se basa en el estado general del paciente, pues la mayoría son quimiorresistentes. Habitualmente los protocolos de experimentación clínica incluyen diversos fármacos citostáticos combinando 5-fluorouracilo, doxorrubicina y mitomicina C, presentando tasas de respuesta variadas entre el 8 % y el 39 % 2. Las tasas de respuestas globales no exceden el 30 %, las remisiones completas son inusuales y aun en los pacientes respondedores no se incrementa la supervivencia. Es fundamental evaluar la eficacia del tratamiento a las 6-8 semanas, y ante la inexistencia de una respuesta terapéutica se deberá abandonar la quimioterapia e instaurar un tratamiento paliativo, como se realizó en nuestro caso.
Como sabemos la frecuencia de MC es extremadamente baja, a pesar del gran tamaño de la superficie corporal y de la riqueza de vasos sanguíneos y linfáticos. Las vías de implantación de las células metastásicas en la piel son la linfática, la sanguínea, por contigüidad y la implantación por procedimientos quirúrgicos. Hay diferentes regiones anatómicas que tienen cierta relación como destinos de metástasis que nos pueden orientar en la búsqueda del tumor primario (tabla 2) 17. En cuanto a la semiología, las MC pueden ser nodulares o subcutáneas (pueden simular lesiones benignas como lipomas o quistes cutáneos, o aparecer como lesiones angiomatosas, principalmente en los carcinomas renales, pulmonares y en los coriocarcinomas), esclerodermiformes (la alopecia neoplásica en cuero cabelludo que puede confundirse con la alopecia cicatricial, y el carcinoma en coraza por un carcinoma mamario), inflamatorias y eczematiformes.
La búsqueda del tumor primario se realizará teniendo en cuenta la frecuencia de los tumores malignos en nuestro medio en relación con el sexo y edad del paciente y con la frecuencia de los tumores que dan MC.
Hemos presentado un caso de adenocarcinoma moderadamente diferenciado de origen primario desconocido, cuya primera manifestación del cáncer fue la presencia de MC. Dadas las características histopatológicas e inmunohistoquímicas, la evolución clínica y el desarrollo final de metástasis óseas, sospechamos que su origen era posiblemente pancreático.
Declaración de conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Correspondencia:
M.ª Teresa Bordel Gómez.
Servicio de Dermatología.
Complejo Asistencial Virgen de la Concha.
Martínez Villergas, 6, 1.º B. 49003 Zamora. España.
matebordel@yahoo.es
maitebordel@aedv.es
Recibido el 14 de febrero de 2006.
Aceptado el 26 de junio de 2006.