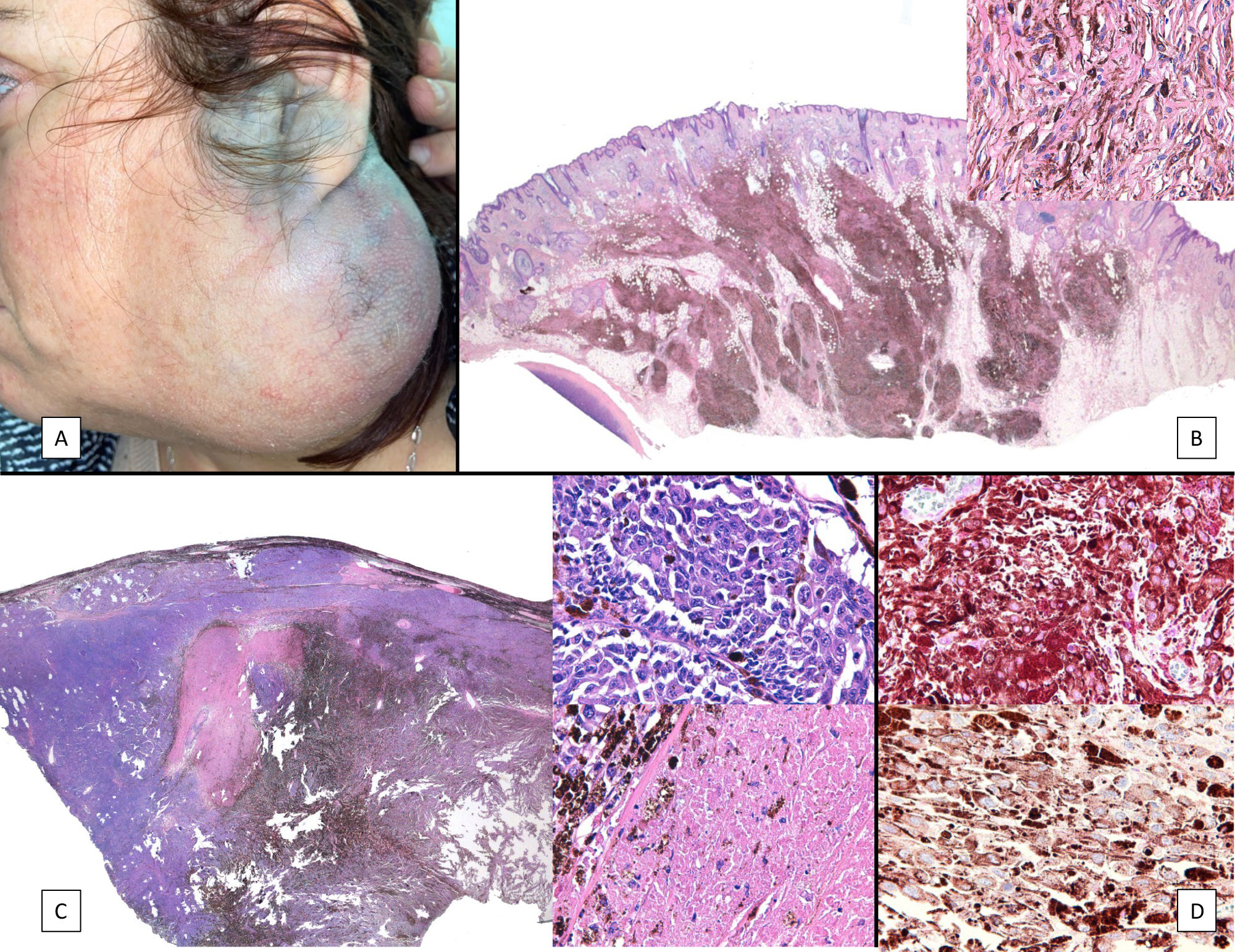
El melanoma sobre nevus azul o melanoma ex-blue nevus es una variedad de melanoma peculiar que tiene un perfil genético diferente al del resto de los melanomas cutáneos y sorprendentemente superponible al perfil del melanoma uveal. Aunque puede aparecer de novo, el melanoma ex-blue nevus se suele desarrollar sobre un nevus azul previo o sobre una melanocitosis dérmica. No todas las lesiones nodulares desarrolladas sobre un nevus azul o una melanocitosis dérmica son melanomas, y los hallazgos clínicos e histológicos pueden ser insuficientes para llegar a un diagnóstico de certeza. Así, cobran relevancia estudios adicionales, como la hibridación genómica comparada, pues la presencia de aberraciones cromosómicas favorece el diagnóstico de malignidad. Es de especial utilidad el estudio del gen BAP1, cuya pérdida de expresión orienta a melanoma en este espectro de lesiones. Presentamos 3casos del espectro nevus azul a melanoma ex-blue nevus con estudios de biología molecular.
Melanoma arising in blue nevus, also known as melanoma ex blue nevus, is a specific form of melanoma whose genetic profile is different to that of other cutaneous melanomas and surprisingly similar to that of uveal melanoma. Although melanoma ex blue nevus can appear de novo, it usually arises in a preexisting blue nevus or dermal melanocytosis. Not all nodular lesions arising in association with blue nevus or dermal melanocytosis are melanomas, however, and because clinical and histologic findings may be insufficient for a definitive diagnosis, additional studies such as comparative genomic hybridization are important. Detection of chromosomal aberrations supports a diagnosis of malignancy. Studies of the BAP1 gene are particularly useful in this setting because loss of expression is indicative of melanoma. We present 3 cases on the spectrum of blue nevus to melanoma ex blue nevus that were studied using molecular biology techniques.
Los nódulos desarrollados sobre melanocitosis dérmicas o sobre nevus azules pueden suponer un desafío diagnóstico, ya que las claves histológicas clásicas que permiten distinguir entre un melanoma y un nevus melanocítico fallan muchas veces en este grupo de lesiones. Por el contrario, la pérdida de la expresión de BAP1 favorece el diagnóstico de melanoma en lesiones dentro de este espectro, incluso en ausencia de rasgos histológicos de malignidad1. Igualmente, la demostración de aberraciones cromosómicas mediante la hibridación genómica comparada (HGC) orienta el diagnóstico a malignidad2,3.
Describimos los casos de 3pacientes que ilustran el espectro de lesiones nodulares desarrolladas sobre melanocitosis dérmicas, desde un polo benigno de nevus azul celular hasta uno de melanoma indudable, pasando por un caso con rasgos mixtos entre un nevus azul atípico y un melanoma ex-blue nevus.
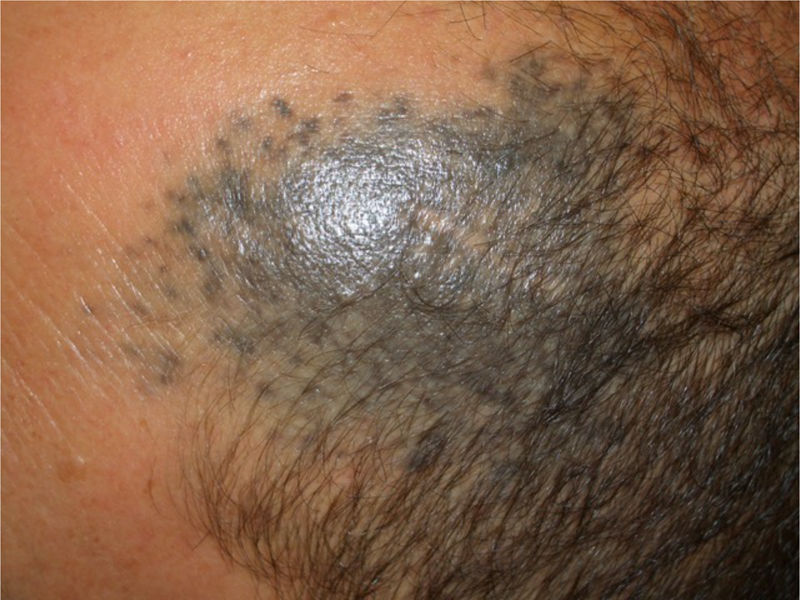
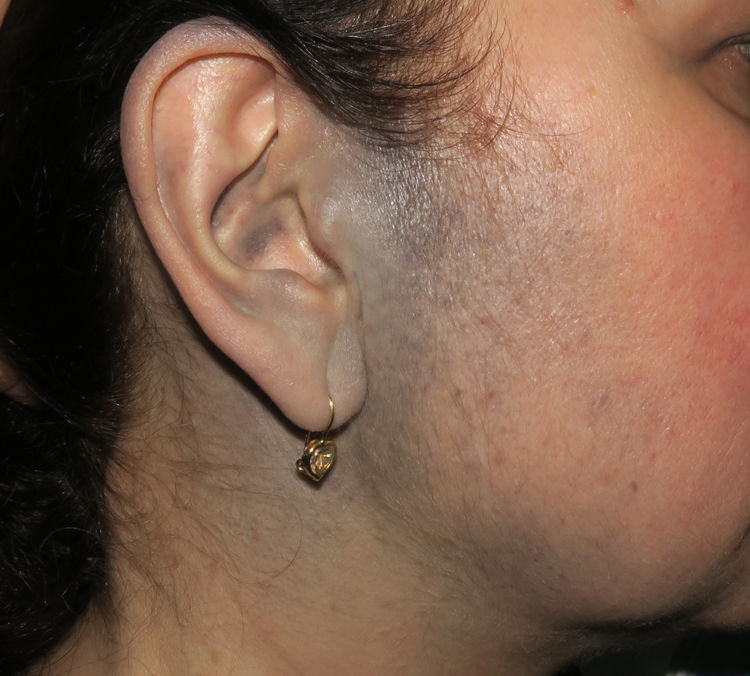
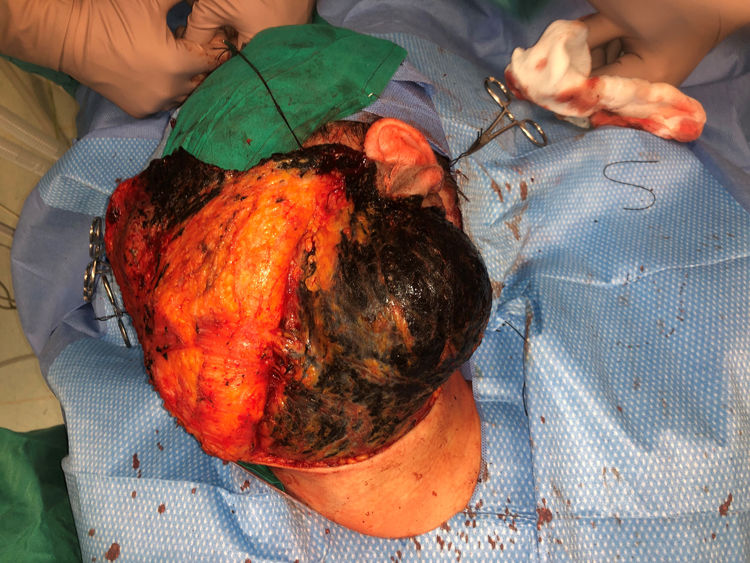
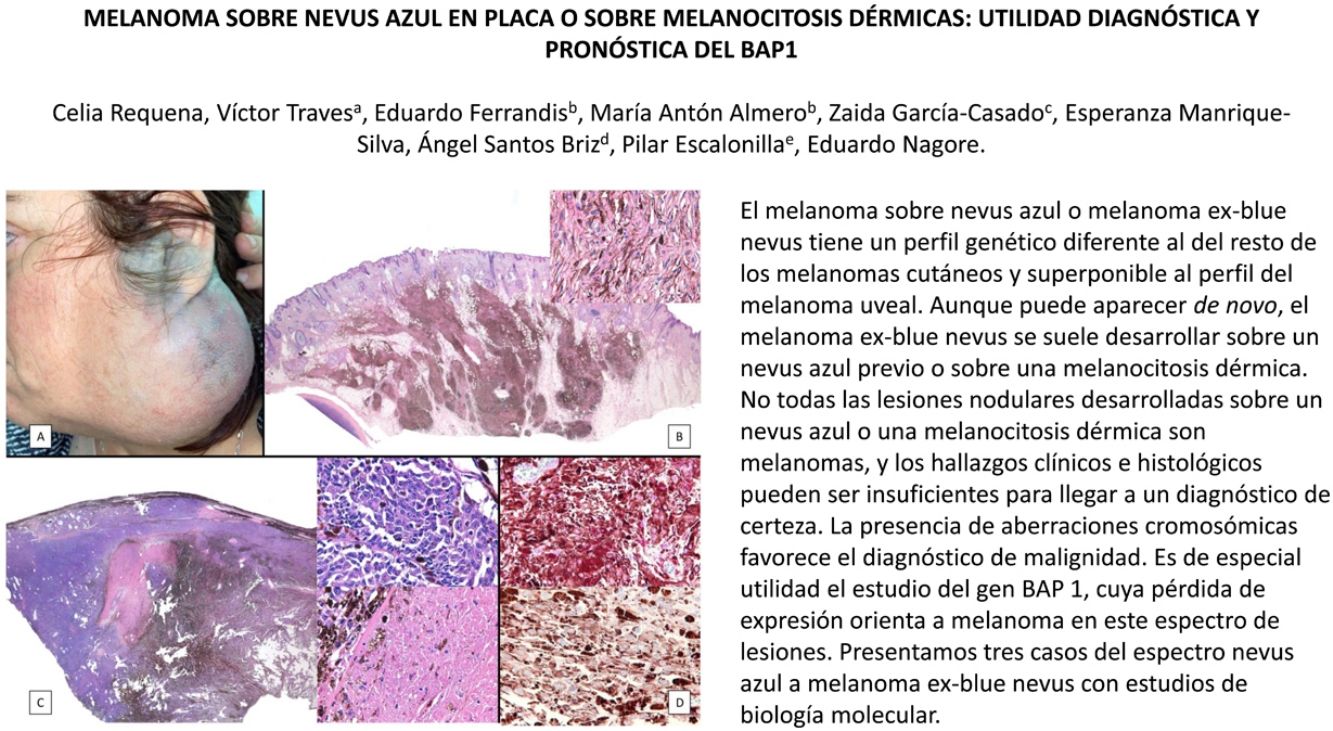
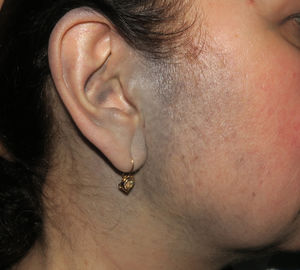
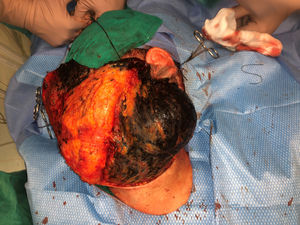
Casos clínicosCaso 1Una mujer de 49 años fue valorada por haber desarrollado una gran masa subcutánea, firme a la palpación, de unos 12cm de diámetro en el área parotídea, sobre la porción inferior de una placa azul-grisácea que había presentado desde el nacimiento y que afectaba al pabellón auricular izquierdo, así como a la piel preauricular y al hemicuello vecinos (fig. 1A). Esta placa no había sido biopsiada nunca y había sido etiquetada clínicamente como una «malformación vascular».
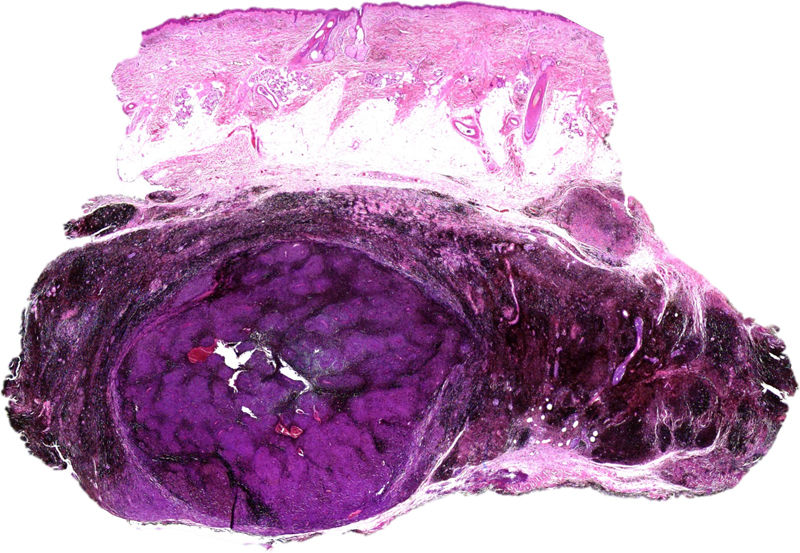
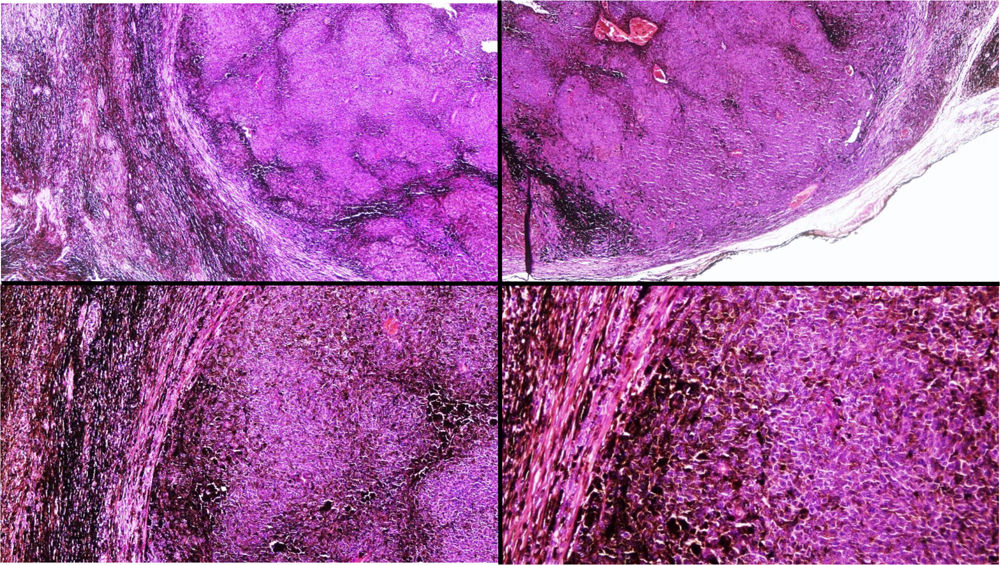
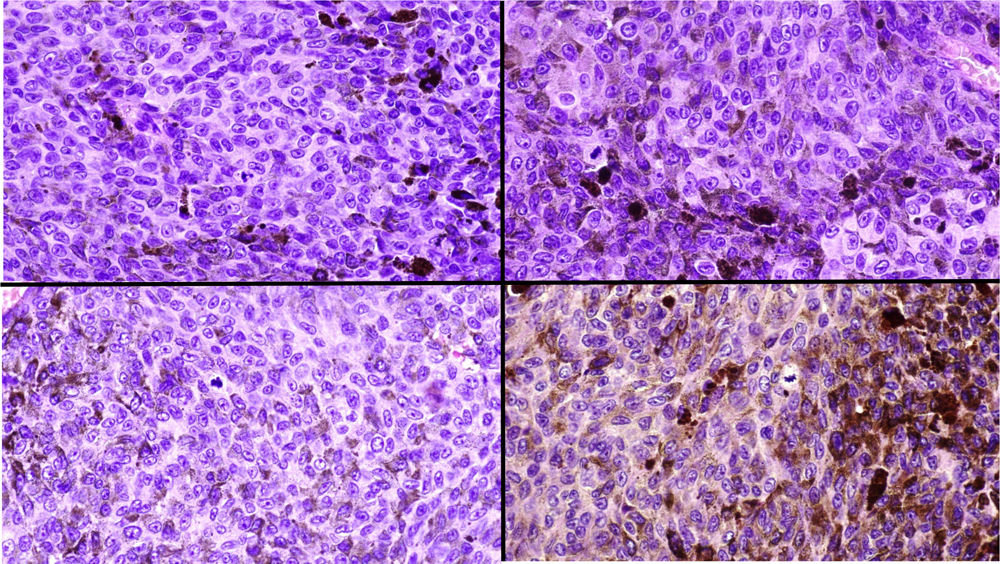
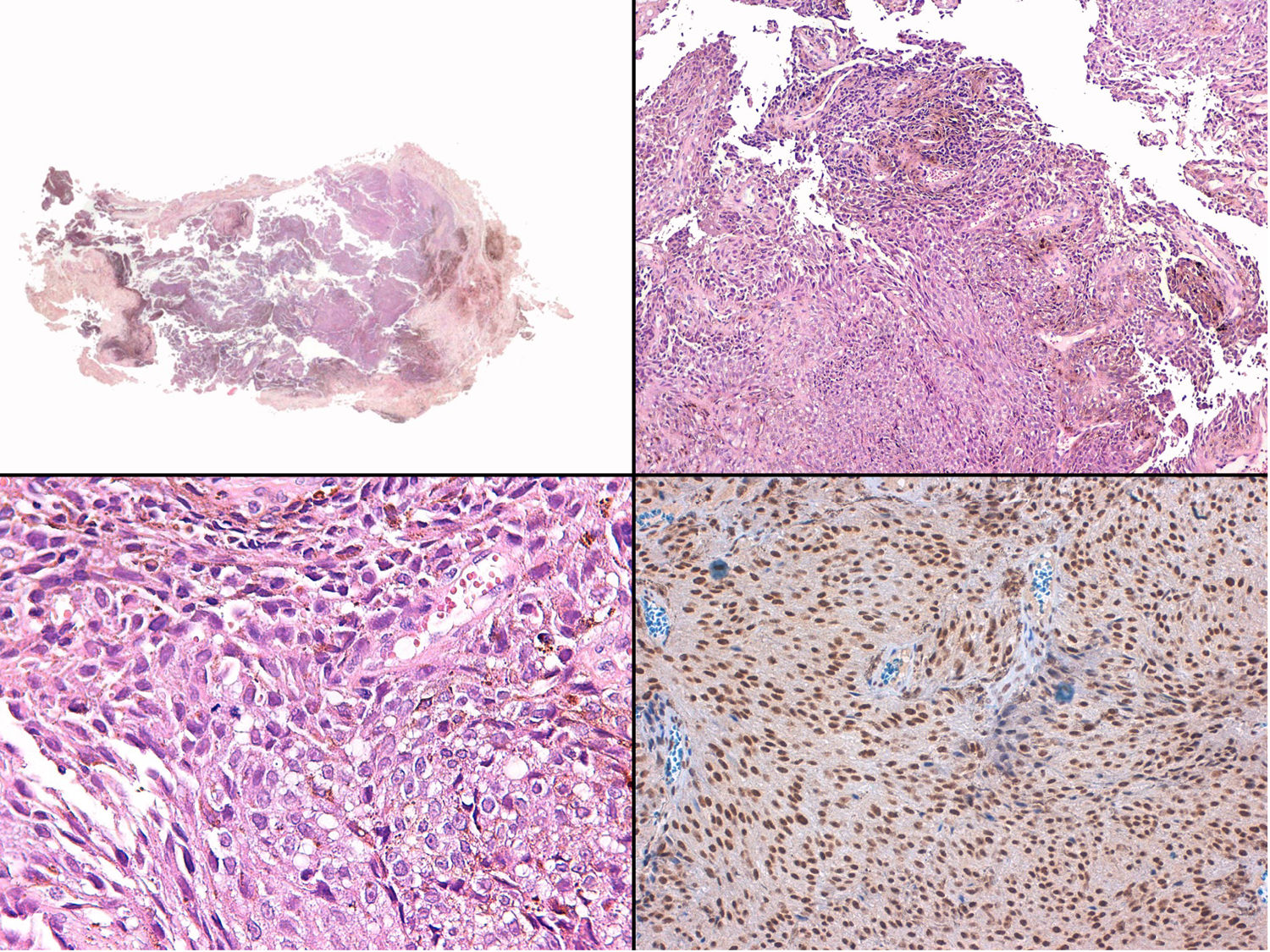
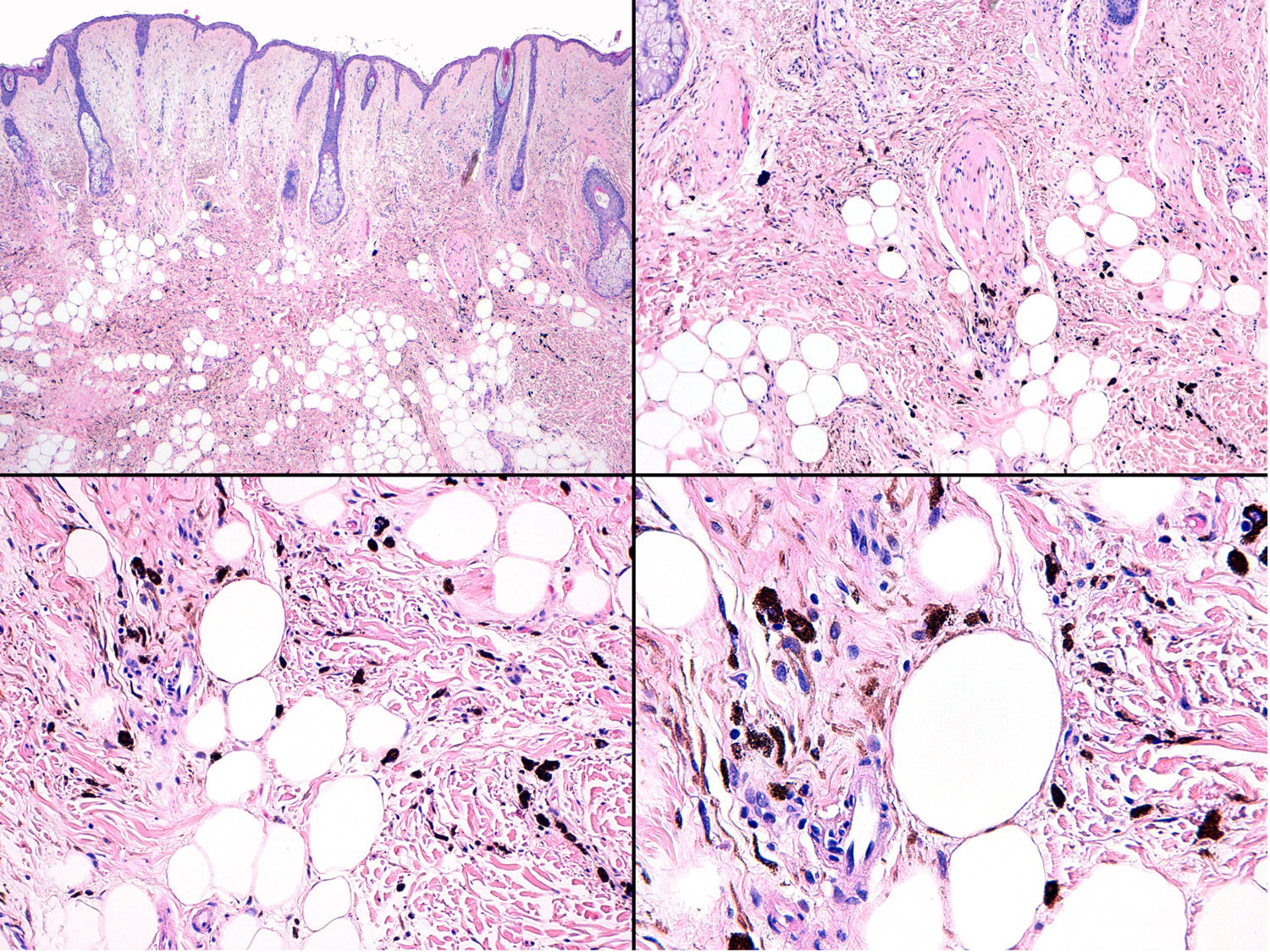
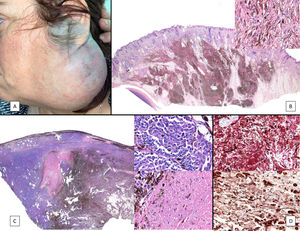
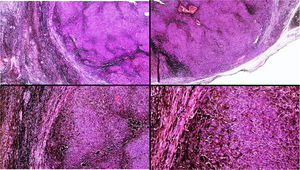
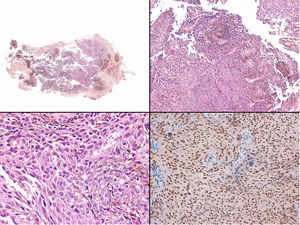
A) Gran masa en la piel mastoidea desarrollada sobre placa azulada en la piel de pabellón auricular, preauricular y de hemicuello izquierdos. B) Nevus azul en placa: panorámica y detalle en recuadro: haces de células fusiformes, abundantes melanófagos y colágeno esclerótico que ocupan la grasa subcutánea y menos la dermis, pero sin afectar a la unión dermoepidérmica. C) Área del tumor central: predominio de sábanas densas de células epitelioides y pleomórficas que sustituyen todas las estructuras preexistentes. En el detalle inferior (recuadro): áreas de necrosis coagulativa en masa. En el detalle superior (recuadro): zonas densamente melanocíticas sin contenido alguno en melanina. D superior) Expresión nuclear de BAP1 (en rojo) conservada en la porción del nevus azul en placa. D inferior) Pérdida de expresión de BAP 1 en los núcleos de la porción melanomatosa.
El nódulo se diagnosticó de melanoma fusocelular mediante el estudio citológico de una muestra obtenida por PAAF, con una positividad para Melan A, HMB45 y S-100. En el estudio de extensión, que incluyó una PET/TAC del cuerpo entero y un estudio del fondo de ojo, no se encontraron lesiones a distancia. La paciente fue intervenida por el servicio de otorrinolaringología y, en el acto quirúrgico, se evidenció que, además de la gran tumoración descrita, había una pigmentación negra azabache muy extensa e imprecisa, tanto de los márgenes laterales amplios como de los márgenes profundos de la resección (fig. 1 del anexo). Se encontró que la glándula tiroides, el nervio facial, las fascias de los músculos cervicales subyacentes y varios ganglios linfáticos estaban totalmente pigmentados.
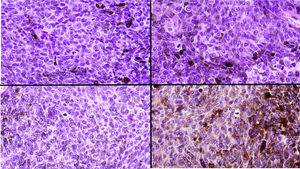
El estudio anatomopatológico de la pieza quirúrgica mostró 2áreas muy diferentes. La porción de la placa periférica preexistente estaba conformada por haces de células fusiformes, acompañadas de abundantes melanófagos y un colágeno esclerótico, distribuidas en gruesos fascículos que ocupaban sobre todo la grasa subcutánea y menos la dermis, pero sin afectar a la unión dermoepidérmica (fig. 1B). Estas células tenían unos núcleos pequeños, sin atipia, pleomorfismo, ni mitosis (fig. 1B detalle). La abundante melanina se distribuía siguiendo un patrón uniforme en toda la tumoración. Todo ello fue interpretado como un nevus azul en placa. La porción de la gran tumoración central mostró áreas más variopintas, con un predominio de sábanas densas de células epitelioides y pleomórficas sustituyendo todas las estructuras preexistentes (fig. 1C). Aparecían grandes áreas de necrosis coagulativa en masa (fig. 1C: detalle inferior) y un patrón de distribución de la melanina muy irregular, con unas áreas de densidad elevada de melanófagos muy cargados de melanina, que contrastaban con zonas densamente melanocíticas sin contenido alguno en melanina (fig. 1C: detalle superior). El estudio inmunohistoquímico con Melan A, HMB45 y S-100 fue positivo. Todo ello fue interpretado como melanoma sobre nevus azul en placa. Así mismo, se realizó un estudio inmunohistoquímico que mostró una expresión nuclear de BAP1 en la porción del nevus azul en placa (fig. 1D superior) y una pérdida de su expresión en la porción melanomatosa (fig. 1D inferior).
El estudio molecular incluyó el análisis somático de 42 genes mediante NGS con el kit Somatic Tumor Genetics® (Sophia Genetics) en el secuenciador NextSeq de Illumina (incluye el análisis de las regiones codificantes y de splicing de los siguientes genes: AKT1, ALK, BRAF,CDK4, CDKN2A, CTNNB1, DDR2, DICER1, EGFR, ERBB2, ERBB4, FBXW7, FGFR1, FGFR2, FGFR3, FOXL2,GNA11, GNAQ, GNAS, H3F3A, H3F3B, HIST1H3B, HRAS, IDH1, IDH2, KIT, KRAS, MAP2K1, MET, MYOD1,NRAS, PDGFRA, PIK3CA, PTPN11, RAC1, RAF1, RET, ROS1, SF3B1, SMAD4, TERT y su promotor, TP53) tanto en la porción del nevus azul como en la porción de melanoma y solo se encontró la mutación patogénica p.Q209L en GNAQ en ambas porciones. Por otro lado, el estudio mediante HCG mostró una completa ausencia de aberraciones cromosómicas en la porción de nevus azul en placa, pero detectó varias alteraciones en la porción de melanoma, incluyendo ganancias de 1q, Cr 2, 5p, 6p, Cr 7 y 8 (4n), Cr 13, 14, 17, 19, 20, 21 y 22, así como una pérdida de heterocigosidad de 1p, Cr 3 y 5q y, además, una pérdida de 6q y CrX.
A los 6 meses de la cirugía la paciente mostró una recaída locorregional con múltiples nódulos rojizos y ulcerados en el área auricular y cervical izquierdas, así como unas metástasis ganglionares cervicales, mediastínicas, pulmonares y hepáticas. La paciente pasó a tratamiento sistémico con ipilimumab y nivolumab. Tras un seguimiento de 4 meses, la paciente permanecía viva con enfermedad en progresión.
Caso 2Un hombre de 53 años estaba en seguimiento por presentar una placa pigmentada gris-azulada de 8×5cm de diámetro, localizada en la región frontotemporal izquierda, de muchos años de evolución (fig. 2 del anexo). La lesión había sido biopsiada en 2ocasiones (2002 y 2004) con el diagnóstico de nevus azul. En la última visita se palpó un nódulo dentro de la placa, que se demostró que estaba localizado en el tejido celular subcutáneo mediante ecografía.
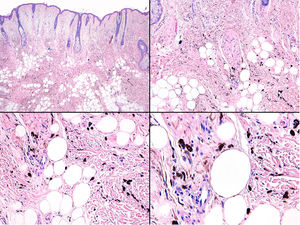
El estudio histológico reveló una porción de nevus azul dendrítico convencional y discreto en la dermis y otra de nevus azul en placa muy pigmentado por debajo de la hipodermis (fig. 3 del anexo). Inmerso en la porción subcutánea del nevus azul en placa, se apreciaba un nódulo expansivo mucho más celular y con una cantidad menor de melanina que la placa vecina (fig. 4 del anexo). Las células de la porción nodular tenían unos núcleos de cromatina laxa con nucléolos evidentes. Aunque había escasa atipia y pleomorfismo en la mayoría de los campos, se encontraron algunas zonas focales con atipia moderada y algunas mitosis (2 mitosis/mm2) (fig. 5 del anexo).
El estudio mediante FISH para las regiones codificantes de C-MYC, CDKN2A y CCDN1 no demostró alteraciones en la porción superficial de nevus azul dendrítico ni en la porción de nevus azul en placa. En la porción nodular profunda se evidenció una amplificación de la región 8q (C-MYC). Por otro lado, el estudio mediante HGC de dicha lesión nodular detectó aberraciones cromosómicas (una pérdida de 6q y 8p y una ganancia de 6p y 8q). La expresión inmunohistoquímica del BAP1 en los núcleos estaba conservada tanto en el nódulo como en la porción de nevus azul. El diagnóstico fue de melanoma sobre nevus azul en placa, apoyado en la presencia de aberraciones cromosómicas en la porción nodular.
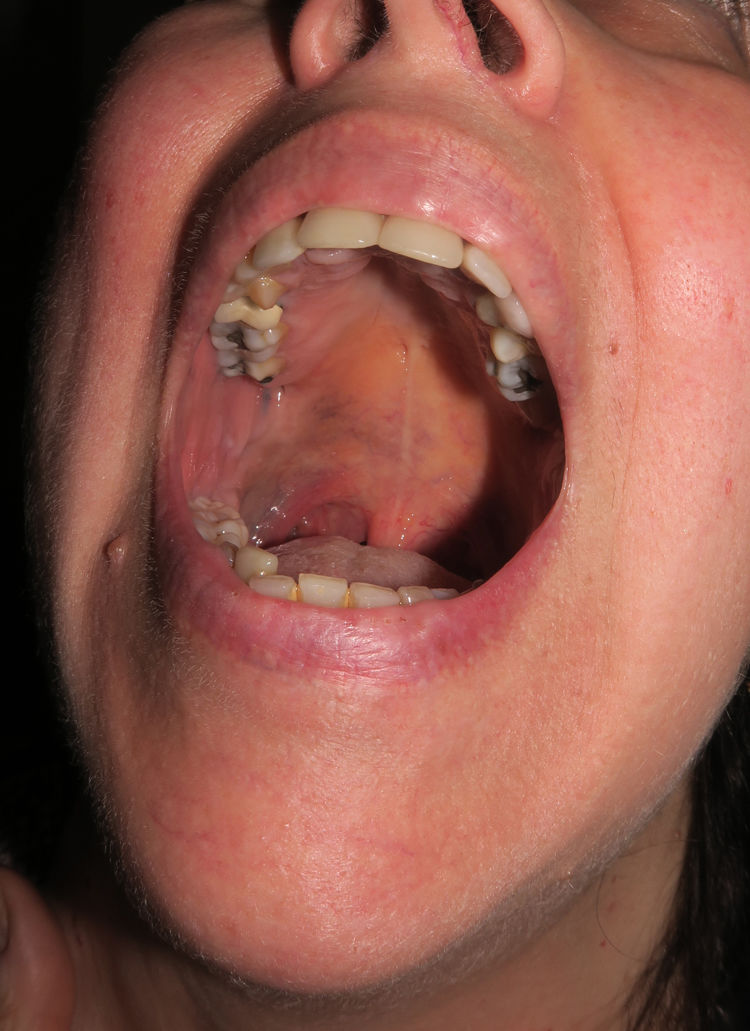
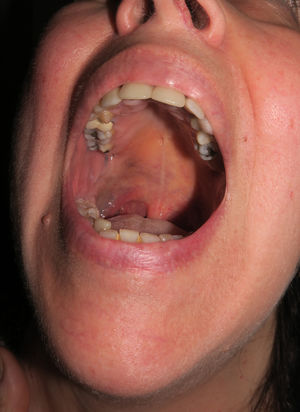
Caso 3Una mujer de 58 años presentaba desde la pubertad una pigmentación cutánea azul-grisácea que afectaba inicialmente a la región auricular derecha y áreas próximas (fig. 6 del anexo), con una extensión posterior y progresiva a la piel del cuello submentoniana y a la mucosa yugal y palatina homolateral (fig. 7 del anexo). La esclera homolateral era completamente blanca. En el curso de un mes le apareció un nódulo preauricular que, desde un punto de vista clínico se interpretó como un absceso, pero que al ser extirpado se diagnosticó de melanoma en su centro de origen.
El estudio anatomopatológico del nódulo de rápido crecimiento mostró una pieza fragmentada y artefactada, constituida por unos agregados de células epitelioides sin clara atipia ni pleomorfismo, acompañados en la periferia de abundantes melanófagos (fig. 8 del anexo). En el nódulo solo se observó una mitosis aislada. La histología de la mancha azul grisácea preexistente mostró escasos melanocitos fusiformes y melanófagos salpicados de forma dispersa en la dermis (fig. 9 del anexo), que en el contexto clínico fue diagnóstico de melanocitosis dérmica de tipo nevus de Ota.
El estudio somático molecular por NGS (ver caso 1) mostró la mutación patogénica p.Q209P en GNAQ tanto en el nódulo como en la melanocitosis dérmica.
El estudio inmunohistoquímico para BAP1 mostró una expresión nuclear conservada en el nódulo desarrollado sobre el nevus de Ota (fig. 8 del anexo: recuadro inmunohistoquimia).
El estudio de extensión no mostró ninguna lesión a distancia, por lo que se trató solo quirúrgicamente. El ganglio centinela fue negativo y la paciente permaneció sin recaídas tras 9 meses de seguimiento.
El diagnóstico final en este caso fue de nevus azul celular sobre melanocitosis dérmica.
DiscusiónEl nevus azul en placa es una variedad de nevus azul generalmente de tipo celular, que suele desarrollarse en la infancia temprana y ser de gran tamaño, mayor de 2 o 3cm, y que puede alcanzar 10cm o más4,5. Se presenta como una placa de aspecto jaspeado, similar al caso 2, formada por una agrupación confluente de nevus azules o bien como una placa azulada uniforme. El diagnóstico histológico requiere de una correlación con la clínica, ya que no tiene rasgos histológicos específicos. La proliferación puede ser profunda y alcanzar incluso la fascia6.
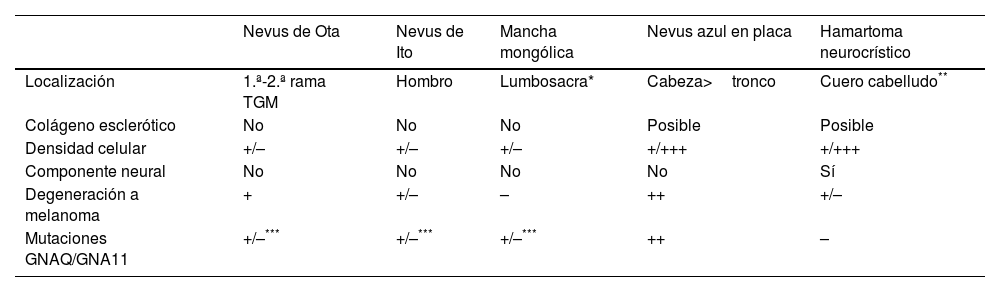
El nevus azul en placa, otras melanocitosis dérmicas y el hamartoma neurocrístico tienen rasgos característicos (tabla 1). El hamartoma neurocrístico se origina por una migración aberrante de los melanocitos desde la cresta neural hacia la epidermis, como en el nevus azul, pero a diferencia de este, se acompaña también de un componente mesenquimal y especialmente neural, con células de Schwann. Sin embargo, su distinción no es tan clara y existen casos en la literatura publicados como hamartomas neurocrísticos que muchos dermatopatólogos diagnosticarían como nevus azul7,8. Quizá el nevus azul en placa pueda ser considerado simplemente como un hamartoma neurocrístico que solo tiene componente melanocítico.
Rasgos de las melanocitosis démicas, el nevus azul en placa y el hamartoma neurocrístico
| Nevus de Ota | Nevus de Ito | Mancha mongólica | Nevus azul en placa | Hamartoma neurocrístico | |
|---|---|---|---|---|---|
| Localización | 1.ª-2.ª rama TGM | Hombro | Lumbosacra* | Cabeza>tronco | Cuero cabelludo** |
| Colágeno esclerótico | No | No | No | Posible | Posible |
| Densidad celular | +/– | +/– | +/– | +/+++ | +/+++ |
| Componente neural | No | No | No | No | Sí |
| Degeneración a melanoma | + | +/– | – | ++ | +/– |
| Mutaciones GNAQ/GNA11 | +/–*** | +/–*** | +/–*** | ++ | – |
Las manchas mongólicas aberrantes pueden aparecer fuera de la localización lumbosacra.
TGM: nervio trigémino.
En la práctica, el desarrollo de un melanoma cutáneo sobre estas lesiones ha sido descrito sobre todo en el nevus azul y, con mucha menos frecuencia, en el nevus de Ota, en el nevus de Ito y en el hamartoma neurocrístico9-11.
El término melanoma sobre nevus azul, melanoma ex-blue nevus o melanoma nevus azul-like incluye tanto a los melanomas desarrollados sobre un nevus azul preexistente (o una melanocitosis dérmica), como a los melanomas desarrollados sobre una cicatriz de una extirpación previa de nevus azul, los melanomas con rasgos histológicos similares a un nevus azul y los melanomas con un componente de nevus azul6. El melanoma ex-blue nevus es un tumor raro con menos de 200 casos publicados12,13, aunque hay casos publicados como hamartomas neurocrísticos con metástasis que se podrían considerar melanomas ex-blue nevus14 y melanomas de evolución letal sobre nevus azul en placa publicados como «nódulos sobre nevus azul en placa»15. La localización más común del melanoma ex-blue nevus es la cabeza y el cuello12, aunque se ha descrito en las nalgas y el tronco. La edad más común de aparición es entre los 45 y los 55 años y su presentación clínica más habitual es un nódulo grande y de crecimiento rápido sobre un nevus azul previo, más frecuentemente un nevus azul celular.
Los criterios histopatológicos clásicos de malignidad en los tumores melánicos no siempre se pueden utilizar en el melanoma sobre nevus azul16. La silueta asimétrica o de predominio profundo, la ausencia de maduración, o el crecimiento expansivo, así como una expresión uniforme de HMB-45 son rasgos habituales en los nevus azules. Sí que son útiles para el diagnóstico de melanoma la presencia de necrosis, un pleomorfismo elevado y la atipia, así como un índice mitótico elevado13. En los casos dudosos, la pérdida de expresión del BAP1 y la demostración de aberraciones cromosómicas mediante FISH o HGC (ganancias y pérdidas en los cromosomas 6 y 8, y pérdidas en el cromosoma 1 y 3) son indicativos de malignidad1-3. Por otra parte, a diferencia de otros melanomas cutáneos, tienen un número escaso de mutaciones y las mutaciones driver más comunes en los melanomas sobre nevus azul se encuentran en GNAQ o GNA11, mutaciones habituales en los nevus azules, y con mucha menor frecuencia mutación en CYSLTR213,16-18. Todos estos rasgos hacen que tengan más similitud con el melanoma uveal que con el cutáneo. Por otra parte, las mutaciones driver se presentan al inicio del desarrollo del tumor, de un modo análogo a las mutaciones en BRAF o NRAS en el melanoma cutáneo convencional. Son mutaciones mutuamente excluyentes y se suelen adquirir de modo somático, pero en fases tempranas del desarrollo embrionario. Estas mutaciones GNAQ/GNA11 sirven de algún modo de «marcadores de extirpe» del espectro nevus azul/melanoma ex-blue nevus. De hecho, la presencia de mutaciones en BRAF o NRAS hace difícil mantener el diagnóstico de nevus azul o melanoma ex-blue nevus16. Las mutaciones patogénicas de GNAQ o GNA11 producen una activación constitutiva de la vía de señalización RAS19. Su presencia es esencial para la aparición de un nevus azul, pero es insuficiente para originar malignidad. Se han descrito alteraciones en otros genes, de adquisición más tardía en la historia natural del melanoma sobre nevus azul, que sí que se asocian a malignidad e incluso a peor pronóstico, como la pérdida de expresión del BAP1, bien por mutación o por pérdida parcial o total de la región que lo codifica (3p21). Como se ha comentado, esta pérdida de expresión del BAP1 en el espectro de lesiones dentro del espectro nevus azul-like tiene implicaciones diagnósticas y también pronósticas1,16-18. La falta de expresión en los núcleos de un tumor nevus azul-like prácticamente permite hacer el diagnóstico de melanoma, incluso en casos con escasa atipia y sin mitosis1. Por otra parte, los melanomas nevus azul-like con pérdida del BAP1 metastatizan más que aquellos que no lo pierden1,16. Esto se ha demostrado también en el melanoma uveal19. Otras mutaciones de aparición más tardía y propias del melanoma sobre nevus azul (así como del melanoma uveal), pero no presentes en los nevus azules, son las mutaciones de los genes EIF1AX y SF3B1. El significado pronóstico de estas mutaciones está menos establecido. En una serie reciente encontraron que 3 de los 5 melanomas ex-blue nevus que tenían mutación SF3B1 fallecieron por metástasis del melanoma, lo cual resultó sorprendente para los autores porque esta mutación se asocia a un mejor pronóstico en el melanoma uveal16.
En este trabajo describimos 3 nuevos casos que ilustran el espectro nevus azul/melanoma ex-blue nevus. El caso número uno es un melanoma indudable, tanto desde el punto de vista clínico, con una recaída precoz y metástasis viscerales, como histológico, con la presencia de grandes áreas de necrosis y una marcada atipia y pleomorfismo, y molecular, la pérdida de expresión del BAP1 y la presencia de múltiples aberraciones cromosómicas. Además, la mala respuesta al tratamiento inmunoterápico es análoga a lo que ocurre en el melanoma uveal, posiblemente debido a la baja carga mutacional, lo que limita mucho las opciones terapéuticas. El caso 2 fue diagnosticado de melanoma sobre nevus azul en placa por la presencia de las aberraciones cromosómicas, pero la expresión del BAP1 y unos hallazgos histológicos mucho menos claros que en el caso 1 podría interpretarse como un nevus azul atípico. La evolución actual de este caso de momento no ha mostrado recaída ni metástasis. Por último, el tercer caso se interpretó como un nevus azul celular desarrollado en el seno de una melanocitosis dérmica, debido a la ausencia de pleomorfismo y necrosis y al hallazgo de una sola mitosis en todos los cortes estudiados, así como a la expresión mantenida de BAP1.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. José Luis Rodríguez Peralto por realizar desinteresadamente los estudios de hibridación genómica comparada.