Los estudios epidemiológicos sobre el melanoma cutáneo de cabeza y cuello (MCC) en la población española son escasos. El objetivo de este estudio es describir las características clínico-patológicas de una muestra representativa de MCC y analizar los cambios observados en un periodo de 21 años.
Material y métodosSe realizó un estudio descriptivo, transversal y retrospectivo que incluyó a 280 pacientes diagnosticados de MCC en el Hospital General Universitario Gregorio Marañón, Madrid, entre el 1 de enero de 1995 y el 31 de diciembre de 2015. Se analizaron las principales variables clínico-patológicas y se compararon en 3 periodos: 1995-2001, 2002-2008 y 2009-2015.
ResultadosLa edad media en el diagnóstico fue de 71,3 años (mediana: 74 años; rango intercuartílico [RIC]: 65-81 años). La cara fue la localización más frecuente, seguida por el cuero cabelludo. El tipo histológico predominante fue el lentigo maligno (n=172, 64%). El espesor tumoral medio fue de 1,6mm (mediana: 0,4mm; RIC: 0-2,1mm). Tras una mediana de seguimiento de 111 meses, 51 pacientes (18,2%) presentaron una recidiva y 29 pacientes (10,4%) fallecieron a raíz del melanoma.
En el periodo de tiempo estudiado se observó un aumento significativo de los pacientes con 75 o más años de edad (p=0,001), del porcentaje de melanomas in situ (p=0,003), mientras que se redujo el espesor tumoral medio (p=0,018), el número de casos con 6 o más mitosis (p=0,013), el porcentaje de pacientes con metástasis (p=0,014) y la mortalidad por melanoma (p=0,005).
ConclusionesEl MCC afecta a una población de edad media avanzada, la localización predominante es la cara y existe un elevado porcentaje de lentigo maligno. Los pacientes con MCC han presentado un espesor cada vez menor, así como una menor probabilidad de metástasis y de muerte por melanoma respecto al inicio del estudio.
Few epidemiological studies have analyzed cutaneous head and neck melanoma (CHNM) in the Spanish population. The aim of this study was to describe the clinical and histologic features of a representative sample of CHNM in Spain and to analyze changes observed over a period of 21 years.
Material and methodsDescriptive, retrospective, cross-sectional study of 280 patients diagnosed with CHNM at Hospital General Universitario Gregorio Marañón in Madrid, Spain, between January 1, 1995, and December 31, 2015. The main clinical and histologic features were analyzed and compared between 3 periods: 1995-2001, 2002-2008, and 2009-2015.
ResultsMean age at diagnosis was 71.3 years (median, 74 years; interquartile range [IQR], 65-81 years). The most common location was the face, followed by the scalp. The main histologic subtype was lentigo maligna (n=172, 64%). Mean tumor thickness was 1.6 mm (median, 0.4mm; IQR, 0-2.1mm). Median follow-up was 111 months; in this time 51 patients experienced CHNM recurrence (18.2%) and 29 died of the disease (10.4%).
In the years analyzed, we observed a significant increase in the number and percentage of patients aged 75 years or older (P=.001) and in the percentage of melanomas in situ (P=.003). We also observed a significant decrease in mean tumor thickness (P=.018), the number of cases with 6 or more mitotic figures (P=.013), the percentage of patients with metastasis (P=.014), and melanoma-specific mortality (P=.005).
ConclusionsCHNM affects elderly patients and is preferentially located on the face. The predominant subtype is lentigo maligna. Patients presented with thinner tumors over time and are now less likely to develop metastasis and to die of melanoma.
El melanoma cutáneo es una entidad heterogénea en función de múltiples factores, entre los cuales destaca la localización del mismo. El melanoma cutáneo de cabeza y cuello (MCC) engloba entre el 12 y el 30% del total de melanomas y presenta una serie de características epidemiológicas, clínico-histológicas y pronósticas que lo diferencian de los melanomas de otras zonas1,2. Los estudios focalizados en MCC son más escasos, tanto a nivel internacional como en España. Este tipo de estudios puede ayudar a caracterizar mejor qué poblaciones son las más afectadas y de qué manera llegan a ser afectadas, con el objetivo de poder mejorar las estrategias de prevención y/o el diagnóstico precoz.
Por todo ello, en este estudio queremos reflejar las principales características clínico-histológicas, así como la probabilidad de metástasis y muerte por melanoma, y los principales cambios observados en todas estas variables que han sufrido los pacientes con MCC a lo largo de un periodo de 21 años en el contexto de una población española.
Material y métodosSe realizó un estudio retrospectivo que incluyó a todos los pacientes diagnosticados de un melanoma localizado en la cabeza o el cuello, con confirmación histológica, en el HGU Gregorio Marañón de Madrid y en los centros sanitarios asociados al mismo, en el periodo comprendido entre el 1 de enero de 1995 y el 31 de diciembre de 2015. Se incluyeron tanto los melanomas in situ (estadio Tis) como los invasivos. Se excluyeron de este estudio los melanomas localizados a nivel de mucosas o partes blandas, los melanomas metastásicos sin un tumor primario conocido y los pacientes sin información del espesor tumoral o del seguimiento.
Los datos clínicos se obtuvieron de las historias clínicas de los pacientes, los datos histopatológicos de los correspondientes informes elaborados por el servicio de anatomía patológica y se registraron en una base de datos específica para el estudio de forma anonimizada. Se establecieron 3 intervalos iguales de años para facilitar el análisis segmentado de los pacientes a lo largo del periodo de seguimiento: 1995-2001, 2002-2008 y 2009-2015. Las características clínicas incluyeron: sexo, localización (cuero cabelludo, cara, oreja y cuello) y edad (recogida como variable continua y también en forma de intervalos: ≤60, 61-74 y ≥75 años). Los datos histológicos incluyeron: tipo histológico (lentigo maligno, extensión superficial, nodular, otros), presencia de ulceración histológica, espesor tumoral (recogido como variable continua y también en forma de variable cualitativa ordinal con intervalos de espesor T1-T4), presencia de componente invasivo del melanoma, número de mitosis/mm2, desarrollo de metástasis y estado vital del paciente. El número de mitosis/mm2 fue recogida en más del 85% de los pacientes con melanoma invasivo. La técnica usada para contabilizar el número de mitosis fue la llamada «hot spot»3. Se establecieron 3 intervalos definidos de número de mitosis (0, 1-5, ≥6 mitosis/mm2), ya que otros autores han descrito la implicación pronóstica y su posible relación con la positividad del ganglio centinela cuando se superan las 6 mitosis/mm24,5. Algunos casos no reflejaban el número de mitosis en el informe anatomopatológico, por lo que dichas muestras fueron revisadas por 2 patólogos expertos en el diagnóstico de lesiones melanocíticas. También se recogió la aparición de metástasis y el estado vital de los pacientes.
En los casos que se compararon variables cualitativas se usaron la prueba Chi-cuadrado y la prueba exacta de Fisher. También se usó la corrección de «Benjamini-Hochberg» para obtener una mayor precisión en los resultados obtenidos y disminuir el efecto de las comparaciones múltiples. En las comparaciones entre variables cualitativas y cuantitativas, la comparación de medias se realizó mediante las pruebas t de Student o ANOVA, según correspondiese. El nivel de significación estadística a alcanzar para todos los casos fue de p<0,05. Los datos obtenidos se analizaron con el programa SPSS® versión 25 (Illinois, Inc; EE. UU.).
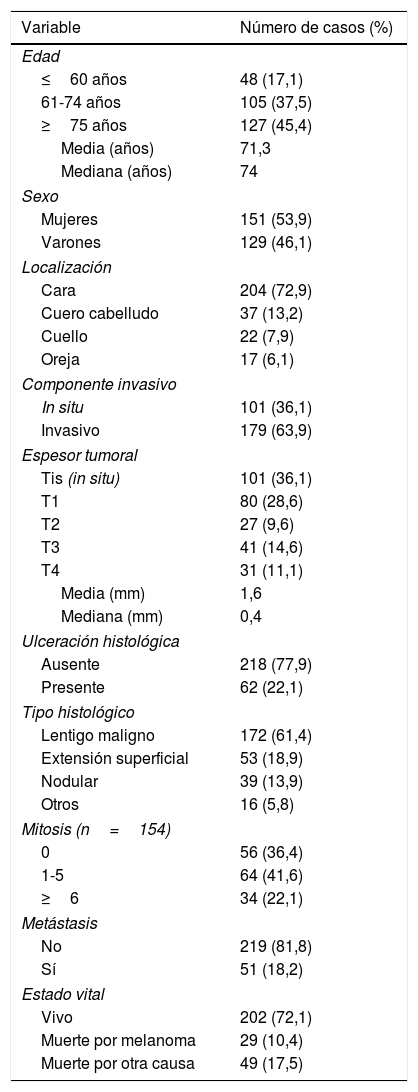
ResultadosCaracterísticas globalesSe identificaron un total de 280 pacientes que habían sido diagnosticados y tratados de MCC en el intervalo 1995-2015. Previamente se habían excluido un total de 13 pacientes por no cumplir con los criterios descritos previamente. En la tabla 1 se recogen los datos clínicos, histológicos y evolutivos más relevantes.
Características epidemiológicas, clínicas, histológicas y evolutivas de los pacientes de la muestra
| Variable | Número de casos (%) |
|---|---|
| Edad | |
| ≤60 años | 48 (17,1) |
| 61-74 años | 105 (37,5) |
| ≥75 años | 127 (45,4) |
| Media (años) | 71,3 |
| Mediana (años) | 74 |
| Sexo | |
| Mujeres | 151 (53,9) |
| Varones | 129 (46,1) |
| Localización | |
| Cara | 204 (72,9) |
| Cuero cabelludo | 37 (13,2) |
| Cuello | 22 (7,9) |
| Oreja | 17 (6,1) |
| Componente invasivo | |
| In situ | 101 (36,1) |
| Invasivo | 179 (63,9) |
| Espesor tumoral | |
| Tis (in situ) | 101 (36,1) |
| T1 | 80 (28,6) |
| T2 | 27 (9,6) |
| T3 | 41 (14,6) |
| T4 | 31 (11,1) |
| Media (mm) | 1,6 |
| Mediana (mm) | 0,4 |
| Ulceración histológica | |
| Ausente | 218 (77,9) |
| Presente | 62 (22,1) |
| Tipo histológico | |
| Lentigo maligno | 172 (61,4) |
| Extensión superficial | 53 (18,9) |
| Nodular | 39 (13,9) |
| Otros | 16 (5,8) |
| Mitosis (n=154) | |
| 0 | 56 (36,4) |
| 1-5 | 64 (41,6) |
| ≥6 | 34 (22,1) |
| Metástasis | |
| No | 219 (81,8) |
| Sí | 51 (18,2) |
| Estado vital | |
| Vivo | 202 (72,1) |
| Muerte por melanoma | 29 (10,4) |
| Muerte por otra causa | 49 (17,5) |
Hubo un cierto predominio femenino en nuestra muestra y la edad media de los pacientes fue de 71,3 años (mediana: 74 años; RIC: 65-81 años). El grupo de pacientes de edad más avanzada (≥75 años) fue el más numeroso y englobó a 127 (45,4%) pacientes.
La localización más habitual fue la cara, seguida a distancia en orden decreciente por el cuero cabelludo, cuello y orejas. Casi 3 de cada 4 melanomas estuvieron localizados en la cara.
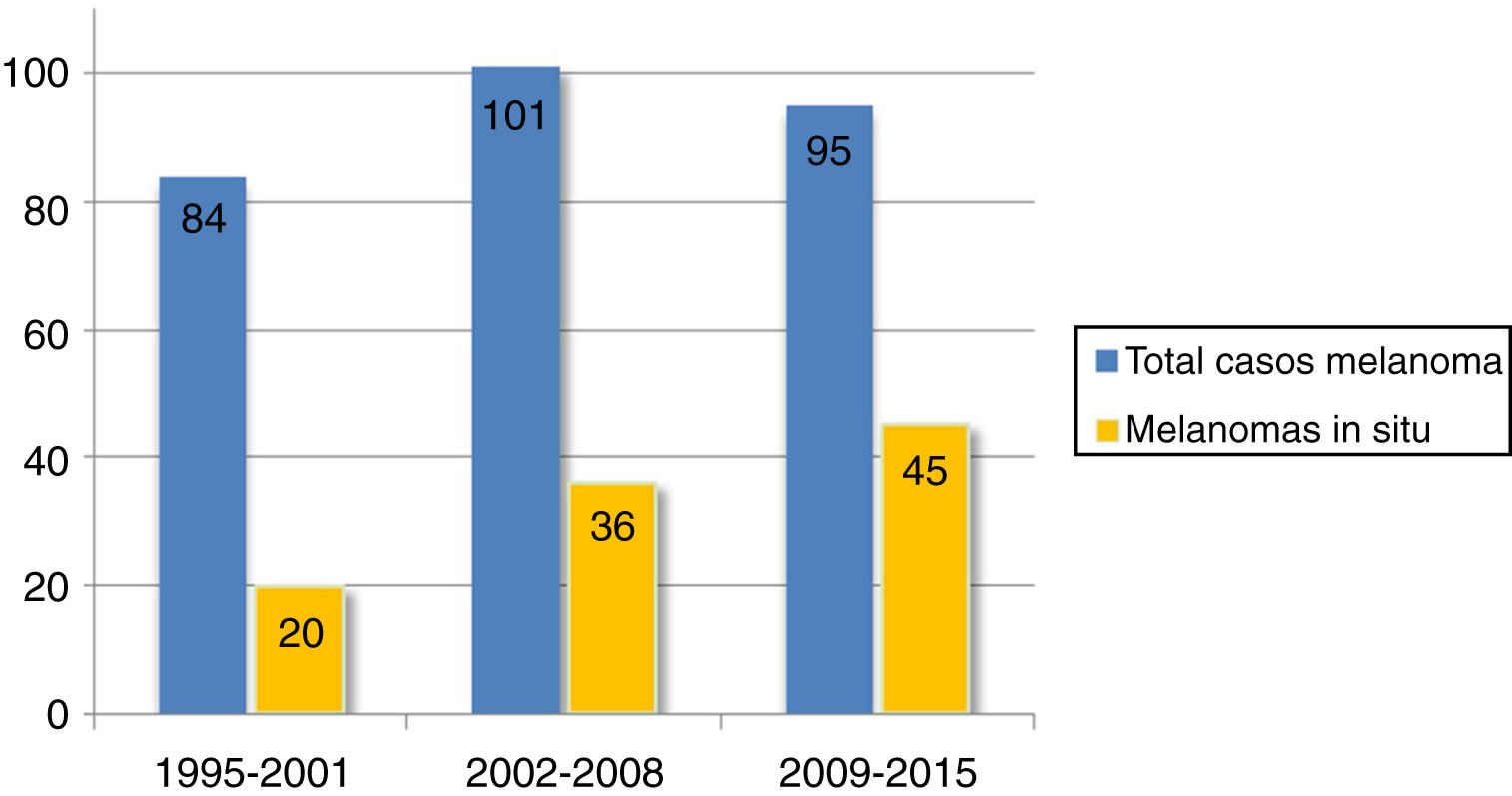
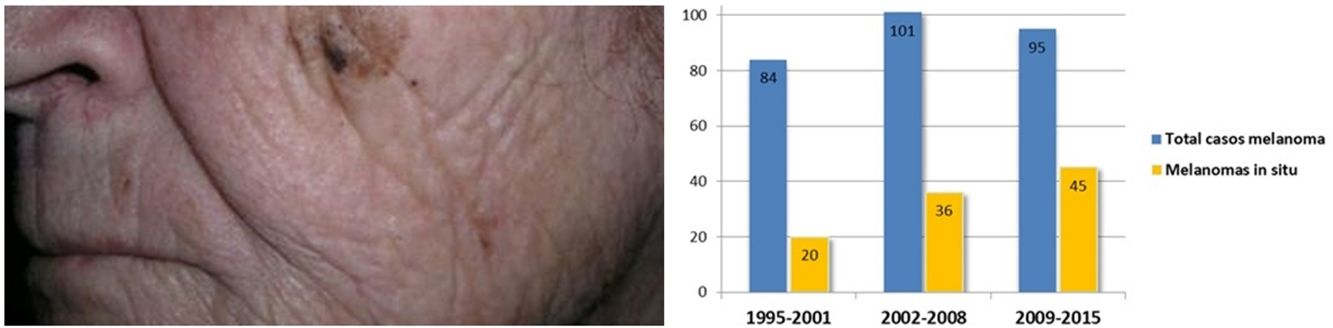
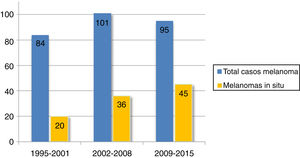
Se encontró un número elevado de melanomas in situ: 101 (36,1%) (fig. 1). La mediana del espesor tumoral fue de 0,4mm (intervalo: 0-18mm). También llamó la atención un número considerable de tumores gruesos: 72 pacientes (25,7%) presentaron MCC con espesor tumoral T3-T4.
El tipo histológico predominante fue el lentigo maligno, con 172 casos (61,4%). El segundo en frecuencia fue el melanoma de extensión superficial, seguido por el melanoma nodular. Si tenemos en cuenta únicamente los melanomas invasivos, 98 (63,7%) de ellos tuvo al menos 1 mitosis/mm2. Además, 34 (22,1%) de estos melanomas presentó un número elevado de mitosis —6 o más—.
Tras una mediana de seguimiento de 111 meses, 51 pacientes (18,2%) presentaron una recidiva y 29 pacientes (10,4%) fallecieron a raíz del melanoma. En la tabla 2 se recoge la localización inicial de las metástasis encontradas.
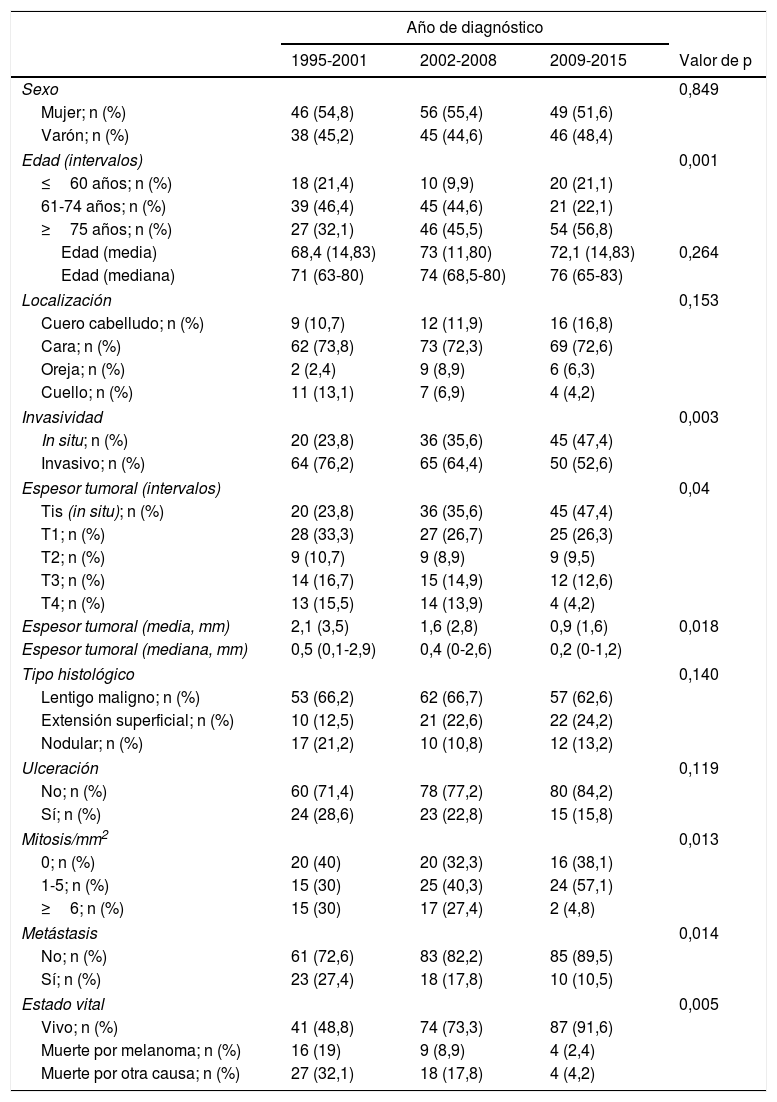
Cambios evolutivos a lo largo del estudioEn la tabla 3 se recoge la comparativa entre las distintas variables en función del periodo de tiempo estudiado.
Comparación de las distintas variables entre los 3 intervalos de años establecidos
| Año de diagnóstico | ||||
|---|---|---|---|---|
| 1995-2001 | 2002-2008 | 2009-2015 | Valor de p | |
| Sexo | 0,849 | |||
| Mujer; n (%) | 46 (54,8) | 56 (55,4) | 49 (51,6) | |
| Varón; n (%) | 38 (45,2) | 45 (44,6) | 46 (48,4) | |
| Edad (intervalos) | 0,001 | |||
| ≤60 años; n (%) | 18 (21,4) | 10 (9,9) | 20 (21,1) | |
| 61-74 años; n (%) | 39 (46,4) | 45 (44,6) | 21 (22,1) | |
| ≥75 años; n (%) | 27 (32,1) | 46 (45,5) | 54 (56,8) | |
| Edad (media) | 68,4 (14,83) | 73 (11,80) | 72,1 (14,83) | 0,264 |
| Edad (mediana) | 71 (63-80) | 74 (68,5-80) | 76 (65-83) | |
| Localización | 0,153 | |||
| Cuero cabelludo; n (%) | 9 (10,7) | 12 (11,9) | 16 (16,8) | |
| Cara; n (%) | 62 (73,8) | 73 (72,3) | 69 (72,6) | |
| Oreja; n (%) | 2 (2,4) | 9 (8,9) | 6 (6,3) | |
| Cuello; n (%) | 11 (13,1) | 7 (6,9) | 4 (4,2) | |
| Invasividad | 0,003 | |||
| In situ; n (%) | 20 (23,8) | 36 (35,6) | 45 (47,4) | |
| Invasivo; n (%) | 64 (76,2) | 65 (64,4) | 50 (52,6) | |
| Espesor tumoral (intervalos) | 0,04 | |||
| Tis (in situ); n (%) | 20 (23,8) | 36 (35,6) | 45 (47,4) | |
| T1; n (%) | 28 (33,3) | 27 (26,7) | 25 (26,3) | |
| T2; n (%) | 9 (10,7) | 9 (8,9) | 9 (9,5) | |
| T3; n (%) | 14 (16,7) | 15 (14,9) | 12 (12,6) | |
| T4; n (%) | 13 (15,5) | 14 (13,9) | 4 (4,2) | |
| Espesor tumoral (media, mm) | 2,1 (3,5) | 1,6 (2,8) | 0,9 (1,6) | 0,018 |
| Espesor tumoral (mediana, mm) | 0,5 (0,1-2,9) | 0,4 (0-2,6) | 0,2 (0-1,2) | |
| Tipo histológico | 0,140 | |||
| Lentigo maligno; n (%) | 53 (66,2) | 62 (66,7) | 57 (62,6) | |
| Extensión superficial; n (%) | 10 (12,5) | 21 (22,6) | 22 (24,2) | |
| Nodular; n (%) | 17 (21,2) | 10 (10,8) | 12 (13,2) | |
| Ulceración | 0,119 | |||
| No; n (%) | 60 (71,4) | 78 (77,2) | 80 (84,2) | |
| Sí; n (%) | 24 (28,6) | 23 (22,8) | 15 (15,8) | |
| Mitosis/mm2 | 0,013 | |||
| 0; n (%) | 20 (40) | 20 (32,3) | 16 (38,1) | |
| 1-5; n (%) | 15 (30) | 25 (40,3) | 24 (57,1) | |
| ≥6; n (%) | 15 (30) | 17 (27,4) | 2 (4,8) | |
| Metástasis | 0,014 | |||
| No; n (%) | 61 (72,6) | 83 (82,2) | 85 (89,5) | |
| Sí; n (%) | 23 (27,4) | 18 (17,8) | 10 (10,5) | |
| Estado vital | 0,005 | |||
| Vivo; n (%) | 41 (48,8) | 74 (73,3) | 87 (91,6) | |
| Muerte por melanoma; n (%) | 16 (19) | 9 (8,9) | 4 (2,4) | |
| Muerte por otra causa; n (%) | 27 (32,1) | 18 (17,8) | 4 (4,2) | |
Se indica desviación estándar en caso de medias y rango intercuartílico en el caso de medianas.
No se encontró un cambio de tendencia en cuanto al predominio del sexo femenino en nuestra muestra. En todos los periodos de tiempo, las mujeres representaron más de la mitad de los pacientes.
Los pacientes con una edad más avanzada (≥75 años) adquirieron un peso progresivamente mayor, ya que aumentaron desde 27 casos (32,1%) en el periodo 1995-2001 hasta los 54 casos (56,8%) del último periodo, 2009-2015 (p=0,001). La edad media de los pacientes aumentó desde los 68,4 años (mediana: 71 años) iniciales hasta los 72,1 (mediana: 76 años) del último periodo.
En cuanto a la localización del melanoma, la cara fue siempre la más frecuente. Aunque no llegó a alcanzar significación estadística, se encontró un cierto aumento progresivo de melanomas en el cuero cabelludo, mientras que los melanomas cervicales fueron cada vez menos frecuentes.
El espesor tumoral se redujo significativamente desde los 2,1mm de media del intervalo 1995-2001 hasta los 0,9mm del último intervalo 2009-2015 (p=0,018). Los melanomas in situ aumentaron a su vez de forma progresiva a lo largo de los años: inicialmente englobaban 20 casos (23,8% del total de MCC), mientras que en los últimos años esta cifra llegó hasta los 45 casos (47,4%) (p=0,003). Por otro lado, los melanomas T4, con un mayor espesor, se redujeron significativamente de forma progresiva.
Se encontró una tendencia hacia una menor frecuencia de ulceración histológica de los MCC, pasando de 24 casos (28,6%) en el periodo 1995-2001 hasta tan solo 15 casos (15,8%) en el periodo 2009-2015, aunque estas cifras no alcanzaron significación estadística (p=0,119). En cuanto al tipo histológico, el tipo lentigo maligno fue siempre el predominante y se apreció una tendencia a una menor proporción de melanomas nodulares conforme avanzaba el intervalo estudiado.
Los MCC con 6 o más mitosis se redujeron significativamente a lo largo del estudio, pasando de 15 casos (30%) a únicamente 2 casos (4,8%) (p=0,013).
Los pacientes que desarrollaron metástasis fueron progresivamente menos frecuentes a lo largo del estudio: 23 pacientes (27,4%) presentaron metástasis en el intervalo 1995-2001 frente a tan solo 10 pacientes (10,5%) en el intervalo 2009-2015 (p=0,014). De forma similar, también se redujo significativamente la mortalidad por melanoma, pasando de 16 casos (19%) en el periodo inicial a tan solo 4 casos (2,4%) en los últimos años del estudio (p=0,005).
DiscusiónEl territorio de cabeza y cuello representa el 9% de la superficie corporal, sin embargo, en esta zona aparecen entre un 12 y un 30% del total de melanomas cutáneos6–10. Pese a la evidente importancia de esta localización, no hemos encontrado trabajos focalizados en el MCC en el contexto de la población española y debemos comparar nuestros resultados bien con series internacionales o con datos parciales de otras series de melanoma realizadas en España.
En poblaciones europeas-caucásicas, incluyendo España, suele describirse un predominio femenino entre los pacientes con melanoma11–13. En cuanto al MCC, algunos estudios reflejan que estos melanomas se asocian más frecuentemente al sexo masculino respecto a los melanomas de otras zonas14. Sin embargo, los resultados en las distintas series son dispares y en las últimas décadas encontramos tanto trabajos donde hay un predominio femenino6,15 como otros donde predominan los varones16,17. En nuestra serie las mujeres superaron discretamente a los varones, con un 53,9% de los casos. Esto coincide con el predominio femenino encontrado en el estudio realizado por Arranz-Sánchez et al.12 en la población de Madrid entre 1990 y 2004, con un 60% de los MCC diagnosticados en mujeres.
El MCC afecta a una población con una edad media mayor respecto al resto de melanomas, independientemente del subtipo histológico2,18. La edad media al diagnóstico en el MCC varía de 64 a 71 años frente a los 50-58 años de edad media del resto de melanomas cutáneos2,7,14. En nuestro estudio, los pacientes presentaron una edad media de 71,3 años y casi la mitad de los pacientes presentó una edad de 75 o más años. Estos datos van en la línea de lo encontrado en un estudio poblacional realizado en un centro oncológico de la Comunidad Valenciana donde se reflejó cómo los pacientes de mayor edad —mayores de 65 años en este caso— engloban a más del 50% del total de MCC19. En nuestra serie, encontramos que el grupo de pacientes de edad más avanzada (≥75 años) alcanzó un porcentaje cada vez más significativo a lo largo del periodo de estudio en nuestra serie. En el periodo 2009-2015 este grupo de pacientes representaba el 56,8% del total de MCC, mientras que en el periodo 1995-2001 solo representaba el 32,1%. Esto coincide con el aumento de la edad media de los pacientes diagnosticados de melanoma observado en otros países20 y en el caso del MCC probablemente se debe al alto porcentaje de melanomas tipo lentigo maligno, asociado al efecto acumulativo de la exposición solar crónica.
La cara representó la localización más frecuente en nuestro estudio. En todas las series de MCC consultadas aparece la cara como localización más prevalente: entre el 53,2 y el 78,5% de los MCC están localizados en la zona facial1,6,7,15. Esto no es de extrañar al tratarse de un área amplia que recibe una intensa cantidad de radiación ultravioleta. Aunque no llegó a alcanzar significación estadística, los melanomas de cuello se redujeron progresivamente a lo largo del estudio, mientras que los de cuero cabelludo aumentaron.
Casi 2 de cada 3 MCC de nuestra serie correspondieron al tipo histológico lentigo maligno. Le siguieron en frecuencia el melanoma de extensión superficial y el melanoma nodular. Clásicamente se ha descrito cómo el lentigo maligno se asocia al territorio de cabeza y cuello y la mayor parte de trabajos refleja que constituye el tipo histológico predominante en esta zona1,6,7,18,21. No obstante, en algunas series de MCC predominan los melanomas de extensión superficial16,17, y en nuestro trabajo ocuparon el segundo lugar en frecuencia con un porcentaje considerable de casos (18,9%).
El 36,1% de los MCC de nuestra serie fueron melanomas in situ. Otros trabajos de MCC reflejan un porcentaje variable de melanomas in situ que comprende desde el 32 hasta el 49,5%2,7,22. Esto representa un porcentaje mayor de melanomas in situ en cabeza y cuello respecto al resto de localizaciones: el Registro Nacional de Melanoma Cutáneo refleja que el porcentaje de melanomas in situ se sitúa en el 16%9. Asimismo, encontramos más del doble de melanomas in situ en el periodo 2009-2015 frente al periodo inicial 1995-2001, lo que refleja el aumento progresivo de melanomas in situ a lo largo de las 2 últimas décadas. Esta tendencia se ha observado tanto en MCC como en los melanomas de otras localizaciones12,13,23 y probablemente pueda explicarse por un diagnóstico cada vez más precoz por el uso de la dermatoscopia y por un seguimiento protocolizado de pacientes en riesgo.
El espesor tumoral medio fue de 1,6mm. Este se redujo significativamente a lo largo del estudio, pasando de 2,1mm (intervalo: 1995-2001) a 0,9mm (intervalo: 2009-2015). Esta reducción en el espesor tumoral medio supone una tendencia que se ha registrado a nivel global a lo largo de las últimas décadas12,23, aunque la mayor parte son estudios que no están limitados al MCC como el nuestro. Un estudio con 98.498 pacientes basado en varios registros Surveillance, Epidemiology and End Results (SEER) de EE. UU., constató una reducción del espesor tumoral medio de 0,77 a 0,65mm en un intervalo de 20 años24. El conjunto de melanomas T3 y T4 supuso un porcentaje considerable (25,7%) del total de MCC de nuestra muestra. Esta heterogeneidad en el espesor tumoral en el MCC —elevada frecuencia tanto de melanomas in situ como de melanomas gruesos— también ha sido descrita por otros autores7, y parece reflejar la coexistencia de numerosos melanomas tipo lentigo maligno junto con otros melanomas de rápido crecimiento, como el melanoma nodular.
El número de mitosis por mm2 representa un marcador cuantificable de la proliferación celular tumoral en el melanoma, se ha relacionado estrechamente con la supervivencia y numerosos estudios lo consideran un factor pronóstico independiente3,25,26. Son escasos los trabajos que describen este hallazgo histológico en el MCC27–29. Shen et al. encontraron que los MCC se asocian a un elevado número de mitosis28, mientras que otros circunscriben este elevado número de mitosis a los melanomas de cuero cabelludo30. En nuestra muestra, el 63,6% de MCC presentaron ≥1 mitosis/mm2. Xie et al. reflejaron en una amplia serie de pacientes con MCC que el 65% del total de MCC presentaban un número de mitosis igual o superior a uno, cifra casi superponible a la encontrada en nuestro estudio. En ese trabajo describieron también que el 30,4% de los pacientes presentaban 5 o más mitosis/mm2, cifra similar al porcentaje de pacientes con mayor actividad mitótica (≥6 mitosis/mm2) encontrado en nuestra serie. Estas cifras son superiores a las descritas en los melanomas cutáneos de otras zonas31. Por otro lado, encontramos que los melanomas con alta actividad mitótica fueron cada vez menos frecuentes en nuestro estudio.
En último lugar, cabe destacar cómo el pronóstico de los pacientes con MCC ha ido mejorando en las 2 últimas décadas: se ha reducido significativamente el desarrollo de metástasis y también el número de muertes por melanoma. Es llamativa la reducción en la mortalidad por melanoma pasando del 19% de muertes por melanoma en el periodo 1995-2001 hasta el 2,4% del último periodo 2009-2015. Este hecho pueda ser posiblemente explicado por la reducción en el espesor tumoral medio, así como un menor número de mitosis y presencia de ulceración.
ConclusionesEn este trabajo presentamos los datos de una muestra amplia de pacientes diagnosticados de MCC en un hospital terciario de la población madrileña.
Las características clínico-histológicas de nuestra muestra coinciden en buena parte con lo ya publicado en la literatura: la localización predominante es la cara y existe un elevado porcentaje de melanomas tipo lentigo maligno. Un porcentaje significativo de los melanomas invasivos presentó una elevada actividad mitótica (≥6 mitosis/mm2).
El MCC afecta a una población con una edad media cada vez mayor, lo que refleja la necesidad de nuevos estudios focalizados en el melanoma de este territorio al encontrarnos en el marco de una sociedad cada vez más envejecida.
Nuestro trabajo refleja cómo los MCC han presentado un espesor cada vez menor, así como una menor probabilidad de metástasis y de muerte por melanoma respecto al inicio del estudio.