El melanoma acral está asociado con un pronóstico desfavorable. El estudio sobre las características y el pronóstico en los pacientes caucásicos puede ser crucial para comprender las características distintivas de este tumor.
ObjetivosAnalizar las características epidemiológicas, clinicopatológicas y pronósticas del melanoma acral en los pacientes caucásicos.
Material y métodosEstudio de cohorte retrospectivo de melanoma acral a partir de una base de datos multiinstitucional en 20 hospitales españoles, entre enero de 2000 y diciembre de 2019.
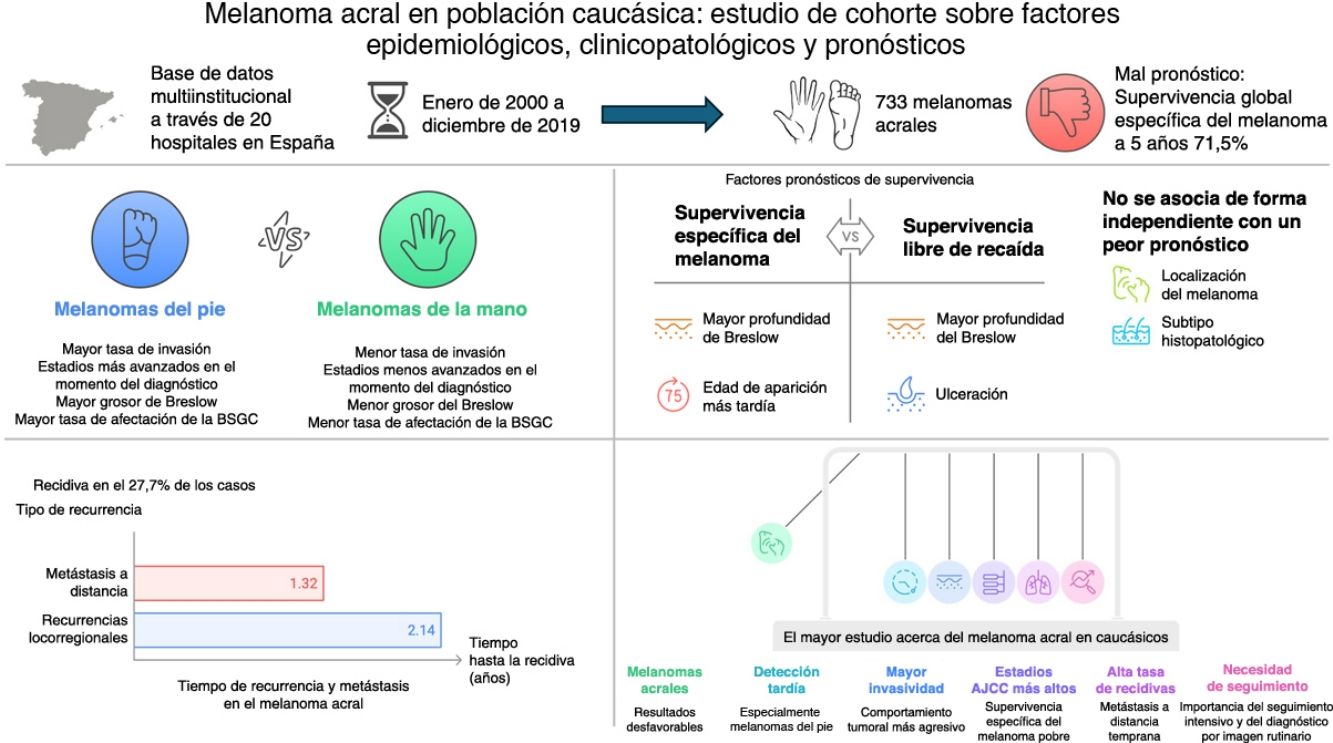
ResultadosSe identificaron un total de 733 melanomas acrales (edad media: 67,5 años, el 95,2% caucásicos y el 77,5% en los pies). En general, el 77,5% de los casos fueron invasivos. Los melanomas localizados en los pies tuvieron una mayor proporción de casos invasivos (80,8 vs. 69,8%; p=0,003), estadios III y IV al diagnóstico (24,8 vs. 11,7%; p<0,001), valores de Breslow más altos (2,8 vs. 2,0mm; p=0,021) y una mayor tasa de positividad de biopsia selectiva del ganglio centinela (30,7 vs. 15,7%; p=0,012). Un mayor índice de Breslow y una edad de aparición más tardía fueron factores de riesgo para menor supervivencia específica por melanoma. Un mayor índice de Breslow y la ulceración fueron factores pronósticos independientes para menor supervivencia libre de recaída. La localización del melanoma y el subtipo histopatológico no se asociaron con un peor pronóstico. Las recurrencias fueron frecuentes (27,7%), y las metástasis a distancia aparecieron antes que las recurrencias locorregionales (1,32 años [RIC: 1,12-1,87] vs. 2,14 años [RIC: 1,68-2,70]; p=0,015).
ConclusiónEste estudio, el mayor en una población predominantemente caucásica, subraya los resultados desfavorables del melanoma acral. Los melanomas en los pies mostraron una detección tardía, mayor proporción de melanomas invasivos, valores de Breslow más altos, mayor positividad o afectación de biopsia selectiva del ganglio centinela y estadios AJCC más avanzados. La alta tasa de recurrencia y las metástasis a distancia tempranas enfatizan el papel crítico del seguimiento intensivo y las pruebas de imagen rutinarias para detectar recaídas asintomáticas.
Acral melanoma is associated with poor prognosis. Studying the characteristics and prognosis of Caucasian patients is crucial to understand the distinct features of this tumor.
ObjectivesTo analyze the epidemiological, clinicopathological, and prognostic features of acral melanoma in Caucasian patients.
MethodsWe conducted a retrospective, multicenter, cohort study of acral melanoma from a database across 20 hospitals from South Europe from January 2000 to December 2019.
ResultsA total of 733 acral melanomas were identified (median age, 67.5 years; 95.2%, Caucasians; 77.5% of which were located on the feet). Overall, 77.5% of cases were invasive melanomas. Foot melanomas had a higher proportion of invasive cases (80.8% vs. 69.8%; P=0.003), stages III and IV at diagnosis (24.8% vs. 11.7%; P<0.001), thicker Breslow depth (2.8mm vs. 2.0mm; P=0.021) and a higher rate of positive sentinel lymph node biopsy (30.7% vs. 15.7%; P=0.012). Thicker Breslow depth and later age of onset were risk factors for melanoma-specific survival. Thicker Breslow depth and ulceration were independent prognostic factors of relapse-free survival. Melanoma location and histopathological subtype were not associated with worse prognosis. Recurrences were a common finding (27.7%), with distant metastases appearing earlier than locorregional recurrences (1.32 years [IQR, 1.12-1.87] vs. 2.14 years [IQR, 1.68-2.70]; P=0.015).
ConclusionThis study, the largest in a predominantly Caucasian population, underscores the unfavorable outcomes of acral melanoma. Foot melanomas exhibited delayed detection, increased invasiveness, thicker Breslow depth, increased sentinel lymph node biopsy involvement, and higher AJCC stages. The high recurrence rate and early distant metastases emphaise the critical role of intensive follow-up and routine imaging modalities to detect asymptomatic relapses.
El melanoma acral afecta a todas las poblaciones del mundo y se describe como un subgrupo distinto de melanoma debido a sus características únicas, incluidas las epidemiológicas, las clinicopatológicas, las moleculares y las pronósticas1-8.
Según la Organización Mundial de la Salud, el melanoma acral es el que aparece en la piel glabra (sin pelo) de la cara volar de los dedos de las manos y los pies, las palmas de las manos, las plantas de los pies y los lechos ungueales8. Por otra parte, el melanoma lentiginoso acral (MLA) es un subtipo histopatológico de melanoma, caracterizado también por tener rasgos histológicos específicos8-10.
El melanoma acral se asocia claramente a un peor pronóstico que el melanoma cutáneo en otras localizaciones1,2,6,8,10,11. Este pronóstico adverso se ha atribuido a varios factores, como un mayor índice de Breslow y estadios más avanzados, que se podrían atribuir a un diagnóstico tardío debido en parte a la edad avanzada y a su aparición en localizaciones anatómicas no visibles, pero también a un comportamiento más agresivo del subtipo histopatológico o al perfil molecular de las zonas no expuestas al sol1,2,4,6,8,10-12.
En el presente estudio, utilizamos una serie amplia de casos de melanoma acral obtenidos de una red multicéntrica de melanoma del sur de Europa, que fue recogida durante 2décadas, con la finalidad de evaluar las características epidemiológicas, clinicopatológicas y pronósticas centrándonos en la localización del melanoma, y analizar los patrones de recurrencia, la supervivencia específica del melanoma (SEM) y la supervivencia libre de recaída (SLR) que pueden influir en el seguimiento y en el tratamiento de los pacientes con un melanoma acral.
Materiales y métodosSe utilizó la base de datos de la Red de Centros de Melanoma de Cataluña (Xarxa Melanoma Catalunya)13-15, un proyecto de base de datos colaborativa, prospectiva y multicéntrica que incluye más de 20 hospitales del noreste de España, para realizar un estudio retrospectivo de los pacientes con melanoma acral desde enero del 2000 hasta diciembre del 2019 y con un seguimiento hasta agosto del 2023.
En el estudio se incluyeron al principio todos los pacientes diagnosticados de melanoma en una localización acral, cuyo diagnóstico debía estar debidamente confirmado y registrado en dichos centros. La recogida de datos y el análisis de todos los pacientes se aprobaron con el número de referencia del protocolo (HCB IRB; aprobación n.° 2015/0298). Se excluyeron los casos que no se ajustaban a la definición de melanoma acral de la Organización Mundial de la Salud, manteniendo únicamente los localizados en la piel glabra de manos y pies, incluido el aparato ungueal. También se excluyeron los casos en los que la localización no era concordante o estaban mal definidos.
La variable principal utilizada para analizar los datos fue la localización anatómica de la mano y el pie. Se registró información sobre los datos demográficos, las características del melanoma y los datos pronósticos. Las variables analizadas incluyeron el sexo, la edad en el momento del diagnóstico, color de piel o etnia, y el número de melanomas primarios. Las características del melanoma incluían la localización (pie vs. mano); el estadio (in situ vs. invasivo), la estadificación según la 8.ª edición del American Joint Committee on Cancer (AJCC), el subtipo histopatológico (melanoma lentiginoso acral, [MLA], melanoma de extensión superficial, [MES], melanoma lentigo maligno, melanoma nodular [MN] y otros subtipos), el índice de Breslow, la presencia de figuras mitóticas, la ulceración, los nevus asociados y la satelitosis; la realización de la biopsia selectiva del ganglio centinela (BSGC) y su estado. Los datos pronósticos incluían los patrones de recurrencia: momento y localización (locorregional [ganglio linfático o en tránsito/satelitosis] y órganos a distancia). El análisis de supervivencia se realizó utilizando la SEM y la SLR a los 5 años mediante el método de Kaplan-Meier. Las muertes relacionadas con el melanoma se determinaron a partir de los certificados de defunción y la historia clínica de los pacientes. La SEM se refiere al tiempo transcurrido desde la extirpación del melanoma hasta la fecha de la muerte directamente atribuida a la enfermedad. La SLR se refiere al periodo transcurrido desde la extirpación del melanoma hasta la detección de la enfermedad en los pacientes que no presentaban enfermedad residual tras los procedimientos quirúrgicos.
Análisis estadísticoSe utilizaron las frecuencias y los porcentajes para representar las distribuciones de las variables categóricas, mientras que las distribuciones de las variables continuas se expresaron como mediana y rango intercuartílico (RIC). El análisis de las variables categóricas incluyó la prueba de chi-cuadrado de Pearson, o la prueba exacta de Fisher cuando cualquier recuento celular esperado era menor de5. Por su parte, las variables ordinales se expresaron mediante la prueba de tendencia. En el contexto de la comparación de variables continuas independientes, se empleó la prueba de suma de rangos de Wilcoxon.
La mediana de seguimiento de la cohorte se estimó mediante el estimador inverso de Kaplan-Meier. Esta estimación se realizó aplicando el paquete Prodlim (versión 2023.3.31) en R, utilizando las funciones ‘prodlim’ e ‘Hist’.
Se realizaron análisis de supervivencia univariantes y multivariantes, presentando los cocientes de riesgos (HR) con intervalos de confianza del 95% a partir de modelos de riesgos proporcionales de Cox ajustados. Estos modelos se crearon utilizando la función ‘coxph’ en el paquete ‘survival’ (versión 3.5.5) en R. Se calcularon los HR para la localización del melanoma acral (pies vs. manos), ajustados de forma independiente por edad en el momento del diagnóstico, sexo, índice de Breslow, ulceración y subtipo histológico. Una tabla de regresión de Cox mostró los cocientes de riesgos univariantes y multivariantes para una mejor visualización de los datos.
Dentro del subgrupo de pacientes metastásicos, evaluamos el momento de la recaída de los melanomas acrales mediante un gráfico de eventos acumulativos, calculando la mediana del tiempo de supervivencia. Además, utilizamos gráficos de Sankey para representar las primeras localizaciones metastásicas de los pacientes con melanoma acral. También determinamos las proporciones de pacientes en cada grupo con progresión de la enfermedad.
Todos los análisis estadísticos se realizaron utilizando el entorno informático R versión 4.3.1 (2023-06-16) y RStudio (versión 2023.6.1.524). Se consideró estadísticamente significativo un valor de p<0,05.
ResultadosSe identificaron 906 pacientes de un total de 19.951 registrados en la base de datos regional (Red de Centros de Melanoma de Cataluña). Tras las exclusiones por protocolo (melanomas localizados en piel no glabra de manos y pies, o localizaciones no concordantes mal definidas), el número total de melanomas acrales de este estudio fue de 733 de un total de 730 pacientes. La mediana del tiempo de seguimiento de la cohorte calculada con los métodos inversos de Kaplan-Meier fue de 8,34 años con un RIC de 4,89-13,01 años.
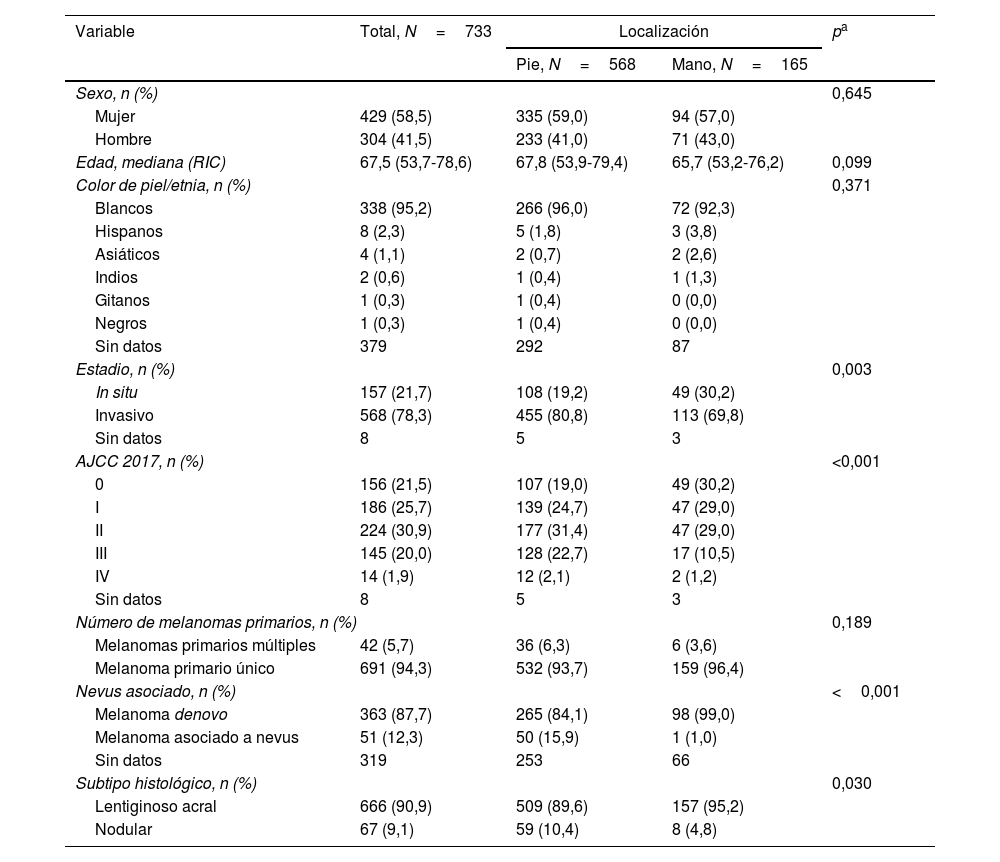
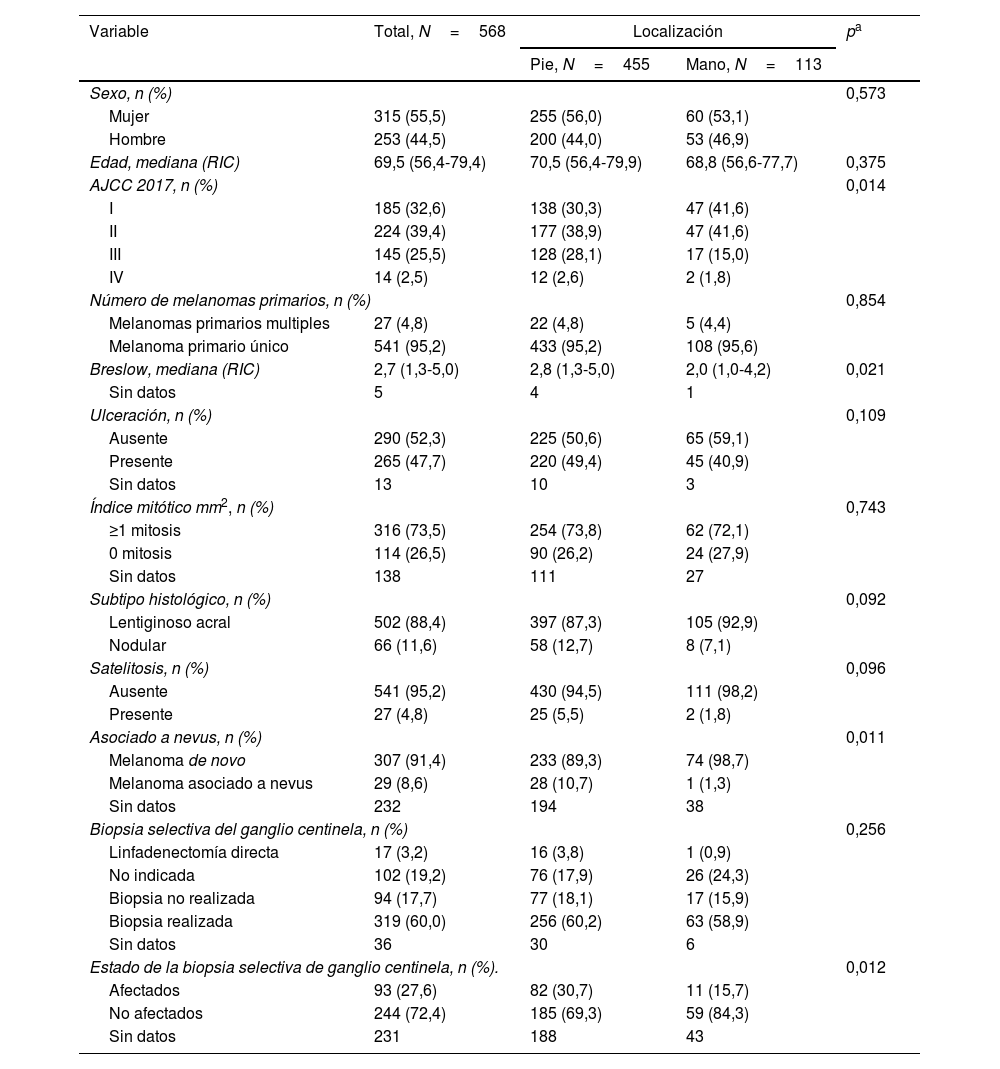
Características demográficas e histopatológicasLas características demográficas e histopatológicas de todos los melanomas se muestran en la tabla 1. Las características de los melanomas invasivos (N=568; 77,5%) se muestran en la tabla 2. En general, la mediana de edad fue de 67,5 años (RIC: 53,7-78,6; 58,5% mujeres).
Características demográficas e histopatológicas de todos los melanomas
| Variable | Total, N=733 | Localización | pa | |
|---|---|---|---|---|
| Pie, N=568 | Mano, N=165 | |||
| Sexo, n (%) | 0,645 | |||
| Mujer | 429 (58,5) | 335 (59,0) | 94 (57,0) | |
| Hombre | 304 (41,5) | 233 (41,0) | 71 (43,0) | |
| Edad, mediana (RIC) | 67,5 (53,7-78,6) | 67,8 (53,9-79,4) | 65,7 (53,2-76,2) | 0,099 |
| Color de piel/etnia, n (%) | 0,371 | |||
| Blancos | 338 (95,2) | 266 (96,0) | 72 (92,3) | |
| Hispanos | 8 (2,3) | 5 (1,8) | 3 (3,8) | |
| Asiáticos | 4 (1,1) | 2 (0,7) | 2 (2,6) | |
| Indios | 2 (0,6) | 1 (0,4) | 1 (1,3) | |
| Gitanos | 1 (0,3) | 1 (0,4) | 0 (0,0) | |
| Negros | 1 (0,3) | 1 (0,4) | 0 (0,0) | |
| Sin datos | 379 | 292 | 87 | |
| Estadio, n (%) | 0,003 | |||
| In situ | 157 (21,7) | 108 (19,2) | 49 (30,2) | |
| Invasivo | 568 (78,3) | 455 (80,8) | 113 (69,8) | |
| Sin datos | 8 | 5 | 3 | |
| AJCC 2017, n (%) | <0,001 | |||
| 0 | 156 (21,5) | 107 (19,0) | 49 (30,2) | |
| I | 186 (25,7) | 139 (24,7) | 47 (29,0) | |
| II | 224 (30,9) | 177 (31,4) | 47 (29,0) | |
| III | 145 (20,0) | 128 (22,7) | 17 (10,5) | |
| IV | 14 (1,9) | 12 (2,1) | 2 (1,2) | |
| Sin datos | 8 | 5 | 3 | |
| Número de melanomas primarios, n (%) | 0,189 | |||
| Melanomas primarios múltiples | 42 (5,7) | 36 (6,3) | 6 (3,6) | |
| Melanoma primario único | 691 (94,3) | 532 (93,7) | 159 (96,4) | |
| Nevus asociado, n (%) | <0,001 | |||
| Melanoma denovo | 363 (87,7) | 265 (84,1) | 98 (99,0) | |
| Melanoma asociado a nevus | 51 (12,3) | 50 (15,9) | 1 (1,0) | |
| Sin datos | 319 | 253 | 66 | |
| Subtipo histológico, n (%) | 0,030 | |||
| Lentiginoso acral | 666 (90,9) | 509 (89,6) | 157 (95,2) | |
| Nodular | 67 (9,1) | 59 (10,4) | 8 (4,8) | |
AJCC: American Joint Committee on Cancer; RIC: rango intercuartílico.
Características demográficas e histopatológicas de los melanomas invasivos
| Variable | Total, N=568 | Localización | pa | |
|---|---|---|---|---|
| Pie, N=455 | Mano, N=113 | |||
| Sexo, n (%) | 0,573 | |||
| Mujer | 315 (55,5) | 255 (56,0) | 60 (53,1) | |
| Hombre | 253 (44,5) | 200 (44,0) | 53 (46,9) | |
| Edad, mediana (RIC) | 69,5 (56,4-79,4) | 70,5 (56,4-79,9) | 68,8 (56,6-77,7) | 0,375 |
| AJCC 2017, n (%) | 0,014 | |||
| I | 185 (32,6) | 138 (30,3) | 47 (41,6) | |
| II | 224 (39,4) | 177 (38,9) | 47 (41,6) | |
| III | 145 (25,5) | 128 (28,1) | 17 (15,0) | |
| IV | 14 (2,5) | 12 (2,6) | 2 (1,8) | |
| Número de melanomas primarios, n (%) | 0,854 | |||
| Melanomas primarios multiples | 27 (4,8) | 22 (4,8) | 5 (4,4) | |
| Melanoma primario único | 541 (95,2) | 433 (95,2) | 108 (95,6) | |
| Breslow, mediana (RIC) | 2,7 (1,3-5,0) | 2,8 (1,3-5,0) | 2,0 (1,0-4,2) | 0,021 |
| Sin datos | 5 | 4 | 1 | |
| Ulceración, n (%) | 0,109 | |||
| Ausente | 290 (52,3) | 225 (50,6) | 65 (59,1) | |
| Presente | 265 (47,7) | 220 (49,4) | 45 (40,9) | |
| Sin datos | 13 | 10 | 3 | |
| Índice mitótico mm2, n (%) | 0,743 | |||
| ≥1 mitosis | 316 (73,5) | 254 (73,8) | 62 (72,1) | |
| 0 mitosis | 114 (26,5) | 90 (26,2) | 24 (27,9) | |
| Sin datos | 138 | 111 | 27 | |
| Subtipo histológico, n (%) | 0,092 | |||
| Lentiginoso acral | 502 (88,4) | 397 (87,3) | 105 (92,9) | |
| Nodular | 66 (11,6) | 58 (12,7) | 8 (7,1) | |
| Satelitosis, n (%) | 0,096 | |||
| Ausente | 541 (95,2) | 430 (94,5) | 111 (98,2) | |
| Presente | 27 (4,8) | 25 (5,5) | 2 (1,8) | |
| Asociado a nevus, n (%) | 0,011 | |||
| Melanoma de novo | 307 (91,4) | 233 (89,3) | 74 (98,7) | |
| Melanoma asociado a nevus | 29 (8,6) | 28 (10,7) | 1 (1,3) | |
| Sin datos | 232 | 194 | 38 | |
| Biopsia selectiva del ganglio centinela, n (%) | 0,256 | |||
| Linfadenectomía directa | 17 (3,2) | 16 (3,8) | 1 (0,9) | |
| No indicada | 102 (19,2) | 76 (17,9) | 26 (24,3) | |
| Biopsia no realizada | 94 (17,7) | 77 (18,1) | 17 (15,9) | |
| Biopsia realizada | 319 (60,0) | 256 (60,2) | 63 (58,9) | |
| Sin datos | 36 | 30 | 6 | |
| Estado de la biopsia selectiva de ganglio centinela, n (%). | 0,012 | |||
| Afectados | 93 (27,6) | 82 (30,7) | 11 (15,7) | |
| No afectados | 244 (72,4) | 185 (69,3) | 59 (84,3) | |
| Sin datos | 231 | 188 | 43 | |
AJCC: American Joint Committee on Cancer; RIC: rango intercuartílico.
La distribución anatómica de los tumores fue de 568 en los pies (77,5%) y 165 en las manos (22,5%). El 95% de los pacientes eran caucásicos.
Considerando toda la serie, todos los casos fueron categorizados histopatológicamente como MLA (N=666; 90,9%) y MN (N=67; 9,1%); el grupo del melanoma del pie tenía más MN (10,4 vs. 4,8%; p=0,030). El grupo de melanomas localizados en las manos tenía más casos insitu y en estadio I (59,2% frente a 43,7% en pies; p<0,001), mientras que el grupo de melanomas localizados en los pies tenía más casos avanzados en el momento del diagnóstico (estadios III y IV) (24,8% frente a 11,7%; p<0,001). Se observaron diferencias significativas en cuanto al número de casos invasivos cuando se compararon los tumores de pie y mano (80,8% frente a 69,8%; p=0,003). En total, 42 pacientes (5,7%) presentaban melanomas primarios múltiples, mientras que solo 3 pacientes de esta cohorte desarrollaron más de un melanoma acral. Además, los melanomas de los pies presentaban un mayor porcentaje de melanoma asociado a nevus frente al grupo de melanomas de las manos (15,9% frente a 0,01%; p<0,001).
Características histopatológicas de los melanomas invasivosEn cuanto a los melanomas invasivos, el grupo de melanomas de las manos tenía un mayor porcentaje de melanomas en estadios I y II (83,2% frente a 69,2%; p=0,014). La mediana del Breslow de la serie fue de 2,7mm (RIC: 1,3-5,0), con el grupo de melanomas localizados en el pie con una mayor índice de Breslow (2,8mm; RIC: 1,3-5,0 vs. 2,0mm; RIC: 1,0-4,2; p=0,021)]. La ulceración estaba presente en el 47,7% de todos los casos, no se detectaron diferencias significativas entre el melanoma acral de la mano y el del pie. La distribución de los subtipos histológicos fue del 88,4% para el MLA y del 11,6% para el MN, sin que se registraran diferencias entre el melanoma acral de la mano y del pie. Los del pie presentaron un mayor porcentaje de melanomas asociados a nevus que el grupo de los localizados en la mano (10,7 vs. 1,3%; p=0,011). En cuanto a los pacientes en el estadio III, observamos que 93 pacientes (64,1%) fueron diagnosticados mediante una BSGC y 52 casos (35,9%) por una enfermedad locorregional visible en el momento del diagnóstico. La BSGC se realizó en 319 casos (60%) con afectación en 93 casos (27,6%). Se observó una diferencia estadísticamente significativa en el estado de la BSGC con un mayor número de BSGC positivos en el grupo de melanomas del pie (30,7% frente a 15,7%; p=0,012).
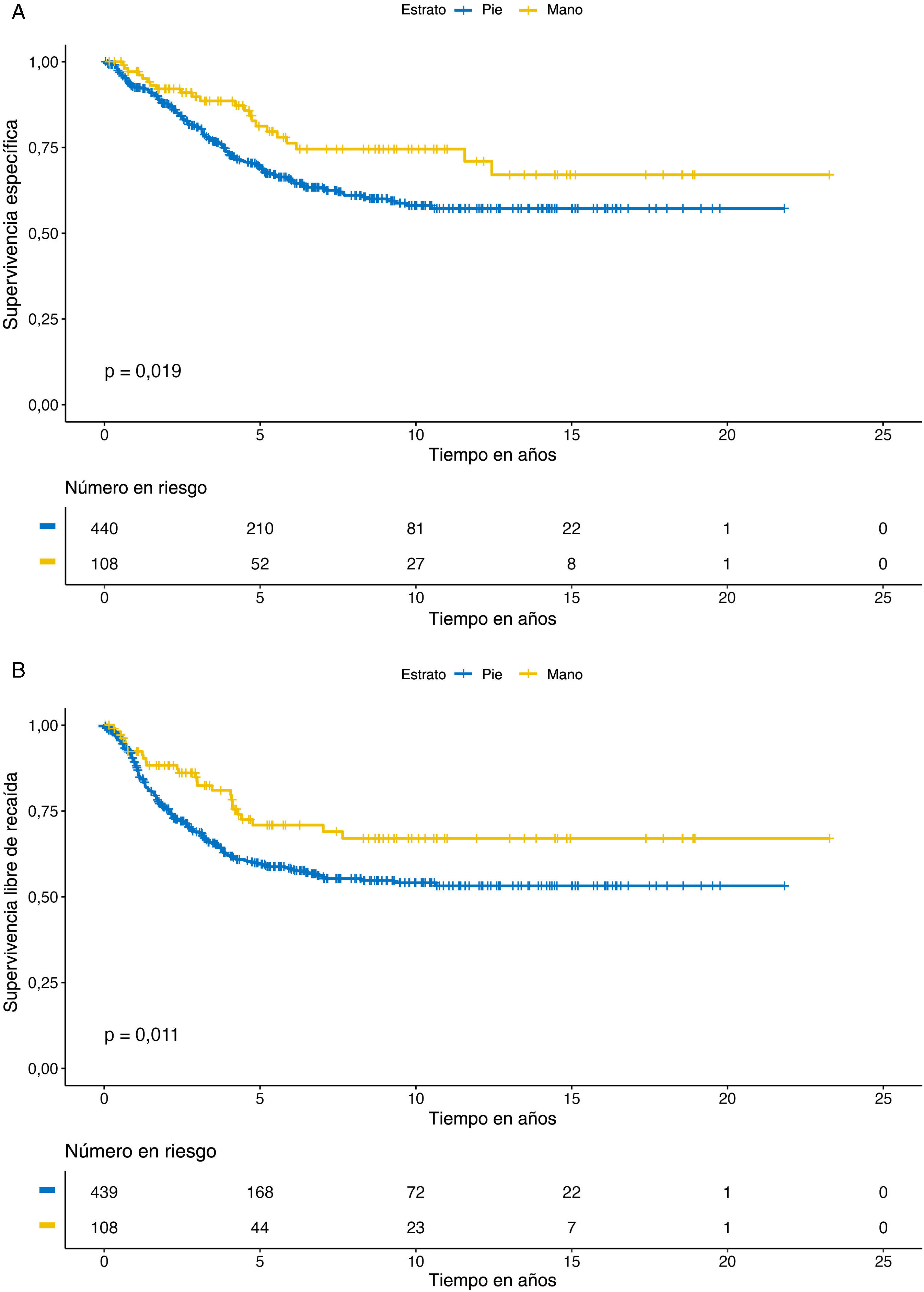
Análisis de supervivenciaEn general, la tasa de SEM a 5 años fue del 71,5% (IC 95%: 67,4-75,8). Estas tasas de supervivencia fueron del 69,1% (IC 95%: 64,6-74,0) para el grupo del pie y del 81,2% (IC 95%: 73,1-90,2) para el grupo de melanomas de la mano. En general, la tasa de SLR a 5 años fue del 61,8% (IC 95%: 57,5-66,5); 59,5% (IC 95%: 54,6-64,8) para el grupo del pie y de 70,9% (IC 95%: 61,4-81,6) para el grupo de melanomas de la mano. Las curvas de Kaplan-Meier mostraron que los melanomas localizados en el pie presentaban tasas de SEM (p=0,019) y de SLR (p=0,011) estadísticamente significativas inferiores a las de los melanomas de la mano. En esta serie, ningún paciente con melanoma in situ falleció por causas relacionadas con el melanoma. Los resultados se muestran en la figura 1.
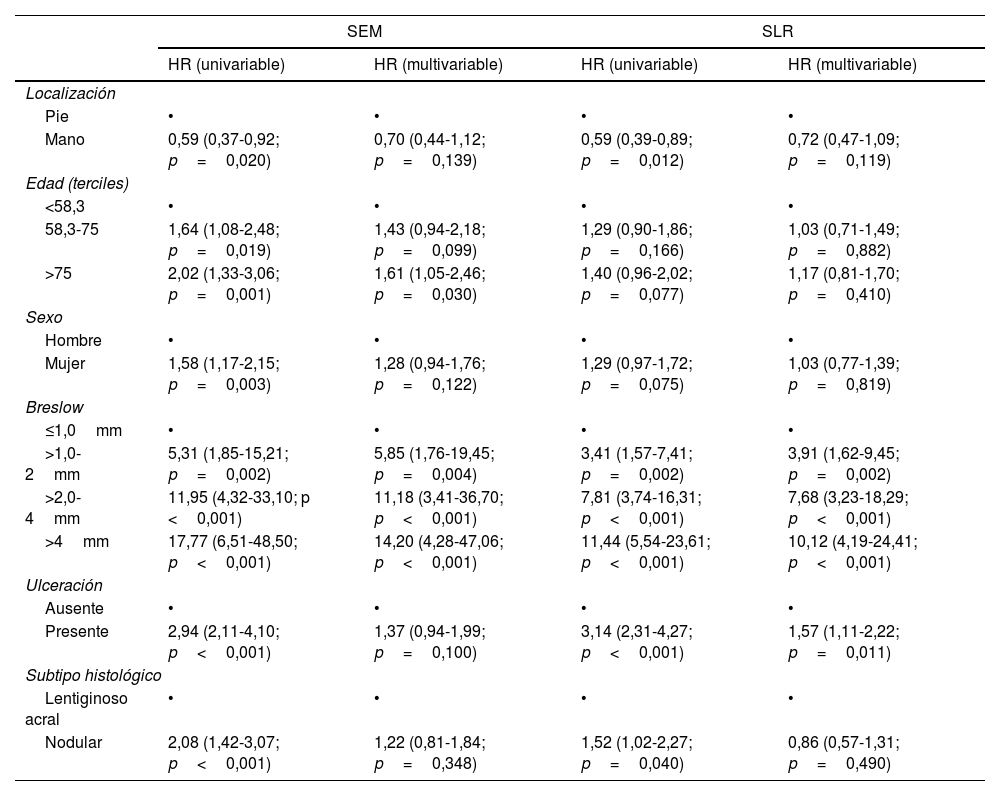
El análisis univariante de regresión de Cox del SEM mostró que la localización del melanoma en el pie, la edad de aparición más tardía, el sexo masculino, un mayor índice de Breslow, la presencia de ulceración y el subtipo de melanoma nodular se asociaban con un peor pronóstico.
El análisis multivariante de regresión logística de Cox confirmó que una edad de aparición más tardía (>75 años; HR: 1,61; IC 95%: 1,05-2,46; p=0,030) y un mayor índice de Breslow (>1,0-2mm; HR: 5,85; IC 95%: 1,76-19,45; p=0,004; >2,0-4mm; HR: 11,18; IC 95%: 3,41-36,70; p<0,001; >4mm; HR: 14,20; IC 95%: 4,28-47,06; p<0,001) fueron predictores independientes de peor SEM.
El análisis multivariante de regresión logística de Cox confirmó que una edad de inicio más avanzada (>75 años; HR: 1,61; IC 95%: 1,05-2,46; p=0,030) y un mayor índice de Breslow (>1,0-2mm; HR: 5,85; IC 95%: 1,76-19,45; p=0,004; >2,0-4mm; HR: 11,18; IC 95%: 3,41-36,70; p<0,001; >4mm; HR: 14,20; IC 95%: 4,28-47,06; p<0,001) fueron predictores independientes de peor SEM.
En cuanto a la SLR, la tasa global de la SLR a 5 años fue del 61,8% (IC 95%: 57,5-66,5) con tasas de SLR a 5 años del 59,5% (IC 95%: 54,6-64,8) para el grupo del pie y del 70,9% (IC 95%: 61,6-81,6) para el grupo de melanomas de la mano.
El análisis de regresión de Cox univariante mostró que la localización del melanoma en el pie, el mayor índice de Breslow, la presencia de ulceración y el subtipo de melanoma nodular se asociaban a una peor SLR. Sin embargo, los modelos de regresión multivariante hallaron que solo el índice de Breslow (>1,0-2mm; HR: 3,91; IC 95%: 1,62-9,45; p=0,002; >2,0-4mm; HR: 7,68; IC 95%: 3,23-18,29; p<0,001; >4mm; HR: 10,12; IC 95%: 4,19-24,41; p<0,001) y la presencia de ulceración (HR: 1,57; IC 95%: 1,11-2,22; p=0,011) fueron factores de riesgo independientes de la SLR.
Los datos asociados a los modelos de regresión de Cox univariantes y multivariantes para la SEM y la SLR se muestran en la tabla 3.
Análisis univariante y multivariante de regresión de Cox de la supervivencia específica del melanoma (SEM) y la supervivencia libre de recaída (SLR)
| SEM | SLR | |||
|---|---|---|---|---|
| HR (univariable) | HR (multivariable) | HR (univariable) | HR (multivariable) | |
| Localización | ||||
| Pie | • | • | • | • |
| Mano | 0,59 (0,37-0,92; p=0,020) | 0,70 (0,44-1,12; p=0,139) | 0,59 (0,39-0,89; p=0,012) | 0,72 (0,47-1,09; p=0,119) |
| Edad (terciles) | ||||
| <58,3 | • | • | • | • |
| 58,3-75 | 1,64 (1,08-2,48; p=0,019) | 1,43 (0,94-2,18; p=0,099) | 1,29 (0,90-1,86; p=0,166) | 1,03 (0,71-1,49; p=0,882) |
| >75 | 2,02 (1,33-3,06; p=0,001) | 1,61 (1,05-2,46; p=0,030) | 1,40 (0,96-2,02; p=0,077) | 1,17 (0,81-1,70; p=0,410) |
| Sexo | ||||
| Hombre | • | • | • | • |
| Mujer | 1,58 (1,17-2,15; p=0,003) | 1,28 (0,94-1,76; p=0,122) | 1,29 (0,97-1,72; p=0,075) | 1,03 (0,77-1,39; p=0,819) |
| Breslow | ||||
| ≤1,0mm | • | • | • | • |
| >1,0-2mm | 5,31 (1,85-15,21; p=0,002) | 5,85 (1,76-19,45; p=0,004) | 3,41 (1,57-7,41; p=0,002) | 3,91 (1,62-9,45; p=0,002) |
| >2,0-4mm | 11,95 (4,32-33,10; p <0,001) | 11,18 (3,41-36,70; p<0,001) | 7,81 (3,74-16,31; p<0,001) | 7,68 (3,23-18,29; p<0,001) |
| >4mm | 17,77 (6,51-48,50; p<0,001) | 14,20 (4,28-47,06; p<0,001) | 11,44 (5,54-23,61; p<0,001) | 10,12 (4,19-24,41; p<0,001) |
| Ulceración | ||||
| Ausente | • | • | • | • |
| Presente | 2,94 (2,11-4,10; p<0,001) | 1,37 (0,94-1,99; p=0,100) | 3,14 (2,31-4,27; p<0,001) | 1,57 (1,11-2,22; p=0,011) |
| Subtipo histológico | ||||
| Lentiginoso acral | • | • | • | • |
| Nodular | 2,08 (1,42-3,07; p<0,001) | 1,22 (0,81-1,84; p=0,348) | 1,52 (1,02-2,27; p=0,040) | 0,86 (0,57-1,31; p=0,490) |
HR: hazard ratio.
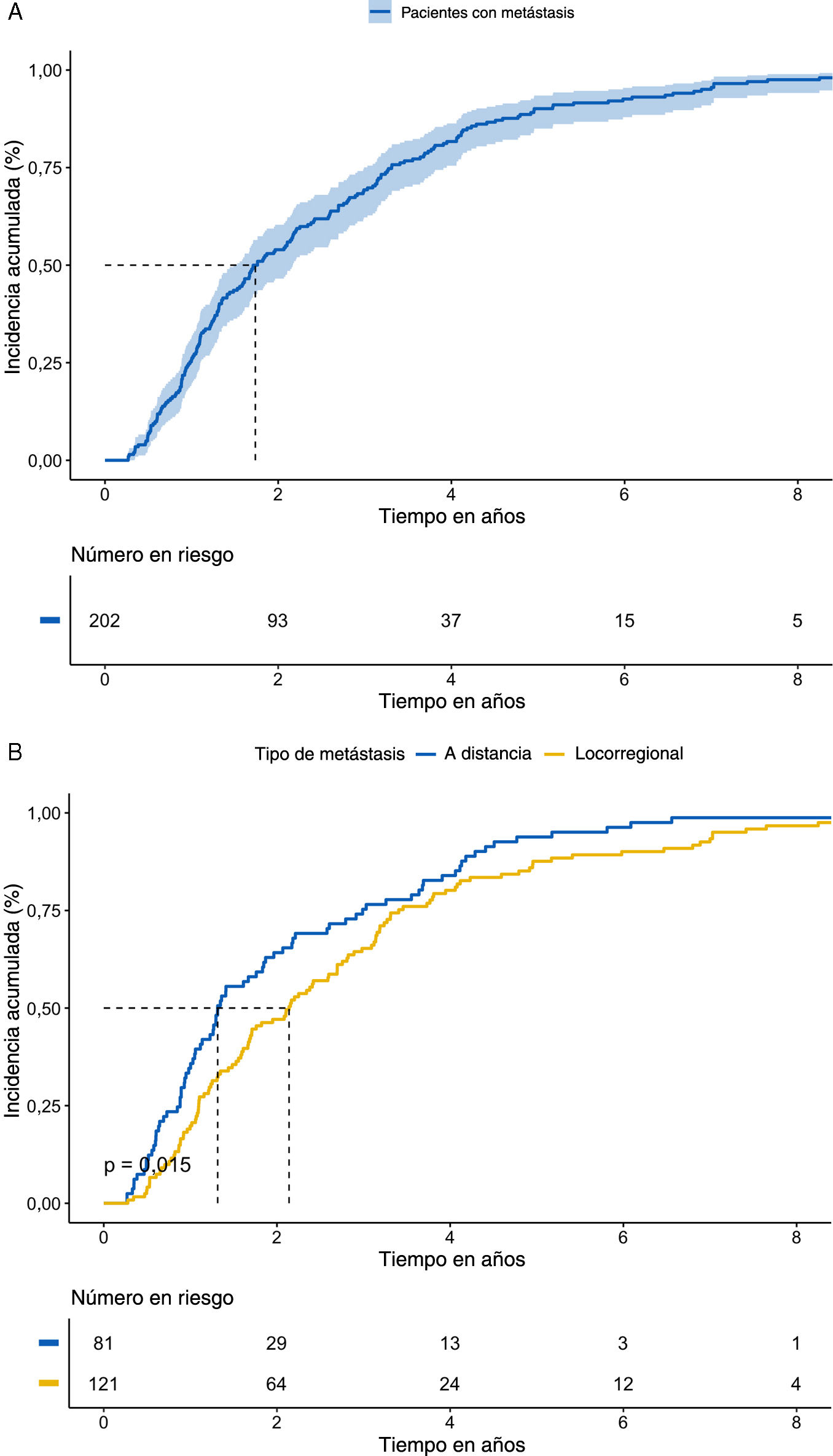
En cuanto al patrón de recurrencia, la mediana del tiempo transcurrido hasta la metástasis índice fue de 1,74 años (IQR: 1,48-2,17) (fig. 2). La mayoría de los pacientes (81,7%) que recurrieron desarrollaron la primera metástasis en los primeros 4 años de seguimiento.
Un total de 202 pacientes (27,7%) desarrollaron recidivas tras un seguimiento medio de 100 meses.
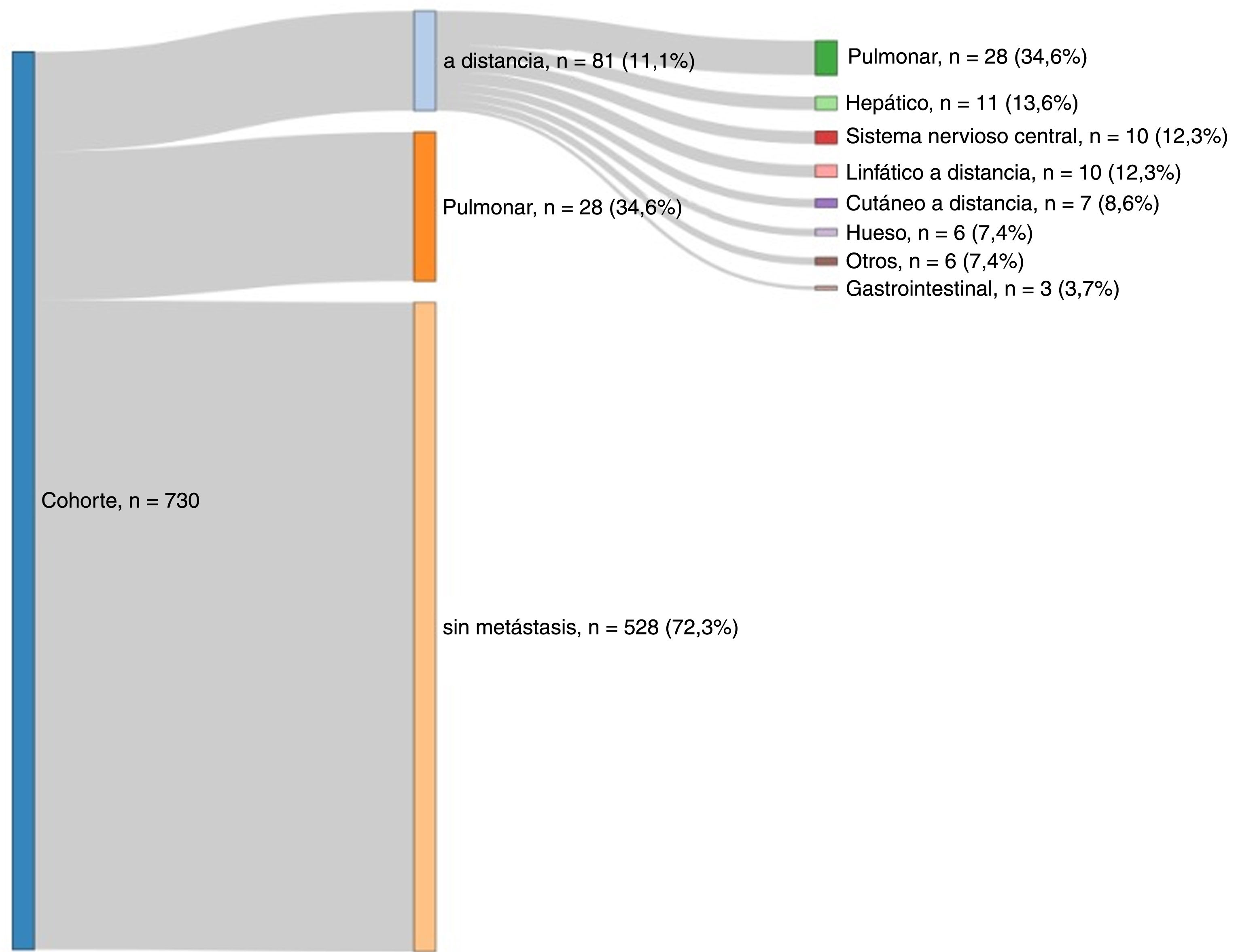
La localización más frecuente de las recidivas fue locorregional (n=121; 59,9%), mientras que 81 pacientes (40,1%) desarrollaron metástasis a distancia.
En cuanto a la localización de la metástasis índice, las curvas de Kaplan-Meier mostraron que las metástasis a distancia aparecieron antes que las locorregionales (mediana de tiempo 1,32 años; RIC: 1,12-1,87) frente a 2,14 años RIC: 1,68-2,70); p=0,015) (fig. 2). La mayoría de las metástasis a distancia fueron pulmonares (34,6%), seguidas de las hepáticas (13,6%), asociadas al sistema nervioso central (12,3%) y linfáticas a distancia (12,3%). La distribución de la metástasis índice se ilustra en la figura 3.
DiscusiónHasta donde conocemos, el presente estudio retrospectivo de 20 años sobre el melanoma acral en Europa es la mayor serie realizada en una población predominantemente caucásica.
El melanoma en las regiones acrales afecta a todas las poblaciones del mundo. Sin embargo, representa un número significativo de casos (del 20% al 70%) en países con una menor incidencia de melanoma relacionado con el sol, como los de las regiones asiáticas, africanas e hispanoamericanas8,16-19. Dada su importancia, la mayoría de los estudios sobre el melanoma acral se centran en poblaciones no caucásicas.
El melanoma acral es una entidad poco frecuente con peculiaridades distintivas asociadas a un peor pronóstico frente al melanoma cutáneo encontrado en otras localizaciones2,6,10,11,20,21. Este pronóstico adverso se ha atribuido a varios factores, como ya se ha mencionado. En nuestra cohorte, un número significativo de casos se diagnosticó con un elevado índice de Breslow, una alta prevalencia de ulceración y estadios avanzados, al igual que en la mayoría de los estudios2,6,10-12,21,22. Cabe destacar que el 21,9% de nuestra cohorte se diagnosticó con enfermedad no localizada en estadios de la 8.ª edición de la AJCC (estadios III y IV), lo que coincide con otras series6,21,23. Este porcentaje de estadios no localizados es considerablemente superior al de las series de melanomas no acrales11. Además, el melanoma acral se asocia a una edad más avanzada y la mayoría de los casos se producen en los pies, como ya hemos visto2,6,10-12,20,22,24. Estos hallazgos indican en conjunto un retraso notable en el diagnóstico, atribuido predominantemente a la localización menos llamativa de los melanomas, como los pies, un factor que es pertinente en poblaciones de edad avanzada, como han propuesto otros autores2,4,10. En general, entre el 20% y el 30% de los melanomas se originan a partir de un nevus melanocítico precursor25-27. Los melanomas asociados a un nevus se han relacionado con una edad más temprana en el momento del diagnóstico, un mayor número de nevus, melanomas más finos y localizaciones corporales expuestas al sol de forma intermitente, como el tronco. Histopatológicamente, suelen presentarse como MES y albergan mutaciones de BRAF25-27. Llama la atención que en nuestra población la prevalencia de melanomas asociados a nevus fuera solo del 1% en el grupo de melanomas localizados en las manos y del 16% en el grupo de melanomas en los pies, lo que podría explicarse por la relativa mayor edad de la población de la cohorte, la ausencia de MES y la baja incidencia de mutaciones en BRAF que suelen asociar los melanomas acrales. Además, algunos estudios sobre el MLA han indicado que estos melanomas tienden a producirse en zonas de las manos y de los pies propensas al estrés mecánico22,28-31. La presión, los traumatismos y el estrés físico en los pies podrían desempeñar un papel en la patogenia de los melanomas asociados a nevus y explicar las diferencias entre el grupo de melanomas de las manos y el de los pies.
El subtipo histológico y la localización del melanoma han sido objeto de debate en cuanto a su impacto en el pronóstico. Algunos estudios señalan que la localización del melanoma acral o el MLA se asocia a un peor pronóstico2,6,10,11,20,21, mientras que otros indican que su pronóstico es similar al de otros subtipos y localizaciones de melanoma4,12,22-24,32,33. En nuestra serie, al comparar los melanomas de las manos y de los pies, observamos que los de los pies presentaban un mayor índice de Breslow, una afectación más prevalente de la BSGC y peores estadios de la 8.ª edición de la AJCC. Sin embargo, la localización del melanoma y su subtipo histopatológico no se asociaron a un peor pronóstico en términos de la SEM o la SLR. Un mayor índice de Breslow y una edad de aparición más tardía (>75 años) fueron los únicos factores pronósticos independientes para la SEM, mientras que un Breslow mayor y la ulceración fueron factores de riesgo independientes para la SLR.
Estudios anteriores señalan que podría haber diferencias en la dinámica de la diseminación metastásica entre el melanoma acral y el no acral, en particular en lo que respecta a las tasas más elevadas tanto de recidiva como de metástasis a distancia en el melanoma acral2,6,10,12,34-43. Además, se ha informado de que los factores de riesgo de metástasis linfáticas o hematógenas pueden variar44,45, se ha descrito que un mayor índice de Breslow es un factor predictivo de metástasis hematógenas45. Además, los pacientes con estadios más tempranos desarrollaron recaídas más tarde que los que presentaban estadios más avanzados, lo que se observó claramente en las metástasis a distancia42,46,47. En nuestra investigación, observamos una elevada tasa de recaídas del melanoma con predominio de las metástasis locorregionales; sin embargo, una proporción significativa de casos también desarrolló metástasis a distancia. Cabe destacar que las metástasis a distancia aparecieron antes que las locorregionales y lo hicieron en un periodo de tiempo más corto que en otras series publicadas hasta la fecha42,48-50, lo que podría explicarse por el mayor índice de Breslow descrito en el estudio, lo que conlleva un mayor riesgo de metástasis a distancia y más tempranas. Hasta donde sabemos, no existen otros estudios específicos sobre este fenómeno en series de melanoma acral. Estas observaciones subrayan la complejidad y variabilidad del comportamiento metastásico de los melanomas y ponen de relieve la importancia de utilizar pruebas de imagen diagnósticas de manera rutinaria para detectar recidivas o metástasis asintomáticas en los primeros 3-5 años tras el diagnóstico, en función del riesgo de recaída, según las guías del National Comprehensive Cancer Network (NCCN)51.
Este estudio tiene las limitaciones inherentes a su diseño retrospectivo. Sin embargo, los datos se recogieron de forma prospectiva y multicéntrica. No contamos con la información en algunos puntos significativos, como son la localización exacta en las zonas acrales, los factores socioeconómicos, los estudios genéticos de los tumores y los márgenes obtenidos en los procedimientos quirúrgicos tras el diagnóstico del melanoma. En el caso de las recidivas, no exploramos si estos pacientes desarrollaron metástasis sincrónicas o a distancia posteriores en pacientes que inicialmente presentaban metástasis locorregionales. Debido a la heterogeneidad de los procedimientos quirúrgicos y las terapias sistémicas a lo largo de 2 décadas, no profundizamos en los resultados en función de las terapias recibidas.
En conclusión, hasta donde sabemos, presentamos el mayor estudio realizado sobre melanomas acrales en una población predominantemente caucásica. Se diagnosticó un número significativo de casos con elevado índice de Breslow, alta prevalencia de ulceración, estadios avanzados y baja prevalencia de melanomas asociados a nevus. Los melanomas originados en los pies se detectaron más tarde, estaban más asociados a nevus, presentaban una mayor proporción del subtipo nodular y estadios más avanzados de la 8.ª edición de la AJCC que los originados en la mano. El mayor índice de Breslow y la edad de aparición más tardía fueron factores pronósticos independientes para al SEM, mientras que el mayor índice de Breslow y la ulceración fueron factores de riesgo independientes para la SLR. La localización del melanoma y el subtipo histopatológico no se asociaron a un peor pronóstico. Las recidivas fueron un hallazgo frecuente, con metástasis a distancia que aparecieron antes que las recidivas locorregionales, lo que subraya la importancia del seguimiento exhaustivo y de las pruebas de imagen rutinarias para detectar las recidivas asintomáticas.
FinanciaciónLa investigación sobre melanoma en el Hospital Universitari Arnau de Vilanova de Lleida fue financiada mediante subvenciones del ISCIII/FEDER «Una manera de hacer Europa» (PI18/00573 y PI21/00294 a R.M. Marti), CIBERONC-CB16/12/00231 y la Generalitat de Catalunya (2021/SGR0093). La investigación del Grupo de Melanoma en el Hospital Clínic de Barcelona recibe apoyo del CIBER de Enfermedades Raras del Instituto de Salud Carlos III, España, AGAUR 2017_SGR_1134 y el Programa CERCA de la Generalitat de Catalunya, España; una beca de investigación de la Fundación Científica de la Asociación Española Contra el Cáncer (GCB15152978SOEN, España); y la Comisión Europea bajo los siguientes programas: Sexto Programa Marco (Contrato No. LSHC-CT-2006-018702, GenoMEL), Séptimo Programa Marco (Diagnoptics), Programa HORIZON2020 (iTobos y Qualitop), Programa Horizon Europe (HORIZON-MISS-2021-CANCER-02, MELCAYA, referencia 101096667). Esta investigación también fue financiada parcialmente por subvenciones del Fondo de Investigaciones Sanitarias (P.I. 18/00419 y 22/01467, España). Parte del trabajo se llevó a cabo en el Centro Esther Koplowitz, Barcelona. J. Angel-Baldo contó con una beca predoctoral del IRBLleida/Diputació de Lleida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Colaboradores de la Red de Centros de Melanoma de Cataluña (Xarxa de Melanoma de Catalunya): Clara Matas-Nadal, Xavier Soria, Sonia Gatius, Felip Vilardell (Hospital Universitari Arnau de Vilanova, Lleida), Inma Gil, Cristina Grau, Fani Martínez (Hospital Universitari Sant Joan de Reus), Nelson Lobos (Hospital Clínic de Barcelona, Barcelona), Oriol Yélamos, Joan Dalmau (Hospital de la Santa Creu i Sant Pau, Barcelona), Carlos González-Cruz, Helena Hilari (Hospital Universitari Vall d’Hebron), Paola Pasquali (Pius Hospital de Valls), Marc Sagristà (Hospital de Calella), María Rosa Olivella-Garcés (Hospital Moisès Broggi, Consorci Sanitari Integral, Sant Joan Despí), Montserrat Bonfill-Ortí, Josep Ramón Ferreres (Hospital Universitari de Bellvitge), Ane Jaka, Ariadna Quer, Nina Richarz (Hospital Universitari Germans Trias i Pujol, Badalona), Inés Zarzoso Muñoz, Emili Masferrer (Hospital Universitari Mútua Terrassa), Pedro Zaballos (Hospital Sant Pau i Santa Tecla, Tarragona), Manel Formigon (Consorci Sanitari de Terrassa), Loida Galvany (Hospital Dos de Maig), Marta Alegre (Hospital Plató, Barcelona), Anna Sánchez-Puigdollers, Nerea Mohino-Farré (Hospital Joan XXIII, Tarragona).Gracias a nuestros pacientes y sus familias, quienes son la razón principal de nuestros estudios. Un agradecimiento especial a todos los fellows y residentes que contribuyeron a mantener actualizada nuestra Base de Datos en la práctica clínica diaria.