Las enfermedades ampollosas autoinmunes constituyen un grupo de entidades relativamente infrecuentes cuyo tratamiento, aunque semejante, varía en función de las escuelas dermatológicas. Dentro de este grupo las más frecuentes son el pénfigo vulgar y foliáceo, el penfigoide ampolloso y de mucosas, la enfermedad IgA lineal y la dermatitis herpetiforme.
En los últimos años se han incluido en el arsenal terapéutico fármacos que han cambiado en ocasiones el pronóstico de las mismas.
Recogemos en este artículo los protocolos de actuación actuales en estos procesos basados en la literatura y en la experiencia de consultas monográficas de enfermedades ampollosas. Así mismo, hemos recogido los datos de una encuesta vía internet sobre los métodos terapéuticos en pénfigo vulgar de más de 40 dermatólogos con experiencia habitualmente hospitalaria en España.
Autoimmune bullous diseases are relatively uncommon and their treatment—although generally similar—may vary depending on the dermatologist. Within this group of diseases, the most common are pemphigus vulgaris and pemphigus foliaceus, bullous and mucosal pemphigoid, linear immunoglobulin A disease, and dermatitis herpetiformis. In recent years, the therapeutic arsenal has been extended by new drugs, some of which have changed the prognosis of these diseases.
This article describes current management protocols for these processes as indicated in the literature and derived from the experience of specialized clinics for bullous diseases. We also present the findings from an Internet survey on therapeutic approaches in pemphigus vulgaris answered by more than 40 dermatologists who work primarily in Spanish hospital clinics.
En los últimos años el conocimiento y manejo de las enfermedades ampollosas autoinmunes ha sufrido un importante avance gracias, por una parte a la aparición de nuevas entidades basadas en determinaciones de antígeno, la mayor sensibilidad y especificidad en el diagnóstico serológico de algunas de estas enfermedades (ELISA para desmogleínas en pénfigo vulgar [PV] y foliáceo, ELISA para BP180 en penfigoide, etc.) y avances en el conocimiento patogénico de la enfermedad, y por otra a nuevas terapias con anticuerpos (rituximab), inmunoglobulinas intravenosas, que han supuesto numerosos artículos de revisión sobre estas enfermedades.
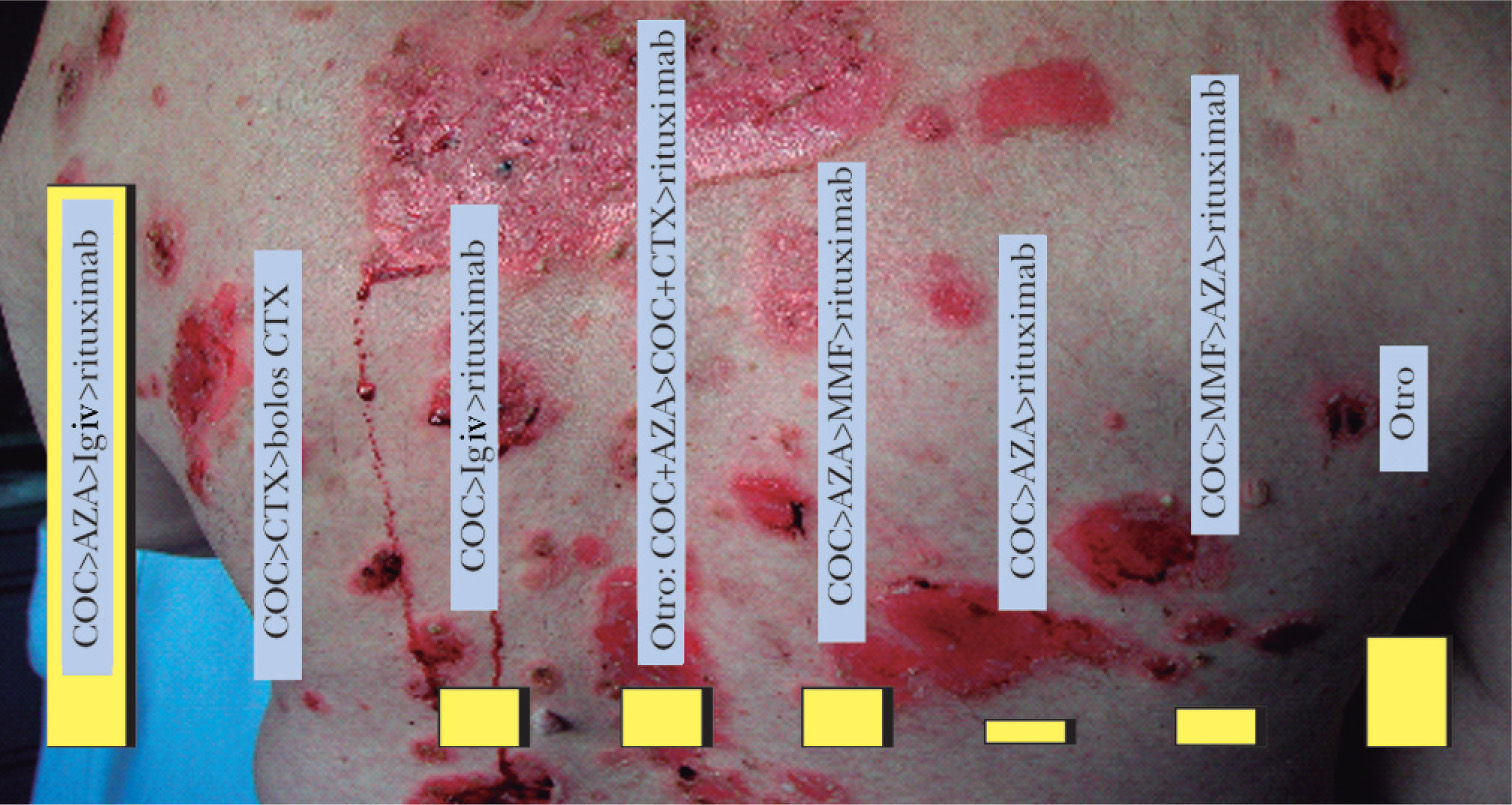
A menudo en España nos basamos en series inglesas, alemanas o americanas para el tratamiento de estas enfermedades. Sin embargo, hemos querido recoger los datos y experiencias de un grupo de dermatólogos interesados en el tema. Esta revisión no pretende ser dogmática, ya que no existe un consenso universal, ni siquiera regional, en el manejo de muchas de estas entidades. Sólo pretende ser una revisión práctica para el manejo diario, habitualmente hospitalario, basado en la unión de la literatura con la experiencia. Incluso hemos recogido los datos de una encuesta vía internet que hemos realizado entre más de 40 dermatólogos españoles que desarrollan su actividad en el ámbito hospitalario, preguntándoles sus opiniones en el manejo del PV, y a los que agradecemos su colaboración (fig. 1).
Para no extender demasiado el contenido del artículo revisaremos el manejo del pénfigo en sus formas más frecuentes, el penfigoide tanto ampolloso como de mucosas y el gestacional, la enfermedad IgA lineal y la dermatitis herpetiforme (DH) que, aunque con patogenia multifactorial, nos ha parecido importante su inclusión. Sabemos que se podrían incluir otras entidades (infantiles, farmacológicas, paraneoplásicas, variantes clínicas de las descritas, etc.) pero probablemente se perdería practicidad.
Opciones terapéuticasCorticoidesSu farmacología es conocida con efectos a nivel antiinflamatorio e inmunosupresor. Debemos vigilar sus múltiples efectos secundarios, tanto agudos como crónicos, entre los que destacan insuficiencia suprarrenal, alteraciones electrolíticas, hipertensión arterial, hiperglucemia, miopatía, inmunosupresión, psicosis, cataratas, glaucoma, osteonecrosis y osteoporosis, infecciones, gastropatía, etc.1,2.
La osteoporosis se vigilará mediante densitometría anual, administración de calcio y vitamina D, así como bifosfonatos (existen comprimidos semanales).
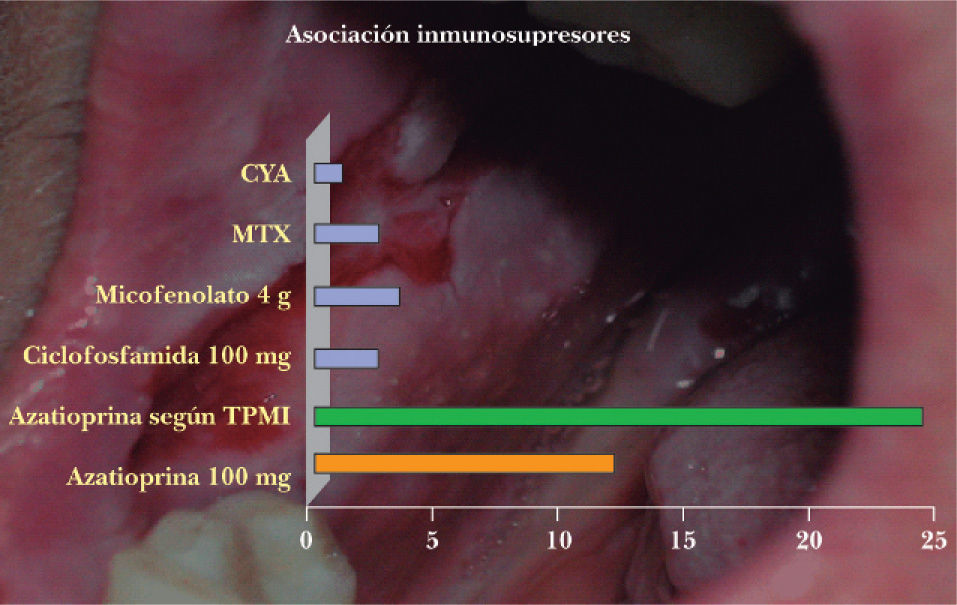
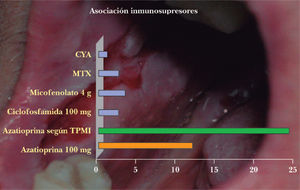
AzatioprinaImurel cápsulas 50 mg, antagonista de las purinas, es el inmunosupresor «ahorrador de corticoides» preferido por la mayoría de dermatólogos españoles consultados (fig. 2). Se usa en el PV desde 1969 con una eficacia publicada del 55 %. Dado que en España se puede solicitar la enzima que lo metaboliza (tiopurina metiltransferasa), lo solicitaremos para ajustar dosis, ya que la inicial de 50 mg/12 horas suele ser escasa, tolerándose en ocasiones 2,5 mg/kg/día. Para poder dar estas dosis debemos comprobar que no hay un déficit de la enzima ya que, en España, hay un 0,5 % de la población con carencia total de ésta y un 11,9 % con déficit parcial. Estos pacientes pueden presentar graves efectos secundarios (hepatitis colestásica, mielosupresión severa, pancreatitis y toxicidad gástrica).
Se obtiene un efecto terapéutico a las 6-10 semanas y debemos prevenir su interacción con alopurinol, captopril, anticoagulantes orales, etc.
El efecto secundario más frecuente son las molestias gastrointestinales y no debemos olvidar el potencial aunque bajo efecto oncogénico.
MicofenolatoMofetil (Cellcept cápsulas 250-500 mg). También es antagonista de la síntesis de ADN-nucleótidos, con buenos resultados en PV en administración oral (40 mg/kg/día en dos dosis). Su eficacia se obtiene a los 3-6 meses. Provoca frecuentes molestias gástricas, astenia y en ocasiones linfopenia y mielosupresión. Es menos hepatotóxico que azatioprina. Se solicita por uso compasivo.
CiclofosfamidaGenoxal 50 mg cápsulas y vial de 1 g (tabla 1). Es un agente alquilante, de uso oral o intravenoso y metabolizado por el citocromo p450. La dosis oral varía entre 1-3 mg/kg/día (máximo 200 mg/día) con efecto terapéutico a las 4-10 semanas. Es más tóxica que azatioprina, aunque algo más eficaz. Provoca frecuentes y potencialmente graves efectos secundarios: leucopenia a veces muy severa sobre todo a los 6-14 días de su administración intravenosa (tabla 2), cistitis hemorrágica por su metabolito acroleína, azoospermia e insuficiencia ovárica irreversible a partir de 4-5 gramos totales e incremento en el riesgo de neoplasia vesical (16-30 % de pacientes con vasculitis de Wegener tratados largos periodos) por lo que debe acompañarse de forzada hidratación oral (hasta 3 litros/día) y descartar hematuria. También aparecen úlceras orales, nefrotoxicidad y hepatotoxicidad, así como fibrosis pulmonar, aunque en raras ocasiones.
Tratamiento con inmunoglobulinas inespecíficas intravenosas
| Uso compasivo |
| Diagnóstico de enfermedad ampollosa con complicaciones con corticoides o no respuesta a inmunosupresores |
| Pedir IgA (riesgo de anafilaxia) |
| Usar siempre el mismo preparado (en nuestro caso Flebogamma 10 g) |
| Dosis: 0,4 g/kg/día 5 días (2 g/kg): 3-4 envases/día |
Repetir cada 21 días y luego ir distanciando si no hay lesiones:
|
Tratamiento con ciclofosfamida intravenosa (Genoxal)
|
Obtenidas de plasma de 1.000-6.000 donantes sanos, actúan por un mecanismo variado (> 19 vías patogénicas). En el PV posiblemente aumentan el catabolismo de los anticuerpos neutralizándolos. Hay varios preparados que difieren en el modo de extracción, cantidad de IgA, impurezas presentes, etc., por lo que, una vez iniciado el tratamiento se recomienda no variar el producto. Debemos solicitar IgA por si hubiera un déficit, que aumentaría la posibilidad de anafilaxia. Tienen una vida media de 21 días, por lo que ése debería ser el tiempo entre ciclos administrados (tabla 1). Se han usado en múltiples patologías autoinmunes y presentan un rápido inicio de acción, aunque se han descrito numerosos efectos secundarios como trombosis, fallo renal agudo y anafilaxia; los que más aparecen son la cefalea y las náuseas, que dependen de la velocidad de infusión.
MetotrexatoEs un antagonista del ácido fólico que ha sido utilizado como ahorrador de corticoides a dosis bajas 7,5-15 mg/semana, junto a ácido fólico en psoriasis, pero a dosis más altas han aparecido graves infecciones y efectos secundarios. En 1996 un metaanálisis desaconsejaba su uso en PV. Sin embargo en España algunos dermatólogos lo usan en ocasiones y es un ahorrador de corticoides indicado por la British Association of Dermatologist, siendo incluso el preferido por autores británicos de prestigio.
RituximabSe trata de un anticuerpo monoclonal anti CD20 que se expresa en células B maduras y preB, por lo que no afecta stem cells ni células plasmáticas. Por este motivo tarda en hacer efecto ± 1 mes y éste dura 9-12 meses hasta que se recupera el clon patógeno de linfocitos B, aunque en ocasiones hay casos sin recaída durante más tiempo. Se usa en cada vez más patologías autoinmunes, siendo el mayor riesgo el de las infecciones severas, oportunistas o no, así como la hipoglobulinemia (tabla 3).
Tratamiento con rituximab (Mabthera)
|
IFI: inmunofluorescencia indirecta; VHC: virus de la hepatitis C.
Dapsona (sulfona oral 100 mg). Su mecanismo de acción es poco conocido, pero se cree que se trata de un efecto antiinflamatorio, dado que es capaz de inhibir la adhesión de los neutrófilos al endotelio de los vasos, quimiotaxis, producción de lipooxigenasa y la acción de la mieloperoxidasa de los neutrófilos y de la mieloperoxidasa de los eosinófilos (tabla 4). Los efectos indeseables hematológicos (hemolisis y metahemoglobinemia) de la dapsona son dependientes de dosis (casi todos con > 150 mg/día, muy pocos con < 100 mg/día) y son tolerables en cierto grado sin que sea siempre necesario suspender la medicación.
Tratamiento con sulfona (dapsona)
|
Ciertos antibióticos, entre los que se incluyen derivados de tetraciclinas y eritromicina, poseen una acción antiinflamatoria además de la bactericida-bacterioestática. Este hecho ha permitido su utilización en procesos que tienen un mecanismo inmunológico en su desencadenamiento. Además, dada la ausencia de importantes efectos secundarios ha permitido su empleo en personas mayores. En el caso de las tetraciclinas se ha observado su capacidad de inhibir la quimiotaxis de neutrófilos y eosinófilos, además de inhibir la acción de ciertas metaloproteasas. Estas dos acciones han permitido su uso en pacientes mayores con penfigoide ampolloso. Las tetraciclinas se suelen asociar a nicotinamida debido a su acción sobre diferentes puntos clave de la respuesta inflamatoria, como la inhibición de la quimiotaxis, de la adhesión de las células inflamatorias al endotelio, de la permeabilidad de los vasos sanguíneos o de la liberación de ciertas enzimas proteolíticas al medio desde las células inflamatorias.
Pénfigo vulgarEn el año 2008 el tratamiento del pénfigo no está consensuado en su totalidad ya que existen puntos de conflicto en las revisiones terapéuticas3. Entre estas diferencias destacamos:
- 1.
El pénfigo es una enfermedad infrecuente, con 1,5 casos/millón de habitantes en poblaciones europeas, siendo de 1,6/100.000 en países como Israel. El término de pénfigo engloba diferentes formas clínicas: PV con su variedad vegetante, pénfigo foliáceo o seborreico con una variedad geográfica en América del sur y Túnez (pénfigo endémico), formas infrecuentes como pénfigo paraneoplásico, pénfigo herpetiforme y pénfigo IgA. Al ser tan infrecuente los casos tratados en las series publicadas nunca exceden de los 50 bien definidos, con la consiguiente dificultad en agrupar series aleatorizadas y con resultados concluyentes4,5.
Algunos artículos incluyen casos diagnosticados de PV sin inmunofluorescencia de ningún tipo, únicamente con clínica e histología.
- 2.
La gravedad del pénfigo es variable incluso individualmente. Se ha intentado establecer una pauta de medición de severidad como el Psoriasis Area Severity Index (PASI) en la psoriasis6, englobando criterios como la regla de los 9, el grado de erosión o costra seca, los alimentos que tolera (el llamado índice de intensidad de enfermedad ampollosa autoinmune), con muy buena intención pero poco práctico. También se marca la severidad en estadios leve-moderado-intenso a juicio del observador.
Sigue teniendo una mortalidad del 5 % habitualmente por complicaciones secundarias al tratamiento.
- 3.
No hay criterios claros de curación-remisión. Algunos autores lo definen según criterios de inmunofluorescencia indirecta, directa, otros en función de la clínica y de la necesidad de tratamiento inmunosupresor. Uno de los criterios seguidos es la ausencia de lesiones en tres meses, lo que no es congruente con la experiencia clínica en este tipo de pacientes. En España solemos catalogarlo así cuando el paciente no presenta lesiones en un año sin necesidad de terapia farmacológica oral.
Con toda esta variabilidad se han cifrado las remisiones completas de pacientes con PV en el 50 % a los 5 años y en un 75 % a los 10 años, cifra que nos parece algo optimista. También se ha publicado que un 17 % de los PV responden rápido con un buen pronóstico entrando en remisión frente a un 35 % que tienen brotes constantes, pero esto se basaba en una serie de 44 pacientes.
- 4.
Hay evidentes criterios diferentes de tratamiento según la zona geográfica mundial, incluso dentro del mismo ámbito geográfico. Así, en Japón se publican series de tratamiento con plasmaféresis que no son tan empleadas en Europa. Autores expertos en el tratamiento del pénfigo publican como su fármaco preferido ahorrador de corticoides metotrexato, mientras que otros artículos lo descartan. Por otra parte, como los criterios de inclusión varían, no existen metaanálisis o revisiones sistemáticas. Con fecha de 2008 los artículos suelen concluir con la afirmación de que cada dermatólogo trate el pénfigo como pueda y tenga experiencia, llegando a hablar del «arte de tratamiento» en el pénfigo. Por ello autores británicos prefieren metotrexato, y en el mismo país otros se decantan por dapsona. Daremos unos criterios de actuación basados en la experiencia de varios hospitales que tratan con frecuencia enfermedades ampollosas, con un entorno geográfico próximo (España) y apoyándonos en el sondeo realizado entre más de 40 dermatólogos que desarrollan su actividad en un medio hospitalario.
- 5.
Existe un entusiasmo inicial por los tratamientos emergentes que, con el tiempo acaban posicionándose en su indicación selectiva. Se publicaron curaciones con 1-3 ciclos de inmunoglobulinas intravenosas (Ig iv) consiguiendo remisiones, se indicó mofetilmicofenolato como monoterapia sin corticoides, pulsos ablativos de ciclofosfamida con importantes efectos secundarios, plasmaféresis y sus variantes, aún empleadas pero en casos muy seleccionados. Por otra parte, cada dermatólogo y cada hospital dispone de unos medios para el tratamiento de su paciente.
- 6.
El único criterio común de actuación es el inicio del tratamiento del PV con corticoides hasta lograr el control, pero pronto comienzan las diferencias: ¿hay corticoides más eficaces?, ¿cómo desciendo la dosis?, ¿asocio inmunosupresor desde el comienzo?, ¿cuál?
El pénfigo de cualquier tipo debe ser diagnosticado por7:
- 1.
Clínica compatible: ampollas, erosiones, costras, a veces con despegamiento por el roce.
- 2.
Histopatología diagnóstica: con acantolisis, a nivel suprabasal en PV, granulosa en el pénfigo foliáceo, o los criterios histológicos típicos de las otras formas clínicas más infrecuentes. La biopsia se tomará de una vesícula pequeña intacta preferiblemente.
- 3.
IFD (inmunofluorescencia directa) positiva de IgG (a veces complemento, IgA). Biopsia de piel sana perilesional.
- 4.
Presencia de anticuerpos circulantes, medidos por IFI (inmunofluorescencia indirecta) titulados o por ELISA (enzimoinmunoanálisis) frente a desmogleínas (dsg). Ambas técnicas son muy específicas, siendo algo más sensible la ELISA. Son paralelas a la actividad clínica, por lo que las pediremos durante el tratamiento.
Estos criterios deben cumplirse para incluir como diagnóstico de PV-foliáceo (los más frecuentes). Si es un caso de pénfigo paraneoplásico debe detectarse el antígeno, variando la IFD.
En áreas de investigación o descripción de nuevas entidades se estudiarán los antígenos implicados (inmunotransferencia e inmunoprecipitación), el subtipo patógeno de Ig, etc.
Estudiaremos afectación otorrinolaringológica, realizaremos Mantoux, radiografía de tórax y serología de hepatitis para prevenir reactivaciones con los tratamientos, además de una analítica básica.
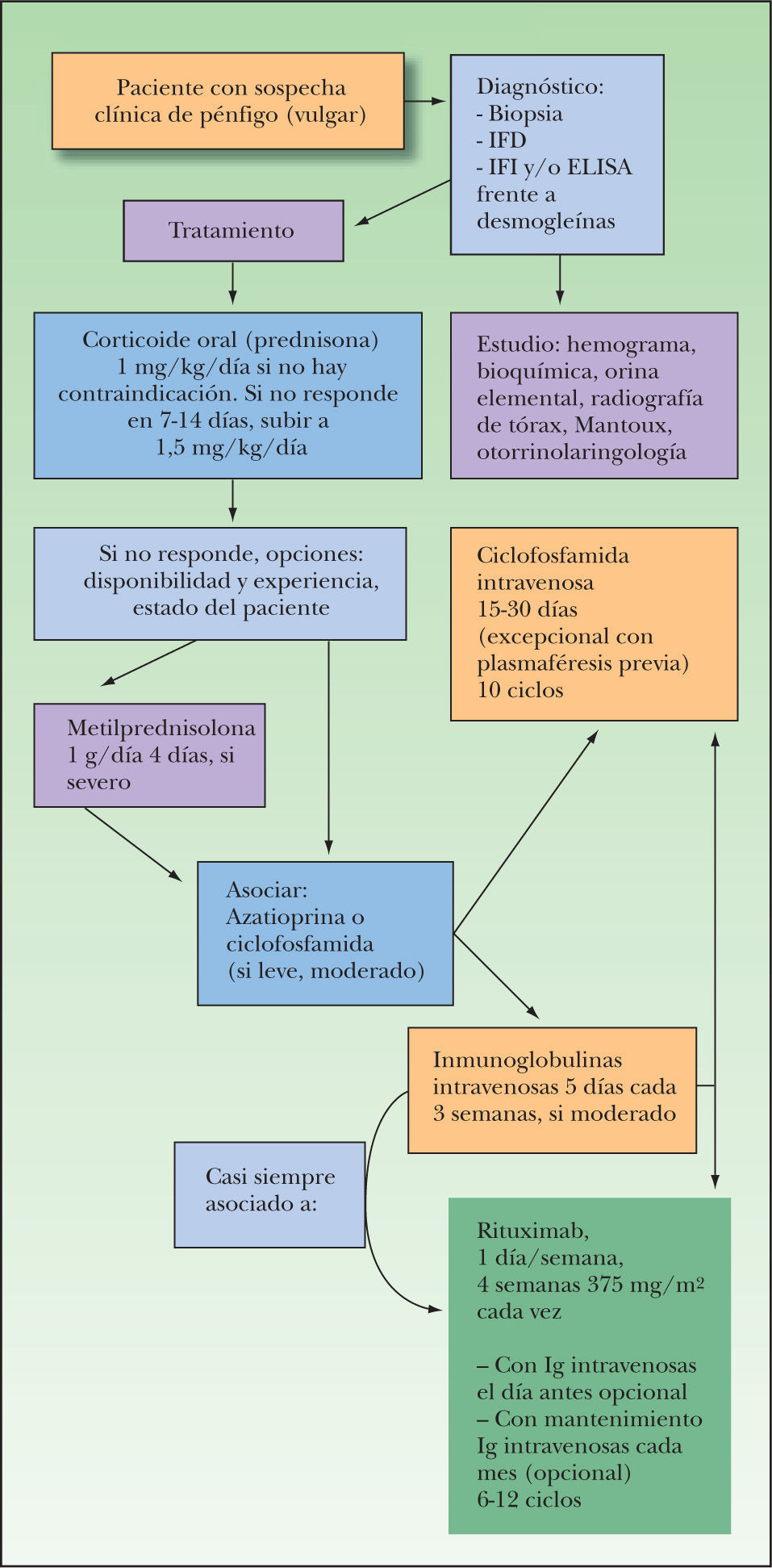
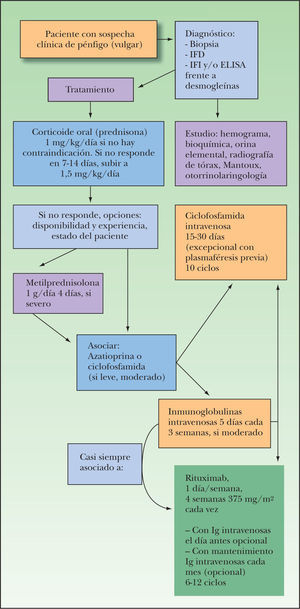
TratamientoLos corticoides continúan siendo el tratamiento inicial de elección (fig. 3). El tipo de corticoide varía, pero en España el más utilizado es prednisona oral 1 mg/kg/día en el desayuno, que aumentaremos a 1,5 mg/kg/día en una toma si no estuviese controlado en unos 10 días8. A partir de aquí hay controversia: unos siguen aumentando hasta 2, 3 o 4 mg/kg/día, pero nosotros preferimos introducir alguna alternativa lógicamente de inicio de acción rápido (Ig iv 2 g/kg) y en ocasiones pulsos de ciclofosfamida cada 15-30 días. Una vez controlado el brote se comienza la disminución progresiva de prednisona, sin pautas rígidas (8-12 semanas) hasta llegar a unos 15-20 mg/día de mantenimiento e intentando a días alternos. Desde el comienzo preferiblemente, o si no, ante la mínima reaparición de lesiones, interrumpimos el descenso de corticoides y asociamos un inmunosupresor.
En casos graves no controlados se pueden utilizar bolos de dexametasona o metilprednisolona (1 g iv/diario 4 días) en infusión lenta 3-4 horas. Debe evitarse en ancianos, pluripatología por riesgo de convulsiones, hipertensión, cardiopatía, alteración electrolítica, psicosis, neuropatía y pancreatitis.
En lesiones recalcitrantes de mucosa oral se ha tratado con triamcinolona intralesional, o con más frecuencia clobetasol propionato 0,05 % en orobase, en función de la eficacia que se obtiene también en lesiones aisladas cutáneas con corticoides tópicos de potencia alta.
Dentro de los posibles inmunosupresores llamados «ahorradores de corticoides», el más usado es la azatioprina, a dosis de 50 mg/12 horas9, pero es mejor ajustarlo según la enzima que lo metaboliza. La asociación de inmunosupresores en PV parece justificada dadas las recaídas al disminuir la dosis de corticoides10.
Otro inmunosupresor que en España se utiliza por uso compasivo es micofenolato mofetilo a dosis variables de 1-3,5 g/día, con un lento inicio de acción y frecuentes molestias11–13 gástricas. Hay series de pacientes que afirman su gran utilidad en PV, pero el fármaco tiene una biodisponibilidad irregular y de ahí su variable resultado14,15.
Ciclofosfamida ha demostrado utilidad en PV tanto en forma oral (50 mg/12 horas) (1,5-2,5 mg/kg/día) como intravenosa16,17. Presenta numerosos efectos secundarios esbozados anteriormente. Se ha empleado con mayor eficacia en forma de pulsos (dosis variable desde 1 g/m2 aunque es más eficaz 5-10 mg/kg/ciclo) cada 15 ó 30 días. Se administra con antieméticos y mesna para intentar evitar la cistitis hemorrágica. También se puede asociar a plasmaféresis previa 5-10 sesiones para reducir el nivel de anticuerpos. Puede provocar además malestar general con vómitos, mielosupresión, alopecia, etc., pero su eficacia ha sido comprobada repetidamente.
En cuanto a las Ig iv hasta 2005 había menos de 100 casos publicados con PV con un protocolo consensuado que distancia los ciclos lentamente (hasta 16 semanas) al producirse el control y la mejoría. Al alcanzar el intervalo de 4 meses sin recaídas podríamos intentar la suspensión de esta terapia18–20.
Su tolerancia es muy buena, con infusión lenta en hospital de día durante 6 horas/ciclo premedicando con antiH1 y paracetamol. Se han descrito efectos secundarios en infusiones más rápidas: cefalea, hipotensión arterial, náuseas, mialgia, etc. y más infrecuentemente trombosis, anafilaxia, insuficiencia renal y cardiaca21–23.
La dosis habitual que empleamos es 0,4 g/kg/día 5 días (2 g/kg total) repetido cada 21 días en monoterapia, aunque cada vez con más frecuencia lo asociamos a tratamiento contra el clon de linfocitos (rituximab o en alguna ocasión ciclofosfamida en bolus). Hemos constatado una eficacia rápida que permite bajar las dosis de corticoides, pero los ciclos son muy numerosos (de 15 a 30) en contra de algunos primeros resultados optimistas que hablaban de eficacia con 1-3 ciclos, por lo que se encarece desproporcionadamente (uso compasivo). Hemos medido los anticuerpos antes y después de los ciclos y no hemos encontrado descenso a pesar de la mejoría clínica. Por eso, últimamente lo asociamos casi siempre a rituximab 4 ciclos (8 pacientes) con gran eficacia. Estimamos que el objeto de su indicación es aquel paciente no controlado a pesar de altas dosis de corticoides o con contraindicación para el uso de éstos (glaucoma, diabetes mal controlada, tuberculosis, etc.) y posiblemente deba asociarse a un inmunosupresor24.
La plasmaféresis hoy en día es empleada en pocas ocasiones, siendo más utilizada en Japón. Se utiliza en casos agudos, severos, con contraindicación para otros tratamientos y con alta concentración de anticuerpos circulantes, ya que extrae éstos de la sangre al filtrarla. Su gran inconveniente, además de la poca disponibilidad, es el efecto rebote precoz desde el segundo-quinto día, que debe ser frenado con pulsos de ciclofosfamida, ya que no suele ser suficiente la terapia oral con inmunosupresores o Ig iv25,26.
Los efectos secundarios no son infrecuentes, ya que extrae un volumen de sangre entre 2-5 litros que filtra y sustituye por sucedáneos del plasma. Hay riesgo de trombosis, infecciones y necesidad de crear fístulas arteriovenosas. También es un procedimiento muy costoso. Lo hemos empleado en varios pacientes en colaboración con el Servicio de Nefrología, obteniendo resultados inmediatos buenos, pero con un importante efecto rebote, por lo que hemos ido abandonándolo. En España parece utilizarse de forma excepcional.
Basadas en la plasmaféresis se han empleado otras técnicas aferéticas con extracción de anticuerpos patógenos, como la inmunoadsorción inmunoespecífica o incluso la fotoféresis extracorpórea con exposición del suero a psoralenos y UVA.
En caso de empleo se suelen realizar 5-10 sesiones de plasmaféresis seguidas al día siguiente del último ciclo de un bolo de ciclofosfamida iv27–30.
Con rituximab ya hay más de 40 casos publicados obteniéndose unos resultados positivos del 88 % con mínimos efectos secundarios. La dosis es la empleada en otras patologías como linfomas B: 375 mg/m2/semana por 4 semanas. En PV se han administrado 2 ciclos en caso de resistencia, o en otras ocasiones infusiones aisladas con la dosis de un día en casos de recidiva. Con frecuencia asociamos Ig iv mensual 0,4 mg/kg 10-12 meses para prevenir infecciones y ayudar a la eficacia terapéutica temprana al neutralizar anticuerpos circulantes donde no actúa rituximab. Se han descrito infecciones oportunistas graves que en los 8 casos que hemos tratado no han aparecido31.
Otros tratamientos empleados en PV han sido o son la ciclosporina, empleada a dosis altas, que no ha demostrado eficacia clara frente a corticoides aislados32–34; dapsona quizás reservada para pénfigos con predominio neutrofílico (IgA, herpetiforme, etc.) y en todo caso leve. Algunos autores defienden su uso en casos iniciales, pero con una alta tasa de fracaso en el control del pénfigo. Las sales de oro, tratamiento clásico en esta enfermedad, se pueden administrar oral o intramuscularmente. Hace años eran más empleadas, pero los efectos secundarios que aparecen hasta en 30 % de pacientes, tanto renales como cutáneos, las han relegado a terapia de tercera línea, en caso de inmunodepresión, jóvenes, etc. Tienen un inicio de acción lento.
También se han empleado en casos aislados infliximab, clorambucil, tetraciclinas, nicotinamida y pirisdostigmina35,36.
Tratamiento en otras formas de pénfigoEn el caso de pénfigo foliáceo no hay variación en las opciones terapéuticas, salvo que suele (no siempre) ser menos rebelde al tratamiento, por lo que la dosis inicial de prednisona puede ser 0,5 mg/kg/día e ir subiendo según la respuesta. El corticoide tópico es más eficaz que en el PV; a veces no necesitan inmunosupresores. No hemos requerido terapia intravenosa en prácticamente ningún caso, pero si hay resistencia a la remisión pueden emplearse.
Los otros casos de pénfigo son más raros, por lo que no serán comentados en esta revisión práctica.
Penfigoide ampollosoAl igual que en otras enfermedades ampollosas autoinmunes no existe unanimidad en cómo debe ser manejado un paciente con penfigoide ampolloso (PA)37. No obstante, en términos generales, esta enfermedad ampollosa suele mostrar una gravedad menor en comparación con el PV38, y presenta por lo general una morbilidad menor que otros procesos como el penfigoide de mucosas o la epidermolisis ampollosa adquirida. Este hecho se traduce en que los tratamientos que deberemos emplear en el PA no son muy agresivos, debiendo incidir principalmente en el componente inflamatorio que presenta, y no tanto en la producción de autoanticuerpos como ocurre en el manejo del PV.
Algunas consideraciones deberán ser realizadas a la hora de comprender mejor esta enfermedad, y valorar adecuadamente a cada paciente39,40.
- 1.
El PA es la enfermedad ampollosa autoinmune con una incidencia más elevada en nuestro medio, estimándose entre 0,7-1,8 casos nuevos por cada 100.000 habitantes, sobre todo en mayores de 75 años.
- 2.
Clínicamente los pacientes presentan prurito generalizado. Posteriormente, pueden aparecer lesiones eritematosas, infiltradas, sobre las que posteriormente aparecen lesiones ampollosas de contenido claro, que pueden volverse hemorrágicas. Asientan principalmente en el tronco inferior, pliegues y superficie flexora de las extremidades. No dejan cicatriz y es rara la afectación de cabeza y cuello. Solo en raras ocasiones pueden aparecer inicialmente formas localizadas en las extremidades que posteriormente se generalizan, comenzar como lesiones dishidrosiformes en las partes distales de extremidades, o aparecer como nódulos eritematosos (penfigoide nodular).
- 3.
Es importante saber que en el PA existen dos componentes definidos en la enfermedad. Por una parte el paciente presenta anticuerpos IgG dirigidos frente a la proteína de la unión dermo-epidérmica, más en concreto frente a las proteínas de los hemidesmosomas, como son sobre todo el BP180. Además existe un componente inflamatorio más relevante que en el PV, donde la acción de neutrófilos activados por la fracción Fc de los autoanticuerpos produce la liberación de enzimas proteolíticas que dañan la unión dermo-epidérmica.
- 4.
No existe un criterio claro y definido para saber cómo y cuándo debemos variar el tratamiento en un paciente con PA. No obstante, a diferencia de otros procesos como el PV, el PA con frecuencia suele ser una enfermedad autolimitada, aunque puede extenderse de unos pocos meses a varios años. Otro aspecto importante a la hora de establecer unos puntos de referencia claros en el manejo del PA es saber que no tenemos parámetros analíticos definidos que nos den una información objetiva sobre la situación de cada paciente. El criterio más utilizado es la evolución clínica del paciente. Junto a esta información será de gran ayuda la determinación de anticuerpos circulantes frente a la zona de la membrana basal de la epidermis mediante IFI utilizando esófago de mono, o la determinación selectiva de anticuerpos circulantes frente al BP180, uno de los antígenos implicados en el PA. A pesar de todo no existen estudios de grupos de pacientes en los que se analice la relación entre la mejoría de los sujetos con PA y el título de estos anticuerpos circulantes.
- 5.
Al igual que en el pénfigo, principalmente en el PV, la aparición de nuevas terapéuticas ha desviado la atención de la prescripción médica muchas veces hacia esos fármacos en pacientes con PA. No obstante, no hay que olvidar que muchos de ellos no han demostrado ser más eficaces que otras medicaciones más clásicas y con más experiencia, además de tener un coste económico mayor.
- 6.
El grupo de población de los pacientes con PA tiene algunas características que deberemos tener presentes. Principalmente son pacientes mayores, muchos de ellos polimedicados. Este hecho es de gran importancia, ya que algunos casos de PA son debidos a fármacos. En segundo lugar, al tratarse de pacientes más mayores su sistema metabólico e inmunológico es más frágil, y por tanto el riesgo de efectos secundarios por la medicación es más elevado. En términos generales, en las lesiones localizadas siempre emplearemos corticosteroides locales. Además, existen trabajos que demuestran que la administración de fármacos inmunorreguladores, o incluso antiinflamatorios, puede ser de utilidad.
Como comentábamos, el aspecto de las lesiones y su localización, así como la asociación a prurito serán los pilares fundamentales en el diagnóstico de un cuadro de PA41.
Histopatológicamente se aprecia la presencia de una ampolla subepidérmica, con un infiltrado inflamatorio rico en eosinófilos en la dermis, y en ocasiones junto a neutrófilos. Se puede ver espongiosis eosinofílica en lesiones precoces.
Mediante IFD de piel perilesional observaremos depósitos lineales de C3 en la unión dermo-epidérmica en más del 90 % de los casos. Además, en esta misma localización pueden observarse depósitos de IgG (hasta en el 80 % de los casos), o más infrecuentemente de IgM e IgA (alrededor del 15 % de los casos).
Mediante IFI detectamos anticuerpos circulantes frente a los antígenos implicados localizados en la unión dermo-epidérmica. Si empleamos como sustrato esófago de mono podremos detectar estos anticuerpos hasta en el 80% de los pacientes. Si utilizamos piel humana mediante la técnica de salt-split este porcentaje aumenta hasta casi el 80 %, detectándose los depósitos principalmente en el lado epidérmico de la hendidura formada.
En aquellos casos en los que disponemos de ELISA podremos detectar anticuerpos circulantes frente al BP180 en casi la totalidad de los pacientes. Mediante inmunoblot encontraremos los anticuerpos frente a la porción NC16A del antígeno del PA.
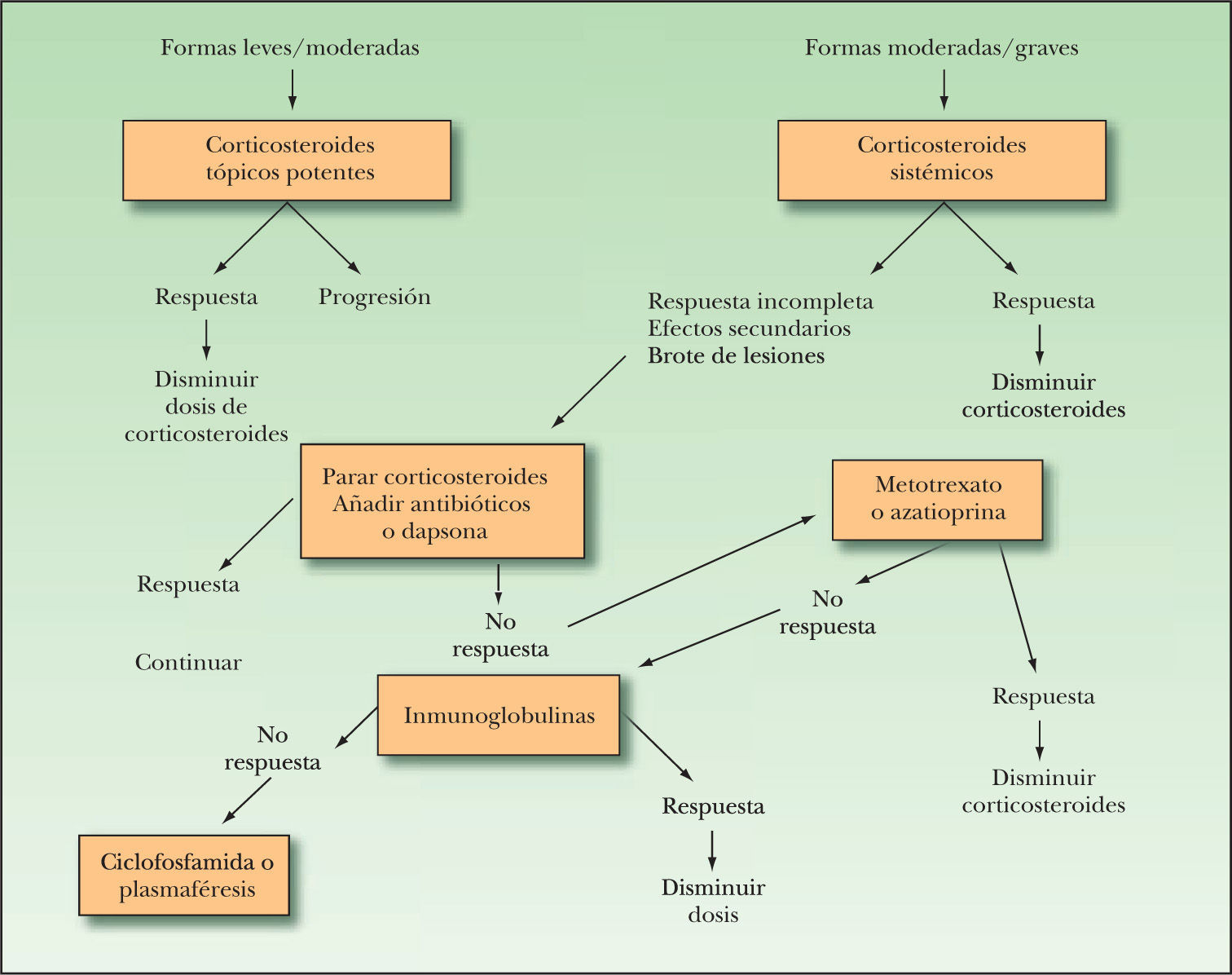
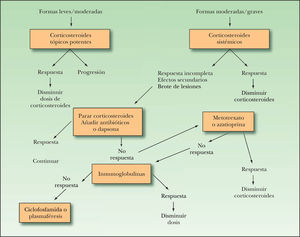
Dentro de los esquemas terapéuticos publicados para el manejo de los pacientes con PA nos ha parecido adecuado el que propone Mutasim (fig. 4), que centra el tratamiento de un paciente con PA dependiendo de si las lesiones son leves-moderadas, o si por el contrario presentan una extensión importante.
En los pacientes con formas leves o moderadas de PA pueden utilizarse inicialmente corticosteroides potentes. Recientes trabajos han demostrado que la utilización de propionato de clobetasol (40 g/día)42,43 permitió controlar la enfermedad en tres semanas en la mayoría de los pacientes tratados con PA extenso, frente al grupo de pacientes con prednisona por vía oral (1 mg/kg/día), donde este porcentaje fue ligeramente inferior en el mismo tiempo de control de la enfermedad. Además, los efectos secundarios y la supervivencia fueron más favorables en el grupo de pacientes tratados tópicamente. Si la enfermedad no se controla deberemos administrar corticosteroides sistémicos.
En relación con la administración de corticosteroides sistémicos, estudios publicados establecen varios puntos importantes: dosis por encima de 0,75 mg/kg/día no parecen conferir un beneficio mayor que dosis inferiores a esta cantidad, y además se asocian a más riesgo de efectos secundarios importantes. Por este motivo la dosis de prednisona recomendada es de 0,5-0,75 mg/kg/día. La respuesta favorable se encuentra ya en las primeras 4 semanas, con curación importante de las lesiones. En este punto puede disminuirse la dosis. Cuando la dosis de prednisona es de 30-40 mg/día podrá instaurarse una pauta de días alternos. Si durante la fase de descenso de la dosis el PA rebrota nuevamente deberemos aumentar de 10 a 20 mg/día cada dos o tres semanas hasta que la enfermedad se controle nuevamente. En muchos casos las lesiones terminan por ceder en un plazo de 6-10 meses, y la dosis de prednisona se puede suspender por completo.
En aquellos pacientes que presentan brotes de lesiones de PA, en los que empiezan a aparecer efectos secundarios por los corticosteroides, o en aquellos en los que no se consigue una respuesta adecuada puede asociarse dapsona. La dosis recomendada será entre 50-150 mg/día.
Pueden emplearse también antibióticos44, principalmente tetraciclinas o eritromicina, asociados a nicotinamida como alternativa a dapsona y en las mismas circunstancias. Además, puede ser el tratamiento de elección cuando los corticosteroides no deben o no pueden usarse, o también en personas muy mayores. Por otra parte, la eritromicina se suele recomendar en niños para evitar así la administración de tetraciclinas en la infancia. La dosis de tetraciclinas será de 500 mg, 4 veces al día y de nicotinamida a dosis de 500 mg, tres veces al día. A veces se ha empleado también la doxiclina a dosis de 100 mg, dos veces al día. Cuando se emplee eritromicina la dosis será 1-3 g al día. Una vez que el número de lesiones se haya controlado, la dosis de corticosteroides asociados se disminuirá hasta incluso suspenderse, reduciendo posteriormente la dosis de nicotinamida y antibióticos.
Cuando el paciente presenta efectos secundarios por los corticoides, y además no se controla la enfermedad con dosis altas, está indicada la administración de inmunosupresores. Existe más experiencia con la azatioprina, con buenos resultados. Puede utilizarse hasta una dosis de 2,5 mg/kg/día, y siempre asociada a prednisona. No obstante, algún estudio aislado ha sugerido que puede tener una eficacia en el PA similar como único fármaco o como ahorrador de corticosteroides. Metotrexato tiene una eficacia menor en el PA, a una dosis de 5-15 mg/semana. Se suele indicar más en aquellos pacientes que presentan asociadas lesiones de psoriasis. No se tiene suficiente información del tratamiento con micofenolato-mofetil, a diferencia de en otras enfermedades autoinmunes.
Si los pacientes no mejoran con la asociación de prednisona junto a azatioprina, o no conseguimos reducir la dosis de corticosteroides sin que las lesiones recidiven, valoraremos la administración de inmunoglobulinas intravenosas; se trata de un fármaco muy caro que suele recomendarse a una dosis de 2 g/kg en ciclos de 3-5 días consecutivos, recibiendo los pacientes 2-4 ciclos distanciados 3-4 semanas.
Si a pesar de la asociación de inmunoglobulinas intravenosas las lesiones no se controlan, recomendaremos la administración de ciclofosfamida. Puede realizarse por vía oral o en bolus intravenosos. Por vía oral la dosis suele ser de 1-2 mg/kg/día. No obstante, la experiencia en su utilización que se puede obtener en la literatura es muy limitada.
Penfigoide gestacionalTambién conocido como Herpes gestationis, es una enfermedad ampollosa autoinmune que aparece en 1/20.000-50.000 partos45 habitualmente durante el segundo o tercer trimestre o en el periodo postparto. Se acompaña de un severo prurito que precede en semanas a la aparición de ampollas, junto a pápulas y placas urticariformes. Suele comenzar en el abdomen para generalizarse posteriormente, incluyendo palmas y plantas. Es rara la afectación mucosa y en ocasiones la paciente presenta otras alteraciones autoinmunes46 (tiroiditis, alopecia areata, etc.).
En la anatomía patológica encontramos ampolla subepidérmica con eosinófilos, a veces formando pequeños abscesos en papilas dérmicas o como espongiosis eosinofílica. Es fundamental para el diagnóstico el realizar inmunofluorescencia directa donde aparece C3 depositado en la membrana basal (a veces con IgG). Mediante piel humana separada con NaCl hay IgG circulantes fijadores de C3 en más del 90 % de los casos. La técnica convencional sólo los detecta en un 20 % de los casos. Por ELISA se encuentran anticuerpos frente a BP180 en un 90 % de los casos, y parecen relacionarse con la actividad de la enfermedad.
Es fundamental diferenciarlo de la erupción polimorfa del embarazo (1/300 embarazos), clínicamente semejante pero sin ampollas, por lo que es fundamental la IFD o la IFI.
El pronóstico en la madre es resolutivo tras unas semanas posparto, pero con riesgo de recurrencia más agresiva en otros embarazos del 92 %. Con anticonceptivos orales puede recurrir hasta en un 15-50 % de casos. En cuanto al feto no parece tener mayor mortalidad, pero sí se observa un mayor porcentaje de recién nacidos pretérmino y de bajo peso. No hay consenso en recomendar o prohibir la lactancia materna47.
El manejo terapéutico consiste en:
- 1.
Aliviar el prurito (dexclorfeniramina).
- 2.
Usar corticoides: tópicos en casos leves y sistémicos en casi el 80 % de casos 0,3-0,5 mg/kg/día de prednisona. Embarazo de riesgo con control ginecológico.
- 3.
En raras ocasiones se han empleado otras terapias: inmunosupresores, Ig iv, ciclosporina, etc.
Antes llamado penfigoide cicatrizal, penfigoide oral u ocular benigno de mucosas48. Probablemente se trate de varias enfermedades con un fenotipo semejante, pero en la que se han implicado varios antígenos (BP180 el más frecuente, integrina α6β4 muy implicado patogénicamente, laminina 5 y 6, colágeno VII, unceína, proteína de 45 kd, 168 kd y 120 kd).
Clínicamente afecta mucosas variadas (ocular 50-70 %, gingival 85 %, yugal, nasal 15 %, génito-anal 15 %, faríngea, laríngea, esofágica, etc.) con eritema, erosiones, ampollas y cicatrices posteriores que pueden provocar simbléfaron, entropión y triquiasis con abrasión de la córnea y perforación llegando a la ceguera. La piel no se suele afectar. En otras mucosas afectadas provoca sangrado, odinofagia, disfonía y disfagia49.
Diagnóstico- 1.
Clínica compatible50.
- 2.
Anatomía patológica: a veces poco útil por dificultad, falta de lesiones agudas. Podemos ver ampollas subepidérmicas con infiltrado mixto con eosinófilos.
- 3.
IFD mejor de mucosa oral. IgG, IgA, C3 en membrana basal.
- 4.
IFI mejor en piel separada con NaCl 24-48 horas, que marca en lado epidérmico. Con ELISA aparecen anticuerpos antiBP180, entre otros.
Con tres puntos de actuación, basado en la intervención de dermatólogo, oftalmólogo y otorrino entre otros51:
- 1.
Disminuir producción de anticuerpos.
- 2.
Disminuir la inflamación.
- 3.
Prevenir secuelas.
Para ello se dividen los pacientes según tengan riesgo bajo (únicamente afectación oral y leve cutánea) que mantendrán una buena higiene oral, corticoides tópicos y en ocasiones dapsona oral. Si no mejora asociamos corticoides orales a dosis bajas. Por otra parte en los pacientes de alto riesgo (afectación ocular, nasofaríngea, genital y esofágica) iniciamos dapsona asociada a prednisona 1 mg/kg/día, y en caso de no mejorar administramos bolus de ciclofosfamida (3 a 10 bolus) acompañados de ciclofosfamida oral. Hay referencias de mejoría con micofenolato, rituximab y mitomicina conjuntival. El manejo, como hemos dicho, debe ser multidisciplinario.
Dermatitis herpetiformeLa DH es una enfermedad ampollosa autoinmune que aparece como expresión cutánea de la intolerancia al gluten52. Forma parte de un abanico de patologías que tienen en común la sensibilidad a este componente, entre las cuales se encuentra la celiaquía y la ataxia por gluten. Se cree que alrededor de un 5 % de pacientes celíacos desarrollarán una DH a lo largo de su vida. Todos los pacientes con DH presentan sensibilidad al gluten, sin embargo la inmensa mayoría de ellos se encuentran asintomáticos desde el punto de vista digestivo. En una serie reciente de casi 300 enfermos con DH sólo el 13 % de ellos presentaban sintomatología digestiva. En el resto de casos sólo la realización de una biopsia intestinal puede llegar al diagnóstico de enteropatía sensible al gluten (ESG). En las diversas series publicadas entre un 60 y un 75 % de pacientes con DH manifiestan alteraciones histopatológicas en la biopsia intestinal53,54.
La erupción es muy pruriginosa y presenta una distribución típica en superficies de extensión, cara posterior de antebrazos y nalgas. Las lesiones cutáneas consisten en pápulas eritematosas, vesículas pequeñas y excoriaciones. Las vesículas intactas pueden ser difíciles de encontrar y la presentación de ampollas francas es excepcional, lo cual puede dificultar un diagnóstico adecuado.
El estudio de biopsias de piel afecta la muestra de microabscesos de neutrófilos en puntas papilares55, infiltrados inflamatorios variables en la dermis superficial y ocasionalmente vesículas subepidérmicas. Estos hallazgos son inespecíficos y se describen en otras enfermedades ampollosas autoinmunes.
El diagnóstico de certeza se basa en el hallazgo —patognomónico— de un depósito granular de IgA (con/sin C3) en la unión dermoepidérmica mediante estudio de IFD de una muestra de piel sana perilesional. Estos depósitos pueden concentrarse en las puntas de las papilas dérmicas. La sensibilidad de esta prueba oscila entre el 90-95 % de pacientes.
Recientemente se han descubierto los autoantígenos endomisiales específicamente reconocidos en ambas enfermedades: la transglutaminasa tisular (TGt) en la celiaquía y la transglutaminasa epidérmica (TGe) en la DH56–58.
Los autoanticuerpos IgA antiendomisio de músculo liso son altamente específicos de ESG (celíacos o con DH). Estos autoanticuerpos están presentes en más del 70 % de pacientes con DH que siguen una dieta normal (con gluten)59.
Todos estos autoanticuerpos (IgA antiendomisio, IgA anti-TGt e IgA anti-TGe) disminuyen significativamente con la dieta exenta en gluten (DEG), y son por tanto de utilidad no sólo en el diagnóstico, sino también en el seguimiento de los pacientes con ESG60,61.
Se pueden detectar además anticuerpos antirreticulina y antigliadina. Los antirreticulina de clase IgA son altamente específicos y se encuentran en uno de cada 4 pacientes con DH, así como en enfermos con celiaquía; éstos también disminuyen hasta desaparecer tras la instauración de la DEG. Tanto los antirreticulina de clase IgG como los antigliadina (IgA o IgG) son inespecíficos y aparecen frecuentemente en sujetos afectos de otras enfermedades ampollosas autoinmunes, e incluso en sujetos sanos.
En aquellos pacientes con sospecha clínica firme, en los que el estudio de estos autoanticuerpos de clase IgA es negativo, debemos solicitar una determinación de IgA total, puesto que esta situación puede deberse a un déficit selectivo de IgA. En estos casos el diagnóstico serológico de sensibilidad al gluten se alcanza mediante la determinación de anticuerpos IgG antitransglutaminasa.
La asociación de DH con el desarrollo de linfomas es controvertida62,63. A diferencia de lo descrito en enfermos con celiaquía, donde la correlación entre la enteropatía con estas neoplasias hematológicas (sobre todo intestinales de tipo T) ha sido bien establecida, la incidencia de linfomas —cualesquiera— en enfermos con DH es inferior al 2 % en los diversos estudios disponibles64.
Manejo terapéuticoLa DH se trata mediante DEG y dapsona65.
La DEG es imprescindible en cualquier enfermo con DH. Es eficaz en el tratamiento de las manifestaciones cutáneas (y digestivas, si las hubiera), aunque la mejoría aparece más tarde que con el uso de dapsona. Los alimentos que contienen trigo, cebada o centeno están prohibidos, pero en cambio se permite la ingesta de arroz, maíz y avena66,67. La DEG debe mantenerse de por vida, ya que la inmensa mayoría de pacientes con DH ven recidivar la enfermedad al reintroducir el gluten en la dieta. Sólo entre un 10 y un 20 % de pacientes desarrollan tolerancia inmunológica y son capaces de seguir una dieta normal tras años de DEG estricta (especialmente casos de inicio en la infancia y/o tratados en algún momento con dapsona).
Dapsona suprime eficazmente y en pocos días las manifestaciones cutáneas de la DH. No tiene efecto sobre la posible afectación intestinal, y tampoco se ha demostrado que disminuya el riesgo de desarrollar linfoma. No tiene efectos curativos sobre la DH, y la erupción cutánea reaparece al suspender este fármaco.
Por último, existen diversas asociaciones y webs para enfermos con celiaquía y/o DH que facilitan el acceso a información de interés (marcas de alimentos permitidos y prohibidos, recetas, establecimientos de compra y restauración, actividades, información para comedores escolares, ayudas económicas, etc.) (tabla 5).
Características básicas de la dermatitis herpetiforme
| Manifestaciones clínicas |
| Prurito intenso |
| Erupción papulovesicular (excoriada) en superficies de extensión y nalgas |
| ¿Sintomatología digestiva? |
| Biopsia cutánea |
| Microabscesos papilares de neutrófilos, separación subepidérmica |
| IgA granular en membrana basal (inmunofluorescencia directa) |
| Estudio inmunológico |
| Anticuerpos IgA antiendomisio |
| Anticuerpos IgA antitransglutaminasa |
| (Anticuerpos antirreticulina IgA) |
| (Anticuerpos antigliadina) |
| Estudio digestivo (si hay clínica digestiva y signos de malabsorción) |
| Valoración por digestólogo/a |
| Biopsia de mucosa de intestino delgado (duodeno distal, yeyuno) por fibrogastroscopia |
| Tratamiento: dieta exenta de gluten, dapsona |
La dermatosis ampollosa IgA lineal (DAIL) es una enfermedad vesículo-ampollosa, que tal como su nombre indica presenta depósitos lineales de IgA a lo largo de la membrana basal. Según algunos estudios realizados en Europa (Francia y Alemania, fundamentalmente) la incidencia anual de esta enfermedad sería aproximadamente de 0,2-0,5 casos por millón de habitantes. Estos datos probablemente subestiman su frecuencia real, dado que no se realizan estudios de inmunofluorescencia correctamente. Se trata de todos modos, junto con la DH, de la enfermedad ampollosa más frecuente en la infancia, y que era conocida antiguamente como «dermatosis ampollosa crónica de la infancia».
El cuadro clínico clásico característico de la DAIL consiste en la aparición de lesiones en forma de placas eritematosas policíclicas o anulares con las vesículas y/o ampollas en la periferia, adoptando un patrón que se ha comparado a un «collar de perlas». En muchos pacientes, sin embargo, puede observarse una clínica que puede ser totalmente indistinguible de una DH, o de un penfigoide ampolloso. En los casos desencadenados por fármacos en particular la clínica puede ser muy atípica y recordar más bien un eritema multiforme o una necrolisis epidérmica tóxica. Es importante resaltar también que las mucosas se afectan muy a menudo en la DAIL, y que puede aparecer un cuadro superponible a un penfigoide de mucosas con afectación oral, ocular, nasal, genital, laríngea o bronquial. Por dicho motivo será importante contar con la colaboración de otros especialistas (por ejemplo oftalmólogos) para el control adecuado de estos pacientes.
Otro punto importante en la evaluación clínica de pacientes a los que se diagnostica una DAIL es investigar los distintos tratamientos farmacológicos que toma el paciente, especialmente en el contexto de los hospitalizados, dado que existe una variante de DAIL inducida por fármacos (se trata de hecho de la enfermedad ampollosa autoinmune que más a menudo es inducida por fármacos). El fármaco que se ha involucrado con mayor frecuencia (más de la mitad de los casos) es vancomicina, pero también han sido implicados otros antibióticos (penicilina y derivados sobre todo), medicaciones para la hipertensión (inhibidores de la enzima de conversión de la angiotensina [IECA]), antiepilépticos, hipolipemiantes, antiinflamatorios no esteroideos, etc. En la mayoría de los casos la dermatosis se resuelve al retirar el fármaco.
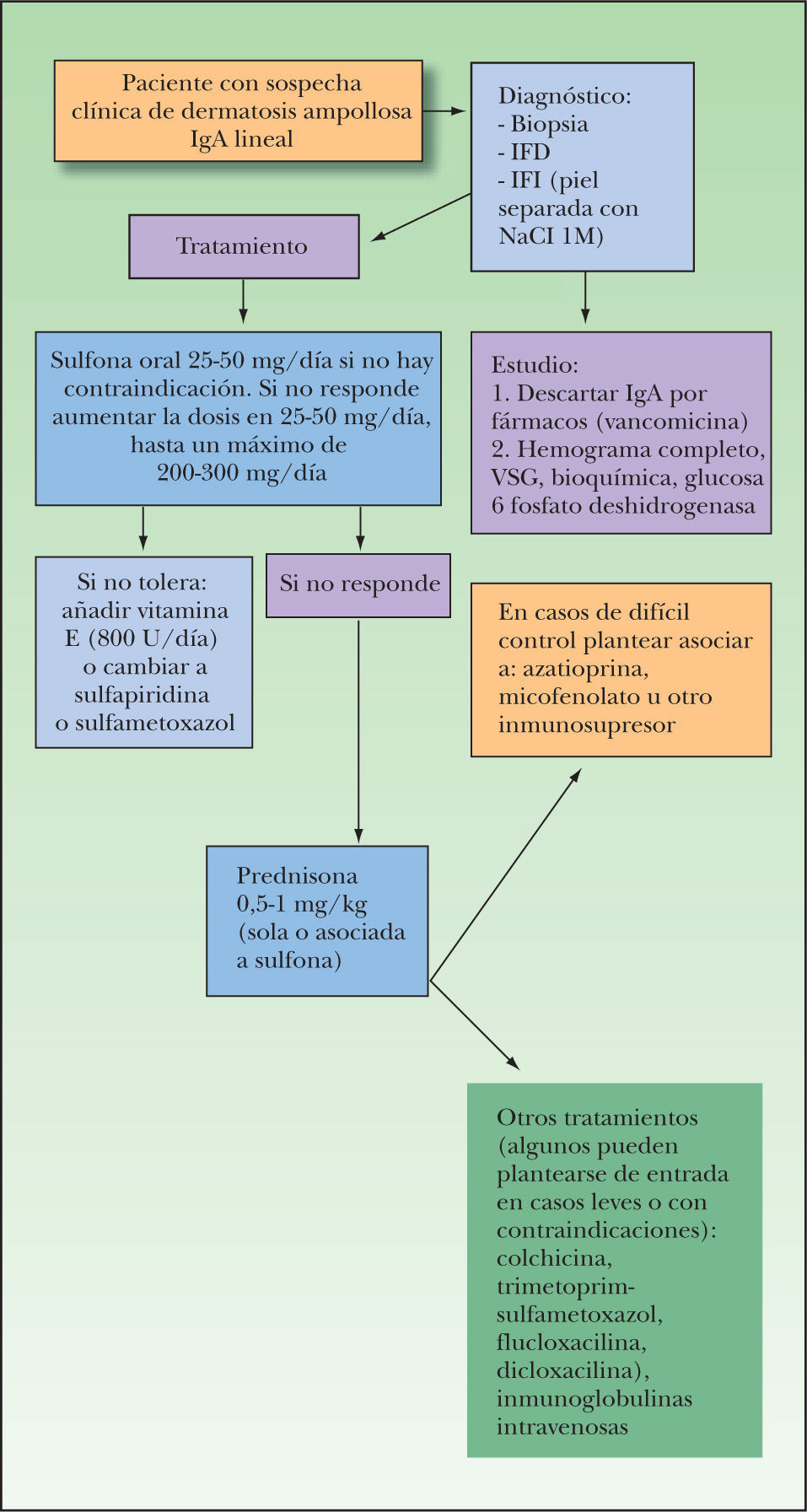
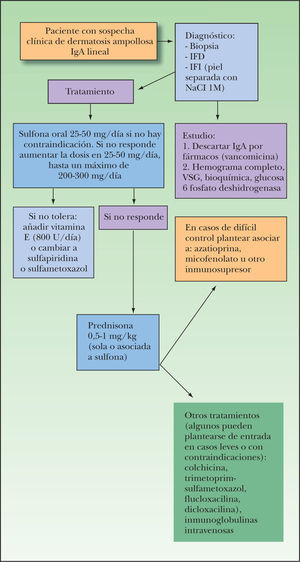
DiagnósticoPara realizar el diagnóstico se deben llevar a cabo exámenes de microscopía óptica y de inmunofluorescencia (fig. 5). La histología de la DAIL no es específica, dado que muestra vesículas subepidérmicas que contienen abundantes neutrófilos en su interior con un número variable de eosinófilos. Estos hallazgos pueden ser totalmente indistinguibles de los de una DH, PA, epidermolisis ampollosa adquirida, o un lupus eritematoso sistémico (LES) ampolloso, y la histología por sí sola es incapaz de diferenciar entre estas enfermedades. Es por ello que el diagnóstico se debe realizar practicando exámenes de inmunofluorescencia. La IFD (biopsia de piel perilesional) muestra la existencia de depósitos lineales de IgA a lo largo de la membrana basal, con o sin presencia de depósitos de complemento. Pueden existir también depósitos de IgG, pero éstos serán siempre de mucha menor intensidad que los de IgA. En el caso contrario el diagnóstico puede corresponder a otras enfermedades como PA, epidermolisis ampollosa adquirida, o un LES ampolloso. Con la IFI se puede detectar en el suero la presencia de autoanticuerpos circulantes de tipo IgA contra la membrana basal dermoepidérmica en casi la mitad de los pacientes. Los títulos de estos autoanticuerpos son casi siempre bajos. La sensibilidad y los títulos de anticuerpos aumentan si se utiliza como sustrato piel humana sana separada con NaCl 1M para realizar este examen. Los anticuerpos de la mayoría (80 % de los pacientes) se unen a la parte epidérmica (techo) de la separación, mientras que el 20 % restante mostrará un patrón dérmico (tinción del suelo).
Opciones terapéuticasA diferencia de lo que sucede con la DH, al no existir una enteropatía sensible al gluten, la dieta sin gluten no tiene ningún papel en el manejo de esta enfermedad. En los casos de DAIL asociada a fármacos deberá retirarse el medicamento implicado. Asimismo es importante que todos los pacientes con sintomatología ocular sean controlados también por un oftalmólogo.
SulfonaEl tratamiento de elección de la DAIL es la sulfona. La dosis inicial suele ser de 25 a 50 mg, que se va aumentando paulatinamente en función de la respuesta clínica y de la tolerancia del paciente hasta llegar a dosis de 100-200 mg/día (ver el apartado «Sulfona» previamente).
También pueden emplearse otras sulfonamidas como sulfapiridina, o sulfametoxipiridazina, que a pesar de presentar el mismo perfil de efectos secundarios que ésta suelen ser mejor toleradas.
Los casos que no responden a sulfona deberán ser tratados con corticoides sistémicos, como prednisona (de 0,5 a 1 mg/kg al día). Los corticoides se pueden administrar solos o combinados con sulfona (si el paciente la tolera). En algunos casos puede ser necesario administrar fármacos inmunosupresores (azatioprina, micofenolato, etc.) con buenos resultados, aunque no existen pautas establecidas para ello y deberían usarse las mismas que para el PV.
Conflicto de interesesDeclaramos no tener ningún conflicto de intereses.